 Алюміній
Алюміній
 Найпоширеніший серед металів 6, 6 ат. % 250 мінералів Al 2 O 3· 2 Si. O 2· 2 H 2 O Al 2 O 3 – корунд (рубін, сапфір) Na 2 O(K 2 O)·Al 2 O 3· 2 Si. O 2 – нефелін Al 2 O 3·x. H 2 O – боксит Na 3[Al. F 6] – кріоліт (поклади вже вичерпані)
Найпоширеніший серед металів 6, 6 ат. % 250 мінералів Al 2 O 3· 2 Si. O 2· 2 H 2 O Al 2 O 3 – корунд (рубін, сапфір) Na 2 O(K 2 O)·Al 2 O 3· 2 Si. O 2 – нефелін Al 2 O 3·x. H 2 O – боксит Na 3[Al. F 6] – кріоліт (поклади вже вичерпані)
 Добування 3 Na 2 CO 3 + 2 Al(OH)3 + 12 HF → 2 Na 3[Al. F 6] + 3 CO 2 + 9 H 2 O Al 2 O 3 tпл = 20450 С Al 2 O 3 + Na 3[Al. F 6] tпл = 6600 С tпроцесу ~ 9600 С t Al 2 O 3 → Al 3+ 3 - + Al. O 3
Добування 3 Na 2 CO 3 + 2 Al(OH)3 + 12 HF → 2 Na 3[Al. F 6] + 3 CO 2 + 9 H 2 O Al 2 O 3 tпл = 20450 С Al 2 O 3 + Na 3[Al. F 6] tпл = 6600 С tпроцесу ~ 9600 С t Al 2 O 3 → Al 3+ 3 - + Al. O 3
 Al 3+ К(-) + 3 e → Al A(+) 34 Al. O 3 – 12 e → 2 Al 2 O 3 + 3 O 2 K(-) та А(+) графітові С + О 2 → суміш СО 2 + СО При добуванні 1 т алюмінію згоряє 0, 7 т графіту Обсяги виробництва Fe – l Al - ll
Al 3+ К(-) + 3 e → Al A(+) 34 Al. O 3 – 12 e → 2 Al 2 O 3 + 3 O 2 K(-) та А(+) графітові С + О 2 → суміш СО 2 + СО При добуванні 1 т алюмінію згоряє 0, 7 т графіту Обсяги виробництва Fe – l Al - ll
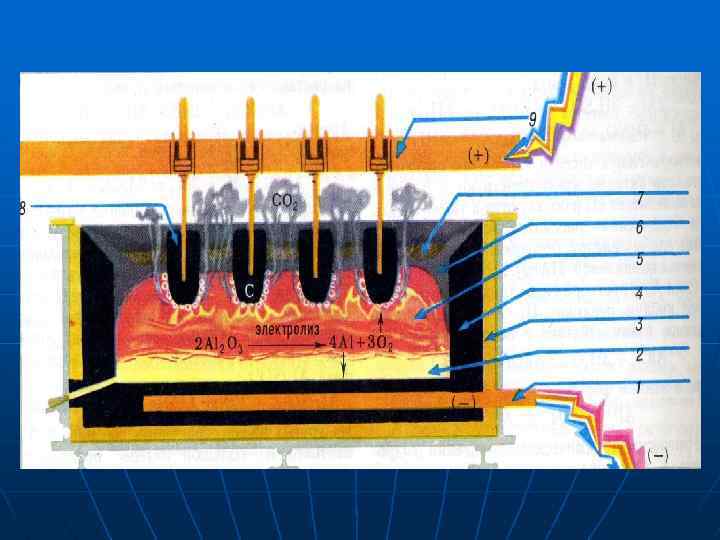
 1 -катод; 2 -розплавленний алюміній; 3 -теплова ізоляція; 4 -вугільна обкладка; 5 -розплавлений електроліт; 7 -шар Al 2 O 3; 8 -вугільні аноди. Електроліт для добування алюмінію складається з розплаву кріоліту Na 3[Al. F 6] і оксиду алюмінію Al 2 O 3. Електроди виготовляють з нафтового коксу, який складається майже з чистого вуглецю. Блоки з коксу, які вкривають дно і стінки ванни, відіграють роль катода. Аноди закріплюються на підвісній рамі і автоматично опускаються в залежності від того, як згоряють. Рідкий алюміній збирається на дні ванни, з якої його періодично випускають через похилий канал, який закривається глиняною пробкою. Процес іде безперервно.
1 -катод; 2 -розплавленний алюміній; 3 -теплова ізоляція; 4 -вугільна обкладка; 5 -розплавлений електроліт; 7 -шар Al 2 O 3; 8 -вугільні аноди. Електроліт для добування алюмінію складається з розплаву кріоліту Na 3[Al. F 6] і оксиду алюмінію Al 2 O 3. Електроди виготовляють з нафтового коксу, який складається майже з чистого вуглецю. Блоки з коксу, які вкривають дно і стінки ванни, відіграють роль катода. Аноди закріплюються на підвісній рамі і автоматично опускаються в залежності від того, як згоряють. Рідкий алюміній збирається на дні ванни, з якої його періодично випускають через похилий канал, який закривається глиняною пробкою. Процес іде безперервно.
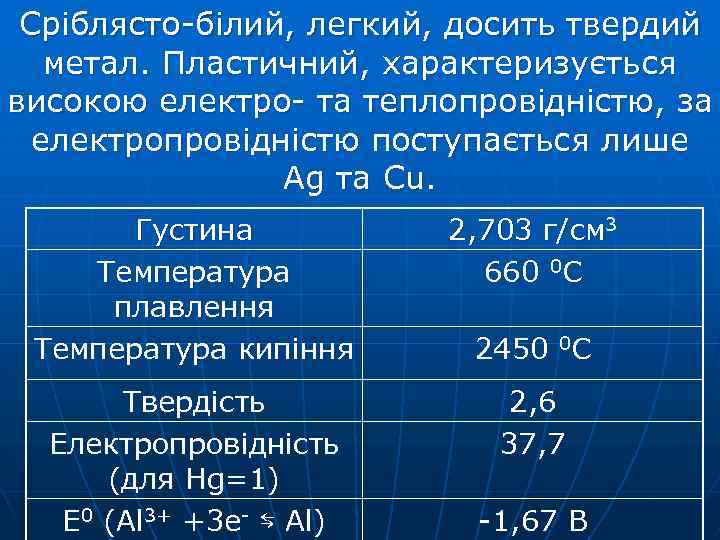 Сріблясто-білий, легкий, досить твердий метал. Пластичний, характеризується високою електро- та теплопровідністю, за електропровідністю поступається лише Ag та Cu. Густина Температура плавлення Температура кипіння 2, 703 г/см 3 660 0 С Твердість Електропровідність (для Hg=1) Е 0 (Al 3+ +3 e- ⇆ Al) 2, 6 37, 7 2450 0 С -1, 67 B
Сріблясто-білий, легкий, досить твердий метал. Пластичний, характеризується високою електро- та теплопровідністю, за електропровідністю поступається лише Ag та Cu. Густина Температура плавлення Температура кипіння 2, 703 г/см 3 660 0 С Твердість Електропровідність (для Hg=1) Е 0 (Al 3+ +3 e- ⇆ Al) 2, 6 37, 7 2450 0 С -1, 67 B
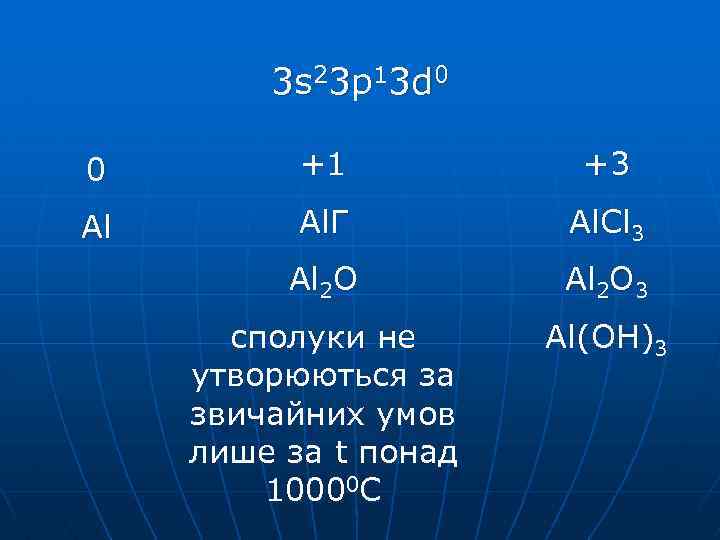 3 s 23 p 13 d 0 0 +1 +3 Al Al. Г Al. Cl 3 Al 2 O 3 сполуки не утворюються за звичайних умов лише за t понад 10000 С Al(OH)3
3 s 23 p 13 d 0 0 +1 +3 Al Al. Г Al. Cl 3 Al 2 O 3 сполуки не утворюються за звичайних умов лише за t понад 10000 С Al(OH)3
 За нагрівання Al реагує з усіма неметалами, крім водню 2 Al + 3 Г 2 → 2 Al. Г 3 (Г – F, Cl, Br, I) 4 Al + 3 O 2 → 2 Al 2 O 3 Поверхнева оксидна плівка легко руйнується ртутю 2 Al + 3 Hg. Cl 2 → 2 Al. Cl 3 + 3 Hg x. Al + y. Hg → Alx. Hgy 2 Al + 6 H 2 O → 2 Al(OH)3↓ + 3 H 2↑
За нагрівання Al реагує з усіма неметалами, крім водню 2 Al + 3 Г 2 → 2 Al. Г 3 (Г – F, Cl, Br, I) 4 Al + 3 O 2 → 2 Al 2 O 3 Поверхнева оксидна плівка легко руйнується ртутю 2 Al + 3 Hg. Cl 2 → 2 Al. Cl 3 + 3 Hg x. Al + y. Hg → Alx. Hgy 2 Al + 6 H 2 O → 2 Al(OH)3↓ + 3 H 2↑
 2 Al + 6 H+ → 2 Al 3+ + 3 H 2↑ 2 Al + 12 OH- + 3 H 2 O → 2[Al(OH)6]3 - + 3 H 2↑ 8 Al + 30 HNO 3(розв. ) → → 8 Al(NO 3)3 + 3 N 2 O +15 H 2 O (N 2 , NH 4 NO 3) Al + 6 HNO 3(конц. ) → Al(NO 3)3 + 3 NO 2 + + 3 H 2 O
2 Al + 6 H+ → 2 Al 3+ + 3 H 2↑ 2 Al + 12 OH- + 3 H 2 O → 2[Al(OH)6]3 - + 3 H 2↑ 8 Al + 30 HNO 3(розв. ) → → 8 Al(NO 3)3 + 3 N 2 O +15 H 2 O (N 2 , NH 4 NO 3) Al + 6 HNO 3(конц. ) → Al(NO 3)3 + 3 NO 2 + + 3 H 2 O
 2 Al + 4 H 2 SO 4(конц. ) → Al 2(SO 4)3 + S + 4 H 2 O t 8 Al + 3 Fe 3 O 4 → 9 Fe + 4 Al 2 O 3 Al + H 2 ↛ Al. Cl 3 + 3 Li. H → Al. H 3 + 3 Li. Cl біла аморфна речовина складу (Al. H 3)x 2 Al. H 3 >100 0 C → 2 Al + 3 H 2
2 Al + 4 H 2 SO 4(конц. ) → Al 2(SO 4)3 + S + 4 H 2 O t 8 Al + 3 Fe 3 O 4 → 9 Fe + 4 Al 2 O 3 Al + H 2 ↛ Al. Cl 3 + 3 Li. H → Al. H 3 + 3 Li. Cl біла аморфна речовина складу (Al. H 3)x 2 Al. H 3 >100 0 C → 2 Al + 3 H 2
 Al. H 3 + 3 H 2 O → Al(OH)3 + 3 H 2↑ Al. H 3 реагує з гідридами лужних металів (за рахунок вакнтної р-орбіталі на валентному підрівні), утворюючи комплексні тетрагідриди Ме[Al. H 4] (Me – Li, Na, K), які легко руйнуються водою і є сильними відновниками Li[Al. H 4] + 4 H 2 O → Li. OH + Al(OH)3 +4 H 2↑ 3 Li. Al. H 4 + 4 CO 2 + 8 H 2 O → 4 CH 3 OH +
Al. H 3 + 3 H 2 O → Al(OH)3 + 3 H 2↑ Al. H 3 реагує з гідридами лужних металів (за рахунок вакнтної р-орбіталі на валентному підрівні), утворюючи комплексні тетрагідриди Ме[Al. H 4] (Me – Li, Na, K), які легко руйнуються водою і є сильними відновниками Li[Al. H 4] + 4 H 2 O → Li. OH + Al(OH)3 +4 H 2↑ 3 Li. Al. H 4 + 4 CO 2 + 8 H 2 O → 4 CH 3 OH +
 4 Al + 3 O 2 → 2 Al 2 O 3 (глинозем) – біла тугоплавка не розчинна у воді речовина Відомі дві кристалічні форми α – Al 2 O 3 450 -600 0 C Al(OH)3 → - H 2 O і Υ -Al 2 O 3 > 950 0 C Υ -Al 2 O 3 → α – Al 2 O 3 у природі зустрічається у вигляді мінералу корунду
4 Al + 3 O 2 → 2 Al 2 O 3 (глинозем) – біла тугоплавка не розчинна у воді речовина Відомі дві кристалічні форми α – Al 2 O 3 450 -600 0 C Al(OH)3 → - H 2 O і Υ -Al 2 O 3 > 950 0 C Υ -Al 2 O 3 → α – Al 2 O 3 у природі зустрічається у вигляді мінералу корунду
 α – Al 2 O 3 хімічно інертний Не розчиняється у воді, розчинах кислот і лугів Перевести α – Al 2 O 3 у розчинний стан можна сплавлянням з піросульфатом Na 2 S 2 O 7, содою або лугами t Al 2 O 3 + 3 Na 2 S 2 O 7 → Al 2(SO 4)3 + 3 Na 2 SO 4·SO 3 t Al 2 O 3 + Na 2 CO 3 → 2 Na. Al. O 2 + CO 2 t Al 2 O 3 + 2 Na. OH → 2 Na. Al. O 2 + H 2 O
α – Al 2 O 3 хімічно інертний Не розчиняється у воді, розчинах кислот і лугів Перевести α – Al 2 O 3 у розчинний стан можна сплавлянням з піросульфатом Na 2 S 2 O 7, содою або лугами t Al 2 O 3 + 3 Na 2 S 2 O 7 → Al 2(SO 4)3 + 3 Na 2 SO 4·SO 3 t Al 2 O 3 + Na 2 CO 3 → 2 Na. Al. O 2 + CO 2 t Al 2 O 3 + 2 Na. OH → 2 Na. Al. O 2 + H 2 O
 Υ -Al 2 O 3 не розчиняється у воді, але розчиняється у розчинах кислот та лугів Al 2 O 3 + 6 Na. OH + 3 H 2 O → 2 Na 3[Al(OH)6] Al 2 O 3 + 6 HCl + 3 H 2 O → 2[Al(H 2 O)6]Cl 3
Υ -Al 2 O 3 не розчиняється у воді, але розчиняється у розчинах кислот та лугів Al 2 O 3 + 6 Na. OH + 3 H 2 O → 2 Na 3[Al(OH)6] Al 2 O 3 + 6 HCl + 3 H 2 O → 2[Al(H 2 O)6]Cl 3
 Al 2(SO 4)3 + 6 Na. OH → 2 Al(OH)3↓ + Na 2 SO 4 Al 3+ + 3 OH- → Al(OH)3↓ Al(OH)3 – амфотерна сполука Al(OH)3 + 3 Н+ + 3 H 2 O → [Al(H 2 O)6]3+ Al(OH)3 + 3 OH- → [Al(OH)6]3 -
Al 2(SO 4)3 + 6 Na. OH → 2 Al(OH)3↓ + Na 2 SO 4 Al 3+ + 3 OH- → Al(OH)3↓ Al(OH)3 – амфотерна сполука Al(OH)3 + 3 Н+ + 3 H 2 O → [Al(H 2 O)6]3+ Al(OH)3 + 3 OH- → [Al(OH)6]3 -
![3 OH- 3 H 3 O [Al(H 2 O)6]3+ ⇄ +[Al (OH)3(H 2 O)3] 3 OH- 3 H 3 O [Al(H 2 O)6]3+ ⇄ +[Al (OH)3(H 2 O)3]](https://present5.com/presentation/-101136264_416166888/image-17.jpg) 3 OH- 3 H 3 O [Al(H 2 O)6]3+ ⇄ +[Al (OH)3(H 2 O)3] ⇄ [Al(OH)6]3+ [Al(OH)3]· 3 H 2 O Кислотні й основні властивості Al(OH)3 виражені слабко: HAl. O 2 ⇆ H+ - + Al. O 2 Al(OH)3 ⇆ Al 3+ + 3 OH- K = 4· 10 -13 K = 1· 10 -9
3 OH- 3 H 3 O [Al(H 2 O)6]3+ ⇄ +[Al (OH)3(H 2 O)3] ⇄ [Al(OH)6]3+ [Al(OH)3]· 3 H 2 O Кислотні й основні властивості Al(OH)3 виражені слабко: HAl. O 2 ⇆ H+ - + Al. O 2 Al(OH)3 ⇆ Al 3+ + 3 OH- K = 4· 10 -13 K = 1· 10 -9
 Al 2(SO 4)3 + 3 Na 2 CO 3 + 3 H 2 O → 2 Al(OH)3↓ + 3 CO 2↑ + 3 Na 2 SO 4 2 Al 3+ + 3 CO 32 - + 3 H 2 O → 2 Al(OH)3↓+3 CO 2↑ t 2 Na. Al. O 2 + CO 2 + 3 H 2 O → 2 Al(OH)3↓ + + Na 2 CO 3
Al 2(SO 4)3 + 3 Na 2 CO 3 + 3 H 2 O → 2 Al(OH)3↓ + 3 CO 2↑ + 3 Na 2 SO 4 2 Al 3+ + 3 CO 32 - + 3 H 2 O → 2 Al(OH)3↓+3 CO 2↑ t 2 Na. Al. O 2 + CO 2 + 3 H 2 O → 2 Al(OH)3↓ + + Na 2 CO 3
 Al 2(SO 4)3 + 6 NH 4 OH → 2 Al. O(OH)↓ + + 3(NH 4)2 SO 4 + 2 H 2 O “старіння” [Al(OH)3]n → [Al. O(OH)]n + n. H 2 O [Al. O(OH)]n → 0, 5 n. Al 2 O 3 + 0, 5 n. H 2 O
Al 2(SO 4)3 + 6 NH 4 OH → 2 Al. O(OH)↓ + + 3(NH 4)2 SO 4 + 2 H 2 O “старіння” [Al(OH)3]n → [Al. O(OH)]n + n. H 2 O [Al. O(OH)]n → 0, 5 n. Al 2 O 3 + 0, 5 n. H 2 O
 Гідроліз Al 2(SO 4)3 Al 3+ + H 2 O →
Гідроліз Al 2(SO 4)3 Al 3+ + H 2 O →
![[Al(H 2 O)6]3+ + H 2 O ⇆ [Al. OH(H 2 O)5]2+ + H [Al(H 2 O)6]3+ + H 2 O ⇆ [Al. OH(H 2 O)5]2+ + H](https://present5.com/presentation/-101136264_416166888/image-22.jpg) [Al(H 2 O)6]3+ + H 2 O ⇆ [Al. OH(H 2 O)5]2+ + H 3 O+
[Al(H 2 O)6]3+ + H 2 O ⇆ [Al. OH(H 2 O)5]2+ + H 3 O+
![[Al(H 2 O)6]3+ + H 2 O⇆ [Al. OH(H 2 O)5]2+ + H 3 [Al(H 2 O)6]3+ + H 2 O⇆ [Al. OH(H 2 O)5]2+ + H 3](https://present5.com/presentation/-101136264_416166888/image-23.jpg) [Al(H 2 O)6]3+ + H 2 O⇆ [Al. OH(H 2 O)5]2+ + H 3 O+ K = 1· 10 -5 [Al. OH(H 2 O)5]2+ + H 2 O ⇆ [Al(OH)2(H 2 O)4]+ + H 3 O+ [Al(OH)2(H 2 O)4]+ + H 2 O ⇆ [Al(OH)3(H 2 O)3] + H 3 O+
[Al(H 2 O)6]3+ + H 2 O⇆ [Al. OH(H 2 O)5]2+ + H 3 O+ K = 1· 10 -5 [Al. OH(H 2 O)5]2+ + H 2 O ⇆ [Al(OH)2(H 2 O)4]+ + H 3 O+ [Al(OH)2(H 2 O)4]+ + H 2 O ⇆ [Al(OH)3(H 2 O)3] + H 3 O+
 З галогенами Al взаємодіє дуже бурхливо з утворенням галогенідів Al. Г 3 2 Al + 3 Г 2 → 2 Al. Г 3 (Г – F, Cl, Br, I) Al. F 3 не розчинний у воді і має високу температуру плавлення (1040 0 С) t Al. F 3 + 3 Na. F → Na 3[Al. F 6]
З галогенами Al взаємодіє дуже бурхливо з утворенням галогенідів Al. Г 3 2 Al + 3 Г 2 → 2 Al. Г 3 (Г – F, Cl, Br, I) Al. F 3 не розчинний у воді і має високу температуру плавлення (1040 0 С) t Al. F 3 + 3 Na. F → Na 3[Al. F 6]
 Al 2 O 3 + 3 Cl 2 → 2 Al. Cl 3↑ + 3 CO↑ Al. Cl 3 + 3 H 2 O → Al(OH)3 + 3 HCl t Al. Cl 3· 6 H 2 O → Al(OH)3 + 3 H 2 O + 3 HCl↑
Al 2 O 3 + 3 Cl 2 → 2 Al. Cl 3↑ + 3 CO↑ Al. Cl 3 + 3 H 2 O → Al(OH)3 + 3 HCl t Al. Cl 3· 6 H 2 O → Al(OH)3 + 3 H 2 O + 3 HCl↑


 Сполуки з іншими неметалами 2 NH 3 + 2 Al → 2 Al. N + 3 H 2↑ Al. N + 3 H 2 O → Al(OH)3 + NH 3↑ Al 2 S 3 + 6 H 2 O → 2 Al(OH)3 + 3 H 2 S↑ Al 4 C 3 + 12 H 2 O → 4 Al(OH)3 + 3 CH 4↑
Сполуки з іншими неметалами 2 NH 3 + 2 Al → 2 Al. N + 3 H 2↑ Al. N + 3 H 2 O → Al(OH)3 + NH 3↑ Al 2 S 3 + 6 H 2 O → 2 Al(OH)3 + 3 H 2 S↑ Al 4 C 3 + 12 H 2 O → 4 Al(OH)3 + 3 CH 4↑
 Ga In Tl
Ga In Tl
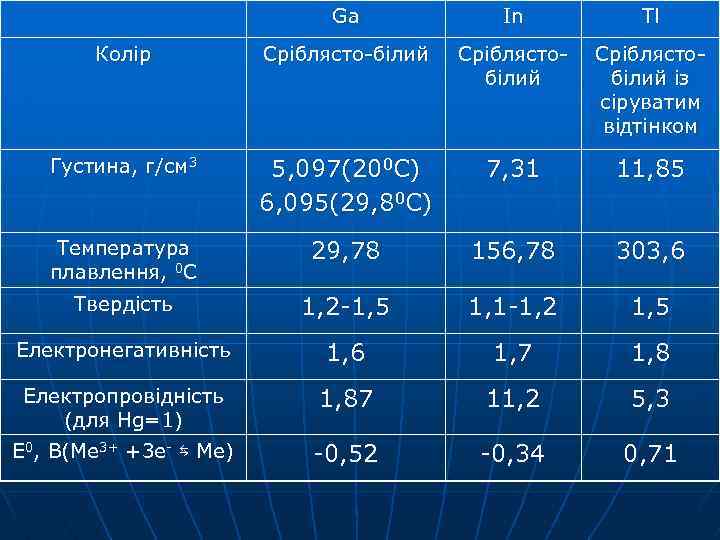 Ga In Tl Колір Сріблясто-білий Сріблястобілий із сіруватим відтінком Густина, г/см 3 5, 097(200 С) 6, 095(29, 80 С) 7, 31 11, 85 Температура плавлення, 0 С 29, 78 156, 78 303, 6 Твердість 1, 2 -1, 5 1, 1 -1, 2 1, 5 Електронегативність 1, 6 1, 7 1, 8 Електропровідність (для Hg=1) 1, 87 11, 2 5, 3 Е 0, В(Ме 3+ +3 e- ⇆ Ме) -0, 52 -0, 34 0, 71
Ga In Tl Колір Сріблясто-білий Сріблястобілий із сіруватим відтінком Густина, г/см 3 5, 097(200 С) 6, 095(29, 80 С) 7, 31 11, 85 Температура плавлення, 0 С 29, 78 156, 78 303, 6 Твердість 1, 2 -1, 5 1, 1 -1, 2 1, 5 Електронегативність 1, 6 1, 7 1, 8 Електропровідність (для Hg=1) 1, 87 11, 2 5, 3 Е 0, В(Ме 3+ +3 e- ⇆ Ме) -0, 52 -0, 34 0, 71
 Хімічні властивості На повітрі Ga та In зберігають блиск, а Tl на свіжому розрізі тьмяніє Ga та In по відношенню до води стійкі, а Tl за наявості повітря поступово нею руйнується Ga та In пасивуються нітратною кислотою 3 Tl + 4 HNO 3 → 3 Tl. NO 3 + NO + 2 H 2 O
Хімічні властивості На повітрі Ga та In зберігають блиск, а Tl на свіжому розрізі тьмяніє Ga та In по відношенню до води стійкі, а Tl за наявості повітря поступово нею руйнується Ga та In пасивуються нітратною кислотою 3 Tl + 4 HNO 3 → 3 Tl. NO 3 + NO + 2 H 2 O
 t In + 6 HNO 3 → In(NO 3)3 + 3 NO 2 + 3 H 2 O 2 Ga + 3 H 2 SO 4 → Ga 2(SO 4)3 + 3 H 2↑ 2 Ga + 2 Na. OH + 6 H 2 O → 2 Na[Ga(OH)4] + 3 H 2↑
t In + 6 HNO 3 → In(NO 3)3 + 3 NO 2 + 3 H 2 O 2 Ga + 3 H 2 SO 4 → Ga 2(SO 4)3 + 3 H 2↑ 2 Ga + 2 Na. OH + 6 H 2 O → 2 Na[Ga(OH)4] + 3 H 2↑
 За нагрівання усі три метали бурхливо взаємодіють з киснем Me + O 2 → Me 2 O 3 2 Tl + 3/2 O 2(г. ) → Tl 2 O 3(т. ) 2 Tl + 1/2 O 2(г. ) → Tl 2 O(т. ) t Tl 2 O 3 → Tl 2 O + O 2 Ga 2 O 3 In 2 O 3 Tl 2 O 3 білий жовтий чорний
За нагрівання усі три метали бурхливо взаємодіють з киснем Me + O 2 → Me 2 O 3 2 Tl + 3/2 O 2(г. ) → Tl 2 O 3(т. ) 2 Tl + 1/2 O 2(г. ) → Tl 2 O(т. ) t Tl 2 O 3 → Tl 2 O + O 2 Ga 2 O 3 In 2 O 3 Tl 2 O 3 білий жовтий чорний
 +3 Ga 2 O 3 In 2 O 3 Tl 2 O 3 основні властивості зростають Tl 2 O 3 + 6 HCl → 2 Tl. Cl 3 + 3 H 2 O Ga 2 O 3 + 2 KOH + 3 H 2 O → 2 K[Ga(OH)4] Me 2 O 3 + H 2 O ↛ [Me(H 2 O)6]3+ + 3 OH- → Me(OH)3↓ + 6 H 2 O
+3 Ga 2 O 3 In 2 O 3 Tl 2 O 3 основні властивості зростають Tl 2 O 3 + 6 HCl → 2 Tl. Cl 3 + 3 H 2 O Ga 2 O 3 + 2 KOH + 3 H 2 O → 2 K[Ga(OH)4] Me 2 O 3 + H 2 O ↛ [Me(H 2 O)6]3+ + 3 OH- → Me(OH)3↓ + 6 H 2 O
 Tl 2 SO 4 + 2 Na. OH + 2 H 2 O 2 → 2 Tl(OH)3↓ + + Na 2 SO 4 2 Tl(OH)3 → Tl 2 O 3 + 3 H 2 O Усі розчинні солі гідролізують [Me(H 2 O)6]3+ + H 2 O ⇆ [Me(OH)(H 2 O)5]2+ + + H 3 O+
Tl 2 SO 4 + 2 Na. OH + 2 H 2 O 2 → 2 Tl(OH)3↓ + + Na 2 SO 4 2 Tl(OH)3 → Tl 2 O 3 + 3 H 2 O Усі розчинні солі гідролізують [Me(H 2 O)6]3+ + H 2 O ⇆ [Me(OH)(H 2 O)5]2+ + + H 3 O+
![Сполуки з гідрогеном 4 Li. H + Me. Cl 3 → Li[Me. H 4] Сполуки з гідрогеном 4 Li. H + Me. Cl 3 → Li[Me. H 4]](https://present5.com/presentation/-101136264_416166888/image-36.jpg) Сполуки з гідрогеном 4 Li. H + Me. Cl 3 → Li[Me. H 4] + 3 Li. Cl - Ga. H 4 - In. H 4 - Tl. H 4 стійкість зменшується
Сполуки з гідрогеном 4 Li. H + Me. Cl 3 → Li[Me. H 4] + 3 Li. Cl - Ga. H 4 - In. H 4 - Tl. H 4 стійкість зменшується
 +1 Ga In Tl стійкість збільшується Найхарактерніша для талію 4 Tl + O 2 → 2 Tl 2 O Гідрооксид Tl(I) – жовта, кристалічна речовина, добре розчиняється у воді Tl 2 O + H 2 O → 2 Tl. OH
+1 Ga In Tl стійкість збільшується Найхарактерніша для талію 4 Tl + O 2 → 2 Tl 2 O Гідрооксид Tl(I) – жовта, кристалічна речовина, добре розчиняється у воді Tl 2 O + H 2 O → 2 Tl. OH
 2 Tl. OH + CO 2 → Tl 2 CO 3 + H 2 O Tl 2 CO 3 + CO 2 + H 2 O → 2 Tl(HCO 3) Більшість солей Tl(I) розчинні у воді і нагадують солі лужних металів t 2 Tl. OH → Tl 2 O + H 2 O Tl. Cl + KCl → K[Tl. Cl 2] Tl. Cl + 2 KCl → K 2[Tl. Cl 3]
2 Tl. OH + CO 2 → Tl 2 CO 3 + H 2 O Tl 2 CO 3 + CO 2 + H 2 O → 2 Tl(HCO 3) Більшість солей Tl(I) розчинні у воді і нагадують солі лужних металів t 2 Tl. OH → Tl 2 O + H 2 O Tl. Cl + KCl → K[Tl. Cl 2] Tl. Cl + 2 KCl → K 2[Tl. Cl 3]
 Застосування Серед металів Al посідає друге місце після заліза за обсягами використання. Світове виробицтво алюмінію сягає багатьох мільйонів тонн Металічний алюміній використовують для виробництва широкого асортименту електричного дроту для заміни(в міру можливості) дорогої міді
Застосування Серед металів Al посідає друге місце після заліза за обсягами використання. Світове виробицтво алюмінію сягає багатьох мільйонів тонн Металічний алюміній використовують для виробництва широкого асортименту електричного дроту для заміни(в міру можливості) дорогої міді
 Al застосовують в алюмотермії для добування металів і виготовлення фольги для конденсаторів, у харчовій промисловості Порошок алюмінію є основою алюмінієвої фарби Сплави алюмінію застосовують у ракетній техніці, авіа-, авто-, судно-, приладобудуванні, залізничному транспорті, хімічому апаратобудуванні
Al застосовують в алюмотермії для добування металів і виготовлення фольги для конденсаторів, у харчовій промисловості Порошок алюмінію є основою алюмінієвої фарби Сплави алюмінію застосовують у ракетній техніці, авіа-, авто-, судно-, приладобудуванні, залізничному транспорті, хімічому апаратобудуванні

 Серед сполук алюмінію найширше використовують сульфат алюмінію: для проклеювання паперу, “білого” дублення шкіри, протравлювання тканин перед фарбуванням, очищення води 3 Ca(HCO 3)2 + Al 2(SO 4)3 → 2 Al(OH)3 + Сорбент + 3 Ca. SO 4 + 6 CO 2↑ Малорозчинна сіль
Серед сполук алюмінію найширше використовують сульфат алюмінію: для проклеювання паперу, “білого” дублення шкіри, протравлювання тканин перед фарбуванням, очищення води 3 Ca(HCO 3)2 + Al 2(SO 4)3 → 2 Al(OH)3 + Сорбент + 3 Ca. SO 4 + 6 CO 2↑ Малорозчинна сіль
 α – Al 2 O 3 у вигляді корунду використовують як абразив, а Υ -Al 2 O 3 – як ефективний сорбент та каталізатор Рубіни широко використовуються у лазерній техніці, виробництві годинників, ювелірній справі
α – Al 2 O 3 у вигляді корунду використовують як абразив, а Υ -Al 2 O 3 – як ефективний сорбент та каталізатор Рубіни широко використовуються у лазерній техніці, виробництві годинників, ювелірній справі
 Ga, In і Tl поки що не знаходять широкого застосування внаслідок їх малої доступності і великої вартоcті Ga запропоновано використовувати у високотемпературних термометрах Він може замінити ртуть у дифузійних вакуумних насосах Галієві оптичні дзеркала мають велику відбивну здатність
Ga, In і Tl поки що не знаходять широкого застосування внаслідок їх малої доступності і великої вартоcті Ga запропоновано використовувати у високотемпературних термометрах Він може замінити ртуть у дифузійних вакуумних насосах Галієві оптичні дзеркала мають велику відбивну здатність
 Індій – для створення антикорозійних покрить Сполуки In. Sb, In. As – перспективні напівпровідники Талій застосовують у матеріалах для інфрачервоної оптики, для виготовлення оптичного скла застосовують Tl 2 CO 3
Індій – для створення антикорозійних покрить Сполуки In. Sb, In. As – перспективні напівпровідники Талій застосовують у матеріалах для інфрачервоної оптики, для виготовлення оптичного скла застосовують Tl 2 CO 3


