Шустов Александр Алюминий.pptx
- Количество слайдов: 10

Алюминий МЯГКИЙ, ЛЁГКИЙ МЕТАЛЛ СЕРЕБРИСТО БЕЛОГО ЦВЕТА.

13 Алюми ний Al Алюм иний 26, 982 3 s 23 p 1 элемент 13 й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Простое вещество алюминий (CAS номер: 7429 90 5) — лёгкий, парамагнитный металл серебри сто белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.

Свойства атома Имя, символ, номер Алюминий / Aluminium (Al), 13 Группа, период, блок 13, 3, Атомная масса (молярная масса) 26, 981539 а. е. м. (г/моль) Электронная конфигурация [Ne] 3 s 2 3 p 1 Электроны по оболочкам 2, 8, 3 Радиус атома 143 пм

Химические свойства Ковалентный радиус 121± 4 пм Радиус Ван-дер-Ваальса 184 пм Радиус иона 51 (+3 e) пм Электроотрицательность 1, 61 (шкала Полинга) Электродный потенциал -1, 66 В Степени окисления 3 Энергия ионизации 1 -я: 577. 5 к. Дж/моль (э. В) 2 -я: 1816. 7 к. Дж/моль (э. В)

Термодинамические свойства простого вещества Термодинамическая фаза Твёрдое вещество Плотность (при н. у. ) 2, 6989 г/см³ Температура плавления 660 °C, 933, 5 K Температура кипения 2518, 82 °C, 2792 K Теплота плавления 10, 75 к. Дж/моль Теплота испарения 284, 1 к. Дж/моль Молярная теплоёмкость 24, 35[1] Дж/(K·моль) Молярный объём 10, 0 см³/моль
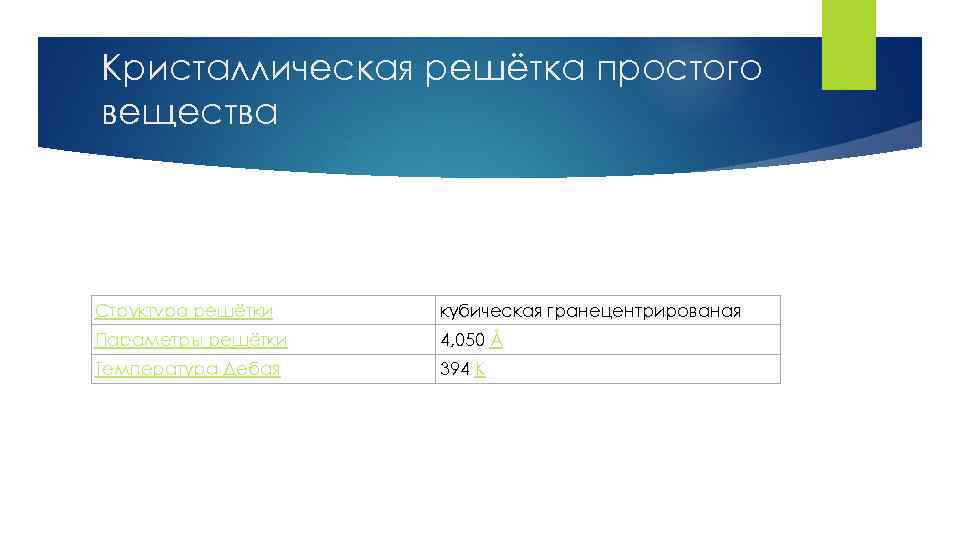
Кристаллическая решётка простого вещества Структура решётки кубическая гранецентрированая Параметры решётки 4, 050 Å Температура Дебая 394 K

Прочие характеристики Теплопроводность (300 K) 237 Вт/(м·К) Скорость звука 5200 м/с
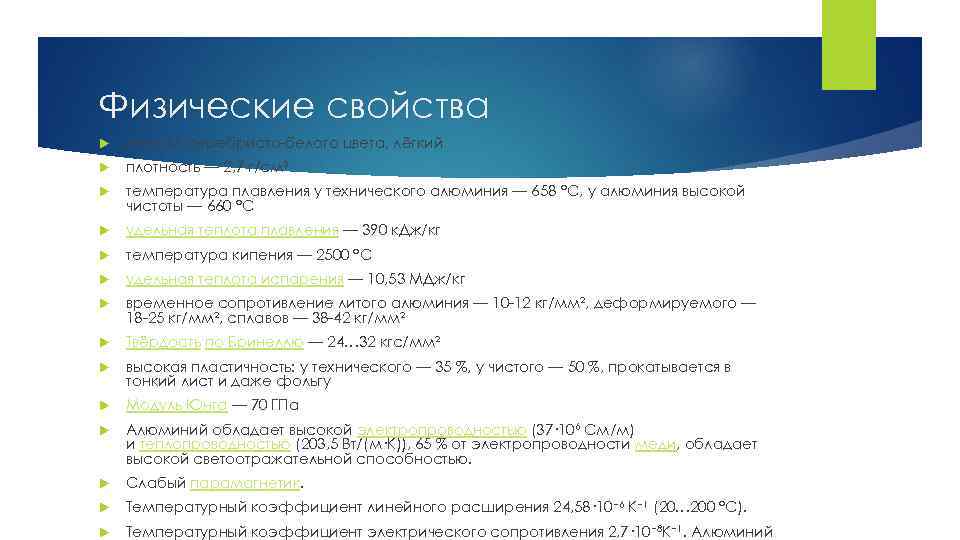
Физические свойства Металл серебристо-белого цвета, лёгкий плотность — 2, 7 г/см³ температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C удельная теплота плавления — 390 к. Дж/кг температура кипения — 2500 °C удельная теплота испарения — 10, 53 МДж/кг временное сопротивление литого алюминия — 10 -12 кг/мм², деформируемого — 18 -25 кг/мм², сплавов — 38 -42 кг/мм² Твёрдость по Бринеллю — 24… 32 кгс/мм² высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу Модуль Юнга — 70 ГПа Алюминий обладает высокой электропроводностью (37· 106 См/м) и теплопроводностью (203, 5 Вт/(м·К)), 65 % от электропроводности меди, обладает высокой светоотражательной способностью. Слабый парамагнетик. Температурный коэффициент линейного расширения 24, 58· 10− 6 К− 1 (20… 200 °C). Температурный коэффициент электрического сопротивления 2, 7· 10 − 8 K− 1. Алюминий

Химические свойства При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H 2 O (t°); O 2, HNO 3(без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH 4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл восстановитель. Легко реагирует с простыми веществами: • с кислородом, образуя оксид алюминия: 4 Al + 3 O 2 = 2 Al 2 O 3 • с галогенами (кроме фтора)[7], образуя хлорид, бромид или иодид алюминия: 2 Al + 3 Hal 2 = 2 Al. Hal 3 (Hal = Cl, Br, I) • с другими неметаллами реагирует при нагревании: • со фтором, образуя фторид алюминия: 2 Al + 3 F 2 = 2 Al. F 3 • с серой, образуя сульфид алюминия: 2 Al + 3 S = Al 2 S 3 • с азотом, образуя нитрид алюминия: 2 Al + N 2 = 2 Al. N • с углеродом, образуя карбид алюминия: 4 Al + 3 С = Al 4 С 3 Сульфид и карбид алюминия полностью гидролизуются: Al 2 S 3 + 6 H 2 O = 2 Al(OH)3 + 3 H 2 S Al 4 C 3 + 12 H 2 O = 4 Al(OH)3+ 3 CH 4 Со сложными веществами: • с водой (после удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи): 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 • со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов): 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 6 Na. OH + 2 Al = 2 Na 3 Al. O 3 + 3 H 2 • Легко растворяется в соляной и разбавленной серной кислотах: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 2 Al + 3 H 2 SO 4(разб) = Al 2(SO 4)3 + 3 H 2 • При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия: 8 Al + 15 H 2 SO 4(конц) = 4 Al 2(SO 4)3 + 3 H 2 S + 12 H 2 O Al + 6 HNO 3(конц) = Al(NO 3)3 + 3 NO 2 + 3 H 2 O • восстанавливает металлы из их оксидов (алюминотермия): 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe 2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr Гидроксид алюминия

Получение Алюминий образует прочную химическую связь с кислородом. По сравнению с другими металлами восстановление алюминия из руды более сложно в связи с его высокой реакционной способностью и с высокой температурой плавления большинства его руд (таких, как бокситы). Прямое восстановление углеродом применяться не может, потому что восстановительная способность алюминия выше, чем у углерода. Возможно непрямое восстановление с получением промежуточного продукта Al 4 C 3, который подвергается разложению при 1900— 2000 °С с образованием алюминия. Этот способ находится в разработке, но представляется более выгодным, чем процесс Холла—Эру, так как требует меньших энергозатрат и приводит к образованию меньшего количества CO 2[2]. работал Шустов Александ
Шустов Александр Алюминий.pptx