Алюминий и его соединения!.pptx
- Количество слайдов: 22

АЛЮМИНИЙ И ЕГО СОЕДИНЕНИЯ

Вопросы: 1. Общая характеристика главной подгруппы III группы 2. Нахождение в природе и получение алюминия 3. Химические свойства алюминия и его соединений 4. Физические свойства алюминия и его соединений 5. Применение алюминия и его соединений

ОБЩАЯ ХАРАКТЕРИСТИКА ПОДГРУППЫ Главная подгруппа III группы ПСХЭ включает в себя следующие элементы – бор, алюминий, галлий, индий и таллий Все эти элементы характеризуются дефицитом электронов, выражающимся в том, что на четыре валентные орбитали (внешнего энергетического уровня) у них имеются только три электрона. Этим определяется металлический характер большинства элементов этой группы. Характерная степень окисления +3, кроме таллия, у него степень окисления +1, что связано с особенностями строения атома этого элемента

ОБЩАЯ ХАРАКТЕРИСТИКА ПОДГРУППЫ Кроме бора все элементы являются типичными металлами. Алюминий и галлий проявляют амфотерные свойства В сложных веществах бор и алюминий всегда трехвалентны, так как их атомы находятся в возбужденном состоянии, т. е. наблюдается переход на внешнем энергетическом уровне 1 s электрона на свободную р-орбиталь У более тяжелых элементов этой группы постепенно увеличивается устойчивость одновалентного состояния
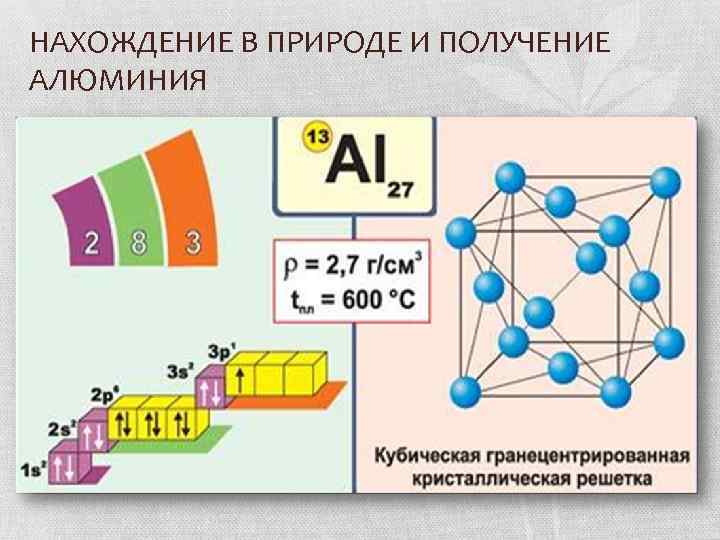
НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ

НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы Ганс Эрстедо

НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ По распространённости в земной коре Земли занимает 1 -е среди металлов и 3 -е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7, 45 до 8, 14 % от массы земной коры. В природе алюминий в связи с высокой химической активностью встречается почти исключительно в виде соединений.

НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ Бокситы — Al 2 O 3 ∙ H 2 O (с примесями Si. O 2, Fe 2 O 3, Ca. CO 3) Нефелины — KNa 3[Al. Si. O 4]4 Алуниты — (Na, K)2 SO 4∙Al 2(SO 4)3∙ 4 Al(OH)3 Глинозёмы (смеси каолинов с песком Si. O 2, известняком Ca. CO 3, магнезитом Mg. CO 3) Корунд (сапфир, рубин) — Al 2 O 3 Полевые шпаты — (K, Na)2 O∙Al 2 O 3∙ 6 Si. O 2, Ca[Al 2 Si 2 O 8] Берилл (изумруд, аквамарин) — 3 Ве. О ∙ Al 2 О 3 ∙ 6 Si. O 2 Хризоберилл (александрит) — Be. Al 2 O 4
![НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ криолит Na 3[AIF 6] каолин (глина) AI 2 НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ криолит Na 3[AIF 6] каолин (глина) AI 2](https://present5.com/presentation/133274630_358125833/image-9.jpg)
НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ криолит Na 3[AIF 6] каолин (глина) AI 2 О 3 ∙ 2 Si. О 2 ∙ 2 Н 2 О Впервые алюминий был получен из комплексного соединения Na[AICI 4] восстановлением натрием: Na[AICI 4] + 3 Na → AI + 4 Na. CI Алюминий был очень дорог и считался драгоценным металлом (в 1825 г. стоил в 1500 раз дороже железа)

НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ Бокситы АЛЮМИНИЯ Al O · H O 2 3 2 Корунд Al 2 O 3 Каолин Al 2 O 3· 2 Si. O 2 · 2 H 2 O Берилл 3 Ве. О · Al 2 О 3 · 6 Si. O 2

НАХОЖДЕНИЕ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ Современная эпоха широкого использования алюминия началась с изобретения в 1886 г. Ч. Холлом электролизного способа получения алюминия (ему был всего 21 год) Ч. Холл

ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ 1. Металлический алюминий образует сплавы со многими металлами. Один из широко известных сплавов дюралюминий, содержащий до 13% меди, а также добавки других металлов (магний и марганец). 2. Взаимодействует с простыми веществами: А) с хлором при комнатной t-ре: 2 AI + 3 CI 2 2 AICI 3 Б) с серой: 2 AI + 3 S AI 2 S 3 В) с азотом: 2 AI + N 2 2 AIN Г) с кислородом: 4 AI + 3 О 2 → AI 2 О 3

ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ В результате такого окисления на воздухе на поверхности алюминия образуется прочная защитная пленка оксида, плотно прилегающая к поверхности металла. Этим объясняется высокая стойкость алюминиевых изделий в атмосферных условиях. Пленка оксида предохраняет металл от дальнейшего окисления 3. Взаимодействует с водой, если снять с поверхности оксидную пленку: 2 AI + 6 Н 2 О → 2 AI(ОН)3 + 3 Н 2

ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ 4. Взаимодействует с разбавленными кислотами: 2 AI + 6 НCI → 2 AICI 3 + 3 Н 2↑ 5. Взаимодействует с горячей серной концентрированной кислотой. С другими концентрированными кислотами на холоду пассивирует, вследствие образования оксидной пленки: 2 AI + 6 H 2 SO 4(КОНЦ) → AI 2(SO 4)3 + 3 SO 2 + 6 H 2 O 6. Алюминий легко сплавляется со щелочами: 2 AI + 2 KOH + 2 H 2 O → 2 KAIO 2 + 3 Н 2 2 AI + 2 Na. OH + 6 H 2 O → 2 Na[AI(OН)4] + 3 Н 2

ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ 8. Алюминий восстанавливает металлы из их оксидов – алюмотермия: Cr 2 O 3 + 2 AI → 2 Cr + AI 2 О 3 9. Алюминия гидроксид, проявляя амфотерные свойства, взаимодействует со щелочами AI(ОН)3 + Na. OH нед → Nа. AIO 2 + Н 2 О → Na[AI(OН)4] AI(ОН)3 + 3 Na. OH изб → Na 3[AI(OН)6] 10. Алюминия оксид, взаимодействуя с растворами щелочей, образует алюминат: AI 2 О 3 + 2 Na. OH → 2 Nа. AIO 2 + Н 2 О

ФИЗИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ Алюминий является серебристо-белым металлом. Плотность алюминия 2, 7 г/см 3, следовательно, он относится к легким металлам, но очень прочным. Обладает высокой тепло- и электропроводностью. Хорошо подвергается обработке при температуре 100 -1500 С, т. е. прокатывается, куется, штампуется, вытягивается в проволоку При температуре 5000 С алюминий становится очень хрупким и может быть истолчен в мелкий порошок. При более высокой температуре вновь становится пластичным

ФИЗИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЧ И ЕГО СОЕДИНЕНИЙ

ПРИМЕНЕНИЕ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ Важнейшая область применения алюминия – производство легких сплавов на его основе. Алюминий используется для изготовления химической аппаратуры, электрических проводов. Алюминиевая фольга используется для изготовления конденсаторов Хлорид алюминия используется в качестве катализатора в органическом синтезе. Сульфат алюминия используется при крашении хлопчатобумажных тканей. Алюмокалиевые квасцы – КAI(SО 4)2 ∙ 12 Н 2 О применяют в медицине для прижиганий и как кровоостанавливающее средство и т. д

ПРИМЕНЕНИЕ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ

ПРИМЕНЕНИЕ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ Гидроксид алюминия применяется в качестве адсорбента: наружно – для присыпок, внутрь – при повышенной кислотности желудочного сока и при интоксикациях Жидкость Бурова (8% раствор ацетата алюминия) оказывает вяжущие и противовоспалительное действие; в больших концентрациях обладает умеренными антисептическими свойствами; в разведенном виде применяют для полоскания, примочек, при воспалительных заболеваниях кожи и слизистых оболочек
ПРИМЕНЕНИЕ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ

Литература: Основные источники: 1. Пустовалова Л. М. , Никанорова И. Е. «Неорганическая химия» , Ростов-на-Дону. Феникс. 2005. Дополнительные источники: 1. Аксенова Н. Ф. , Афанасьева М. Н. Пособие для учащихся «Окислительновосстановительные реакции» . Изд. ООО «Учитель» , Курск, 2005. - 135 с. 2. Ахметов Н. С. «Общая и неорганическая химия» , М. , Высшая школа, 2009. 3. Глинка Н. Л. «Общая химия» , Кно. Рус, 2009. Глинка Н. Л. Учебное пособие: Задачи и упражнения по общей химии. Изд. Интегралпресс, 2005. - 240 с. 4. Кузьменко Н. Е. , Еремин В. В. «Начала химии» . Современных курс для поступающих в вузы. , М. , Экзамен, 2002. 5. Тамаров М. А. Неорганическая химия. М. : Медицина, 1974. - 480 с. 6. Хомченко Г. П. «Химия для поступающих в вуз» . М. , Новая Волна, 2007. 7. Хомченко И. Г Сборник задач и упражнений по химии для средней школы. – М. : ООО «Изд. Новая волна» , 2001. – 222 с. 8. Чернобельская Г. М. , Чертков И. Н. Химия: Учебное пособие для медицинских образовательных учреждений. – М. : Дрофа. 2005. 9. Оганесян Э. Г. , Книжник А. З. «Неорганическая химия» . М. Медицина. 1989.
Алюминий и его соединения!.pptx