 АЛЮМИНИЙ
АЛЮМИНИЙ
 1. Электронное строение Аl 27 0 P+ = 13 e- = 13 n 0 = 14 +13 2 e 8 e 3 e 3 s 2 2 s 2 Порядок заполнения 3 p 1 2 p 6 1 s 2 Краткая электронная запись 2
1. Электронное строение Аl 27 0 P+ = 13 e- = 13 n 0 = 14 +13 2 e 8 e 3 e 3 s 2 2 s 2 Порядок заполнения 3 p 1 2 p 6 1 s 2 Краткая электронная запись 2
 Характеристика 1. 2. 3. 4. 5. 6. Находится в III группе, в главной подгруппе На наружном слое 3 электрона: 3 s 23 p 6 Р – элемент СО: 0, +3 Восстановитель Переходный элемент.
Характеристика 1. 2. 3. 4. 5. 6. Находится в III группе, в главной подгруппе На наружном слое 3 электрона: 3 s 23 p 6 Р – элемент СО: 0, +3 Восстановитель Переходный элемент.
 Физические свойства Серебристо-белый, легкий металл, механически прочный, обладает хорошей электро- и теплопроводностью, пластичен, tплавл = 6600 С, ρ = 2, 7 г/см 3 Поверхность алюминия всегда покрыта очень прочной оксидной пленкой оксида алюминия Аl 2 O 3
Физические свойства Серебристо-белый, легкий металл, механически прочный, обладает хорошей электро- и теплопроводностью, пластичен, tплавл = 6600 С, ρ = 2, 7 г/см 3 Поверхность алюминия всегда покрыта очень прочной оксидной пленкой оксида алюминия Аl 2 O 3
 Нахождение в природе В природе встречается только в виде соединений. Алюмосиликаты Na[Al. Si 3 O 8] Боксит Al 2 O 3 • n. H 2 O Нефелин Na[Al. Si. O 4]
Нахождение в природе В природе встречается только в виде соединений. Алюмосиликаты Na[Al. Si 3 O 8] Боксит Al 2 O 3 • n. H 2 O Нефелин Na[Al. Si. O 4]
 Химические свойства Взаимодействие с простыми веществами 1. с кислородом: 4 Al + 3 O 2 = 2 Al 2 O 3 Алюминий горит 2. с галогенами: 2 Al + 3 Br 2 = 2 Al. Br 3 + Q 2 Al + 3 I 2 = 2 Al I 3 + Q 3. с серой: t 2 Al + 3 S = Al 2 S 3 I.
Химические свойства Взаимодействие с простыми веществами 1. с кислородом: 4 Al + 3 O 2 = 2 Al 2 O 3 Алюминий горит 2. с галогенами: 2 Al + 3 Br 2 = 2 Al. Br 3 + Q 2 Al + 3 I 2 = 2 Al I 3 + Q 3. с серой: t 2 Al + 3 S = Al 2 S 3 I.
 Химические свойства II. Взаимодействие со сложными веществами 1. с водой: 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 2. с кислотами: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 3. со щелочами: 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 Если Na. OH в твердом состоянии: 2 Al + 2 Na. OH + 6 H 2 O = 2 Na. Al. O 2 + 3 H 2
Химические свойства II. Взаимодействие со сложными веществами 1. с водой: 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 2. с кислотами: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 3. со щелочами: 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 Если Na. OH в твердом состоянии: 2 Al + 2 Na. OH + 6 H 2 O = 2 Na. Al. O 2 + 3 H 2
 Химические свойства 4. С оксидами менее активных металлов 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe + Q 5. С солями менее активных металлов 2 Al + 3 Cu. SO 4 = Al 2(SO 4)3 + 3 Cu
Химические свойства 4. С оксидами менее активных металлов 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe + Q 5. С солями менее активных металлов 2 Al + 3 Cu. SO 4 = Al 2(SO 4)3 + 3 Cu
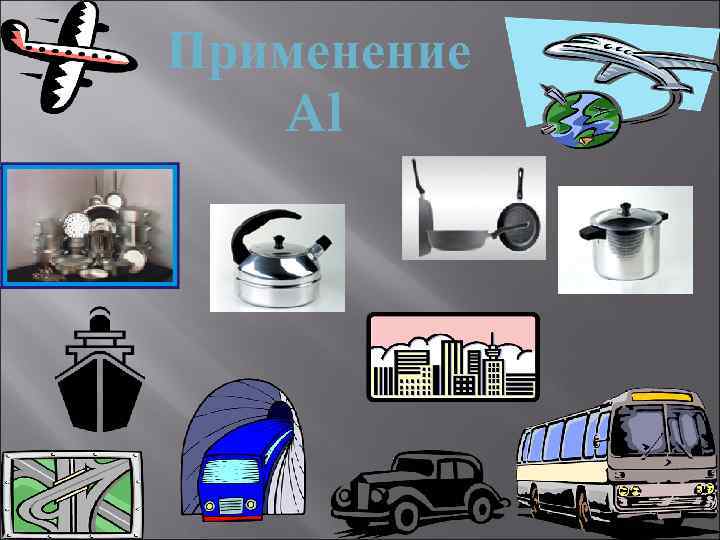 Применение Al
Применение Al
 Алюминий и его сплавы широко применяют как конструкционный материал
Алюминий и его сплавы широко применяют как конструкционный материал
 Из алюминия делают линии электропередач, ёмкости, цистерны, «серебряную» краску.
Из алюминия делают линии электропередач, ёмкости, цистерны, «серебряную» краску.