Алёхина Е.А. Механизмы взаимного влияния Алёхина Е.А. Межмолекулярные





























9186-4_mekhmy_vz-vl_khim_sv.ppt
- Количество слайдов: 47
 Алёхина Е.А. Механизмы взаимного влияния
Алёхина Е.А. Механизмы взаимного влияния
 Алёхина Е.А. Межмолекулярные взаимодействия Типы и характеристики химических связей Внутримолекулярные электронные взаимодействия Литература Содержание
Алёхина Е.А. Межмолекулярные взаимодействия Типы и характеристики химических связей Внутримолекулярные электронные взаимодействия Литература Содержание
 Алёхина Е.А. Механизмы взаимного влияния Межмолекулярное взаимодействие – это взаимодействие кинетически независимых частиц вещества (атомов, нейтральных молекул, одно- или многозарядных ионов), приводящих к изменению агрегатного состояния и его свойств.
Алёхина Е.А. Механизмы взаимного влияния Межмолекулярное взаимодействие – это взаимодействие кинетически независимых частиц вещества (атомов, нейтральных молекул, одно- или многозарядных ионов), приводящих к изменению агрегатного состояния и его свойств.
 Алёхина Е.А. Е = Еприт + Еотт, Межмолекулярные взаимодействия Выражение для потенциальной энергии межмолекулярного взаимодействия имеет вид: где: Е – энергия межмолекулярного взаимодействия, Еприт – энергия притяжения, Еприт – энергия отталкивания
Алёхина Е.А. Е = Еприт + Еотт, Межмолекулярные взаимодействия Выражение для потенциальной энергии межмолекулярного взаимодействия имеет вид: где: Е – энергия межмолекулярного взаимодействия, Еприт – энергия притяжения, Еприт – энергия отталкивания
 Алёхина Е.А. Еприт = Еор + Еинд + Едисп + Ерез, Межмолекулярные взаимодействия Энергия притяжения представляет собой сумму: где: Еор – энергия ориентационного взаимодействия, Еинд – энергия индукционного взаимодействия, Едисп – энергия дисперсионного взаимодействия, Ерез – энергия резонансного взаимодействия (обычно пренебрегают)
Алёхина Е.А. Еприт = Еор + Еинд + Едисп + Ерез, Межмолекулярные взаимодействия Энергия притяжения представляет собой сумму: где: Еор – энергия ориентационного взаимодействия, Еинд – энергия индукционного взаимодействия, Едисп – энергия дисперсионного взаимодействия, Ерез – энергия резонансного взаимодействия (обычно пренебрегают)
 Алёхина Е.А. Типы и характеристики химических связей органических соединений Электронная структура атома углерода Валентные состояния и типы гибридизации атома углерода в органических соединениях Различные виды перекрывания атомных орбиталей Типы химических связей Характеристики химических связей
Алёхина Е.А. Типы и характеристики химических связей органических соединений Электронная структура атома углерода Валентные состояния и типы гибридизации атома углерода в органических соединениях Различные виды перекрывания атомных орбиталей Типы химических связей Характеристики химических связей
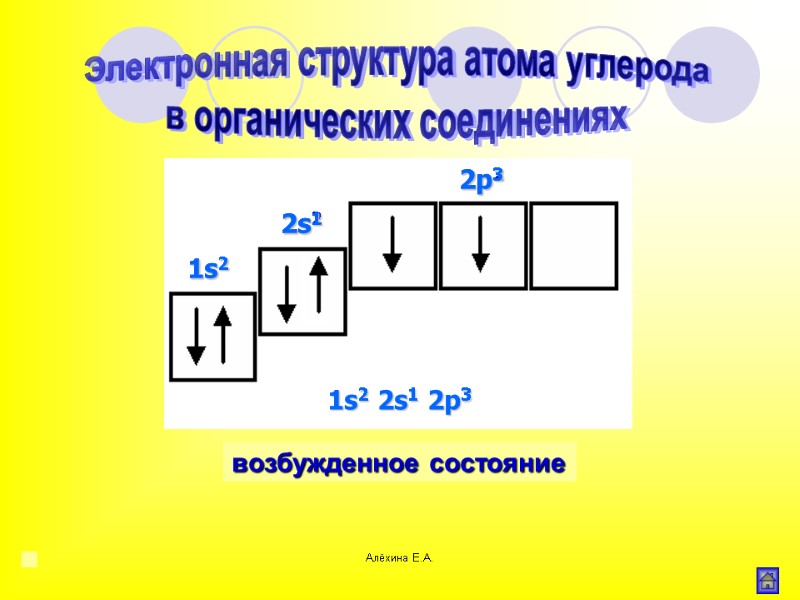
 Алёхина Е.А. основное состояние возбужденное состояние Электронная структура атома углерода в органических соединениях 1s2 2s2 2p2 1s2 2s1 2p3 2p2 2s2 1s2 2p3 2s1 1s2
Алёхина Е.А. основное состояние возбужденное состояние Электронная структура атома углерода в органических соединениях 1s2 2s2 2p2 1s2 2s1 2p3 2p2 2s2 1s2 2p3 2s1 1s2
 Алёхина Е.А. это часть пространства, в которой вероятность нахождения электрона максимальна. Атомная орбиталь
Алёхина Е.А. это часть пространства, в которой вероятность нахождения электрона максимальна. Атомная орбиталь
 Алёхина Е.А. Гибридизация Гибридизация в химии – это выравнивание электронных облаков по форме и энергии Гибридизация в биологии
Алёхина Е.А. Гибридизация Гибридизация в химии – это выравнивание электронных облаков по форме и энергии Гибридизация в биологии
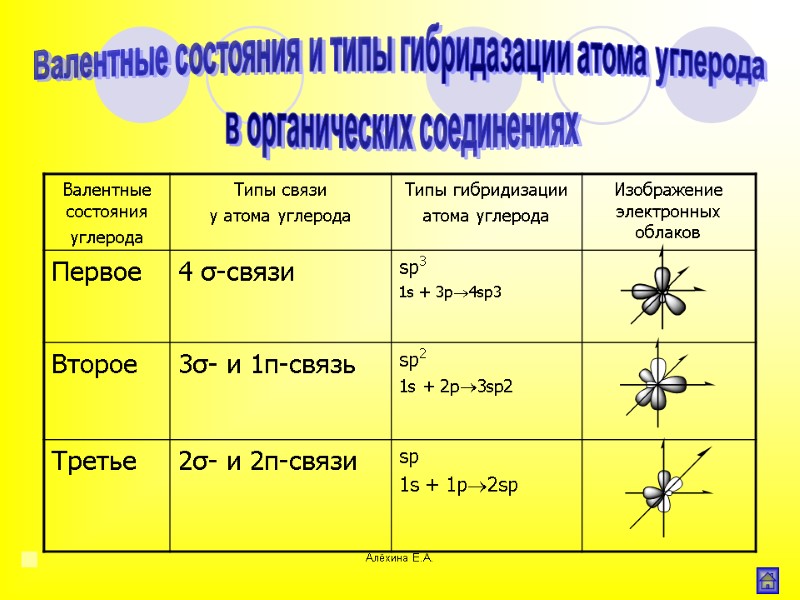
 Алёхина Е.А. Валентные состояния и типы гибридазации атома углерода в органических соединениях
Алёхина Е.А. Валентные состояния и типы гибридазации атома углерода в органических соединениях
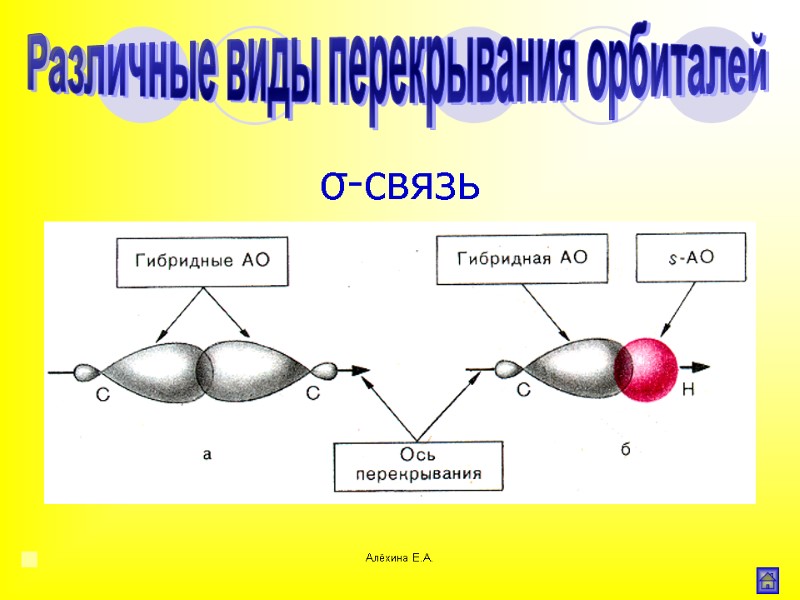
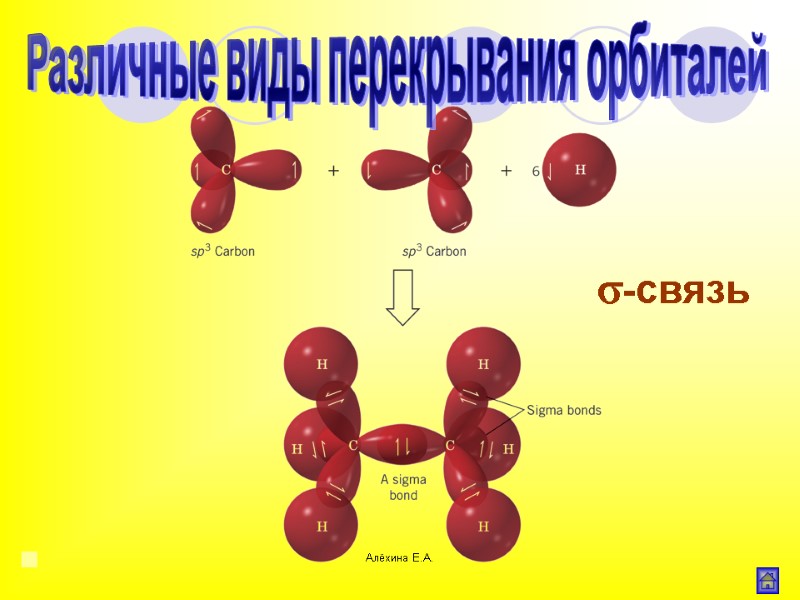
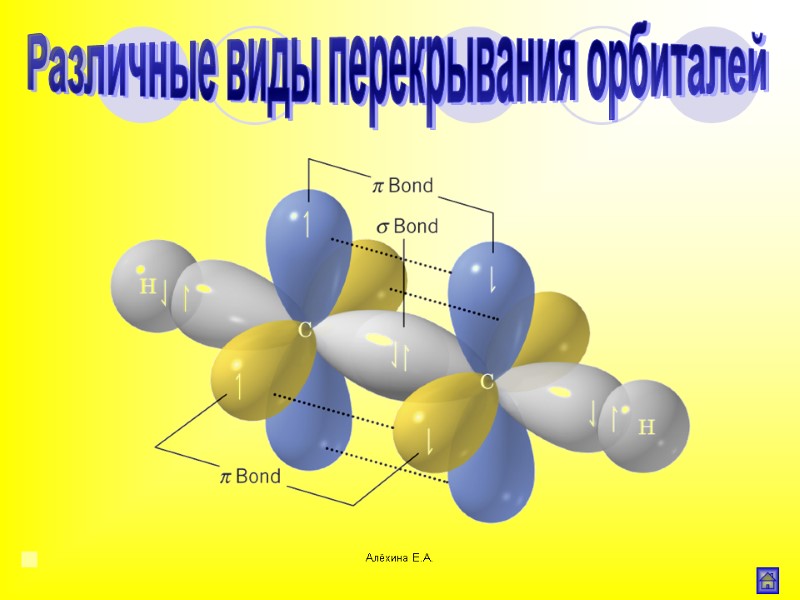
 Алёхина Е.А. σ-связь Область максимального перекрывания электронной плотности или перекрывания электронных орбиталей лежит на линии соединяющей центры атомов. Различные виды перекрывания орбиталей
Алёхина Е.А. σ-связь Область максимального перекрывания электронной плотности или перекрывания электронных орбиталей лежит на линии соединяющей центры атомов. Различные виды перекрывания орбиталей
 Алёхина Е.А. σ-связь Различные виды перекрывания орбиталей
Алёхина Е.А. σ-связь Различные виды перекрывания орбиталей
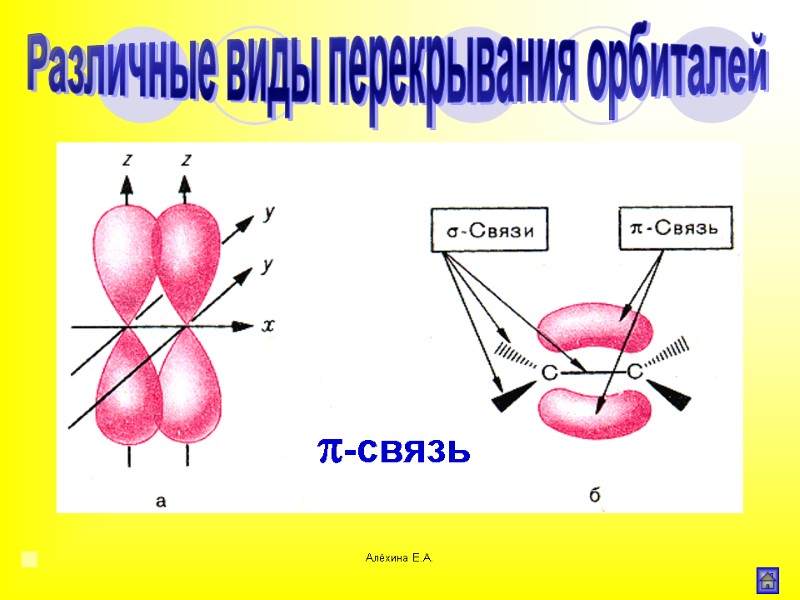
 Алёхина Е.А. Связь образованная при перекрывании р- орбиталей соседних атомов Различные виды перекрывания орбиталей -связь
Алёхина Е.А. Связь образованная при перекрывании р- орбиталей соседних атомов Различные виды перекрывания орбиталей -связь
 Алёхина Е.А. π-связь Различные виды перекрывания орбиталей -связь
Алёхина Е.А. π-связь Различные виды перекрывания орбиталей -связь
 Алёхина Е.А. -связь Различные виды перекрывания орбиталей
Алёхина Е.А. -связь Различные виды перекрывания орбиталей
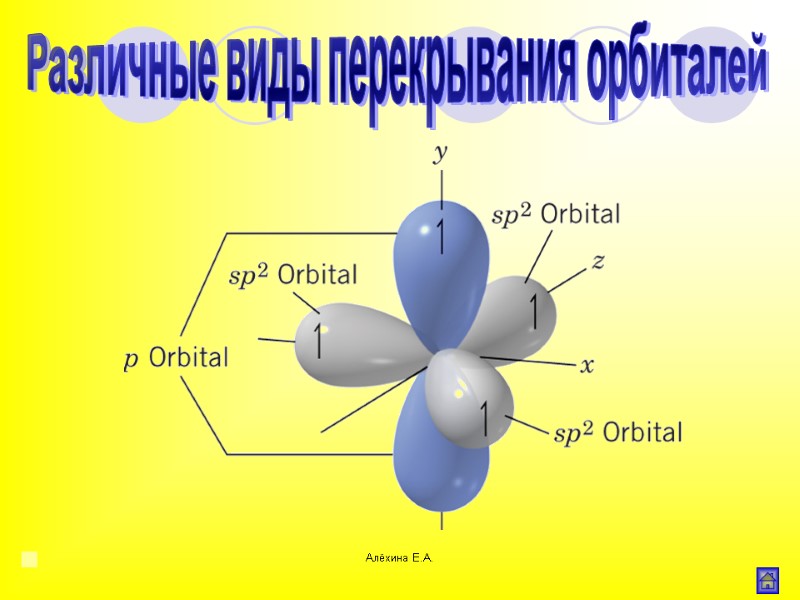
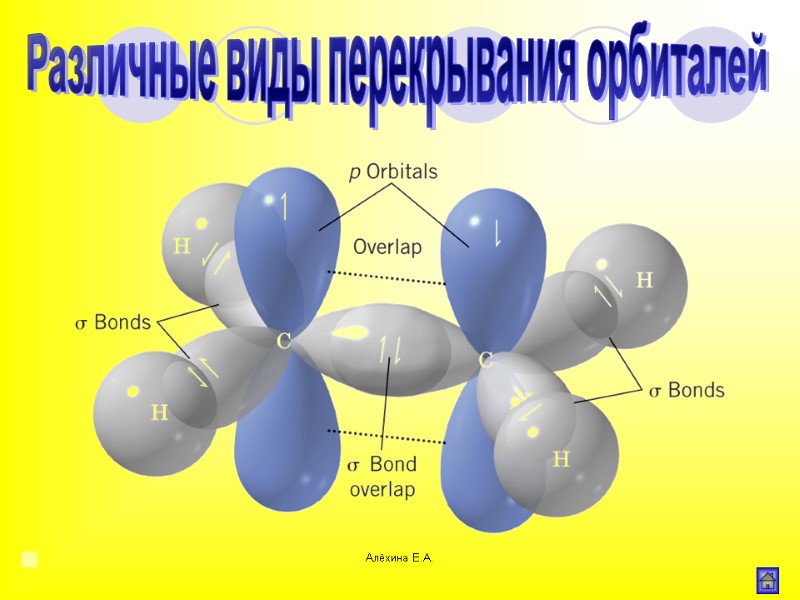
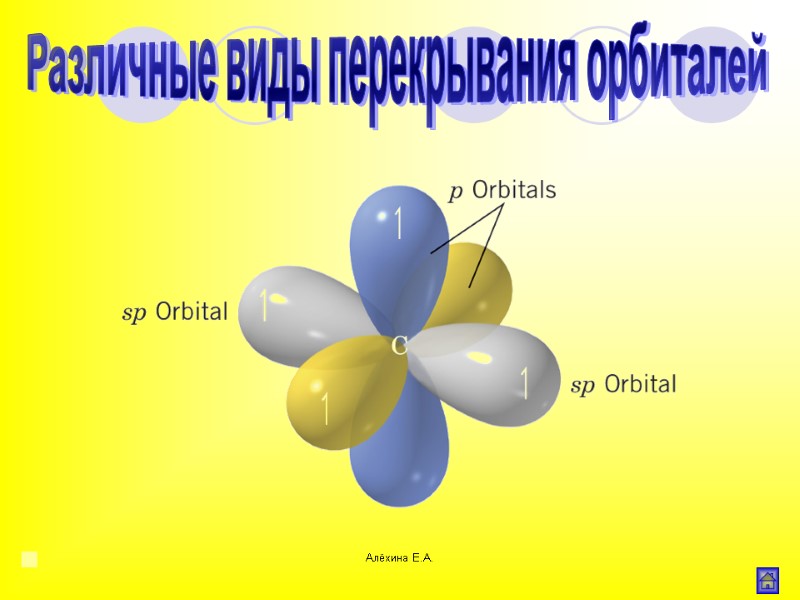
 Алёхина Е.А. Различные виды перекрывания орбиталей
Алёхина Е.А. Различные виды перекрывания орбиталей
 Алёхина Е.А. Различные виды перекрывания орбиталей
Алёхина Е.А. Различные виды перекрывания орбиталей
 Алёхина Е.А. Различные виды перекрывания орбиталей
Алёхина Е.А. Различные виды перекрывания орбиталей
 Алёхина Е.А. Различные виды перекрывания орбиталей
Алёхина Е.А. Различные виды перекрывания орбиталей
 Алёхина Е.А. Ионная (гетерополярная) связь СН3СООNa Ковалентная (гомеополярная) связь СН3-СН3, Cl-Cl Донорноакцепторная (координационная) связь :NH3 + Н+ 3HN:+Н [NH4]+ CH3-NH2 + Н+ CH3-NH3+ Семи(полу)полярная связь А: + В А+:В– (или АВ) Водородная связь Внутримолекулярная Межмолекулярная (ДНК и РНК) (вода, спирты, карб.кислоты) Основные типы химической связи в органических соединениях
Алёхина Е.А. Ионная (гетерополярная) связь СН3СООNa Ковалентная (гомеополярная) связь СН3-СН3, Cl-Cl Донорноакцепторная (координационная) связь :NH3 + Н+ 3HN:+Н [NH4]+ CH3-NH2 + Н+ CH3-NH3+ Семи(полу)полярная связь А: + В А+:В– (или АВ) Водородная связь Внутримолекулярная Межмолекулярная (ДНК и РНК) (вода, спирты, карб.кислоты) Основные типы химической связи в органических соединениях
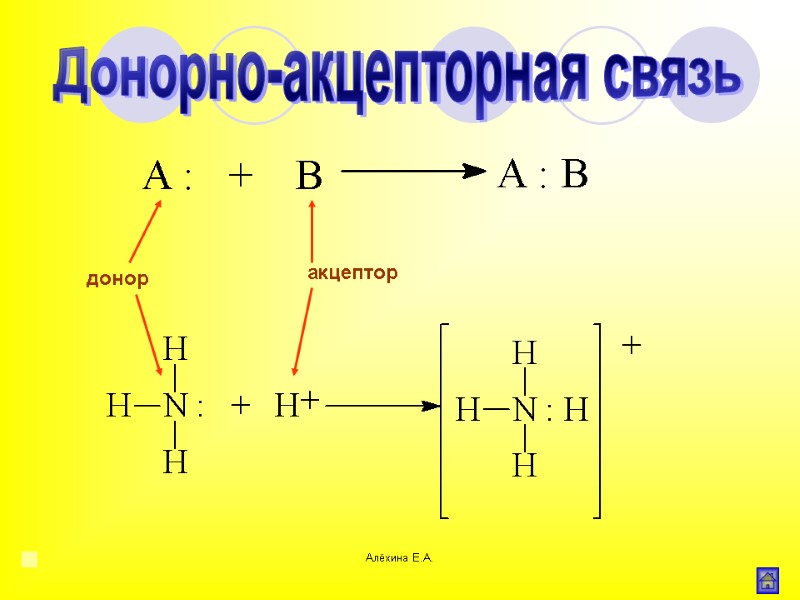
 Алёхина Е.А. донор акцептор Донорно-акцепторная связь
Алёхина Е.А. донор акцептор Донорно-акцепторная связь
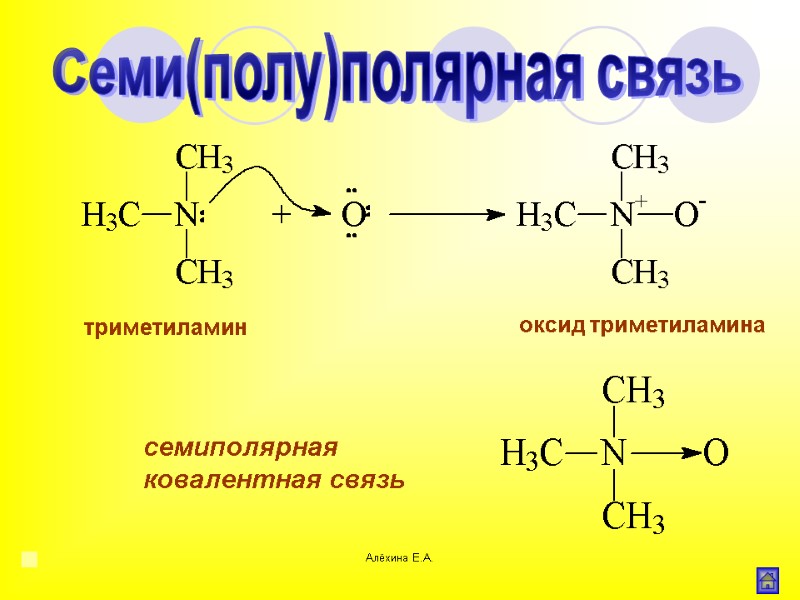
 Алёхина Е.А. триметиламин оксид триметиламина семиполярная ковалентная связь Семи(полу)полярная связь
Алёхина Е.А. триметиламин оксид триметиламина семиполярная ковалентная связь Семи(полу)полярная связь
 Алёхина Е.А. Водородная связь осуществляется при участии электроно-дефицитного атома водорода, ковалентно связанного с электроотрицательным атомом (фтор, кислород, азот). Он способен к дополнительному электростатическому взаимодействию с другим атомом, имеющим неподеленную пару электронов. Энергия водородных связей значительно меньше, чем ковалентных, т.е. они менее прочные. Существуют меж- и внутримолекулярные водородные связи, т. е. возникающие между атомами разных или одной и той же молекулы. Водородная связь 12,5—20 кДж/моль
Алёхина Е.А. Водородная связь осуществляется при участии электроно-дефицитного атома водорода, ковалентно связанного с электроотрицательным атомом (фтор, кислород, азот). Он способен к дополнительному электростатическому взаимодействию с другим атомом, имеющим неподеленную пару электронов. Энергия водородных связей значительно меньше, чем ковалентных, т.е. они менее прочные. Существуют меж- и внутримолекулярные водородные связи, т. е. возникающие между атомами разных или одной и той же молекулы. Водородная связь 12,5—20 кДж/моль
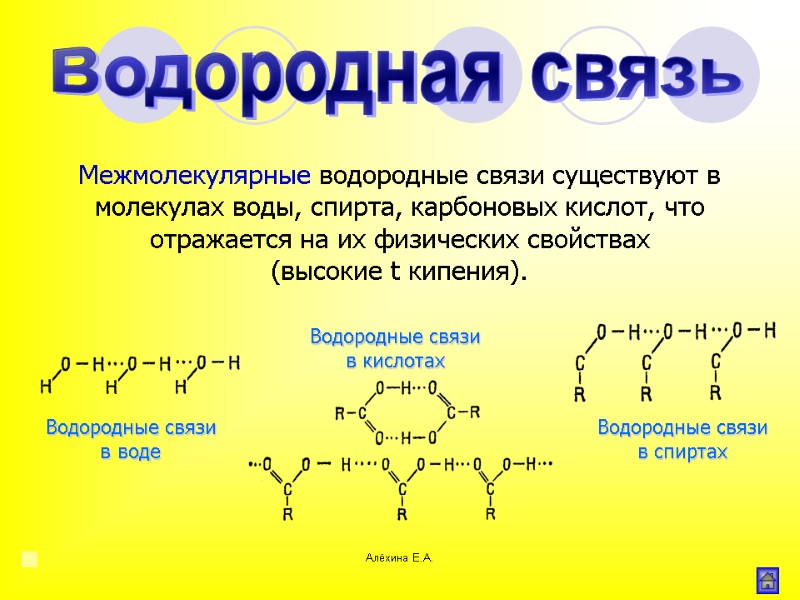
 Алёхина Е.А. Межмолекулярные водородные связи существуют в молекулах воды, спирта, карбоновых кислот, что отражается на их физических свойствах (высокие t кипения). Водородная связь Водородные связи в воде Водородные связи в спиртах Водородные связи в кислотах
Алёхина Е.А. Межмолекулярные водородные связи существуют в молекулах воды, спирта, карбоновых кислот, что отражается на их физических свойствах (высокие t кипения). Водородная связь Водородные связи в воде Водородные связи в спиртах Водородные связи в кислотах
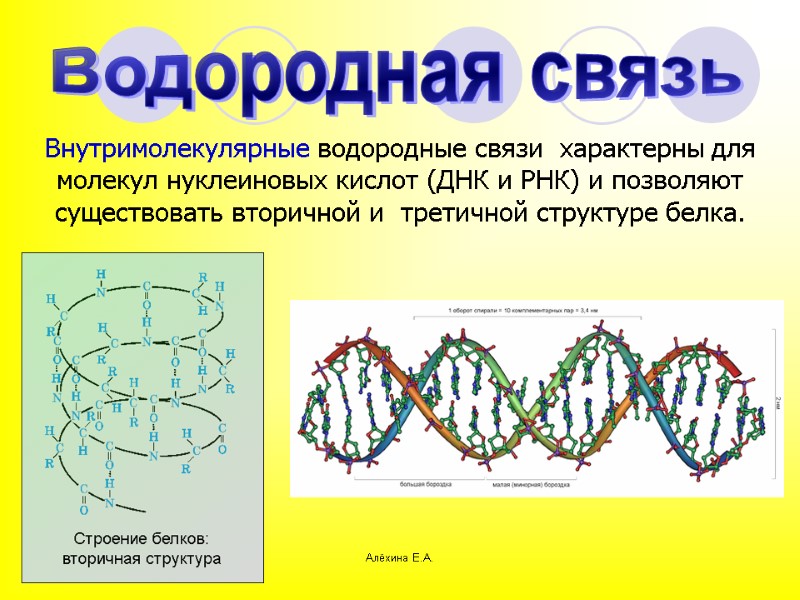
 Алёхина Е.А. Водородная связь Внутримолекулярные водородные связи характерны для молекул нуклеиновых кислот (ДНК и РНК) и позволяют существовать вторичной и третичной структуре белка.
Алёхина Е.А. Водородная связь Внутримолекулярные водородные связи характерны для молекул нуклеиновых кислот (ДНК и РНК) и позволяют существовать вторичной и третичной структуре белка.
 Алёхина Е.А. Прочность связи Энергия связи – энергия, затрачиваемая на разрыв этой связи или выделяющаяся при ее образовании в расчете на 1 моль частиц. Длина – равновесное расстояние между центрами ядер. Значения длины С-С связи колеблются от 1,204 до 1,543 А, в зависимости от типа гибридизации. Валентный угол для sp3-гибридных он равен 109,5, для sp2-гибридных – 120, для sp-гибридных – 180. Полярность (поляризуемость) Дипольный момент для ковалентных связей от 0 до 3, для координационных 2-7, для ионных выше 7. Характеристики химической связи в органических соединениях
Алёхина Е.А. Прочность связи Энергия связи – энергия, затрачиваемая на разрыв этой связи или выделяющаяся при ее образовании в расчете на 1 моль частиц. Длина – равновесное расстояние между центрами ядер. Значения длины С-С связи колеблются от 1,204 до 1,543 А, в зависимости от типа гибридизации. Валентный угол для sp3-гибридных он равен 109,5, для sp2-гибридных – 120, для sp-гибридных – 180. Полярность (поляризуемость) Дипольный момент для ковалентных связей от 0 до 3, для координационных 2-7, для ионных выше 7. Характеристики химической связи в органических соединениях
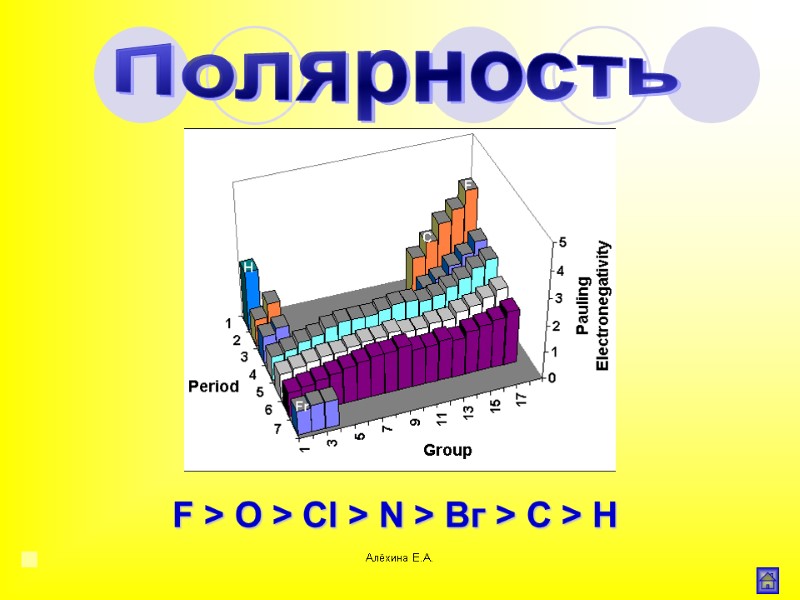
 Алёхина Е.А. F > O > Сl > N > Вг > С > Н Полярность
Алёхина Е.А. F > O > Сl > N > Вг > С > Н Полярность
 Алёхина Е.А. Полярность
Алёхина Е.А. Полярность
 Алёхина Е.А. способность изменять свою полярность, например, под влиянием внешнего воздействия. -связи поляризуются гораздо легче, чем -связи Поляризуемость
Алёхина Е.А. способность изменять свою полярность, например, под влиянием внешнего воздействия. -связи поляризуются гораздо легче, чем -связи Поляризуемость
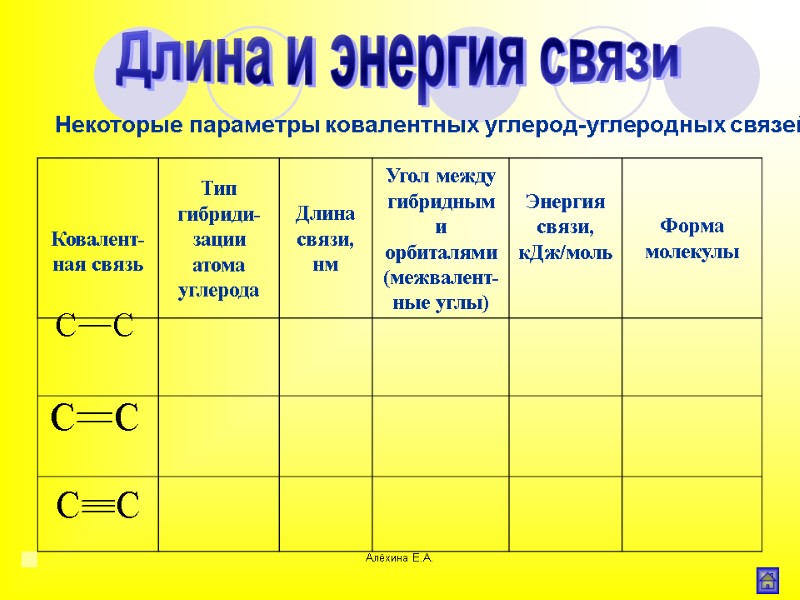
 Алёхина Е.А. Некоторые параметры ковалентных углерод-углеродных связей Длина и энергия связи
Алёхина Е.А. Некоторые параметры ковалентных углерод-углеродных связей Длина и энергия связи
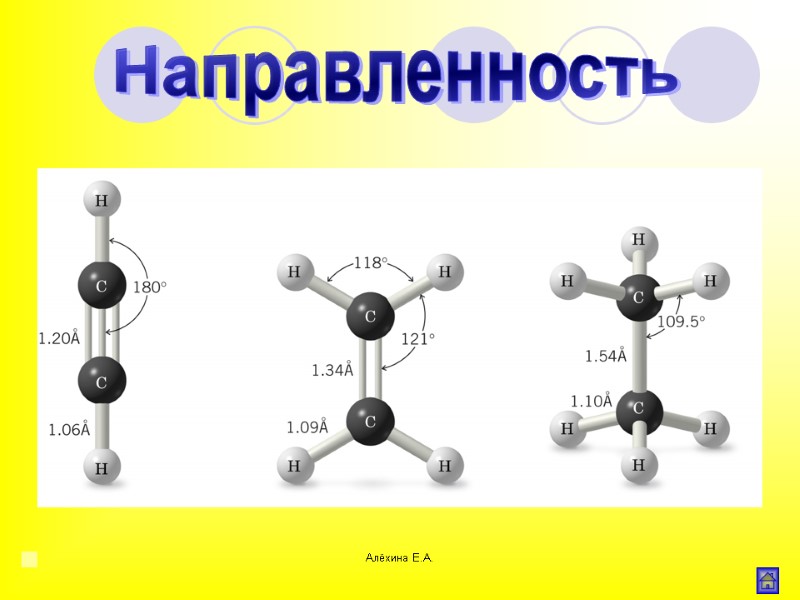
 Алёхина Е.А. Направленность
Алёхина Е.А. Направленность
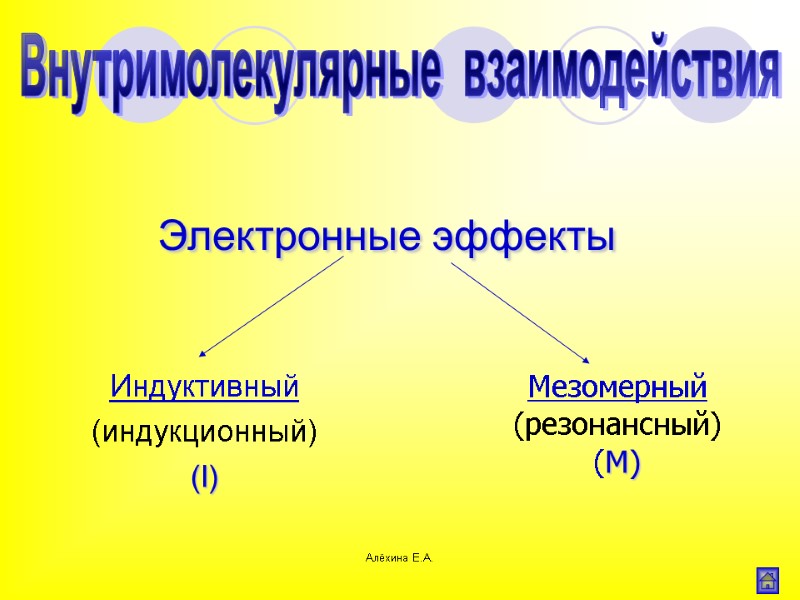
 Алёхина Е.А. Электронные эффекты Индуктивный (индукционный) (I) Внутримолекулярные взаимодействия Мезомерный (резонансный) (M)
Алёхина Е.А. Электронные эффекты Индуктивный (индукционный) (I) Внутримолекулярные взаимодействия Мезомерный (резонансный) (M)
 Алёхина Е.А. смещение электронной плотности по -связи в сторону более электроотрицательного атома элемента или группы атомов. СН3 – СН2 – СН2 – Cl Знак эффекта определяется зарядом, приобретаемым заместителем после смещения электронной плотности Например: – I В цепи индуктивный эффект затухает Индуктивный эффект (I)
Алёхина Е.А. смещение электронной плотности по -связи в сторону более электроотрицательного атома элемента или группы атомов. СН3 – СН2 – СН2 – Cl Знак эффекта определяется зарядом, приобретаемым заместителем после смещения электронной плотности Например: – I В цепи индуктивный эффект затухает Индуктивный эффект (I)
 Алёхина Е.А. Знак эффекта определяется зарядом, приобретаемым заместителем после смещения электронной плотности или Если смещение электронной плотности от углеродной основы, то «–», а если не углеродную основу, то «+»). Индуктивный эффект (I)
Алёхина Е.А. Знак эффекта определяется зарядом, приобретаемым заместителем после смещения электронной плотности или Если смещение электронной плотности от углеродной основы, то «–», а если не углеродную основу, то «+»). Индуктивный эффект (I)
 Алёхина Е.А. Дают те атомы и группы атомов, которые обладают большей электроотрицательностью, чем углерод. Они оттягивают электронную плотность на себя. Отрицательный индуктивный эффект (-I) Х = -Hal; -СN; -NO2; -OH; -CHO; -COOH; - COOR и т.д.
Алёхина Е.А. Дают те атомы и группы атомов, которые обладают большей электроотрицательностью, чем углерод. Они оттягивают электронную плотность на себя. Отрицательный индуктивный эффект (-I) Х = -Hal; -СN; -NO2; -OH; -CHO; -COOH; - COOR и т.д.
 Алёхина Е.А. Дают атомы и группы атомы, которые имеют элетроотрицательность меньшую по сравнению с углеродом. Отдают свою электронную плотность. Положительный индуктивный эффект (+I) где Х= -СН3; -CH2–CH3 и т.д.
Алёхина Е.А. Дают атомы и группы атомы, которые имеют элетроотрицательность меньшую по сравнению с углеродом. Отдают свою электронную плотность. Положительный индуктивный эффект (+I) где Х= -СН3; -CH2–CH3 и т.д.
 Алёхина Е.А. 1. Величина индуктивного эффекта растет с увеличением заряда заместителя Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта
Алёхина Е.А. 1. Величина индуктивного эффекта растет с увеличением заряда заместителя Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта
 Алёхина Е.А. 2. Чем больше электроотрицательность, тем сильнее отрицательный индуктивный эффект. В изоэлектронном ряду он растет слева направо, в группах снизу вверх. Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта -I растет -I растет
Алёхина Е.А. 2. Чем больше электроотрицательность, тем сильнее отрицательный индуктивный эффект. В изоэлектронном ряду он растет слева направо, в группах снизу вверх. Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта -I растет -I растет
 Алёхина Е.А. 3. У заместителей с кратными связями чем больше кратность, тем сильнее отрицательный индуктивный эффект Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта -I растет
Алёхина Е.А. 3. У заместителей с кратными связями чем больше кратность, тем сильнее отрицательный индуктивный эффект Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта -I растет
 Алёхина Е.А. 4. Алкильные группы проявляют положительный индуктивный эффект тем сильнее, чем выше разветвленность Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта + I растет
Алёхина Е.А. 4. Алкильные группы проявляют положительный индуктивный эффект тем сильнее, чем выше разветвленность Индуктивный эффект Закономерности изменения величины и знака индуктивного эффекта + I растет
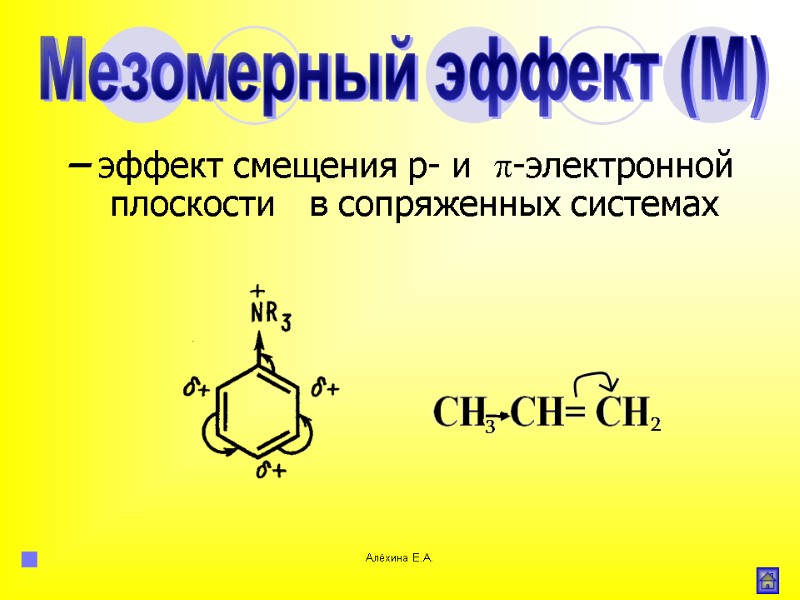
 Алёхина Е.А. – эффект смещения р- и -электронной плоскости в сопряженных системах Мезомерный эффект (М)
Алёхина Е.А. – эффект смещения р- и -электронной плоскости в сопряженных системах Мезомерный эффект (М)
 Алёхина Е.А. +М обладают электронодонорные группы -R; -Hal; -OH; -NH2 и т.д. -СN; -NO2; -CHO; -COOH; - COOR; -SO3H и т.д. Мезомерный эффект -М обладают электроноакцепторные группы (содержат неподеленные электронные пары) (содержат кратные связи)
Алёхина Е.А. +М обладают электронодонорные группы -R; -Hal; -OH; -NH2 и т.д. -СN; -NO2; -CHO; -COOH; - COOR; -SO3H и т.д. Мезомерный эффект -М обладают электроноакцепторные группы (содержат неподеленные электронные пары) (содержат кратные связи)
 Алёхина Е.А. 1. Величина мезомерного эффекта растет с увеличением заряда заместителя - М растет - М убывает Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
Алёхина Е.А. 1. Величина мезомерного эффекта растет с увеличением заряда заместителя - М растет - М убывает Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
 Алёхина Е.А. Отрицательный мезомерный эффект тем сильнее, чем больше электроотрицательность находящихся в заместителе атомов. - М растет - М растет Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
Алёхина Е.А. Отрицательный мезомерный эффект тем сильнее, чем больше электроотрицательность находящихся в заместителе атомов. - М растет - М растет Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
 Алёхина Е.А. Отрицательный мезомерный эффект заместителей тем сильнее, чем меньше их внутренняя мезомерия -М растет Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
Алёхина Е.А. Отрицательный мезомерный эффект заместителей тем сильнее, чем меньше их внутренняя мезомерия -М растет Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
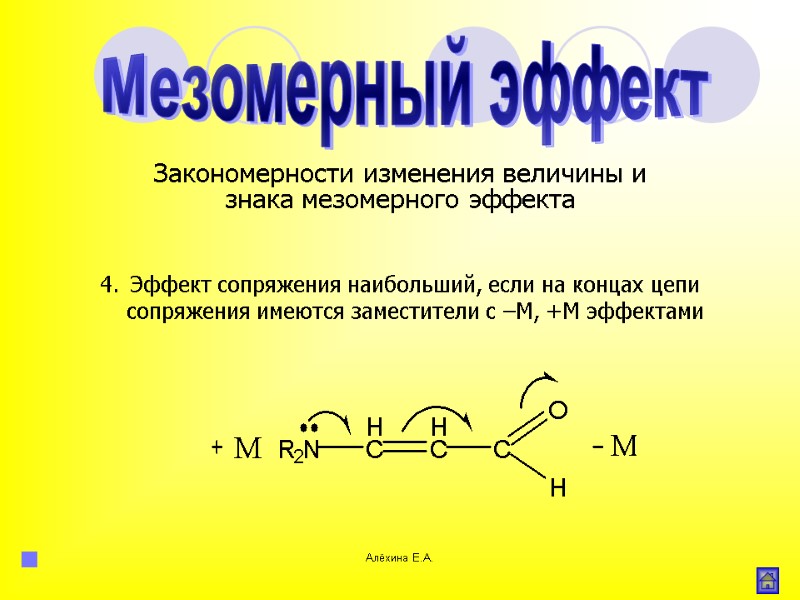
 Алёхина Е.А. Эффект сопряжения наибольший, если на концах цепи сопряжения имеются заместители с –М, +М эффектами Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
Алёхина Е.А. Эффект сопряжения наибольший, если на концах цепи сопряжения имеются заместители с –М, +М эффектами Мезомерный эффект Закономерности изменения величины и знака мезомерного эффекта
 Алёхина Е.А. Литература Ким А.М. Органическая химия. – Новосибирск: Сиб. унив. изд-во, 2004. – 842 с. Перекалин В.В. и др. Органическая химия. – М.: Просвещение, – М., 1982. – 560 с. Степаненко Б.Н. Курс органической химии. В 2-х т. – М.: Высшая школа, 1981. Травень В.Ф. Органическая химия. В 2-х т. – М.: ИКЦ «Академкнига», 2005. Шабаров Ю.С. Органическая химия. В 2-х т. – М.: Химия, 1996.
Алёхина Е.А. Литература Ким А.М. Органическая химия. – Новосибирск: Сиб. унив. изд-во, 2004. – 842 с. Перекалин В.В. и др. Органическая химия. – М.: Просвещение, – М., 1982. – 560 с. Степаненко Б.Н. Курс органической химии. В 2-х т. – М.: Высшая школа, 1981. Травень В.Ф. Органическая химия. В 2-х т. – М.: ИКЦ «Академкнига», 2005. Шабаров Ю.С. Органическая химия. В 2-х т. – М.: Химия, 1996.

