Аллотропия v.1.0.ppt
- Количество слайдов: 14
 АЛЛОТРОПИЯ
АЛЛОТРОПИЯ
 Основные понятия Прежде чем приступить к рассмотрению аллотропных модификаций конкретных химических элементов вспомним некоторые базовые понятия и принципы. Главный принцип: свойства материальной системы определяются её составом и строением. Этот принцип является общим принципом природы, мы будем его применять по отношению к веществам. Если состав двух веществ одинаков, но строение различное, то и свойства у этих веществ будут разными. Одним из самых ярких примеров являются графит и алмаз – оба эти вещества состоят только из атомов углерода, но соединены эти атомы по-разному, что приводит к кардинально различающимся свойствам: Подробнее эти вещества будут рассмотрены ниже. а) б) Строение кристаллических решеток алмаза (а) и графита (б) и изображения самородного алмаза и графита
Основные понятия Прежде чем приступить к рассмотрению аллотропных модификаций конкретных химических элементов вспомним некоторые базовые понятия и принципы. Главный принцип: свойства материальной системы определяются её составом и строением. Этот принцип является общим принципом природы, мы будем его применять по отношению к веществам. Если состав двух веществ одинаков, но строение различное, то и свойства у этих веществ будут разными. Одним из самых ярких примеров являются графит и алмаз – оба эти вещества состоят только из атомов углерода, но соединены эти атомы по-разному, что приводит к кардинально различающимся свойствам: Подробнее эти вещества будут рассмотрены ниже. а) б) Строение кристаллических решеток алмаза (а) и графита (б) и изображения самородного алмаза и графита
 Основные понятия Аллотропия – явление существования химического элемента в виде нескольких простых веществ. Например, химический элемент кислород может существовать в виде простых веществ дикислорода O 2 и озона O 3. Аллотропные модификации – простые вещества, в виде которых существуют химические элементы. Примеры рассмотрим ниже – это все-таки основной материал презентации : ) Сведем в одну таблицу все аллотропные модификации, которые нужно знать или иметь о них представление. В первом столбце указан символ химического элемента, во втором те аллотропные модификации, которые входят в школьный курс, в третьем аллотропные модификации, которые (по современным представлениям) реально существуют в природе. Последняя фраза нуждается в примере. В школе у водорода нет аллотропных модификаций, но при переходе в ВУЗ химической направленности у водорода сразу появляется 2 аллотропные модификации (орто- и пара-водород).
Основные понятия Аллотропия – явление существования химического элемента в виде нескольких простых веществ. Например, химический элемент кислород может существовать в виде простых веществ дикислорода O 2 и озона O 3. Аллотропные модификации – простые вещества, в виде которых существуют химические элементы. Примеры рассмотрим ниже – это все-таки основной материал презентации : ) Сведем в одну таблицу все аллотропные модификации, которые нужно знать или иметь о них представление. В первом столбце указан символ химического элемента, во втором те аллотропные модификации, которые входят в школьный курс, в третьем аллотропные модификации, которые (по современным представлениям) реально существуют в природе. Последняя фраза нуждается в примере. В школе у водорода нет аллотропных модификаций, но при переходе в ВУЗ химической направленности у водорода сразу появляется 2 аллотропные модификации (орто- и пара-водород).
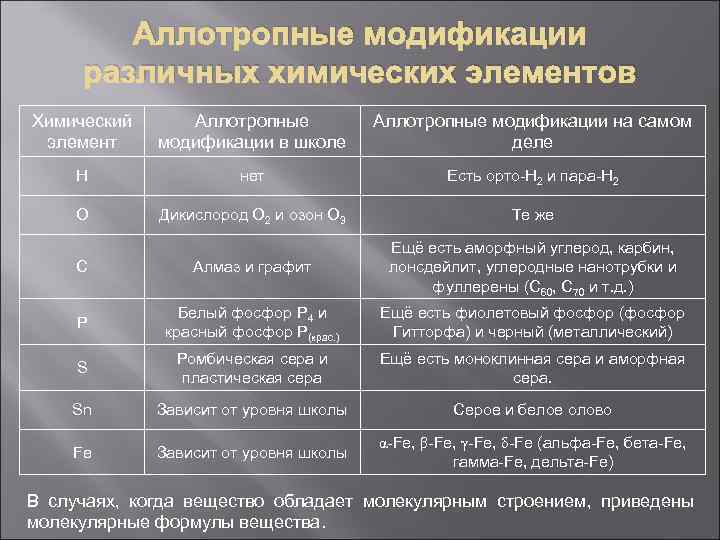 Аллотропные модификации различных химических элементов Химический элемент Аллотропные модификации в школе Аллотропные модификации на самом деле H нет Есть орто-H 2 и пара-Н 2 O Дикислород О 2 и озон О 3 Те же C Алмаз и графит Ещё есть аморфный углерод, карбин, лонсдейлит, углеродные нанотрубки и фуллерены (C 60, С 70 и т. д. ) P Белый фосфор P 4 и красный фосфор P(крас. ) Ещё есть фиолетовый фосфор (фосфор Гитторфа) и черный (металлический) S Ромбическая сера и пластическая сера Ещё есть моноклинная сера и аморфная сера. Sn Зависит от уровня школы Серое и белое олово Fe Зависит от уровня школы α-Fe, β-Fe, γ-Fe, δ-Fe (альфа-Fe, бета-Fe, гамма-Fe, дельта-Fe) В случаях, когда вещество обладает молекулярным строением, приведены молекулярные формулы вещества.
Аллотропные модификации различных химических элементов Химический элемент Аллотропные модификации в школе Аллотропные модификации на самом деле H нет Есть орто-H 2 и пара-Н 2 O Дикислород О 2 и озон О 3 Те же C Алмаз и графит Ещё есть аморфный углерод, карбин, лонсдейлит, углеродные нанотрубки и фуллерены (C 60, С 70 и т. д. ) P Белый фосфор P 4 и красный фосфор P(крас. ) Ещё есть фиолетовый фосфор (фосфор Гитторфа) и черный (металлический) S Ромбическая сера и пластическая сера Ещё есть моноклинная сера и аморфная сера. Sn Зависит от уровня школы Серое и белое олово Fe Зависит от уровня школы α-Fe, β-Fe, γ-Fe, δ-Fe (альфа-Fe, бета-Fe, гамма-Fe, дельта-Fe) В случаях, когда вещество обладает молекулярным строением, приведены молекулярные формулы вещества.
 Аллотропные модификации различных химических элементов Примечание № 1. Те аллотропные модификации, которые располагаются во втором столбике (школьный уровень) нужно знать всем. Те аллотропные модификации, которые расположены в третьем столбике, необходимо знать или иметь представление о них (особенно о модификациях углерода и олова) людям, собирающимся участвовать в химических олимпиадах. Примечание № 2. На зачетах и экзаменах в школе лучше не выпендриваться и не говорить о том, о чем имеете слабое представление. Так что не всегда имеет смысл даже упоминать всякую экзотику типа фиолетового фосфора (фосфора Гитторфа). Проще будет ограничиться четким и прочным знанием школьного курса, а то можно получить логичный вопрос об упомянутой экзотике : ) Примечание № 3. Презентация будет постоянно обновляться, на данном этапе она содержит подробные сведения только об аллотропных модификациях кислорода, углерода и фосфора.
Аллотропные модификации различных химических элементов Примечание № 1. Те аллотропные модификации, которые располагаются во втором столбике (школьный уровень) нужно знать всем. Те аллотропные модификации, которые расположены в третьем столбике, необходимо знать или иметь представление о них (особенно о модификациях углерода и олова) людям, собирающимся участвовать в химических олимпиадах. Примечание № 2. На зачетах и экзаменах в школе лучше не выпендриваться и не говорить о том, о чем имеете слабое представление. Так что не всегда имеет смысл даже упоминать всякую экзотику типа фиолетового фосфора (фосфора Гитторфа). Проще будет ограничиться четким и прочным знанием школьного курса, а то можно получить логичный вопрос об упомянутой экзотике : ) Примечание № 3. Презентация будет постоянно обновляться, на данном этапе она содержит подробные сведения только об аллотропных модификациях кислорода, углерода и фосфора.
 Аллотропные модификации кислорода Дикислород О 2 Озон О 3 1) Строение молекулы линейное: 1) Строение молекулы угловое: О О–О О 2) Газообразный О 2 - бесцветный Жидкий О 2 – светло-голубой 2) Газообразный О 3 – голубой Жидкий О 3 – темно-синий tпл = - 219˚С tкип = - 183˚С tпл = - 193˚С tкип = - 112˚С жидкий O 2 3) Парамагнитен магнитное поле) 4) Окислитель О жидкий O 3 (втягивается в 3) Диамагнитен (выталкивается из магнитного поля) 4) Более сильный окислитель Состав и строение молекул разные, следовательно, разные свойства
Аллотропные модификации кислорода Дикислород О 2 Озон О 3 1) Строение молекулы линейное: 1) Строение молекулы угловое: О О–О О 2) Газообразный О 2 - бесцветный Жидкий О 2 – светло-голубой 2) Газообразный О 3 – голубой Жидкий О 3 – темно-синий tпл = - 219˚С tкип = - 183˚С tпл = - 193˚С tкип = - 112˚С жидкий O 2 3) Парамагнитен магнитное поле) 4) Окислитель О жидкий O 3 (втягивается в 3) Диамагнитен (выталкивается из магнитного поля) 4) Более сильный окислитель Состав и строение молекул разные, следовательно, разные свойства
 Аллотропные модификации фосфора Белый фосфор Р 4 Красный фосфор Р(крас. ) 1) Вещество состоит из молекул; молекула построена из 4 атомов фосфора, обладает тетраэдрическим строением: а) б) в) Строение молекулы P 4(а), образец белого фосфора(б) и его хранение под слоем воды(в) 2) Свойства: мягкое легкоплавкое (плавится в горячей воде) - химически активен - ядовит!!! - светится в темноте 1) Вещество полимерного строения т. е. атомы соединены в бесконечные цепочки (условно называемые бесконечными). вещество Образцы красного фосфора 2) Свойства: аморфное вещество (нет упорядоченного строения как в кристаллах) - химически неактивное вещество - при аккуратном обращении (если не употреблять внутрь) не ядовит Строение разное, следовательно, разные свойства
Аллотропные модификации фосфора Белый фосфор Р 4 Красный фосфор Р(крас. ) 1) Вещество состоит из молекул; молекула построена из 4 атомов фосфора, обладает тетраэдрическим строением: а) б) в) Строение молекулы P 4(а), образец белого фосфора(б) и его хранение под слоем воды(в) 2) Свойства: мягкое легкоплавкое (плавится в горячей воде) - химически активен - ядовит!!! - светится в темноте 1) Вещество полимерного строения т. е. атомы соединены в бесконечные цепочки (условно называемые бесконечными). вещество Образцы красного фосфора 2) Свойства: аморфное вещество (нет упорядоченного строения как в кристаллах) - химически неактивное вещество - при аккуратном обращении (если не употреблять внутрь) не ядовит Строение разное, следовательно, разные свойства
 Аллотропные модификации углерода Алмаз 1) Вещество немолекулярного кристаллического строения: каждый атом углерода образует 4 равноценные связи с четырьмя другими атомами углерода. В результате образуется очень прочный кристалл: алмаз – эталон твердости (10 баллов по шкале Мооса) а) б) в) Строение кристаллической решетки алмаза (а), самородок алмаза (б) и бриллиант – ограненный алмаз (в) Графит 1) Вещество немолекулярного кристаллического слоистого строения: каждый атом углерода образует три равноценные прочные связи с тремя атомами углерода в своем слое, оставшаяся валентность тратится на связывание слоев. Между слоями связь гораздо длиннее, чем внутри слоя, поэтому слои связаны слабо и легко смещаются относительно другу друга. Это обуславливает использование графита как пишущего материала в карандашах и как твердой смазки. Такое строение обуславливает так же полупроводниковые свойства графита. а) Строение кристаллической решетки графита (а) и образец графита (б) б)
Аллотропные модификации углерода Алмаз 1) Вещество немолекулярного кристаллического строения: каждый атом углерода образует 4 равноценные связи с четырьмя другими атомами углерода. В результате образуется очень прочный кристалл: алмаз – эталон твердости (10 баллов по шкале Мооса) а) б) в) Строение кристаллической решетки алмаза (а), самородок алмаза (б) и бриллиант – ограненный алмаз (в) Графит 1) Вещество немолекулярного кристаллического слоистого строения: каждый атом углерода образует три равноценные прочные связи с тремя атомами углерода в своем слое, оставшаяся валентность тратится на связывание слоев. Между слоями связь гораздо длиннее, чем внутри слоя, поэтому слои связаны слабо и легко смещаются относительно другу друга. Это обуславливает использование графита как пишущего материала в карандашах и как твердой смазки. Такое строение обуславливает так же полупроводниковые свойства графита. а) Строение кристаллической решетки графита (а) и образец графита (б) б)
 Аллотропные модификации углерода Алмаз Графит 2) Физические свойства: - твердое вещество - изолятор - Tпл > 3000˚С - ρ = 3, 5 г/см 3 2) Физические свойства: - мягкое вещество - полупроводник - Tпл > 1800˚С - ρ = 2, 27 г/см 3 3) Теплота сгорания Qсгор. : С(алмаз) + О 2(г. ) = СО 2(г. ) + 395 к. Дж 4) В ходе химических реакций структура алмаза разрушается С(графит) + О 2(г. ) = СО 2(г. ) + 393 к. Дж 4) В ходе химических реакций структура графита может разрушаться, а может сохраняться (в интеркалятах) Строение разное, следовательно, разные свойства
Аллотропные модификации углерода Алмаз Графит 2) Физические свойства: - твердое вещество - изолятор - Tпл > 3000˚С - ρ = 3, 5 г/см 3 2) Физические свойства: - мягкое вещество - полупроводник - Tпл > 1800˚С - ρ = 2, 27 г/см 3 3) Теплота сгорания Qсгор. : С(алмаз) + О 2(г. ) = СО 2(г. ) + 395 к. Дж 4) В ходе химических реакций структура алмаза разрушается С(графит) + О 2(г. ) = СО 2(г. ) + 393 к. Дж 4) В ходе химических реакций структура графита может разрушаться, а может сохраняться (в интеркалятах) Строение разное, следовательно, разные свойства
 Другие аллотропные модификации углерода III. Аморфный углерод характеризуется отсутствием упорядоченной структуры (в отличие от алмаза и графита). Межатомные связи беспорядочные, случайные, поэтому их проще всего разрушить. а) б) Схематичное изображение аморфного углерода (а) и его внешний вид (б) Аморфный углерод (сажа) – самая распространенная и поэтому одна из наиболее практически важных модификаций углерода. Применяется в качестве топлива (высокая теплоты сгорания) и в качестве адсорбента – вещества, способного поглощать другие соединения за счет очень большой площади поверхности. В таком качестве аморфный углерод используется в виде таблеток активированного угля и как наполнитель в противогазах. Современный способ получения активированного угля предложил профессор МГУ Н. Д. Зелинский во время Первой мировой войны, когда начали активно использовать отравляющие газообразные вещества.
Другие аллотропные модификации углерода III. Аморфный углерод характеризуется отсутствием упорядоченной структуры (в отличие от алмаза и графита). Межатомные связи беспорядочные, случайные, поэтому их проще всего разрушить. а) б) Схематичное изображение аморфного углерода (а) и его внешний вид (б) Аморфный углерод (сажа) – самая распространенная и поэтому одна из наиболее практически важных модификаций углерода. Применяется в качестве топлива (высокая теплоты сгорания) и в качестве адсорбента – вещества, способного поглощать другие соединения за счет очень большой площади поверхности. В таком качестве аморфный углерод используется в виде таблеток активированного угля и как наполнитель в противогазах. Современный способ получения активированного угля предложил профессор МГУ Н. Д. Зелинский во время Первой мировой войны, когда начали активно использовать отравляющие газообразные вещества.
 Другие аллотропные модификации углерода IV. Фуллерены – шарообразные (C 60) или дынеобразные (C 70) полые молекулы, построенные из 5 - и 6 -членных циклов из атомов углерода наподобие футбольного мяча (рис. а и б). Внешний вид фуллеренов состава C 60 приведен на рис. в. Эта аллотропная модификация углерода была названа в честь американского архитектора Р. Б. Фуллера, разработавшего принцип построения куполов зданий из 5 - и 6 -членных циклов (рис. г) Кроме С 60 и С 70 существуют фуллерены и другого состава (рис. д). Изучение этих молекул является одним из перспективных направлений нанохимии. а) б) в) г) д)
Другие аллотропные модификации углерода IV. Фуллерены – шарообразные (C 60) или дынеобразные (C 70) полые молекулы, построенные из 5 - и 6 -членных циклов из атомов углерода наподобие футбольного мяча (рис. а и б). Внешний вид фуллеренов состава C 60 приведен на рис. в. Эта аллотропная модификация углерода была названа в честь американского архитектора Р. Б. Фуллера, разработавшего принцип построения куполов зданий из 5 - и 6 -членных циклов (рис. г) Кроме С 60 и С 70 существуют фуллерены и другого состава (рис. д). Изучение этих молекул является одним из перспективных направлений нанохимии. а) б) в) г) д)
 Другие аллотропные модификации углерода V. Углеродные нанотрубки – молекулярные структуры из графитовых слоев (см. строение графита), свернутых в трубки диаметром около 1 нм (10 -9 м). Углеродные нанотрубки можно использовать как «форму» для синтеза длинных наночастиц (внутри трубки). Полученные наночастицы могут обладать рядом практически важных свойств. а) б) в) Схематичное изображение структуры углеродной нанотрубки (а) и фотографии, сделанные на электронном микроскопе (б, в) – обратите внимание на масштаб (μm – микрометр 10 -6 м; nm – нанометр 10 -9 м)
Другие аллотропные модификации углерода V. Углеродные нанотрубки – молекулярные структуры из графитовых слоев (см. строение графита), свернутых в трубки диаметром около 1 нм (10 -9 м). Углеродные нанотрубки можно использовать как «форму» для синтеза длинных наночастиц (внутри трубки). Полученные наночастицы могут обладать рядом практически важных свойств. а) б) в) Схематичное изображение структуры углеродной нанотрубки (а) и фотографии, сделанные на электронном микроскопе (б, в) – обратите внимание на масштаб (μm – микрометр 10 -6 м; nm – нанометр 10 -9 м)
 Другие аллотропные модификации углерода VI. Лонсдейлит представляет из себя вещество со структурой, которая получается в результате искажения структуры алмаза. Лонсдейлит тверже алмаза (на 58% !), однако из-за сложностей получения врядли найдет широкое применение. а) б) Схематичное изображение структуры лонсдейлита (а) и его внешний вид (б) VII. Карбин – полимерное вещество, а) б) состоящее из последовательно соединенных в цепочки атомов углерода. Есть два варианта построения цепи: а) только двойные связи …=С=С=С=… Схематичное изображение двух вариантов б) чередование одинарных и тройных структуры карбина (а) и его внешний вид (б) …–С≡С–С≡С–…
Другие аллотропные модификации углерода VI. Лонсдейлит представляет из себя вещество со структурой, которая получается в результате искажения структуры алмаза. Лонсдейлит тверже алмаза (на 58% !), однако из-за сложностей получения врядли найдет широкое применение. а) б) Схематичное изображение структуры лонсдейлита (а) и его внешний вид (б) VII. Карбин – полимерное вещество, а) б) состоящее из последовательно соединенных в цепочки атомов углерода. Есть два варианта построения цепи: а) только двойные связи …=С=С=С=… Схематичное изображение двух вариантов б) чередование одинарных и тройных структуры карбина (а) и его внешний вид (б) …–С≡С–С≡С–…
 Продолжение следует…
Продолжение следует…


