Алкины.pptx
- Количество слайдов: 33
 АЛКИНЫ Алкинами называются соединения, молекулы которых содержат углеродный атом, имеющий тройную связь с другим атомом углерода СН ≡ СН - ацетилен Формула для алкинов записывается в следующем виде: Cn. H 2 n-2
АЛКИНЫ Алкинами называются соединения, молекулы которых содержат углеродный атом, имеющий тройную связь с другим атомом углерода СН ≡ СН - ацетилен Формула для алкинов записывается в следующем виде: Cn. H 2 n-2
 I. НОМЕНКЛАТУРА И ИЗОМЕРИЯ рациональная систематическая номенклатура СН ≡ НС ацетилен СН 3 – С ≡ СН метилацетилен СН 3 – С ≡ С – СН 3 диметилацетилен СН ≡ С – СН 2 – СН 3 пропилацетилен этин пропин бутин – 2 пентин – 1 СН ≡ С – СН 3 | СН 3 З – метил бутин – 1 изопропилацетилен
I. НОМЕНКЛАТУРА И ИЗОМЕРИЯ рациональная систематическая номенклатура СН ≡ НС ацетилен СН 3 – С ≡ СН метилацетилен СН 3 – С ≡ С – СН 3 диметилацетилен СН ≡ С – СН 2 – СН 3 пропилацетилен этин пропин бутин – 2 пентин – 1 СН ≡ С – СН 3 | СН 3 З – метил бутин – 1 изопропилацетилен
 II. СПОСОБЫ ПОЛУЧЕНИЯ АЛКИНОВ 1. Промышленные способы получения ацетилена 1) из карбида кальция: t Ca. CO 3 Ca. O + 3 C Ca. O + CO 2 t Ca. C 2 + 2 H 2 O Ca. C 2 + CO Ca(OH)2 + C 2 H 2 2) окисление метана: 2 CН 4 O 2, 1000° С 2 Н 2 + ЗН 2
II. СПОСОБЫ ПОЛУЧЕНИЯ АЛКИНОВ 1. Промышленные способы получения ацетилена 1) из карбида кальция: t Ca. CO 3 Ca. O + 3 C Ca. O + CO 2 t Ca. C 2 + 2 H 2 O Ca. C 2 + CO Ca(OH)2 + C 2 H 2 2) окисление метана: 2 CН 4 O 2, 1000° С 2 Н 2 + ЗН 2

 2. Лабораторные способы получения 1) получение из дигалогенопроизводных углеводородов: Cl | Na. NH 2 Na. OH(спирт. р-р) CH 3 – CH CH 2 = CH CH ≡ CH -Na. Cl - Na. Cl | | -H O Cl Cl -NH 3 2 Если избыток Na. OH, значит реакция идет до конца CH 2 – CH 2 | | Cl Cl Na. OH(спирт. р-р) -Na. Cl -H O 2 CH = CH 2 | Cl Na. NH 2 CH ≡ CH - Na. Cl -NH 3
2. Лабораторные способы получения 1) получение из дигалогенопроизводных углеводородов: Cl | Na. NH 2 Na. OH(спирт. р-р) CH 3 – CH CH 2 = CH CH ≡ CH -Na. Cl - Na. Cl | | -H O Cl Cl -NH 3 2 Если избыток Na. OH, значит реакция идет до конца CH 2 – CH 2 | | Cl Cl Na. OH(спирт. р-р) -Na. Cl -H O 2 CH = CH 2 | Cl Na. NH 2 CH ≡ CH - Na. Cl -NH 3
 2) из тетрагалогенидов: Cl Cl | | CH – CH + 2 Zn | | пыль Cl Cl CH ≡ CH + 2 Zn. Cl 2 З) дегидрирование алканов и алкенов: CH 3 – CH 3 Pt; Pd, Ni 200 -300° CH 2 = CH 2 Pt; Pd, Ni CH ≡ CH 4) Из ацетиленидов щелочных металлов: HC ≡ CNa + CH 3 Cl ацетиленид натрия HC ≡ C – CH 3 + Na. Cl необходимо учитывать реакционную способность галогеналкила
2) из тетрагалогенидов: Cl Cl | | CH – CH + 2 Zn | | пыль Cl Cl CH ≡ CH + 2 Zn. Cl 2 З) дегидрирование алканов и алкенов: CH 3 – CH 3 Pt; Pd, Ni 200 -300° CH 2 = CH 2 Pt; Pd, Ni CH ≡ CH 4) Из ацетиленидов щелочных металлов: HC ≡ CNa + CH 3 Cl ацетиленид натрия HC ≡ C – CH 3 + Na. Cl необходимо учитывать реакционную способность галогеналкила
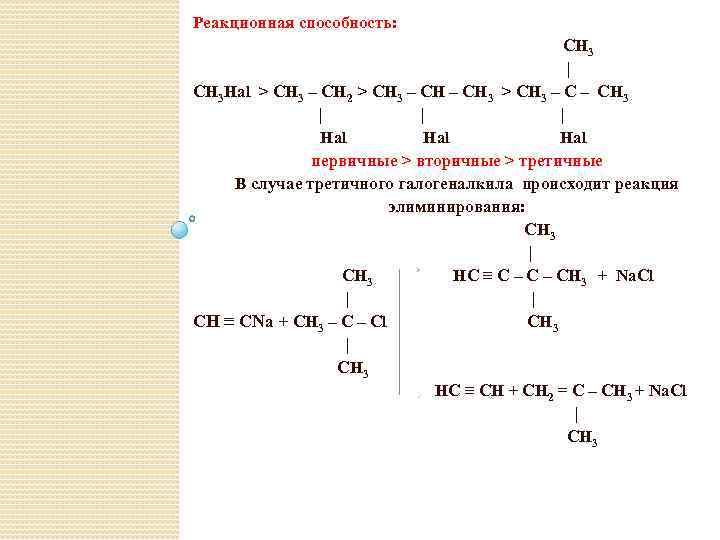 Реакционная способность: CH 3 | CH 3 Hal > CH 3 – CH 2 > CH 3 – CH 3 | | | Hal Hal первичные > вторичные > третичные В случае третичного галогеналкила происходит реакция элиминирования: CH 3 | CH 3 HC ≡ C – CH 3 + Na. Cl | | CH ≡ CNa + CH 3 – Cl CH 3 | CH 3 HC ≡ CH + CH 2 = C – CH 3 + Na. Cl | CH 3
Реакционная способность: CH 3 | CH 3 Hal > CH 3 – CH 2 > CH 3 – CH 3 | | | Hal Hal первичные > вторичные > третичные В случае третичного галогеналкила происходит реакция элиминирования: CH 3 | CH 3 HC ≡ C – CH 3 + Na. Cl | | CH ≡ CNa + CH 3 – Cl CH 3 | CH 3 HC ≡ CH + CH 2 = C – CH 3 + Na. Cl | CH 3
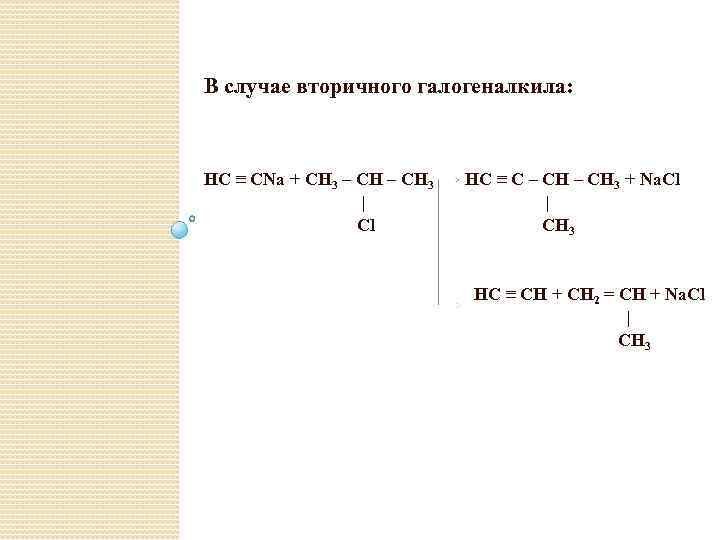 В случае вторичного галогеналкила: HC ≡ CNa + CH 3 – CH 3 | Cl HC ≡ C – CH 3 + Na. Cl | CH 3 HC ≡ CH + CH 2 = CH + Na. Cl | CH 3
В случае вторичного галогеналкила: HC ≡ CNa + CH 3 – CH 3 | Cl HC ≡ C – CH 3 + Na. Cl | CH 3 HC ≡ CH + CH 2 = CH + Na. Cl | CH 3
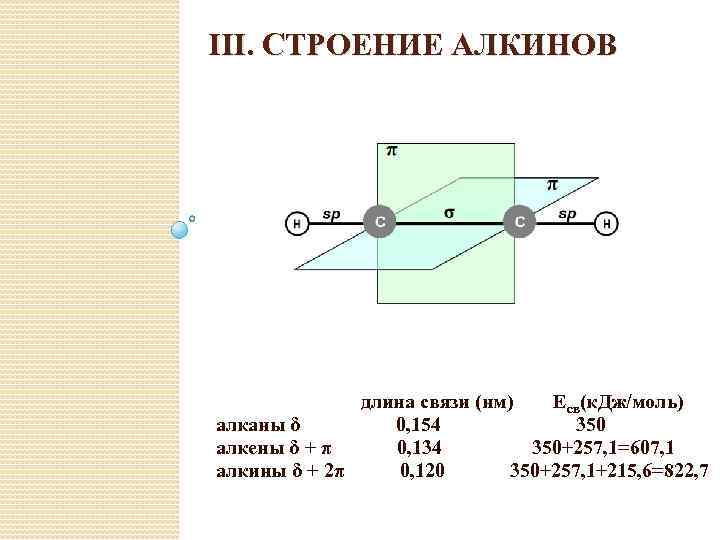 III. СТРОЕНИЕ АЛКИНОВ длина связи (нм) Есв(к. Дж/моль) алканы δ 0, 154 350 алкены δ + π 0, 134 350+257, 1=607, 1 алкины δ + 2π 0, 120 350+257, 1+215, 6=822, 7
III. СТРОЕНИЕ АЛКИНОВ длина связи (нм) Есв(к. Дж/моль) алканы δ 0, 154 350 алкены δ + π 0, 134 350+257, 1=607, 1 алкины δ + 2π 0, 120 350+257, 1+215, 6=822, 7
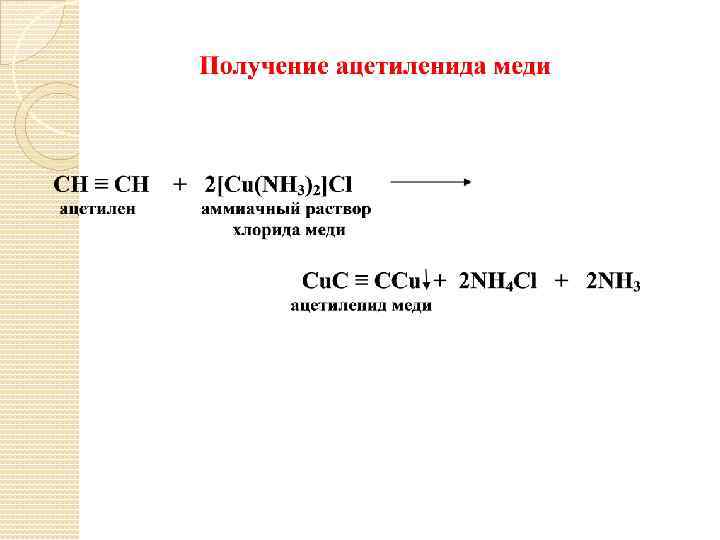
 IV. ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ 1. Кислотные свойства (получение ацетиленидов щелочных и тяжелых металлов): HC ≡ CH + Na. OH HC ≡ CH + Na. NH 2 HC ≡ CH + Ag. NO 3 HC ≡ CNa + H 2 O ацетиленид натрия HC ≡ CNa + NH 3 HC ≡ CAg + HNO 3 ацетиленид серебра качественная реакция на концевую тройную связь CH ≡ C – CH 2 – CH 3+Ag. NО 3 Ag – C ≡ C – CH 2 – CH 3↓+HNO 3 CH 3 – C ≡ C – CH 3 + Ag. NO 3 нет водорода при тройной связи.
IV. ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ 1. Кислотные свойства (получение ацетиленидов щелочных и тяжелых металлов): HC ≡ CH + Na. OH HC ≡ CH + Na. NH 2 HC ≡ CH + Ag. NO 3 HC ≡ CNa + H 2 O ацетиленид натрия HC ≡ CNa + NH 3 HC ≡ CAg + HNO 3 ацетиленид серебра качественная реакция на концевую тройную связь CH ≡ C – CH 2 – CH 3+Ag. NО 3 Ag – C ≡ C – CH 2 – CH 3↓+HNO 3 CH 3 – C ≡ C – CH 3 + Ag. NO 3 нет водорода при тройной связи.





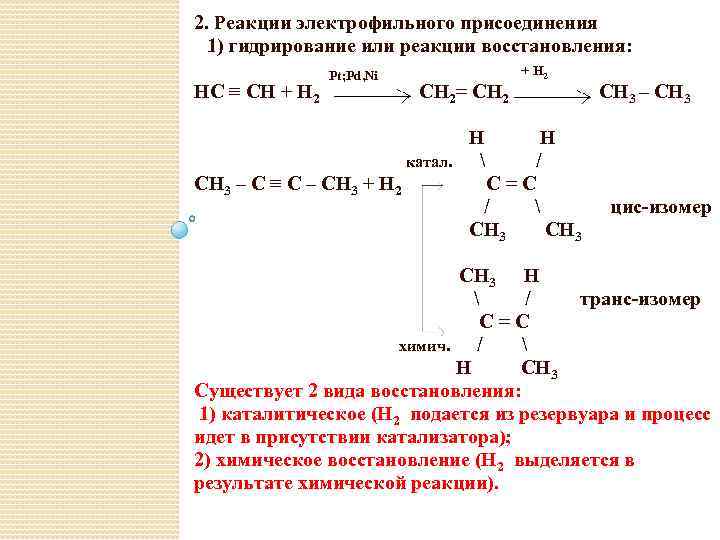 2. Реакции электрофильного присоединения 1) гидрирование или реакции восстановления: HC ≡ CH + H 2 Pt; Pd, Ni CH 2= CH 2 катал. CH 3 – C ≡ C – CH 3 + H 2 H / C=C / CH 3 – CH 3 H цис-изомер CH 3 H / транс-изомер C=C химич. / H CH 3 Существует 2 вида восстановления: 1) каталитическое (Н 2 подается из резервуара и процесс идет в присутствии катализатора); 2) химическое восстановление (Н 2 выделяется в результате химической реакции).
2. Реакции электрофильного присоединения 1) гидрирование или реакции восстановления: HC ≡ CH + H 2 Pt; Pd, Ni CH 2= CH 2 катал. CH 3 – C ≡ C – CH 3 + H 2 H / C=C / CH 3 – CH 3 H цис-изомер CH 3 H / транс-изомер C=C химич. / H CH 3 Существует 2 вида восстановления: 1) каталитическое (Н 2 подается из резервуара и процесс идет в присутствии катализатора); 2) химическое восстановление (Н 2 выделяется в результате химической реакции).
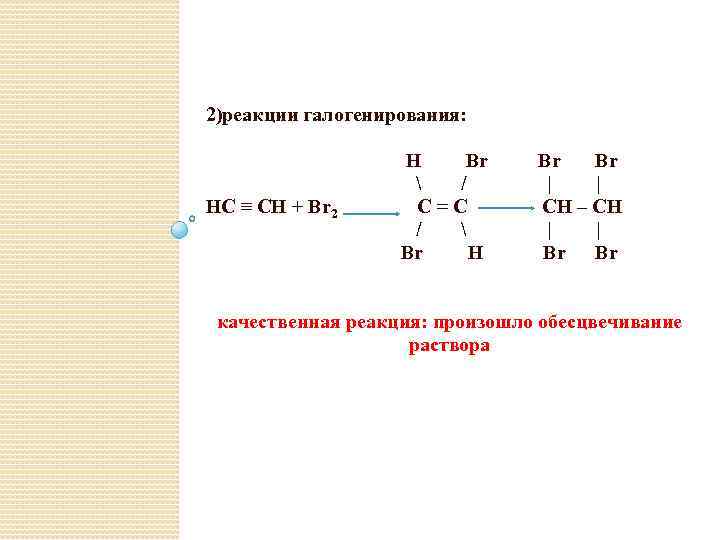 2)реакции галогенирования: HC ≡ CH + Br 2 H Br / C=C / Br H Br Br | | СН – СН | | Br Br качественная реакция: произошло обесцвечивание раствора
2)реакции галогенирования: HC ≡ CH + Br 2 H Br / C=C / Br H Br Br | | СН – СН | | Br Br качественная реакция: произошло обесцвечивание раствора



 3) реакции гидрогалогенирования: HC ≡ CH + HCl CH 3 – C ≡ CH + HCl CH 2 = CH | Cl CH 3 – C = CH 2 | Cl Реакция идёт по правилу Марковникова
3) реакции гидрогалогенирования: HC ≡ CH + HCl CH 3 – C ≡ CH + HCl CH 2 = CH | Cl CH 3 – C = CH 2 | Cl Реакция идёт по правилу Марковникова
 3. Реакции нуклеофильного присоединения: 1) реакции гидратации (реакция Кучерова): Hg. SO 4 HC ≡ CH + H 2 O CH 2 = CH CH 3 – C = O | OH H енол По пр. Эльтекова при образовании енола происходит кетоенольная таутомерия +H 2 O HC ≡ CH + Hg 2+ HC = +CH HC = CH | | Hg+ H-O+-H CH 2 = CH CH 3 – C = O | OH H альдегид Hg. SO 4 CH 3 – C ≡ CH + H 2 O CH 3 – C = CH 2 CH 3 – CH 3 | ║ OH O кетон
3. Реакции нуклеофильного присоединения: 1) реакции гидратации (реакция Кучерова): Hg. SO 4 HC ≡ CH + H 2 O CH 2 = CH CH 3 – C = O | OH H енол По пр. Эльтекова при образовании енола происходит кетоенольная таутомерия +H 2 O HC ≡ CH + Hg 2+ HC = +CH HC = CH | | Hg+ H-O+-H CH 2 = CH CH 3 – C = O | OH H альдегид Hg. SO 4 CH 3 – C ≡ CH + H 2 O CH 3 – C = CH 2 CH 3 – CH 3 | ║ OH O кетон
 2) реакции со спиртом: +H+ CH 3 – C ≡ CH + (C 2 H 5 O)-H+ CH 3 – C = CH - CH 3 – C = CH 2 | | O – C 2 H 5 3) реакции с карбоновыми кислотами: +H+ CH 3 – C ≡ CH + (CH 3 – C = O)-H+ CH 3 – C = CH - CH 3 – C = CH 2 | | О O–C=O O – C =O CH 3 реакции идут по правилу Марковникова CH 3
2) реакции со спиртом: +H+ CH 3 – C ≡ CH + (C 2 H 5 O)-H+ CH 3 – C = CH - CH 3 – C = CH 2 | | O – C 2 H 5 3) реакции с карбоновыми кислотами: +H+ CH 3 – C ≡ CH + (CH 3 – C = O)-H+ CH 3 – C = CH - CH 3 – C = CH 2 | | О O–C=O O – C =O CH 3 реакции идут по правилу Марковникова CH 3
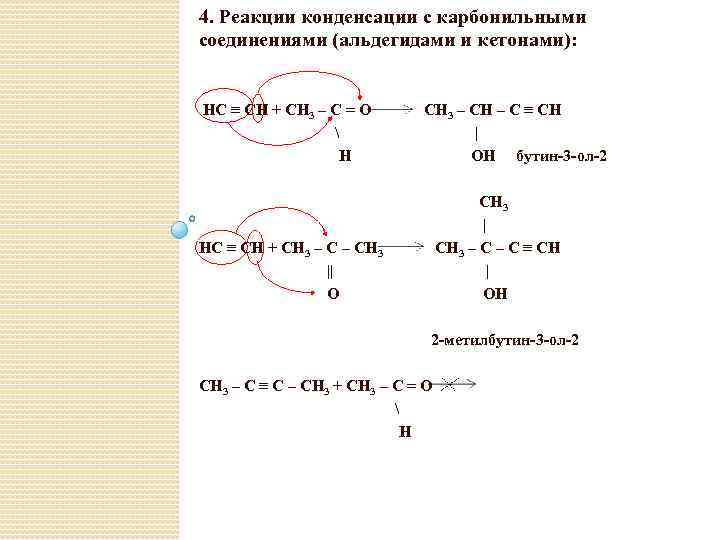 4. Реакции конденсации с карбонильными соединениями (альдегидами и кетонами): HC ≡ CH + CH 3 – C = O H CH 3 – CH – C ≡ CH | OH бутин-3 -ол-2 CH 3 | CH 3 – C ≡ CH | ОH HC ≡ CH + CH 3 – CH 3 || O 2 -метилбутин-3 -ол-2 CH 3 – C ≡ C – CH 3 + CH 3 – C = O H
4. Реакции конденсации с карбонильными соединениями (альдегидами и кетонами): HC ≡ CH + CH 3 – C = O H CH 3 – CH – C ≡ CH | OH бутин-3 -ол-2 CH 3 | CH 3 – C ≡ CH | ОH HC ≡ CH + CH 3 – CH 3 || O 2 -метилбутин-3 -ол-2 CH 3 – C ≡ C – CH 3 + CH 3 – C = O H
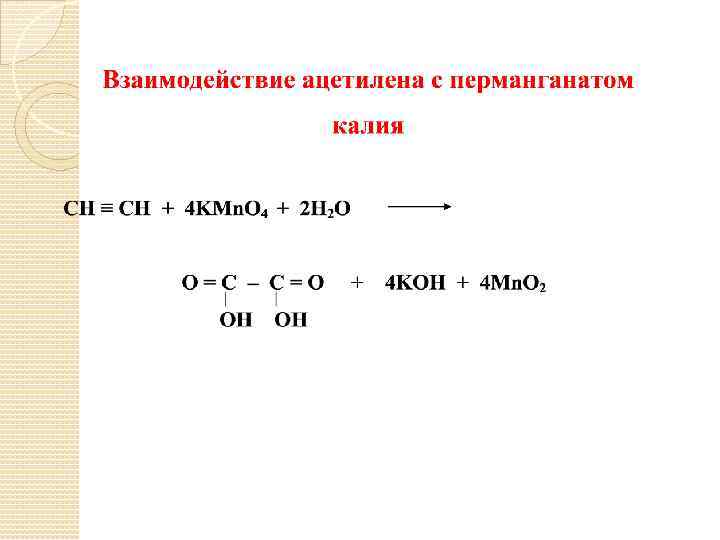
 5. Реакции окисления: Если имеется концевая тройная связь, то в результате реакции образуется CO 2. [O] CH 3 – C ≡ CH CH 3 – C = O + CO 2 OH [O] CH 3 – CH – C ≡ C – CH 2 – CH 3 – CH – C = O + CH 3 – CH 2 – C = O | | CH 3 CH 3 [O] CH 3 – CH – C ≡ CH CH 3 – CH – C = O + CO 2 | | CH 3 CH 3 [O] CH 3 – C ≡ C – CH 3 2 CH 3 – C = O OH OH
5. Реакции окисления: Если имеется концевая тройная связь, то в результате реакции образуется CO 2. [O] CH 3 – C ≡ CH CH 3 – C = O + CO 2 OH [O] CH 3 – CH – C ≡ C – CH 2 – CH 3 – CH – C = O + CH 3 – CH 2 – C = O | | CH 3 CH 3 [O] CH 3 – CH – C ≡ CH CH 3 – CH – C = O + CO 2 | | CH 3 CH 3 [O] CH 3 – C ≡ C – CH 3 2 CH 3 – C = O OH OH




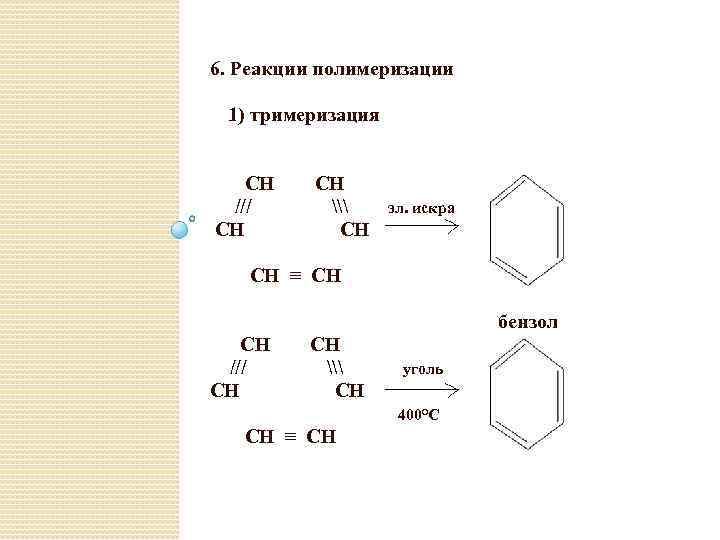 6. Реакции полимеризации 1) тримеризация CH /// СН СН \ CH эл. искра СН ≡ CH бензол CH /// СН СН \ CH уголь 400°C СН ≡ CH
6. Реакции полимеризации 1) тримеризация CH /// СН СН \ CH эл. искра СН ≡ CH бензол CH /// СН СН \ CH уголь 400°C СН ≡ CH
 2) димеризация с последующей полимеризацией: HCl HC ≡ CH + HC ≡ CH CH 2 = CH – C ≡ CH n CH 2 = CH – C= CH 2 | Cl CH 2 = CH – C =CH 2 | хлоропрен Cl [ – CH 2 – C = CH – CH 2 – ] n | Cl хлоропреновый каучук CH 2 = CH – C= CH + HC ≡ CH CH 2 = CH – C ≡ C – CH = CH 2 дивинилацетилен 3) полимеризация в присутствии катализатора Cu: Cu HC ≡ CH [ – CH = CH – ] n купрен
2) димеризация с последующей полимеризацией: HCl HC ≡ CH + HC ≡ CH CH 2 = CH – C ≡ CH n CH 2 = CH – C= CH 2 | Cl CH 2 = CH – C =CH 2 | хлоропрен Cl [ – CH 2 – C = CH – CH 2 – ] n | Cl хлоропреновый каучук CH 2 = CH – C= CH + HC ≡ CH CH 2 = CH – C ≡ C – CH = CH 2 дивинилацетилен 3) полимеризация в присутствии катализатора Cu: Cu HC ≡ CH [ – CH = CH – ] n купрен


