Alkenes-2.pptx
- Количество слайдов: 23
 Алкены Химические свойства -реакции присоединения -реакции замещения -окисления -озонолиз -полимеризация
Алкены Химические свойства -реакции присоединения -реакции замещения -окисления -озонолиз -полимеризация
 Алкены Химические свойства π-связь – область повышенной электронной плотности Атаке электрофилом подвергается π-связь алкена Характерные для алкенов реакции – электрофильное присоединение
Алкены Химические свойства π-связь – область повышенной электронной плотности Атаке электрофилом подвергается π-связь алкена Характерные для алкенов реакции – электрофильное присоединение
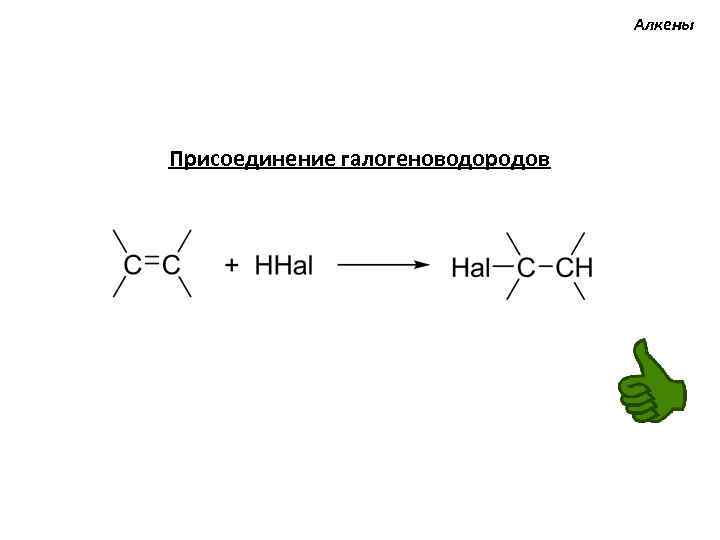 Алкены Присоединение галогеноводородов
Алкены Присоединение галогеноводородов
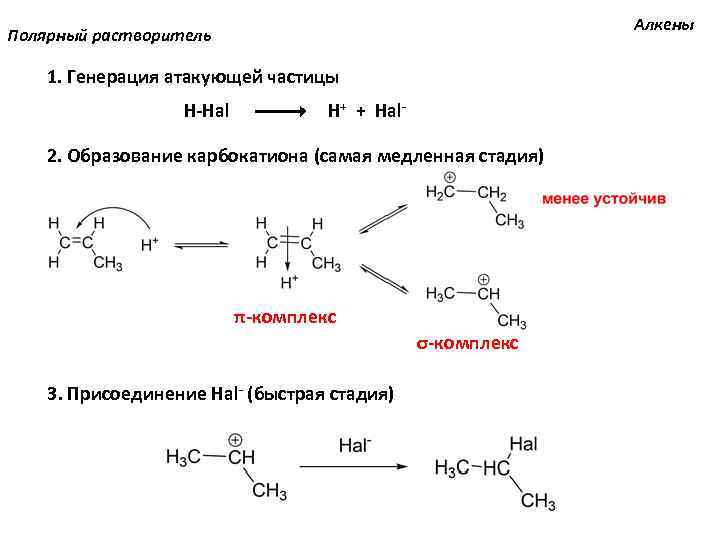 Алкены Полярный растворитель 1. Генерация атакующей частицы H-Hal H+ + Hal- 2. Образование карбокатиона (самая медленная стадия) π-комплекс σ-комплекс 3. Присоединение Hal- (быстрая стадия)
Алкены Полярный растворитель 1. Генерация атакующей частицы H-Hal H+ + Hal- 2. Образование карбокатиона (самая медленная стадия) π-комплекс σ-комплекс 3. Присоединение Hal- (быстрая стадия)
 Алкены Присоединение галогеноводородов к алкенам подчиняется правилу Марковникова 1869 год. Когда несимметричный алкен соединяется с галогеноводородной кислотой, галоген присоединяется к атому углерода, содержащему меньше атомов водорода, то есть к атому углерода, на который больше влияют другие атомы углерода Современная трактовка. При присоединении галогеноводорода к несимметричному алкену, атом водорода присоединяется к более гидрогенизированному атому углерода Присоединение к алкенам проходит через стадию образования наиболее устойчивой промежуточной частицы
Алкены Присоединение галогеноводородов к алкенам подчиняется правилу Марковникова 1869 год. Когда несимметричный алкен соединяется с галогеноводородной кислотой, галоген присоединяется к атому углерода, содержащему меньше атомов водорода, то есть к атому углерода, на который больше влияют другие атомы углерода Современная трактовка. При присоединении галогеноводорода к несимметричному алкену, атом водорода присоединяется к более гидрогенизированному атому углерода Присоединение к алкенам проходит через стадию образования наиболее устойчивой промежуточной частицы
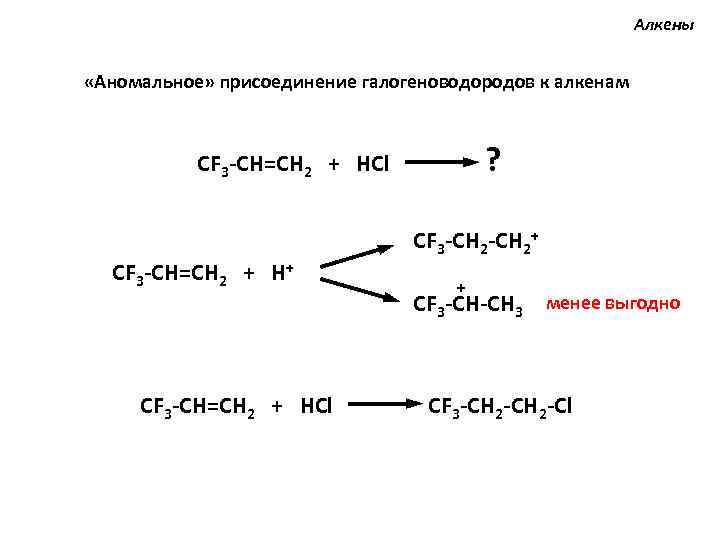 Алкены «Аномальное» присоединение галогеноводородов к алкенам ? CF 3 -CH=CH 2 + HCl CF 3 -CH=CH 2 + H+ CF 3 -CH=CH 2 + HCl CF 3 -CH 2+ + CF 3 -CH-CH 3 менее выгодно CF 3 -CH 2 -Cl
Алкены «Аномальное» присоединение галогеноводородов к алкенам ? CF 3 -CH=CH 2 + HCl CF 3 -CH=CH 2 + H+ CF 3 -CH=CH 2 + HCl CF 3 -CH 2+ + CF 3 -CH-CH 3 менее выгодно CF 3 -CH 2 -Cl
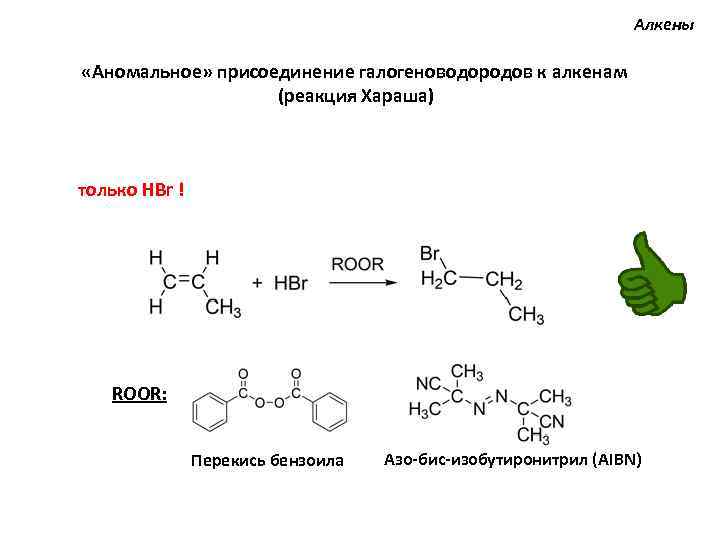 Алкены «Аномальное» присоединение галогеноводородов к алкенам (реакция Хараша) только HBr ! ROOR: Перекись бензоила Азо-бис-изобутиронитрил (AIBN)
Алкены «Аномальное» присоединение галогеноводородов к алкенам (реакция Хараша) только HBr ! ROOR: Перекись бензоила Азо-бис-изобутиронитрил (AIBN)
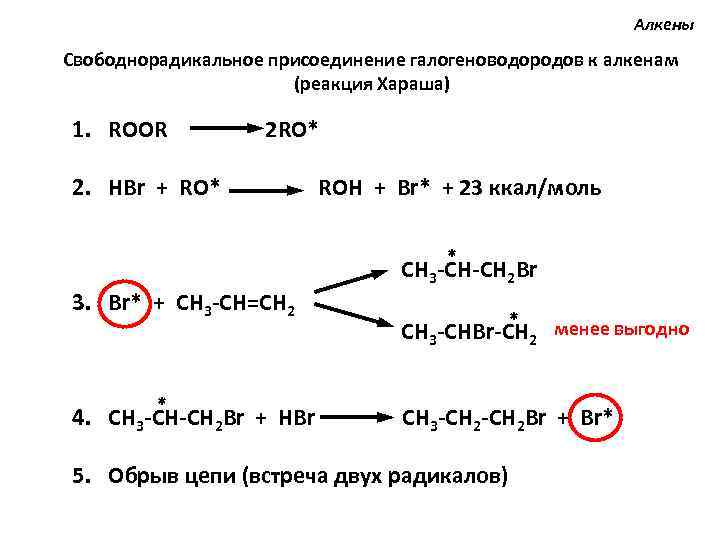 Алкены Свободнорадикальное присоединение галогеноводородов к алкенам (реакция Хараша) 1. ROOR 2 RO* 2. HBr + RO* ROH + Br* + 23 ккал/моль * 3. Br* + CH 3 -CH=CH 2 CH 3 -CH-CH 2 Br * CH 3 -CHBr-CH 2 менее выгодно * 4. CH 3 -CH-CH 2 Br + HBr CH 3 -CH 2 Br + Br* 5. Обрыв цепи (встреча двух радикалов)
Алкены Свободнорадикальное присоединение галогеноводородов к алкенам (реакция Хараша) 1. ROOR 2 RO* 2. HBr + RO* ROH + Br* + 23 ккал/моль * 3. Br* + CH 3 -CH=CH 2 CH 3 -CH-CH 2 Br * CH 3 -CHBr-CH 2 менее выгодно * 4. CH 3 -CH-CH 2 Br + HBr CH 3 -CH 2 Br + Br* 5. Обрыв цепи (встреча двух радикалов)
 Алкены Присоединение галогенов Cl 2 и Br 2 – очень высокий выход в реакции (почти 100%) F 2 – разрушение молекулы I 2 – обратимая реакция, равновесие смещено к исходным веществам Быстрое обесцвечивание бромной воды – качественная реакция на наличие кратных связей (двойных и тройных)!
Алкены Присоединение галогенов Cl 2 и Br 2 – очень высокий выход в реакции (почти 100%) F 2 – разрушение молекулы I 2 – обратимая реакция, равновесие смещено к исходным веществам Быстрое обесцвечивание бромной воды – качественная реакция на наличие кратных связей (двойных и тройных)!
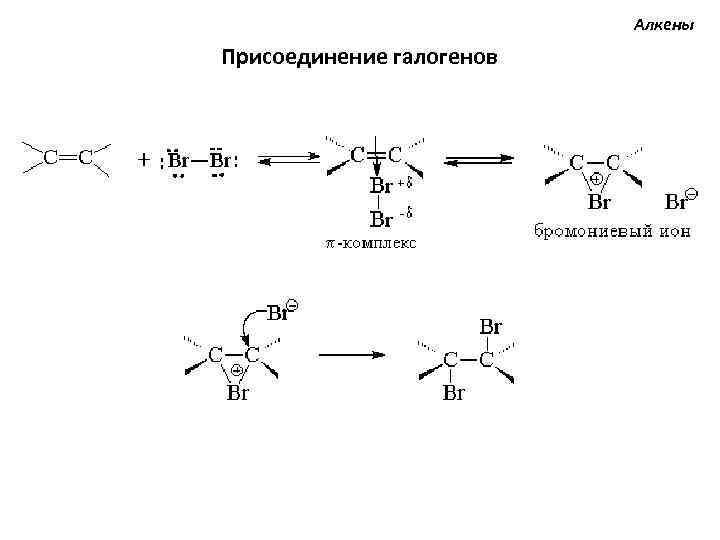 Алкены Присоединение галогенов
Алкены Присоединение галогенов
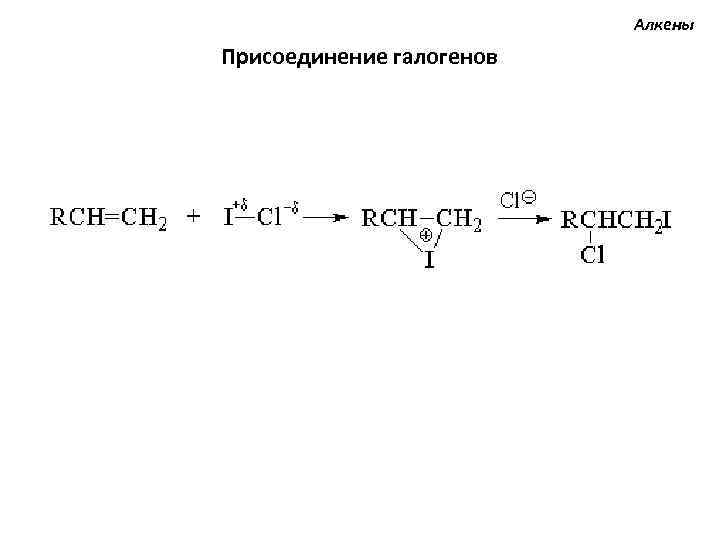 Алкены Присоединение галогенов
Алкены Присоединение галогенов
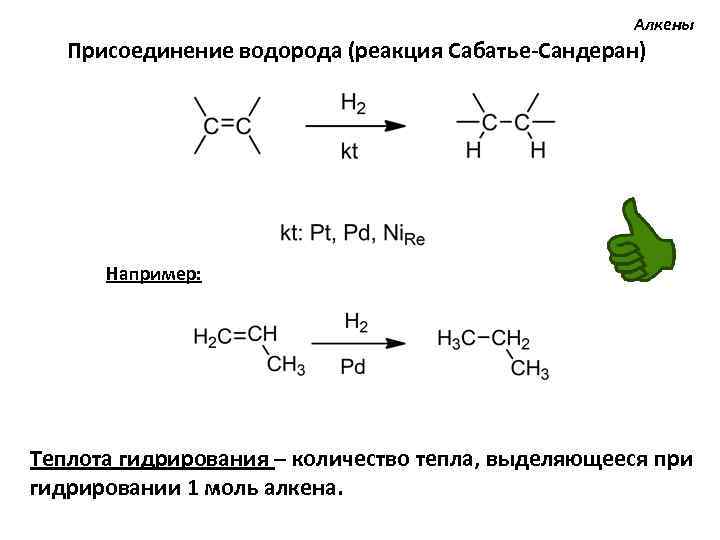 Алкены Присоединение водорода (реакция Сабатье-Сандеран) Например: Теплота гидрирования – количество тепла, выделяющееся при гидрировании 1 моль алкена.
Алкены Присоединение водорода (реакция Сабатье-Сандеран) Например: Теплота гидрирования – количество тепла, выделяющееся при гидрировании 1 моль алкена.
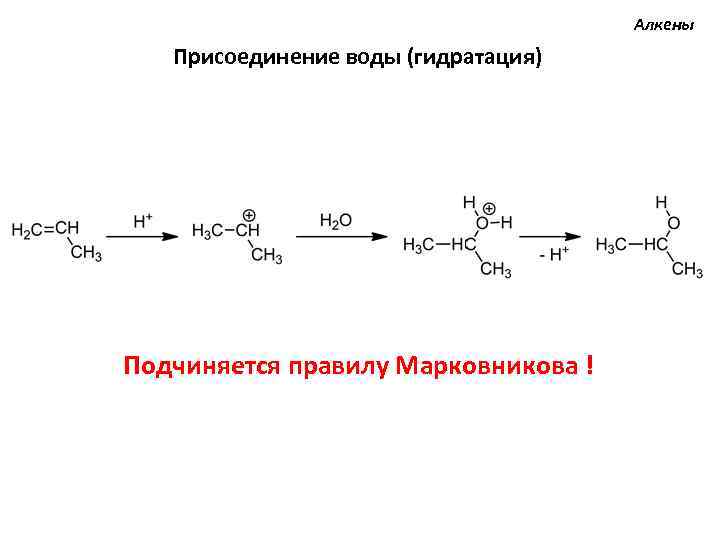 Алкены Присоединение воды (гидратация) Подчиняется правилу Марковникова !
Алкены Присоединение воды (гидратация) Подчиняется правилу Марковникова !
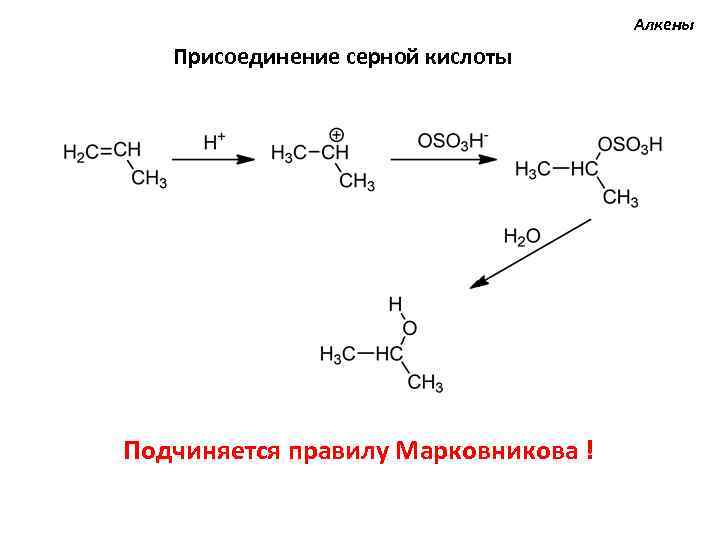 Алкены Присоединение серной кислоты Подчиняется правилу Марковникова !
Алкены Присоединение серной кислоты Подчиняется правилу Марковникова !
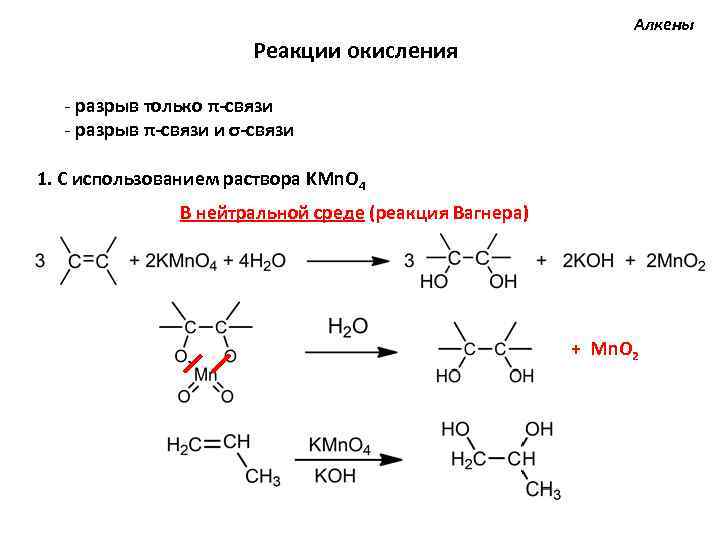 Алкены Реакции окисления - разрыв только π-связи - разрыв π-связи и σ-связи 1. С использованием раствора KMn. O 4 В нейтральной среде (реакция Вагнера) + Mn. O 2
Алкены Реакции окисления - разрыв только π-связи - разрыв π-связи и σ-связи 1. С использованием раствора KMn. O 4 В нейтральной среде (реакция Вагнера) + Mn. O 2
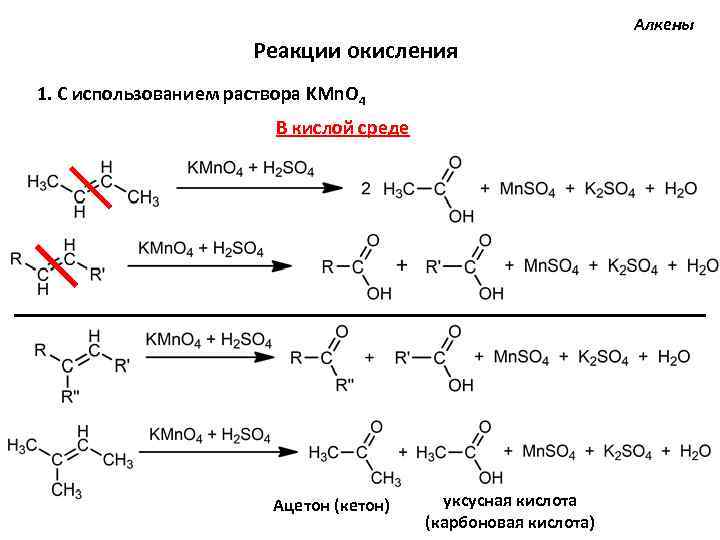 Алкены Реакции окисления 1. С использованием раствора KMn. O 4 В кислой среде Ацетон (кетон) уксусная кислота (карбоновая кислота)
Алкены Реакции окисления 1. С использованием раствора KMn. O 4 В кислой среде Ацетон (кетон) уксусная кислота (карбоновая кислота)
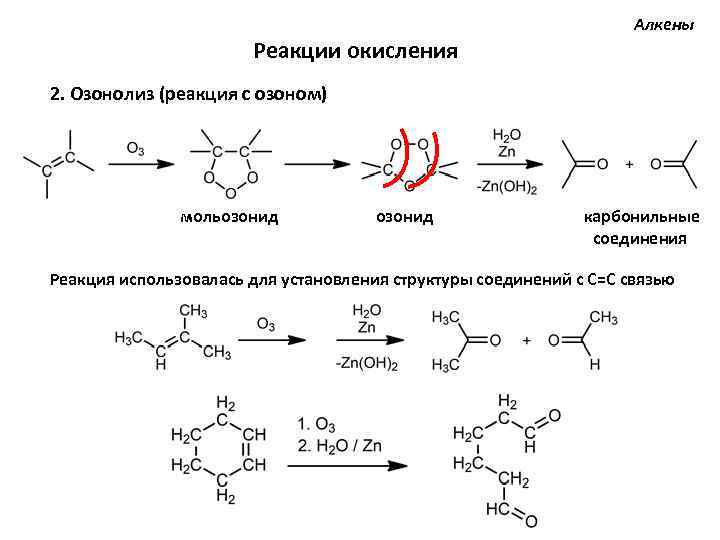 Алкены Реакции окисления 2. Озонолиз (реакция с озоном) мольозонид карбонильные соединения Реакция использовалась для установления структуры соединений с С=С связью
Алкены Реакции окисления 2. Озонолиз (реакция с озоном) мольозонид карбонильные соединения Реакция использовалась для установления структуры соединений с С=С связью
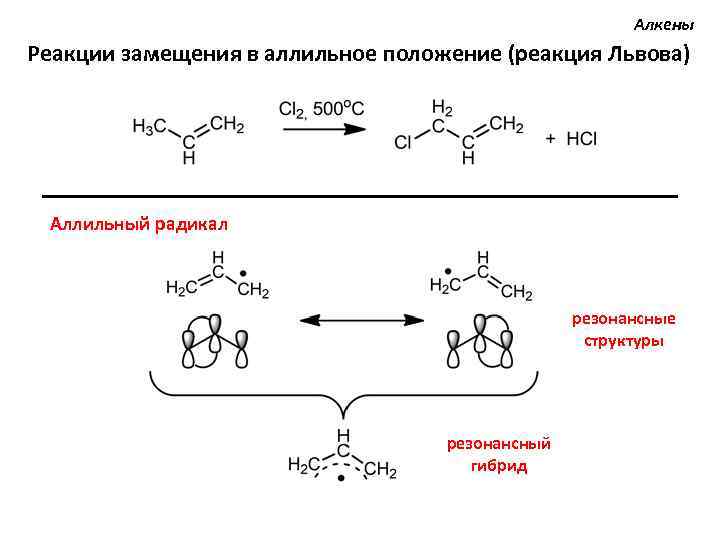 Алкены Реакции замещения в аллильное положение (реакция Львова) Аллильный радикал резонансные структуры резонансный гибрид
Алкены Реакции замещения в аллильное положение (реакция Львова) Аллильный радикал резонансные структуры резонансный гибрид
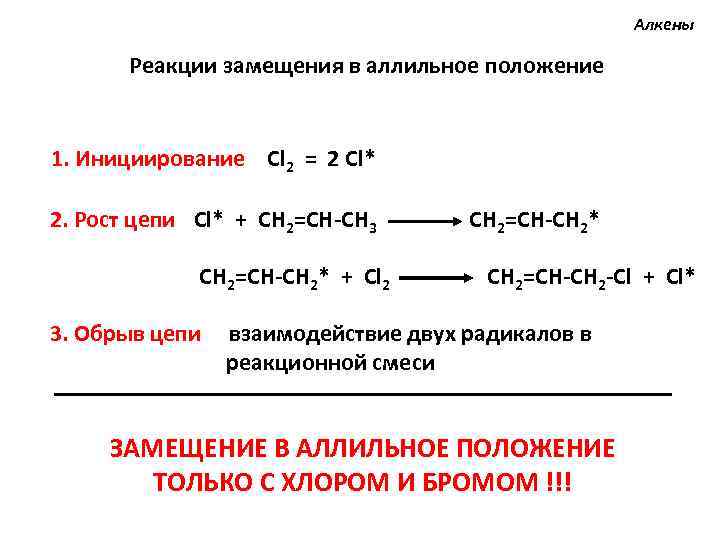 Алкены Реакции замещения в аллильное положение 1. Инициирование Cl 2 = 2 Cl* 2. Рост цепи Cl* + СH 2=CH-CH 3 CH 2=CH-CH 2* + Cl 2 CH 2=CH-CH 2* CH 2=CH-CH 2 -Cl + Cl* 3. Обрыв цепи взаимодействие двух радикалов в реакционной смеси ЗАМЕЩЕНИЕ В АЛЛИЛЬНОЕ ПОЛОЖЕНИЕ ТОЛЬКО С ХЛОРОМ И БРОМОМ !!!
Алкены Реакции замещения в аллильное положение 1. Инициирование Cl 2 = 2 Cl* 2. Рост цепи Cl* + СH 2=CH-CH 3 CH 2=CH-CH 2* + Cl 2 CH 2=CH-CH 2* CH 2=CH-CH 2 -Cl + Cl* 3. Обрыв цепи взаимодействие двух радикалов в реакционной смеси ЗАМЕЩЕНИЕ В АЛЛИЛЬНОЕ ПОЛОЖЕНИЕ ТОЛЬКО С ХЛОРОМ И БРОМОМ !!!
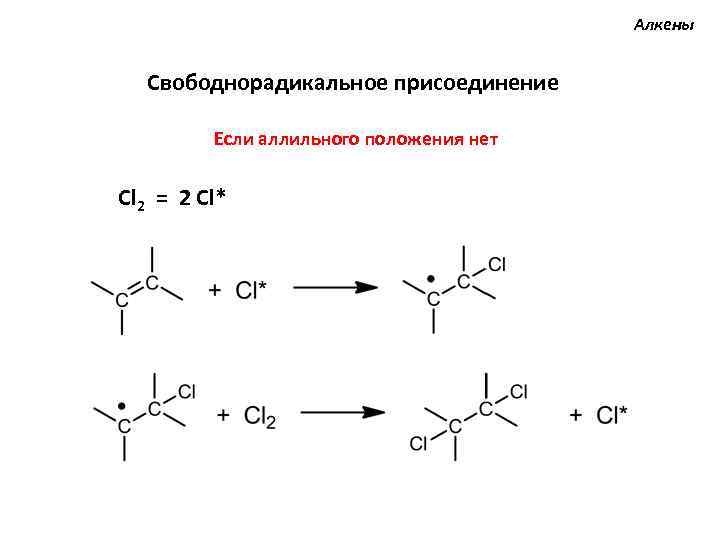 Алкены Свободнорадикальное присоединение Если аллильного положения нет Cl 2 = 2 Cl*
Алкены Свободнорадикальное присоединение Если аллильного положения нет Cl 2 = 2 Cl*
 Применение алкенов Алкены являются важнейшим химическим сырьем. Промышленное использование этилена Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла. Мировое производство этилена составляет порядка 100 млн тонн в год. Промышленное использование пропилена Пропилен в промышленности применяется, в основном, для синтеза полипропилена (62 % процента всего выпускаемого объема). Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид. В настоящее время мировые мощности по выпуску пропилена составляют около 70 млн тонн в год. Промышленное использование прочих алкенов Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона и пр. Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ. Его сополимеры с бутенами применяют как присадки к маслам и герметики. Высшие алкены С 10−С 18 применяют при синтезе ПАВ, а также для получения высших спиртов.
Применение алкенов Алкены являются важнейшим химическим сырьем. Промышленное использование этилена Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла. Мировое производство этилена составляет порядка 100 млн тонн в год. Промышленное использование пропилена Пропилен в промышленности применяется, в основном, для синтеза полипропилена (62 % процента всего выпускаемого объема). Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид. В настоящее время мировые мощности по выпуску пропилена составляют около 70 млн тонн в год. Промышленное использование прочих алкенов Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона и пр. Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ. Его сополимеры с бутенами применяют как присадки к маслам и герметики. Высшие алкены С 10−С 18 применяют при синтезе ПАВ, а также для получения высших спиртов.
 Полимеры и полимеризация Алкены Процесс соединения одинаковых молекул в более крупные молекулы (макромолекулы) называется реакцией полимеризации, а продукт – полимером. Т. е. , полимер – это макромолекула, состоящая из очень большого числа (до нескольких сот тысяч) повторяющихся звеньев. n. A An мономер полимер Низкомолекулярное вещество, из которого синтезируют полимер, называется мономером; многократно повторяющиеся в макромолекуле группы атомов – структурными звеньями. Число n в формуле полимера показывает, сколько молекул мономера соединяются в макромолекулу. Оно называется степенью полимеризации.
Полимеры и полимеризация Алкены Процесс соединения одинаковых молекул в более крупные молекулы (макромолекулы) называется реакцией полимеризации, а продукт – полимером. Т. е. , полимер – это макромолекула, состоящая из очень большого числа (до нескольких сот тысяч) повторяющихся звеньев. n. A An мономер полимер Низкомолекулярное вещество, из которого синтезируют полимер, называется мономером; многократно повторяющиеся в макромолекуле группы атомов – структурными звеньями. Число n в формуле полимера показывает, сколько молекул мономера соединяются в макромолекулу. Оно называется степенью полимеризации.
 Полимеры и полимеризация X Y + инициатор полимеризации n. A Алкены X (A)n Y концевые группы Макромолекулы полимеров могут иметь различную геометрическую форму: а) линейную (зигзагообразную), когда структурные звенья соединены в длинные цепи последовательно одно за другим (полиэтилен, полипропилен); б) разветвленную (крахмал); в) пространственную, когда линейные молекулы соединены между собой химическими связями (вулканизированный каучук – резина). Геометрическая форма полимеров существенно сказывается на их свойствах.
Полимеры и полимеризация X Y + инициатор полимеризации n. A Алкены X (A)n Y концевые группы Макромолекулы полимеров могут иметь различную геометрическую форму: а) линейную (зигзагообразную), когда структурные звенья соединены в длинные цепи последовательно одно за другим (полиэтилен, полипропилен); б) разветвленную (крахмал); в) пространственную, когда линейные молекулы соединены между собой химическими связями (вулканизированный каучук – резина). Геометрическая форма полимеров существенно сказывается на их свойствах.


