 АЛКЕНЫ
АЛКЕНЫ
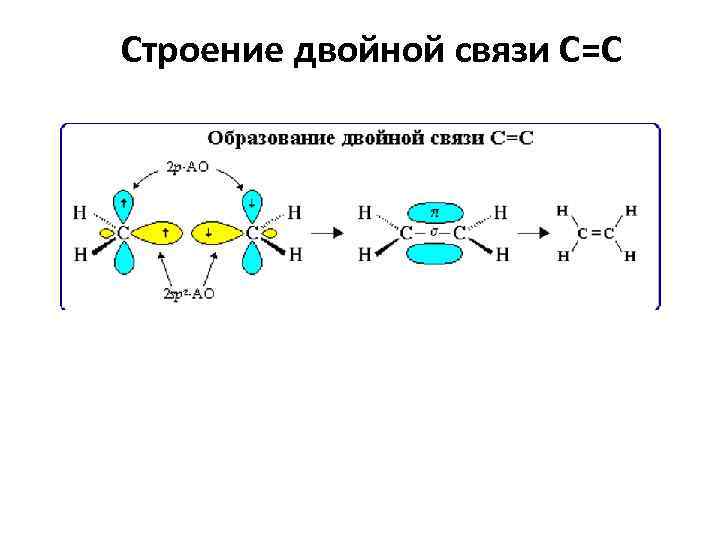 Строение двойной связи С=С
Строение двойной связи С=С
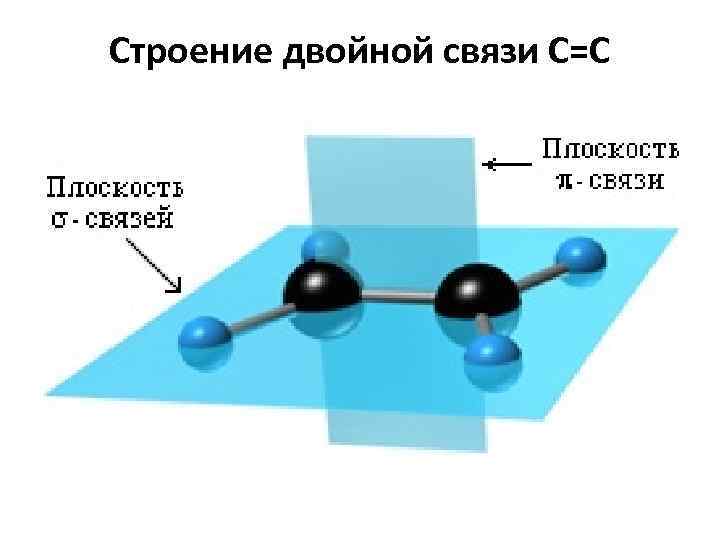 Строение двойной связи С=С
Строение двойной связи С=С
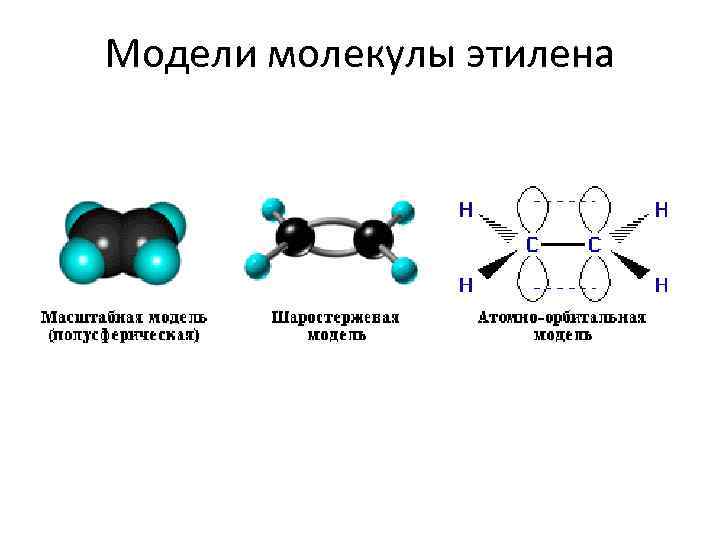 Модели молекулы этилена
Модели молекулы этилена
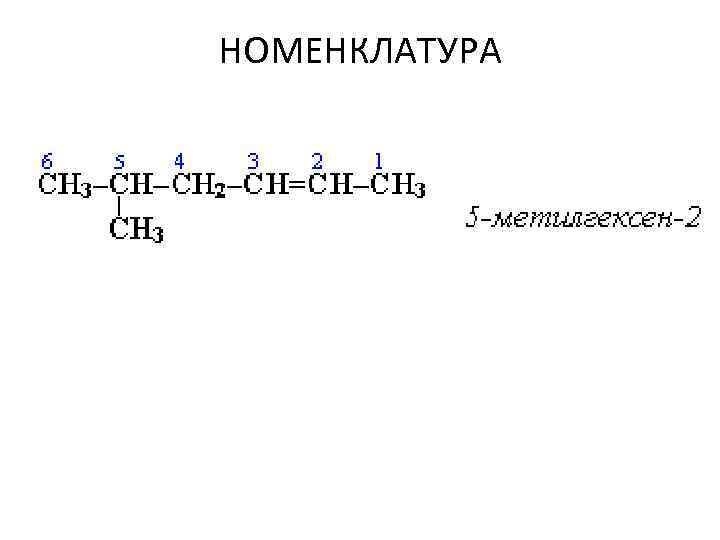 НОМЕНКЛАТУРА
НОМЕНКЛАТУРА
 Изомерия алкенов Структурная изомерия алкенов: 1. Изомерия углеродного скелета (начиная с С 4 Н 8); 2. Изомерия положения двойной связи (начиная с С 4 Н 8); 3. Межклассовая изомерия с циклоалканами, начиная с С 3 Н 6. Пространственная изомерия алкенов: цис-транс-изомерия
Изомерия алкенов Структурная изомерия алкенов: 1. Изомерия углеродного скелета (начиная с С 4 Н 8); 2. Изомерия положения двойной связи (начиная с С 4 Н 8); 3. Межклассовая изомерия с циклоалканами, начиная с С 3 Н 6. Пространственная изомерия алкенов: цис-транс-изомерия
 Структурная изомерия алкенов 1. Изомерия углеродного скелета (начиная с С 4 Н 8): 2. Изомерия положения двойной связи (начиная с С 4 Н 8): 3. Межклассовая изомерия с циклоалканами, начиная с С 3 Н 6:
Структурная изомерия алкенов 1. Изомерия углеродного скелета (начиная с С 4 Н 8): 2. Изомерия положения двойной связи (начиная с С 4 Н 8): 3. Межклассовая изомерия с циклоалканами, начиная с С 3 Н 6:
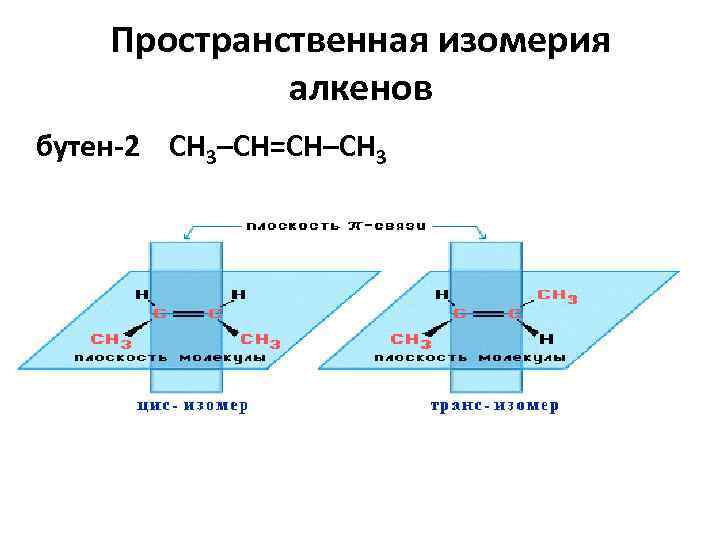 Пространственная изомерия алкенов бутен-2 СН 3–СН=СН–СН 3
Пространственная изомерия алкенов бутен-2 СН 3–СН=СН–СН 3
 Физические свойства от С 2 Н 4 по С 4 Н 8 – газы, начиная с С 5 Н 10 – жидкости, с С 18 Н 36 – твердые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях. Температуры кипения и плавления ниже, чем у соответствующих алканов.
Физические свойства от С 2 Н 4 по С 4 Н 8 – газы, начиная с С 5 Н 10 – жидкости, с С 18 Н 36 – твердые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях. Температуры кипения и плавления ниже, чем у соответствующих алканов.
 Характеристики углерод-углеродных связей
Характеристики углерод-углеродных связей
 Химические свойства для алкенов наиболее характерны реакции, протекающие за счет раскрытия менее прочной -связи. Исходное ненасыщенное соединение превращается в насыщенное без образования других продуктов, т. е. происходит реакция присоединения.
Химические свойства для алкенов наиболее характерны реакции, протекающие за счет раскрытия менее прочной -связи. Исходное ненасыщенное соединение превращается в насыщенное без образования других продуктов, т. е. происходит реакция присоединения.
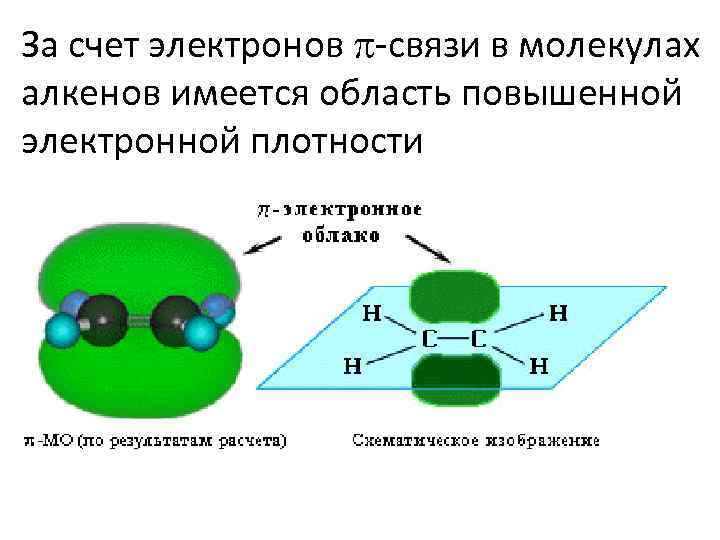 За счет электронов -связи в молекулах алкенов имеется область повышенной электронной плотности
За счет электронов -связи в молекулах алкенов имеется область повышенной электронной плотности
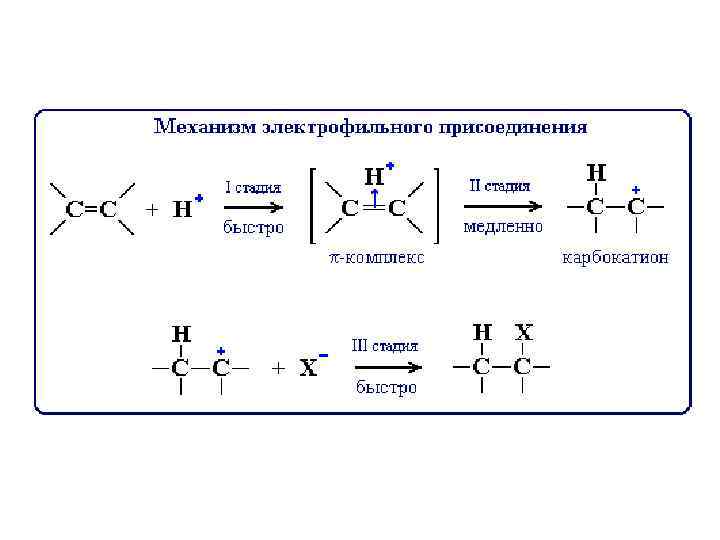
 Механизм реакции присоединения 1. Двойная связь склонна подвергаться атаке электрофильным (электронодефицитным) реагентом. В этом случае будет происходить гетеролический разрыв связей и реакция пойдет как электрофильное присоединение АЕ. 2. С другой стороны, углерод-углеродная -связь, являясь неполярной, может разрываться гомолитически, и тогда реакция будет идти по радикальному механизму АR.
Механизм реакции присоединения 1. Двойная связь склонна подвергаться атаке электрофильным (электронодефицитным) реагентом. В этом случае будет происходить гетеролический разрыв связей и реакция пойдет как электрофильное присоединение АЕ. 2. С другой стороны, углерод-углеродная -связь, являясь неполярной, может разрываться гомолитически, и тогда реакция будет идти по радикальному механизму АR.
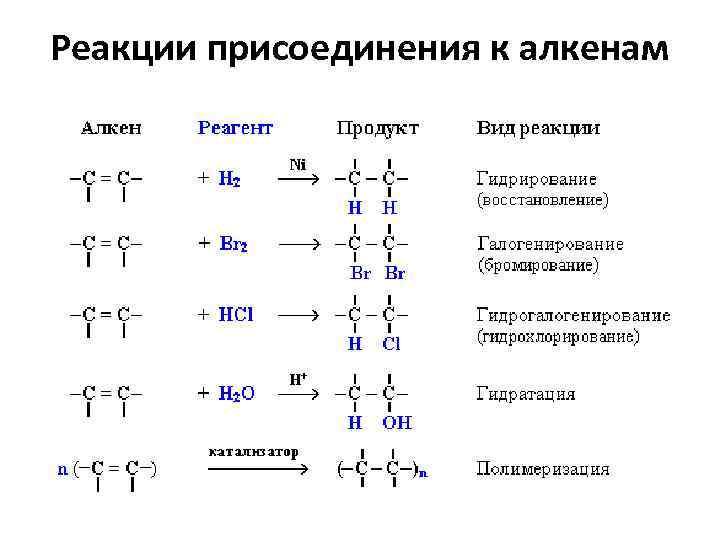 Реакции присоединения к алкенам
Реакции присоединения к алкенам
 Гидрирование (присоединение водорода) в присутствии металлов Pt, Pd или Ni: Происходит понижение степ. окисления (гидрирование алкенов относят к реакциям восстановления):
Гидрирование (присоединение водорода) в присутствии металлов Pt, Pd или Ni: Происходит понижение степ. окисления (гидрирование алкенов относят к реакциям восстановления):
 Галогенирование (присоединение галогенов) присоединение хлора (при обыч. услов. ): Качественная реакция на наличие двойной связи – обесцвечивание красно-бурой окраски бромной воды: Эти реакции протекают по механизму электрофильного присоединения с гетеролитическим разрывом связей в молекуле галогена.
Галогенирование (присоединение галогенов) присоединение хлора (при обыч. услов. ): Качественная реакция на наличие двойной связи – обесцвечивание красно-бурой окраски бромной воды: Эти реакции протекают по механизму электрофильного присоединения с гетеролитическим разрывом связей в молекуле галогена.
 При нагревании до 500°С возможно радикальное замещение атома водорода при соседнем к двойной связи атоме углерода:
При нагревании до 500°С возможно радикальное замещение атома водорода при соседнем к двойной связи атоме углерода:
 Гидрогалогенирование (присоединение галогеноводородов) Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X - галоген).
Гидрогалогенирование (присоединение галогеноводородов) Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X - галоген).
 правило Марковникова: В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т. е. атому углерода, связанному с наибольшим числом атомов водорода).
правило Марковникова: В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т. е. атому углерода, связанному с наибольшим числом атомов водорода).
 метильная группа СН 3 за счет суммирования небольшой полярности трех С–Н связей является донором электронов и проявляет +I-эффект по отношению к соседним атомам углерода. Это вызывает смещение подвижных p -электронов двойной связи в сторону более гидрогенизированного атома углерода (в группе СН 2) и появлению на нем частичного отрицательного заряда:
метильная группа СН 3 за счет суммирования небольшой полярности трех С–Н связей является донором электронов и проявляет +I-эффект по отношению к соседним атомам углерода. Это вызывает смещение подвижных p -электронов двойной связи в сторону более гидрогенизированного атома углерода (в группе СН 2) и появлению на нем частичного отрицательного заряда:

 Устойчивость карбокатиона возрастает с увеличением числа алкильных групп, которые за счет +I-эффекта уменьшают положительный заряд на атоме углерода:
Устойчивость карбокатиона возрастает с увеличением числа алкильных групп, которые за счет +I-эффекта уменьшают положительный заряд на атоме углерода:
 Современная формулировка правила Марковникова: электрофильное присоединение к двойной связи идет через образование наиболее устойчивого карбокатиона.
Современная формулировка правила Марковникова: электрофильное присоединение к двойной связи идет через образование наиболее устойчивого карбокатиона.
 Присоединение против правила Марковникова отмечается в случаях, когда заместитель при двойной связи оттягивает электронную плотность на себя, т. е. проявляет электроноакцепторные свойства (–I и/или –М-эффект).
Присоединение против правила Марковникова отмечается в случаях, когда заместитель при двойной связи оттягивает электронную плотность на себя, т. е. проявляет электроноакцепторные свойства (–I и/или –М-эффект).
 Гидратация (присоединение воды) Гидратация происходит в присутствии минеральных кислот по механизму электрофильного присоединения:
Гидратация (присоединение воды) Гидратация происходит в присутствии минеральных кислот по механизму электрофильного присоединения:
 В реакциях несимметричных алкенов соблюдается правило Марковникова.
В реакциях несимметричных алкенов соблюдается правило Марковникова.
 Полимеризация алкенов Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера). Число n называется степенью полимеризации.
Полимеризация алкенов Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера). Число n называется степенью полимеризации.
 Реакции окисления алкенов 1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера): В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMn. O 4. Поэтому она используется как качественная реакция на алкены.
Реакции окисления алкенов 1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера): В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMn. O 4. Поэтому она используется как качественная реакция на алкены.
 2. При жестком окислении алкенов кипящим раствором KMn. O 4 (дихроматом калия или азотной кислотой) в кислой среде происходит полный разрыв двойной связи:
2. При жестком окислении алкенов кипящим раствором KMn. O 4 (дихроматом калия или азотной кислотой) в кислой среде происходит полный разрыв двойной связи:
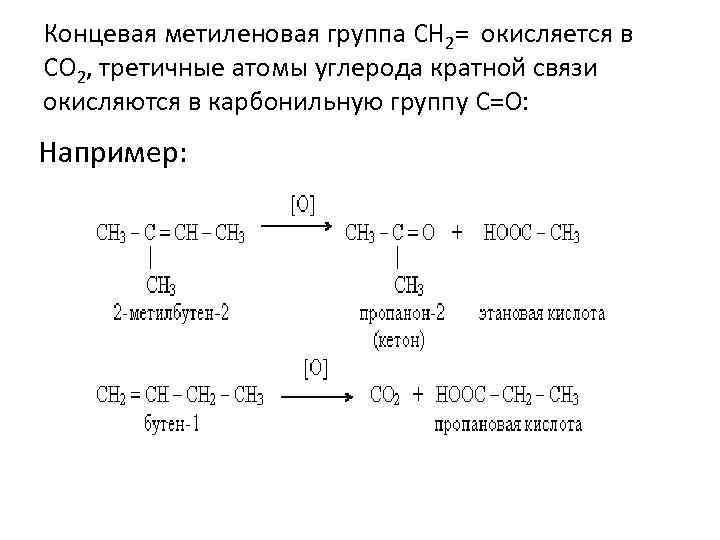 Концевая метиленовая группа СН 2= окисляется в СО 2, третичные атомы углерода кратной связи окисляются в карбонильную группу С=О: Например:
Концевая метиленовая группа СН 2= окисляется в СО 2, третичные атомы углерода кратной связи окисляются в карбонильную группу С=О: Например:
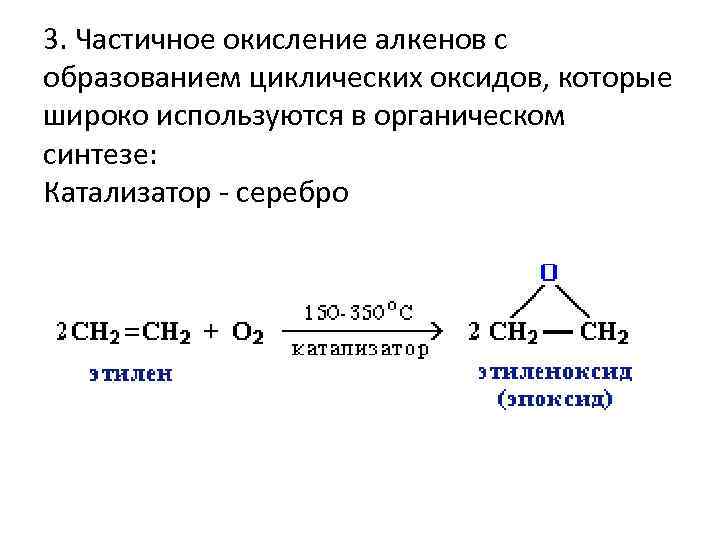 3. Частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе: Катализатор - серебро
3. Частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе: Катализатор - серебро
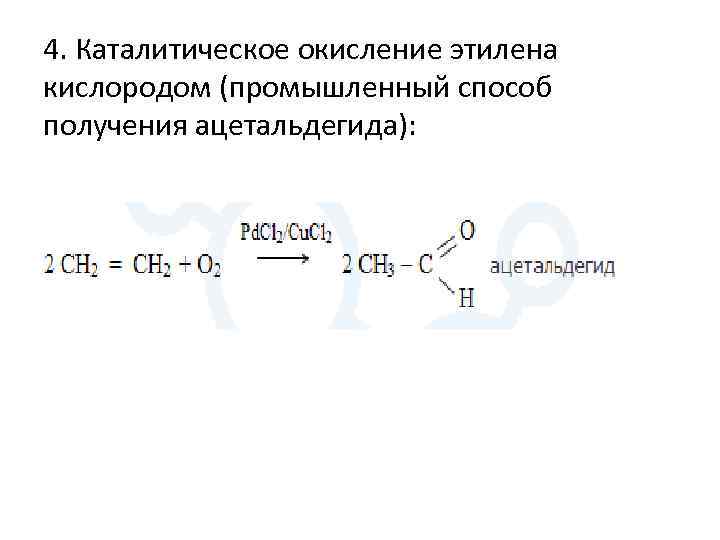 4. Каталитическое окисление этилена кислородом (промышленный способ получения ацетальдегида):
4. Каталитическое окисление этилена кислородом (промышленный способ получения ацетальдегида):
 5. Полное окисление (горение): Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
5. Полное окисление (горение): Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
 Изомеризация алкенов Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al 2 O 3). Изомеризация алкенов приводит или к перемещению –связи: или к перестройке углеродного скелета:
Изомеризация алкенов Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al 2 O 3). Изомеризация алкенов приводит или к перемещению –связи: или к перестройке углеродного скелета:
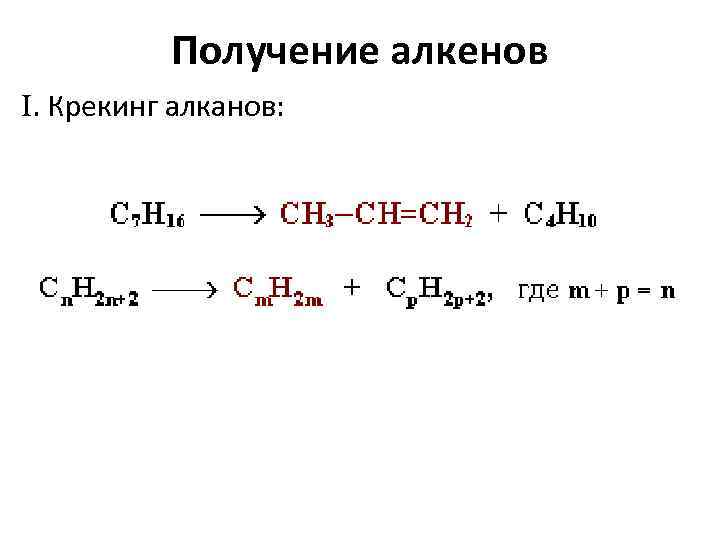 Получение алкенов . Крекинг алканов:
Получение алкенов . Крекинг алканов:
 II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи. 1. Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи:
II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи. 1. Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи:
 2. Дегидратация спиртов при температуре 180°C в присутствии водоотнимающих реагентов:
2. Дегидратация спиртов при температуре 180°C в присутствии водоотнимающих реагентов:
 Правило Зайцева: Отщепление атома водорода в реакциях деггидрологенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода. Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов. Такие алкены обладают более низкой энергией.
Правило Зайцева: Отщепление атома водорода в реакциях деггидрологенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода. Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов. Такие алкены обладают более низкой энергией.

 3. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов : 4. Дегидрирование алканов при 500°С:
3. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов : 4. Дегидрирование алканов при 500°С:


