АЛКЕНЫ лекц.ppt
- Количество слайдов: 113
 АЛКЕНЫ 1
АЛКЕНЫ 1
 Алкены Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. Сn. Н 2 n олефины 2
Алкены Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. Сn. Н 2 n олефины 2
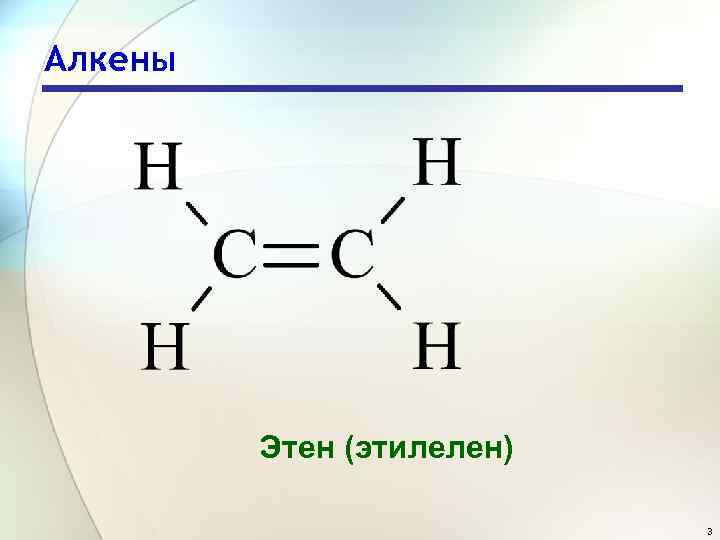 Алкены Этен (этилелен) 3
Алкены Этен (этилелен) 3
 Алкены Номенклатура 1) в алкенах с неразветвленной цепью нумерацию производят с того конца, ближе к которому находится двойная связь. В названии алкана, соответствующего этой родоначальной структуре, суффикс -ан заменяется на –ен. Этен (этилен) Пропен (пропилен) гексен-2 4
Алкены Номенклатура 1) в алкенах с неразветвленной цепью нумерацию производят с того конца, ближе к которому находится двойная связь. В названии алкана, соответствующего этой родоначальной структуре, суффикс -ан заменяется на –ен. Этен (этилен) Пропен (пропилен) гексен-2 4
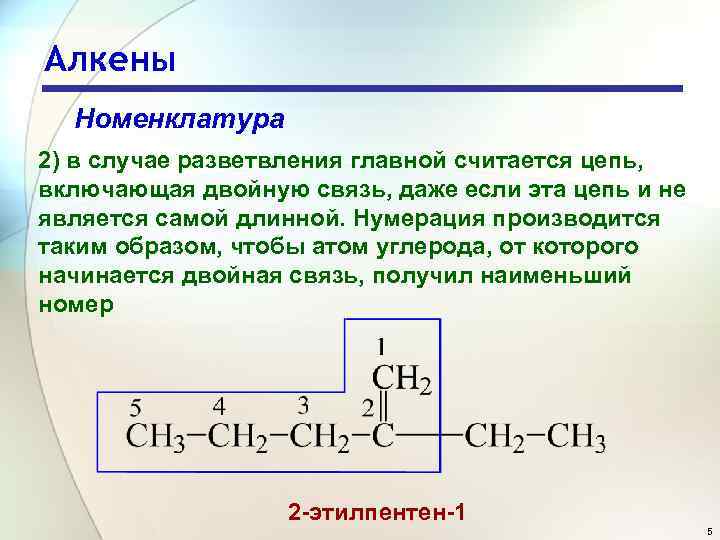 Алкены Номенклатура 2) в случае разветвления главной считается цепь, включающая двойную связь, даже если эта цепь и не является самой длинной. Нумерация производится таким образом, чтобы атом углерода, от которого начинается двойная связь, получил наименьший номер 2 -этилпентен-1 5
Алкены Номенклатура 2) в случае разветвления главной считается цепь, включающая двойную связь, даже если эта цепь и не является самой длинной. Нумерация производится таким образом, чтобы атом углерода, от которого начинается двойная связь, получил наименьший номер 2 -этилпентен-1 5
 Алкены Номенклатура 3) Углеводородные заместители обозначаются префиксом. Положение их указывается цифрой, соответствующей номеру того атома углерода, у которого находится заместитель. Заместители перечисляются в алфавитном порядке. В случае нескольких одинаковых углеводородных заместителей перед их названием ставится умножительная приставка ди-, три- и т. д. 6
Алкены Номенклатура 3) Углеводородные заместители обозначаются префиксом. Положение их указывается цифрой, соответствующей номеру того атома углерода, у которого находится заместитель. Заместители перечисляются в алфавитном порядке. В случае нескольких одинаковых углеводородных заместителей перед их названием ставится умножительная приставка ди-, три- и т. д. 6
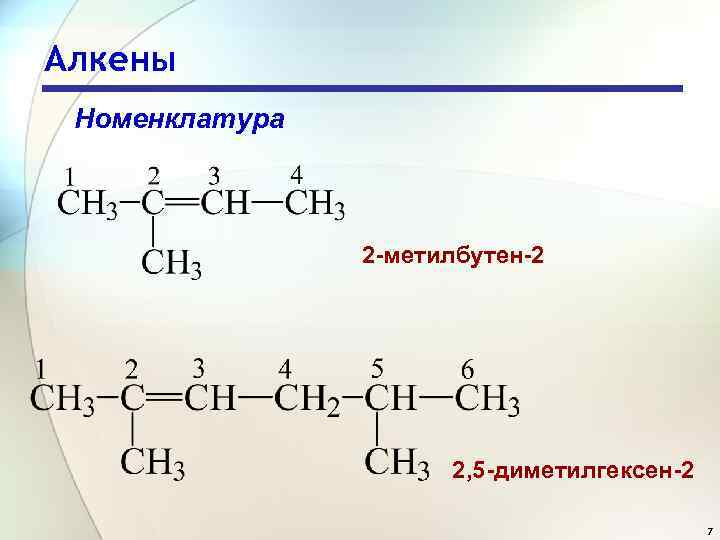 Алкены Номенклатура 2 -метилбутен-2 2, 5 -диметилгексен-2 7
Алкены Номенклатура 2 -метилбутен-2 2, 5 -диметилгексен-2 7
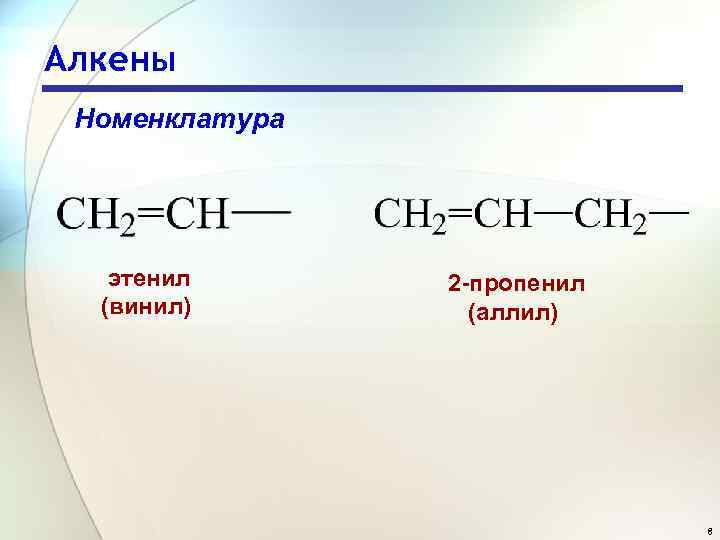 Алкены Номенклатура этенил (винил) 2 -пропенил (аллил) 8
Алкены Номенклатура этенил (винил) 2 -пропенил (аллил) 8
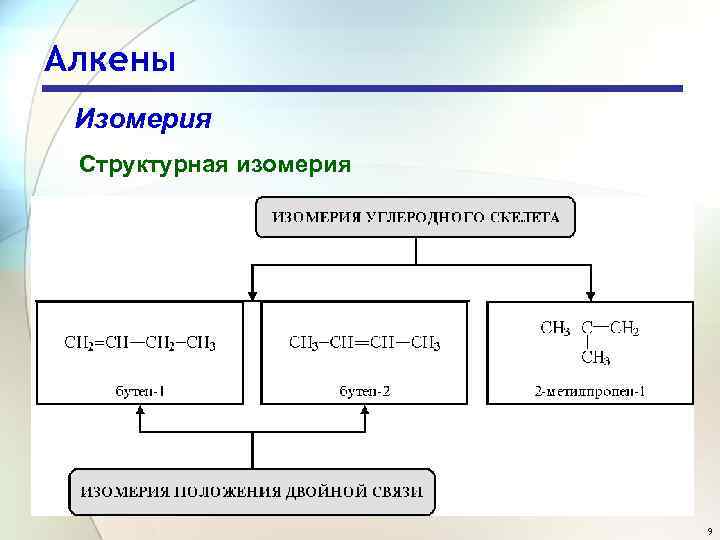 Алкены Изомерия Структурная изомерия 9
Алкены Изомерия Структурная изомерия 9
 Алкены Изомерия Пространственная изомерия Цис- и транс-изомеры бутена-2 10
Алкены Изомерия Пространственная изомерия Цис- и транс-изомеры бутена-2 10
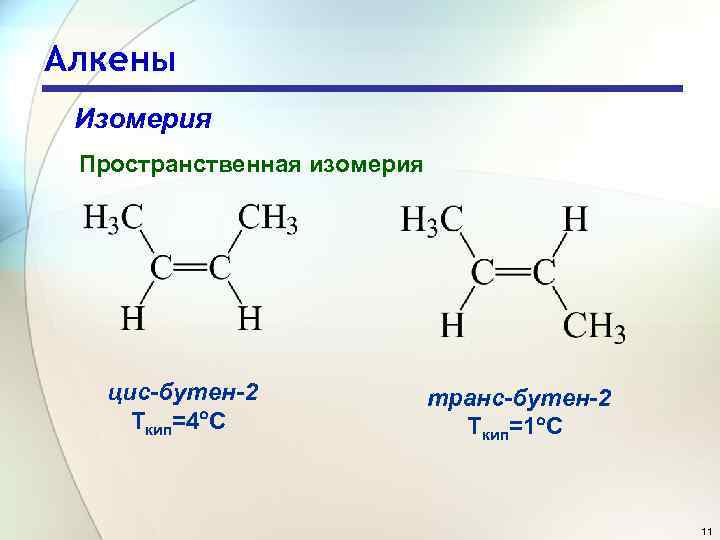 Алкены Изомерия Пространственная изомерия цис-бутен-2 Ткип=4 С транс-бутен-2 Ткип=1 С 11
Алкены Изомерия Пространственная изомерия цис-бутен-2 Ткип=4 С транс-бутен-2 Ткип=1 С 11
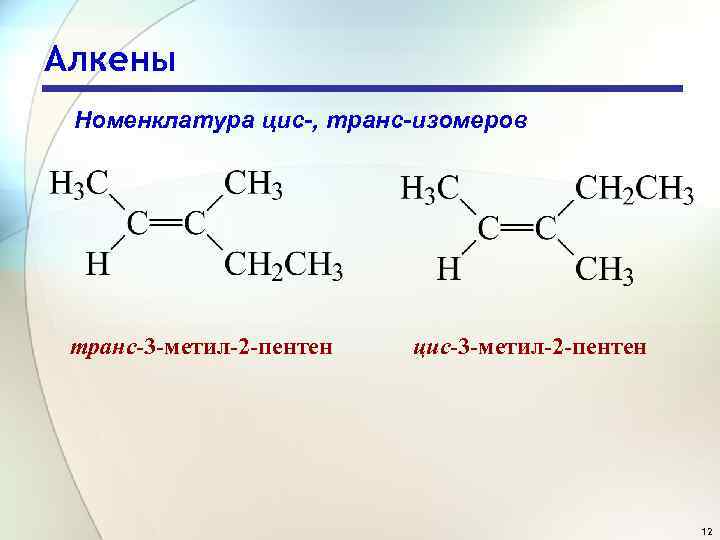 Алкены Номенклатура цис-, транс-изомеров транс-3 -метил-2 -пентен цис-3 -метил-2 -пентен 12
Алкены Номенклатура цис-, транс-изомеров транс-3 -метил-2 -пентен цис-3 -метил-2 -пентен 12
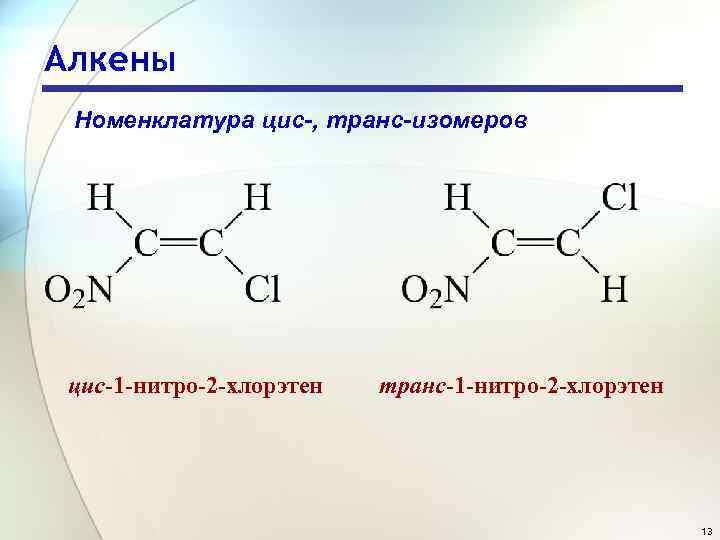 Алкены Номенклатура цис-, транс-изомеров цис-1 -нитро-2 -хлорэтен транс-1 -нитро-2 -хлорэтен 13
Алкены Номенклатура цис-, транс-изомеров цис-1 -нитро-2 -хлорэтен транс-1 -нитро-2 -хлорэтен 13
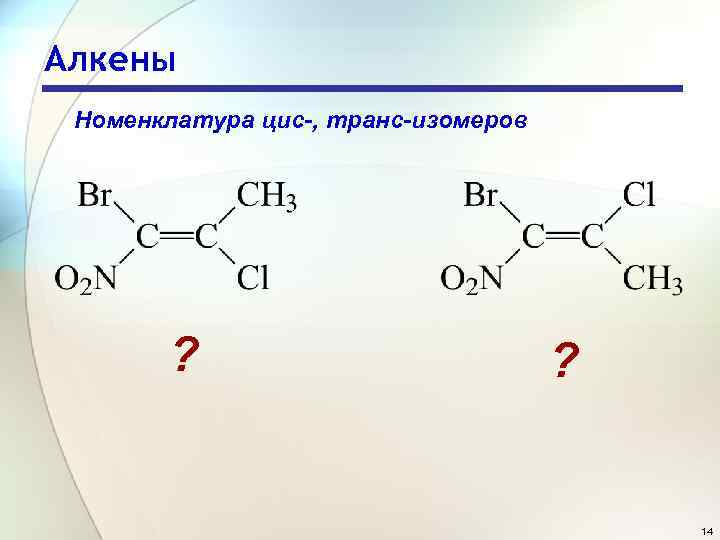 Алкены Номенклатура цис-, транс-изомеров ? ? 14
Алкены Номенклатура цис-, транс-изомеров ? ? 14
 Алкены Номенклатура цис-, транс-изомеров Система Кана–Ингольда–Прелога ? Роберт Сидни Кан (9. 06. 1899 -15. 09. 1981) (Великобритания) Ингольд Кристофер Прелог Владимир (28. 10. 1893– 8. 10. 1970) (23. 07. 1906– 07. 01. 1998) (Великобритания) (Швейцария) 15
Алкены Номенклатура цис-, транс-изомеров Система Кана–Ингольда–Прелога ? Роберт Сидни Кан (9. 06. 1899 -15. 09. 1981) (Великобритания) Ингольд Кристофер Прелог Владимир (28. 10. 1893– 8. 10. 1970) (23. 07. 1906– 07. 01. 1998) (Великобритания) (Швейцария) 15
 Алкены Номенклатура цис-, транс-изомеров 1. Используя систему Кана–Ингольда–Прелога, определяют сначала относительное старшинство заместителей, связанных с двойной связью, и дают им номера по старшинству 1 или 2. 2. Если две наиболее старшие группы расположены по одну сторону от плоскости -связи, то конфигурация заместителей обозначается символом Z, если же эти группы находятся по разные стороны от плоскости -связи, то конфигурация обозначается символом Е. 16
Алкены Номенклатура цис-, транс-изомеров 1. Используя систему Кана–Ингольда–Прелога, определяют сначала относительное старшинство заместителей, связанных с двойной связью, и дают им номера по старшинству 1 или 2. 2. Если две наиболее старшие группы расположены по одну сторону от плоскости -связи, то конфигурация заместителей обозначается символом Z, если же эти группы находятся по разные стороны от плоскости -связи, то конфигурация обозначается символом Е. 16
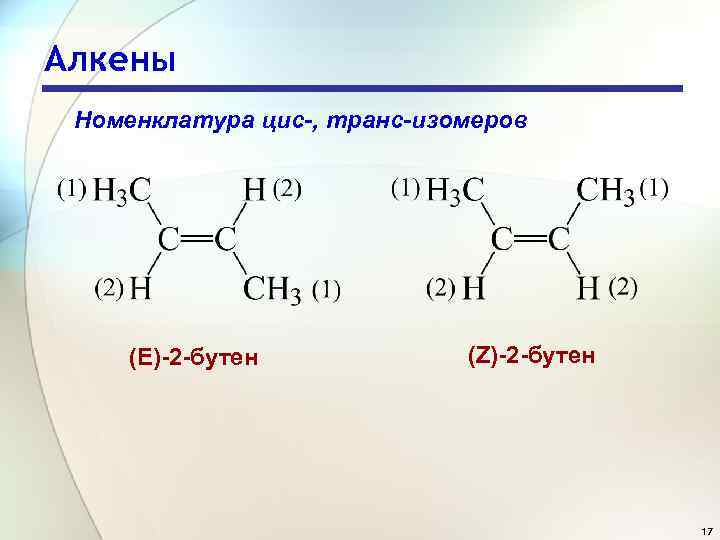 Алкены Номенклатура цис-, транс-изомеров (Е)-2 -бутен (Z)-2 -бутен 17
Алкены Номенклатура цис-, транс-изомеров (Е)-2 -бутен (Z)-2 -бутен 17
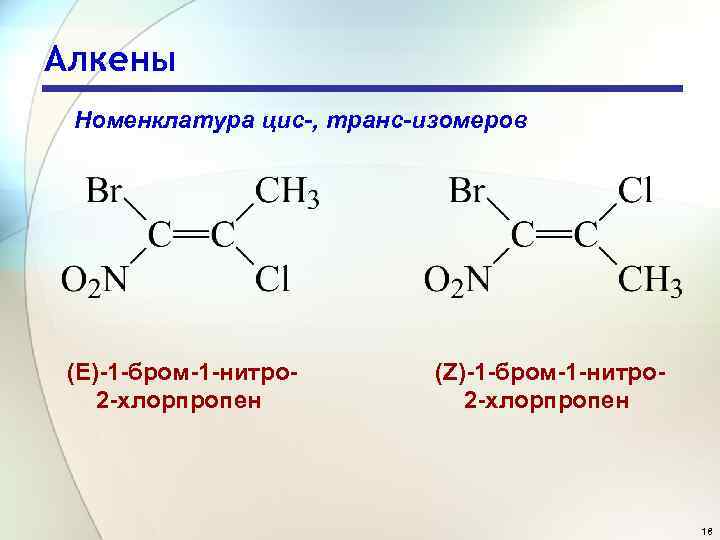 Алкены Номенклатура цис-, транс-изомеров (Е)-1 -бром-1 -нитро 2 -хлорпропен (Z)-1 -бром-1 -нитро 2 -хлорпропен 18
Алкены Номенклатура цис-, транс-изомеров (Е)-1 -бром-1 -нитро 2 -хлорпропен (Z)-1 -бром-1 -нитро 2 -хлорпропен 18
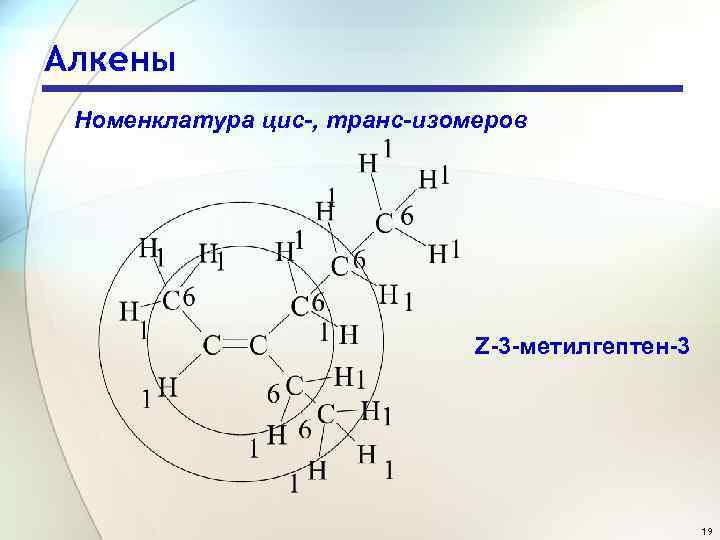 Алкены Номенклатура цис-, транс-изомеров Z-3 -метилгептен-3 19
Алкены Номенклатура цис-, транс-изомеров Z-3 -метилгептен-3 19
 Алкены Физические свойства 20
Алкены Физические свойства 20
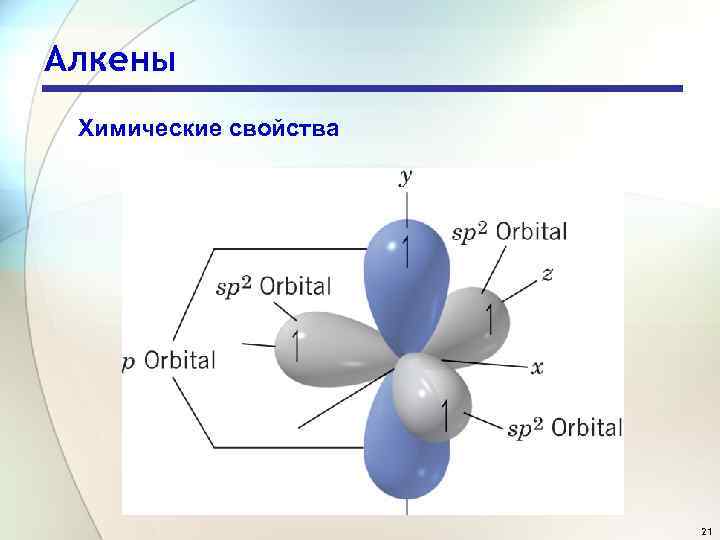 Алкены Химические свойства 21
Алкены Химические свойства 21
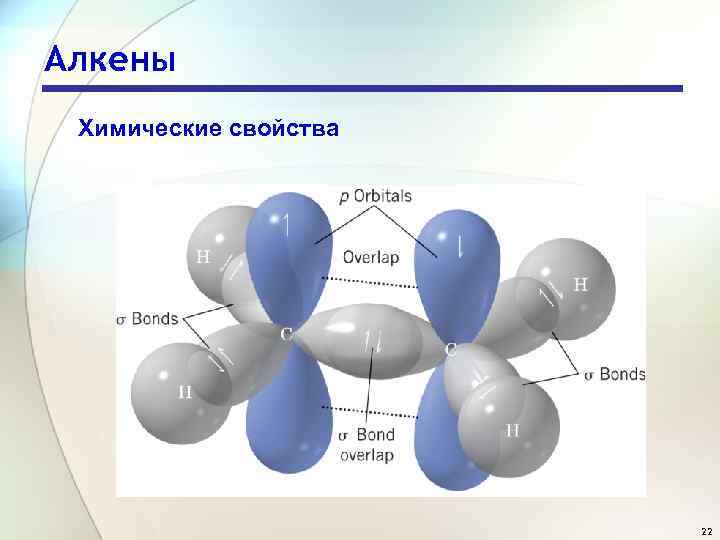 Алкены Химические свойства 22
Алкены Химические свойства 22
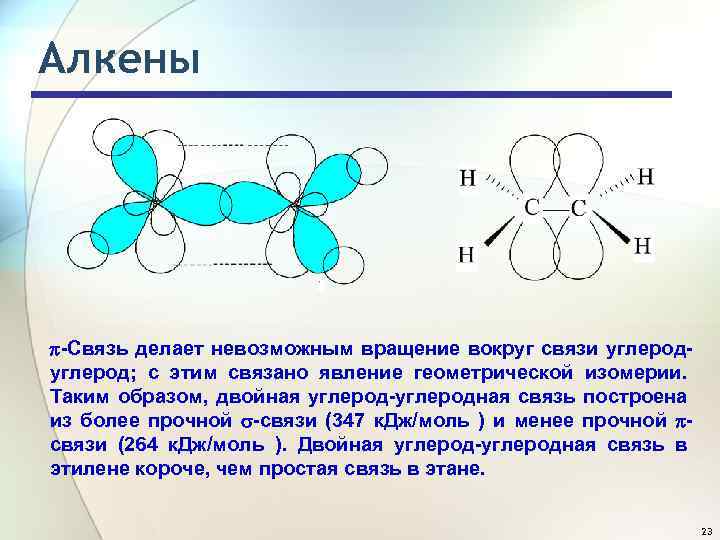 Алкены -Связь делает невозможным вращение вокруг связи углерод; с этим связано явление геометрической изомерии. Таким образом, двойная углерод-углеродная связь построена из более прочной -связи (347 к. Дж/моль ) и менее прочной связи (264 к. Дж/моль ). Двойная углерод-углеродная связь в этилене короче, чем простая связь в этане. 23
Алкены -Связь делает невозможным вращение вокруг связи углерод; с этим связано явление геометрической изомерии. Таким образом, двойная углерод-углеродная связь построена из более прочной -связи (347 к. Дж/моль ) и менее прочной связи (264 к. Дж/моль ). Двойная углерод-углеродная связь в этилене короче, чем простая связь в этане. 23
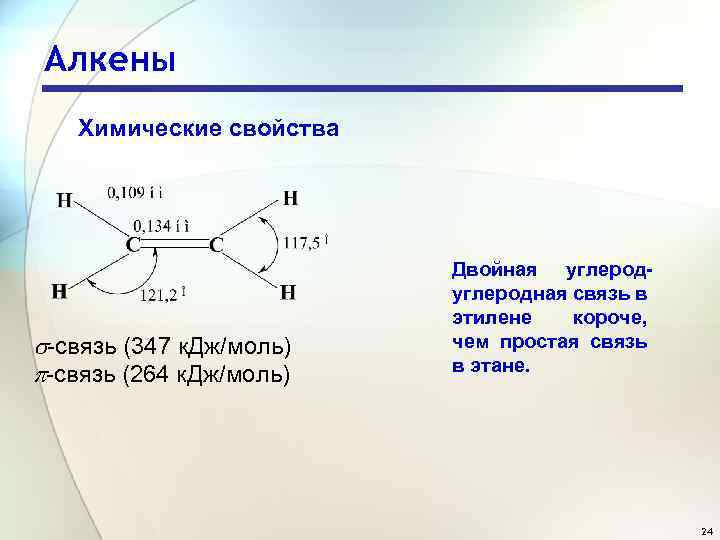 Алкены Химические свойства -связь (347 к. Дж/моль) -связь (264 к. Дж/моль) Двойная углеродная связь в этилене короче, чем простая связь в этане. 24
Алкены Химические свойства -связь (347 к. Дж/моль) -связь (264 к. Дж/моль) Двойная углеродная связь в этилене короче, чем простая связь в этане. 24
 Алкены Химические свойства Расстояние С-Н в этилене равно 0, 109 нм, что меньше, чем расстояние С-Н в этане (0, 110 нм). Гибридизация атомов углерода в этих соединениях неодинакова. По сравнению с sp 3 - орбиталью, sp 2 -орбиталь имеет меньшую долю pорбитали и большую долю s-орбитали. p-Орбиталь находится на большем расстоянии от ядра, чем s- орбиталь. По мере возрастания s-характера гибридной орбитали её эффективный размер уменьшается и одновременно уменьшается длина связи с другим атомом. 25
Алкены Химические свойства Расстояние С-Н в этилене равно 0, 109 нм, что меньше, чем расстояние С-Н в этане (0, 110 нм). Гибридизация атомов углерода в этих соединениях неодинакова. По сравнению с sp 3 - орбиталью, sp 2 -орбиталь имеет меньшую долю pорбитали и большую долю s-орбитали. p-Орбиталь находится на большем расстоянии от ядра, чем s- орбиталь. По мере возрастания s-характера гибридной орбитали её эффективный размер уменьшается и одновременно уменьшается длина связи с другим атомом. 25
 Алкены Химические свойства 50 % 33 % 25 % Чем больше доля s-состояния в гибридной орбитали атома углерода, тем более электроотрицательным он будет 26
Алкены Химические свойства 50 % 33 % 25 % Чем больше доля s-состояния в гибридной орбитали атома углерода, тем более электроотрицательным он будет 26
 Алкены Химические свойства Типичными реакциями двойной связи являются реакции, в которых происходит разрыв -связи и образование вместо нее двух более прочных -связей. Такие реакции называются реакциями присоединения. Они обозначаются символом Аd (Addition - присоединение). 27
Алкены Химические свойства Типичными реакциями двойной связи являются реакции, в которых происходит разрыв -связи и образование вместо нее двух более прочных -связей. Такие реакции называются реакциями присоединения. Они обозначаются символом Аd (Addition - присоединение). 27
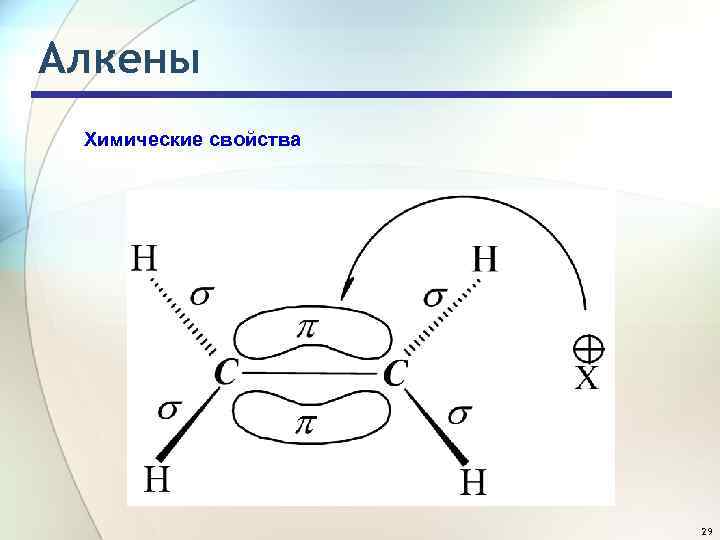
 Алкены Химические свойства Облака -электронов находятся над и под плоскостью, в которой лежат атомы углерода и водорода. Двойная углеродная связь служит донором электронов, т. е. ведет себя как основание (По Льюису, основание - соединение, предоставляющее пару электронов для образования связи, донор пары электронов; кислота - акцептор пары электронов). Она реагирует с соединениями, которые обеднены электронами, т. е. с кислотами (по Льюису). Эти реагенты, не имеющие пары электронов, называются электрофильными реагентами (электрофил - любящий электроны). Следовательно, типичными реакциями алкенов являются реакции электрофильного присоединения (Ad. E). 28
Алкены Химические свойства Облака -электронов находятся над и под плоскостью, в которой лежат атомы углерода и водорода. Двойная углеродная связь служит донором электронов, т. е. ведет себя как основание (По Льюису, основание - соединение, предоставляющее пару электронов для образования связи, донор пары электронов; кислота - акцептор пары электронов). Она реагирует с соединениями, которые обеднены электронами, т. е. с кислотами (по Льюису). Эти реагенты, не имеющие пары электронов, называются электрофильными реагентами (электрофил - любящий электроны). Следовательно, типичными реакциями алкенов являются реакции электрофильного присоединения (Ad. E). 28
 Алкены Химические свойства 29
Алкены Химические свойства 29
 Алкены Химические свойства Существуют реагенты другого типа, также обедненные электронами, - свободные радикалы. С ними алкены вступают в реакции радикального присоединения (Ad. R). Большинство алкенов содержит алкильные группы, которые являются остатками алканов, следовательно, такие алкены могут подобно алканам участвовать в реакциях свободнорадикального замещения атома водорода в алкильном остатке (SR). 30
Алкены Химические свойства Существуют реагенты другого типа, также обедненные электронами, - свободные радикалы. С ними алкены вступают в реакции радикального присоединения (Ad. R). Большинство алкенов содержит алкильные группы, которые являются остатками алканов, следовательно, такие алкены могут подобно алканам участвовать в реакциях свободнорадикального замещения атома водорода в алкильном остатке (SR). 30
 Алкены Гидрирование 31
Алкены Гидрирование 31
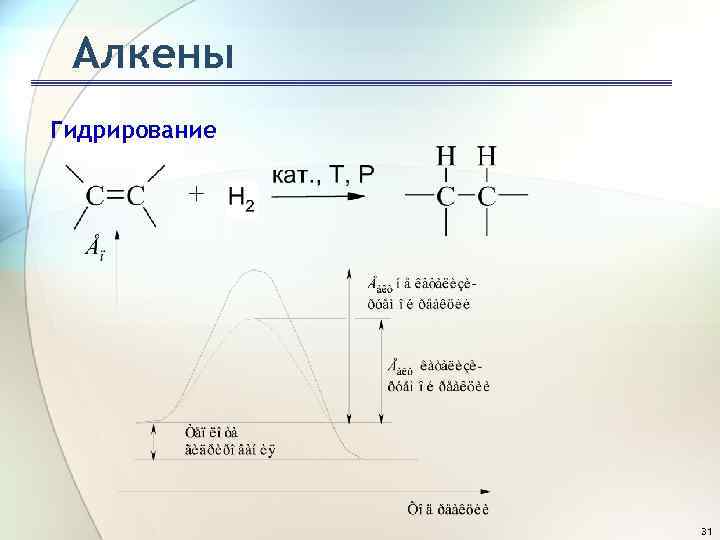
 Алкены Гидрирование этена С*, H* - атомы углерода и водорода, активированные на поверхности катализатора 32
Алкены Гидрирование этена С*, H* - атомы углерода и водорода, активированные на поверхности катализатора 32
 Алкены Теплота гидрирования и устойчивость алкенов 33
Алкены Теплота гидрирования и устойчивость алкенов 33
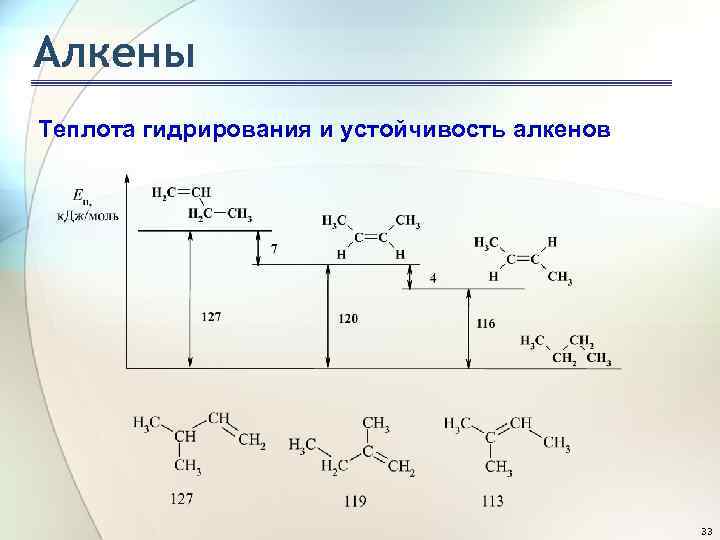
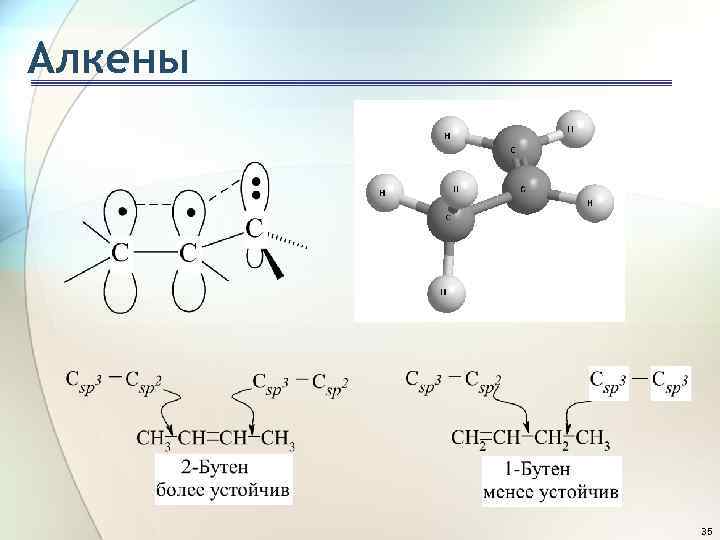
 Алкены Теплота гидрирования и устойчивость алкенов Чем больше степень алкилирования атомов углерода при двойной связи, тем более устойчив алкен: 34
Алкены Теплота гидрирования и устойчивость алкенов Чем больше степень алкилирования атомов углерода при двойной связи, тем более устойчив алкен: 34
 Алкены 35
Алкены 35
 Алкены Присоединение галогенов АE (от англ. addition electrophilic) 36
Алкены Присоединение галогенов АE (от англ. addition electrophilic) 36
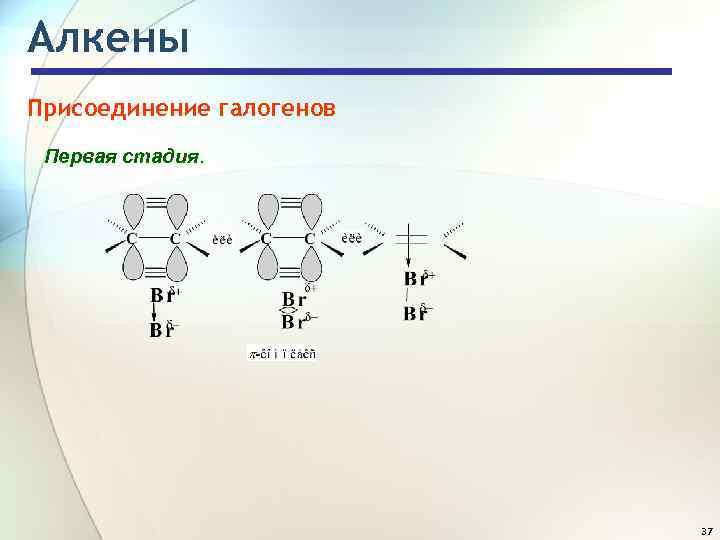 Алкены Присоединение галогенов Первая стадия. 37
Алкены Присоединение галогенов Первая стадия. 37
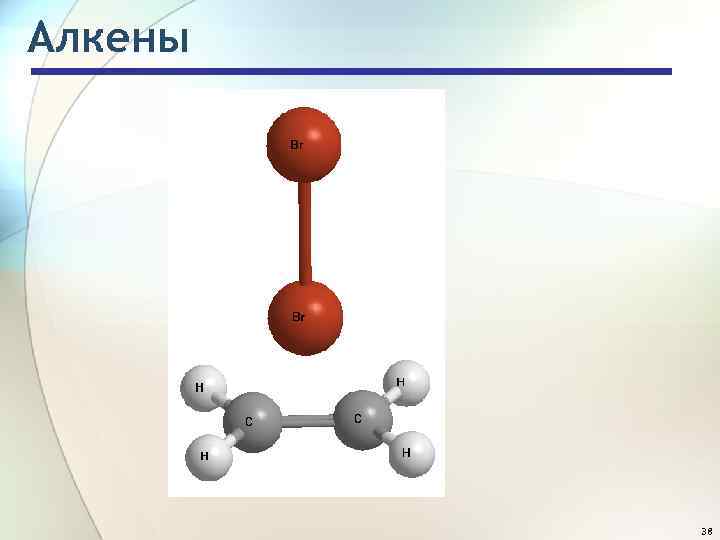 Алкены 38
Алкены 38
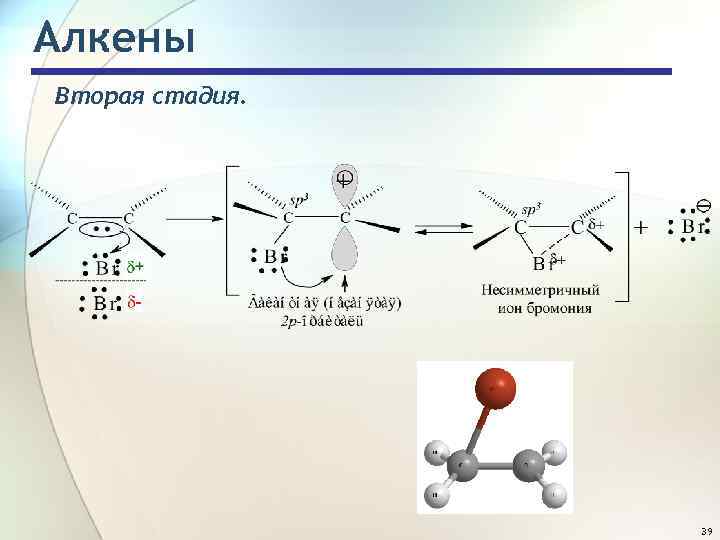 Алкены Вторая стадия. 39
Алкены Вторая стадия. 39
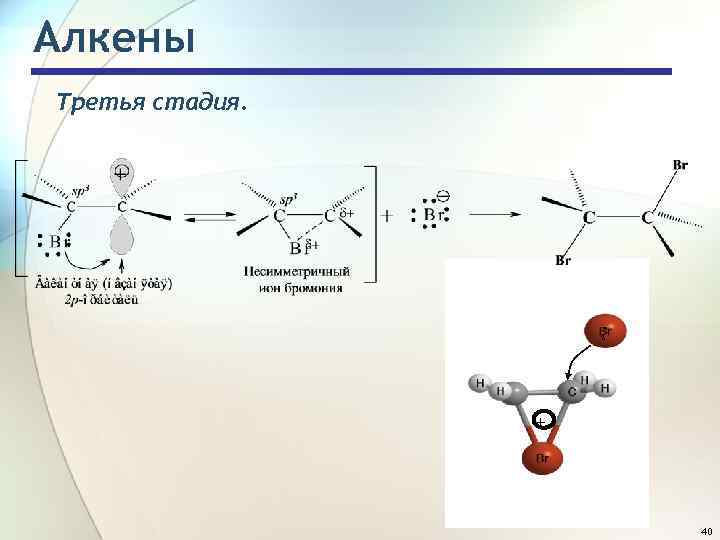 Алкены Третья стадия. - 3 + 40
Алкены Третья стадия. - 3 + 40
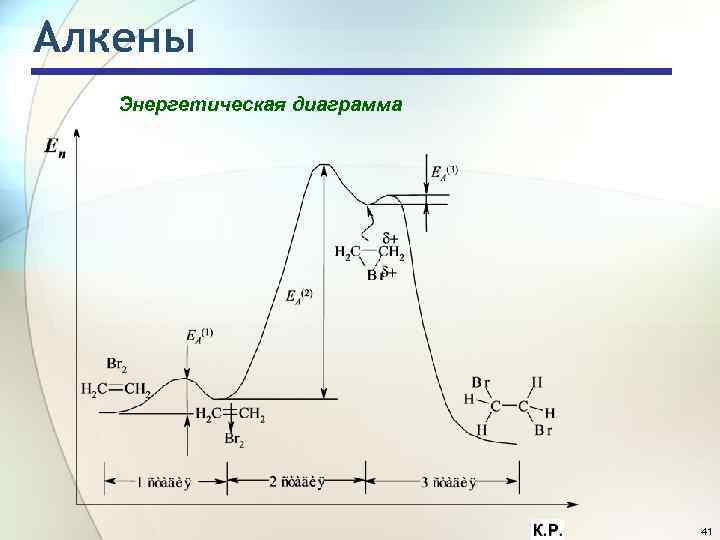 Алкены Энергетическая диаграмма 41
Алкены Энергетическая диаграмма 41
 Алкены Сопряженное присоединение Стереоспецифическим называется процесс, в котором орбаразуется только один из возможных стереоизомеров. Стереоселективным называется процесс, в котором преимущественно образуется один стереоизомер. 42
Алкены Сопряженное присоединение Стереоспецифическим называется процесс, в котором орбаразуется только один из возможных стереоизомеров. Стереоселективным называется процесс, в котором преимущественно образуется один стереоизомер. 42
 Алкены Реакционная способность галогенов в реакции Аd. Е Присоединение хлора и брома к алкенам происходит легко и во многих случаях с количественным выходом. Присоединения йода к алкенам осуществить не удается. Взаимодействие фтора с алкенами происходит так энергично, что углеводород распадается на осколки с меньшим числом атомов углерода. I 2 << Br 2 < Cl 2 < F 2 43
Алкены Реакционная способность галогенов в реакции Аd. Е Присоединение хлора и брома к алкенам происходит легко и во многих случаях с количественным выходом. Присоединения йода к алкенам осуществить не удается. Взаимодействие фтора с алкенами происходит так энергично, что углеводород распадается на осколки с меньшим числом атомов углерода. I 2 << Br 2 < Cl 2 < F 2 43
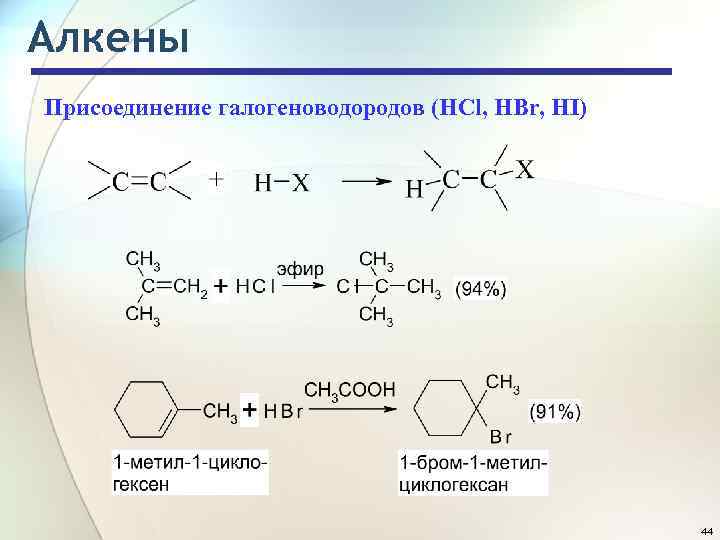 Алкены Присоединение галогеноводородов (HCl, HBr, HI) 44
Алкены Присоединение галогеноводородов (HCl, HBr, HI) 44
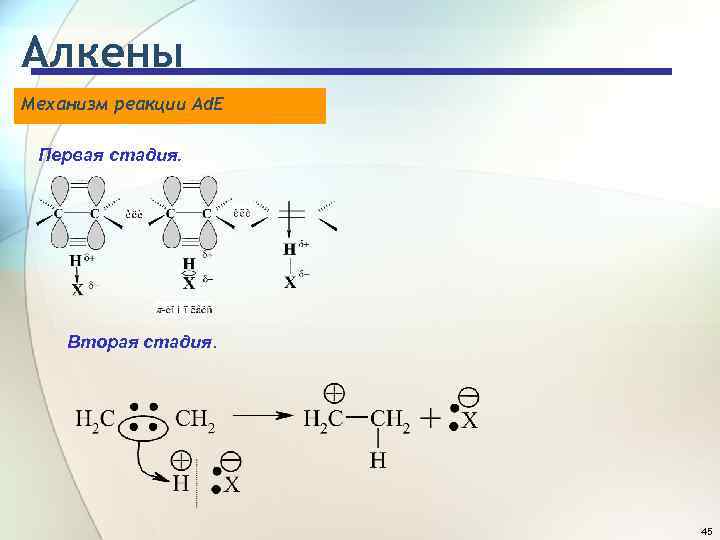 Алкены Механизм реакции Ad. E Первая стадия. Вторая стадия. 45
Алкены Механизм реакции Ad. E Первая стадия. Вторая стадия. 45
 Алкены Механизм реакции Ad. E Третья стадия. Порядок увеличения реакционной способности галогеноводородов по отношению к алкенам совпадает с порядком увеличения их кислотности: HF << HCI < HBr < HI. 46
Алкены Механизм реакции Ad. E Третья стадия. Порядок увеличения реакционной способности галогеноводородов по отношению к алкенам совпадает с порядком увеличения их кислотности: HF << HCI < HBr < HI. 46
 Алкены Направление электрофильного присоединения 1869 г. В. Марковников Галогеноводороды, как и другие протонные кислоты, присоединяются к несимметричным алкенам таким образом, что водород присоединяется к атому углерода, несущему наибольшее число атомов водорода. 47
Алкены Направление электрофильного присоединения 1869 г. В. Марковников Галогеноводороды, как и другие протонные кислоты, присоединяются к несимметричным алкенам таким образом, что водород присоединяется к атому углерода, несущему наибольшее число атомов водорода. 47
 Алкены МАРКОВНИКОВ Владимир Васильевич 13. 12. 1837 – 29. 01. 1904 48
Алкены МАРКОВНИКОВ Владимир Васильевич 13. 12. 1837 – 29. 01. 1904 48
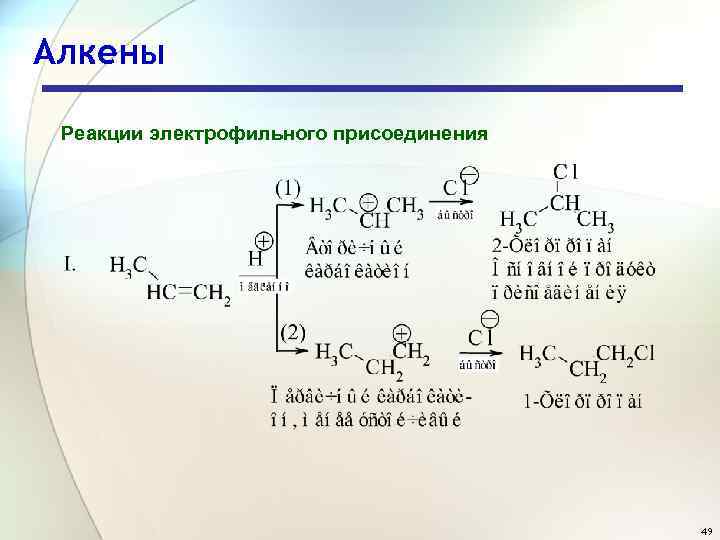 Алкены Реакции электрофильного присоединения 49
Алкены Реакции электрофильного присоединения 49
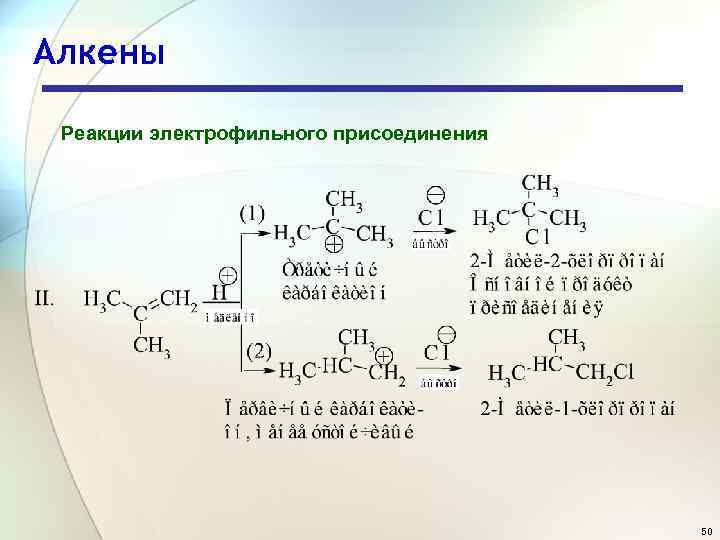 Алкены Реакции электрофильного присоединения 50
Алкены Реакции электрофильного присоединения 50
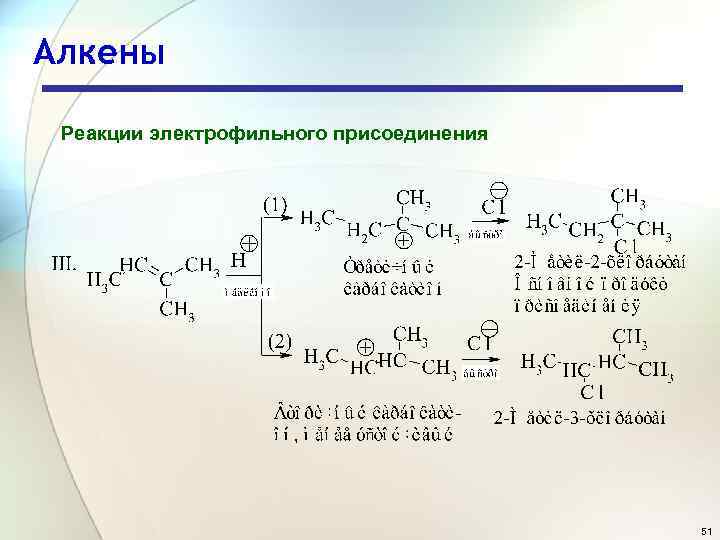 Алкены Реакции электрофильного присоединения 51
Алкены Реакции электрофильного присоединения 51
 Алкены Реакции электрофильного присоединения Состав продуктов реакции показывает, что в первой стадии вторичный карбокатион образуется быстрее, чем первичный по реакции 1, а третичный - быстрее, чем первичный и вторичный, как следует из реакций II и III. Легкость образования карбокатионов увеличивается в следующей последовательности: первичный < вторичный < третичный. Устойчивость карбокатионов увеличивается следующей последовательности: первичный < вторичный < третичный. в 52
Алкены Реакции электрофильного присоединения Состав продуктов реакции показывает, что в первой стадии вторичный карбокатион образуется быстрее, чем первичный по реакции 1, а третичный - быстрее, чем первичный и вторичный, как следует из реакций II и III. Легкость образования карбокатионов увеличивается в следующей последовательности: первичный < вторичный < третичный. Устойчивость карбокатионов увеличивается следующей последовательности: первичный < вторичный < третичный. в 52
 Алкены Строение карбокатиона 53
Алкены Строение карбокатиона 53
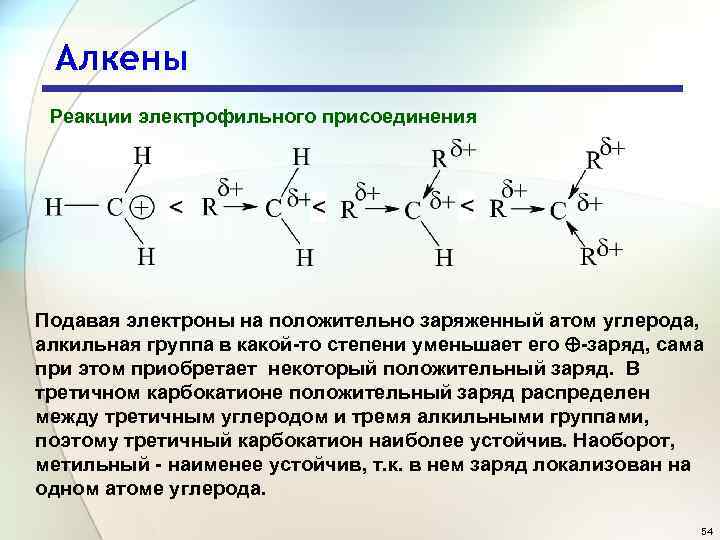 Алкены Реакции электрофильного присоединения Подавая электроны на положительно заряженный атом углерода, алкильная группа в какой-то степени уменьшает его -заряд, сама при этом приобретает некоторый положительный заряд. В третичном карбокатионе положительный заряд распределен между третичным углеродом и тремя алкильными группами, поэтому третичный карбокатион наиболее устойчив. Наоборот, метильный - наименее устойчив, т. к. в нем заряд локализован на одном атоме углерода. 54
Алкены Реакции электрофильного присоединения Подавая электроны на положительно заряженный атом углерода, алкильная группа в какой-то степени уменьшает его -заряд, сама при этом приобретает некоторый положительный заряд. В третичном карбокатионе положительный заряд распределен между третичным углеродом и тремя алкильными группами, поэтому третичный карбокатион наиболее устойчив. Наоборот, метильный - наименее устойчив, т. к. в нем заряд локализован на одном атоме углерода. 54
 Алкены Реакции электрофильного присоединения Устойчивость карбокатионов изменяется в таком же порядке, как и лёгкость их образования. Чем устойчивее карбокатион, тем легче он образуется. 55
Алкены Реакции электрофильного присоединения Устойчивость карбокатионов изменяется в таком же порядке, как и лёгкость их образования. Чем устойчивее карбокатион, тем легче он образуется. 55
 Алкены Реакции электрофильного присоединения Современная трактовка правила Марковникова электрофильное присоединение к алкенам происходит через стадию образования более устойчивого карбокатиона. 56
Алкены Реакции электрофильного присоединения Современная трактовка правила Марковникова электрофильное присоединение к алкенам происходит через стадию образования более устойчивого карбокатиона. 56
 Алкены Индуктивный эффект – перераспределение электронной плотности внутри σ-связей, которое возникает вследствие разности величин электроотрицатеньности атомов, участвующих в этих связях. 57
Алкены Индуктивный эффект – перераспределение электронной плотности внутри σ-связей, которое возникает вследствие разности величин электроотрицатеньности атомов, участвующих в этих связях. 57
 Алкены Заместитель (Х), притягивающий электронную плотность -связи сильнее, чем атом водорода, проявляет отрицательный индуктивный эффект (-I). Такие заместители в целом снижают электронную плотность системы и их называют электроноакцепторными (галогены, ОН, NO 2, СООН, катионы и др. ). Если заместитель (Y) по сравнению с атомом водорода смещает электронную плотность -связи в сторону атома углерода цепи, то он проявляет положительный индуктивный эффект (+I). Такие заместители ведут к повышению электронной плотности в цепи и называются электронодонорными. К их числу относятся алкильные группы, металлы и анионы. 58
Алкены Заместитель (Х), притягивающий электронную плотность -связи сильнее, чем атом водорода, проявляет отрицательный индуктивный эффект (-I). Такие заместители в целом снижают электронную плотность системы и их называют электроноакцепторными (галогены, ОН, NO 2, СООН, катионы и др. ). Если заместитель (Y) по сравнению с атомом водорода смещает электронную плотность -связи в сторону атома углерода цепи, то он проявляет положительный индуктивный эффект (+I). Такие заместители ведут к повышению электронной плотности в цепи и называются электронодонорными. К их числу относятся алкильные группы, металлы и анионы. 58
 Алкены Эффект, проявляющийся в смещении электронной плотности в ненасыщенных и, особенно, в сопряженных системах называют мезомерным (М-эффектом) или эффектом сопряжения. Он обусловлен смещением -электронов сопряженных связей или неподеленных пар в сторону атомов с недостроенной до октета электронной оболочкой. Электронное смещение (обозначается изогнутой стрелкой) приводит к появлению частичных зарядов на концах сопряженной цепи. 59
Алкены Эффект, проявляющийся в смещении электронной плотности в ненасыщенных и, особенно, в сопряженных системах называют мезомерным (М-эффектом) или эффектом сопряжения. Он обусловлен смещением -электронов сопряженных связей или неподеленных пар в сторону атомов с недостроенной до октета электронной оболочкой. Электронное смещение (обозначается изогнутой стрелкой) приводит к появлению частичных зарядов на концах сопряженной цепи. 59
 Алкены В отличие от индуктивного, мезомерный эффект передается по системе сопряженных связей на значительно большее расстояние. Заместители, способные к эффекту сопряжения, одновременно проявляют и индуктивный эффект. При этом М- и I-эффекты могут иметь как одинаковое, так и противоположное направление. При оценке влияния заместителей на распределение электронной плотности надо учитывать результирующее действие индуктивного и мезомерного эффектов 60
Алкены В отличие от индуктивного, мезомерный эффект передается по системе сопряженных связей на значительно большее расстояние. Заместители, способные к эффекту сопряжения, одновременно проявляют и индуктивный эффект. При этом М- и I-эффекты могут иметь как одинаковое, так и противоположное направление. При оценке влияния заместителей на распределение электронной плотности надо учитывать результирующее действие индуктивного и мезомерного эффектов 60
 Алкены По результирующему действию заместители можно поделить на электронодонорные группы и электроноакцепторные Электронодонорные группы Электроноакцепторные группы 61
Алкены По результирующему действию заместители можно поделить на электронодонорные группы и электроноакцепторные Электронодонорные группы Электроноакцепторные группы 61
 Алкены 62
Алкены 62
 Алкены Реакции электрофильного присоединения 63
Алкены Реакции электрофильного присоединения 63
 Алкены Реакционная способность и селективность Наиболее реакционноспособным должен быть алкен, дающий наиболее устойчивый карбокатион: 64
Алкены Реакционная способность и селективность Наиболее реакционноспособным должен быть алкен, дающий наиболее устойчивый карбокатион: 64
 Алкены Реакционная способность и селективность Влияние, которое повышает электронную плотность двойной связи, будет увеличивать ее реакционную способность, тогда как влияние понижающее электронную плотность, будет уменьшать реакционную способность. Виниловые эфиры CH 2=CHOR присоединяют НХ (X=Hal) по правилу Марковникова с гораздо большей скоростью, чем все перечисленные выше замещенные алкены. Это связано со значительным +М-эффектом RО-группы. В отличие от нитрогруппы, RО-группа по суммарному электронному эффекту (+М > -I) является сильным электронодонорным заместителем, эффективно стабилизирующим соседний карбокатионный центр. 65
Алкены Реакционная способность и селективность Влияние, которое повышает электронную плотность двойной связи, будет увеличивать ее реакционную способность, тогда как влияние понижающее электронную плотность, будет уменьшать реакционную способность. Виниловые эфиры CH 2=CHOR присоединяют НХ (X=Hal) по правилу Марковникова с гораздо большей скоростью, чем все перечисленные выше замещенные алкены. Это связано со значительным +М-эффектом RО-группы. В отличие от нитрогруппы, RО-группа по суммарному электронному эффекту (+М > -I) является сильным электронодонорным заместителем, эффективно стабилизирующим соседний карбокатионный центр. 65
 Алкены Перегруппировка происходит в том случае, если при 1, 2 -сдвиге гидрид-иона или отрицательно заряженной CH 3 группы может образоваться более устойчивый карбокатион. 66
Алкены Перегруппировка происходит в том случае, если при 1, 2 -сдвиге гидрид-иона или отрицательно заряженной CH 3 группы может образоваться более устойчивый карбокатион. 66
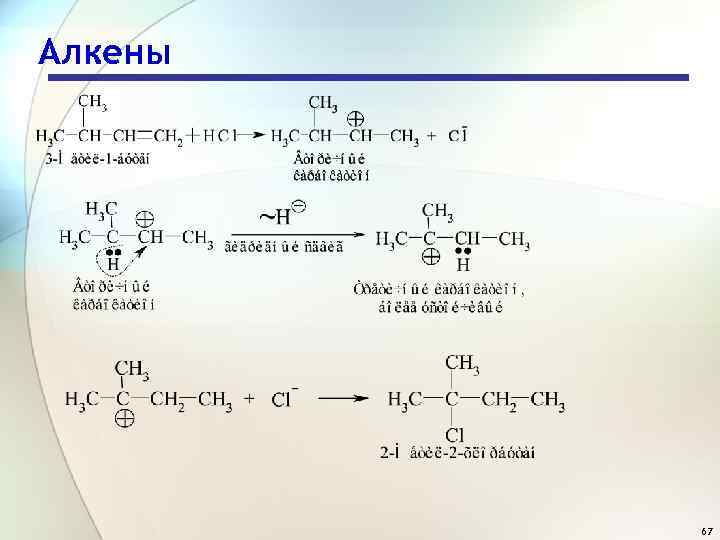 Алкены 67
Алкены 67
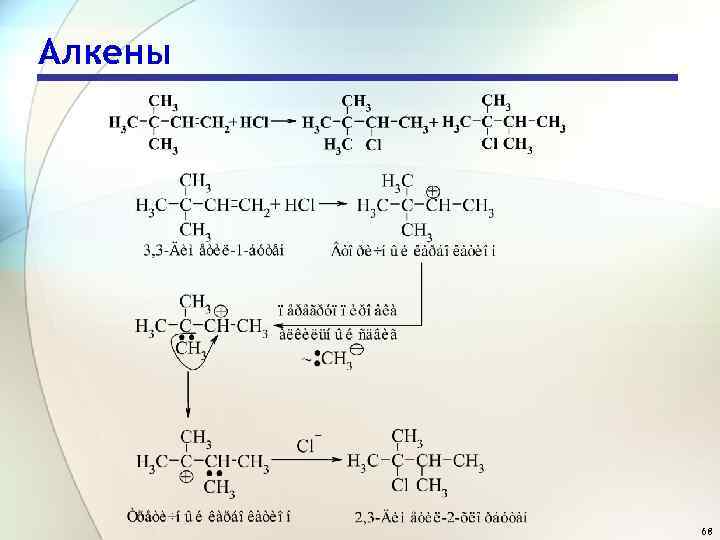 Алкены 68
Алкены 68
 Алкены Присоединение серной кислоты 69
Алкены Присоединение серной кислоты 69
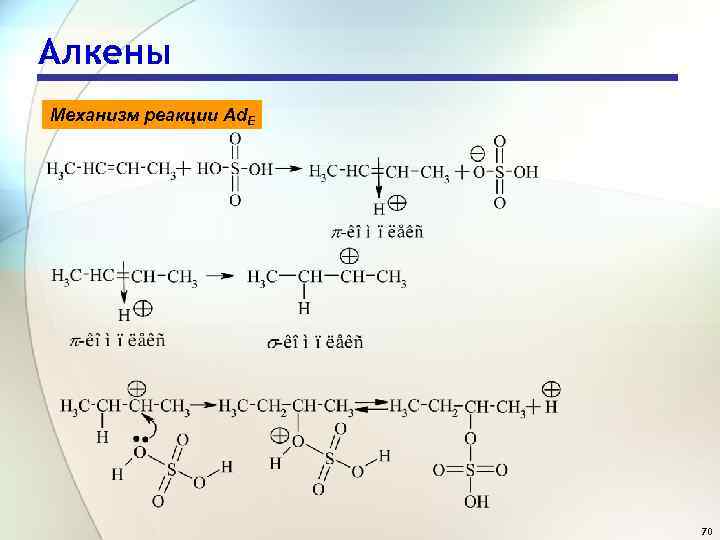 Алкены Механизм реакции Ad. E 70
Алкены Механизм реакции Ad. E 70
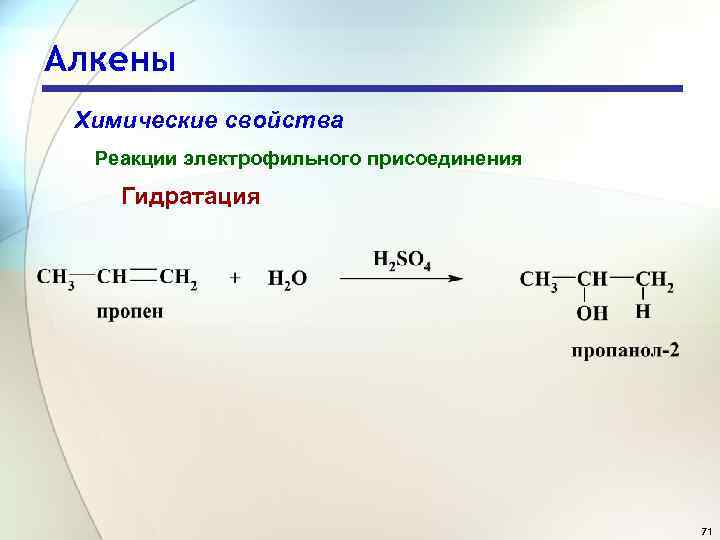 Алкены Химические свойства Реакции электрофильного присоединения Гидратация 71
Алкены Химические свойства Реакции электрофильного присоединения Гидратация 71
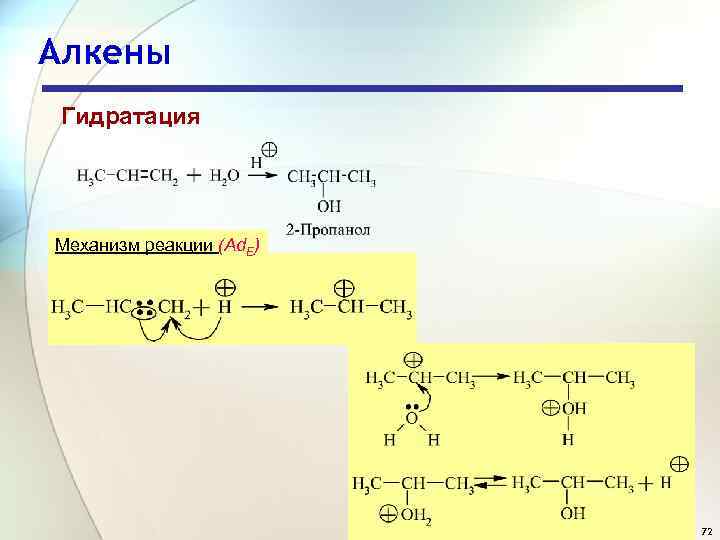 Алкены Гидратация Механизм реакции (Ad. E) 72
Алкены Гидратация Механизм реакции (Ad. E) 72
 Алкены Синтез простых эфиров 73
Алкены Синтез простых эфиров 73
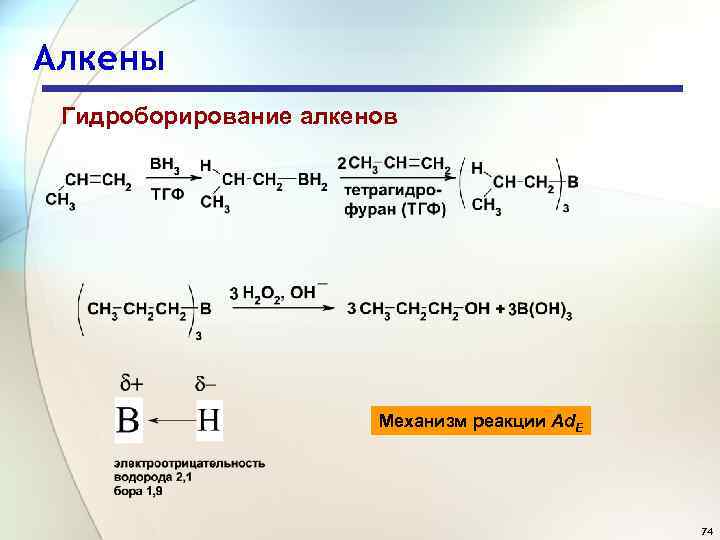 Алкены Гидроборирование алкенов Механизм реакции Ad. E 74
Алкены Гидроборирование алкенов Механизм реакции Ad. E 74
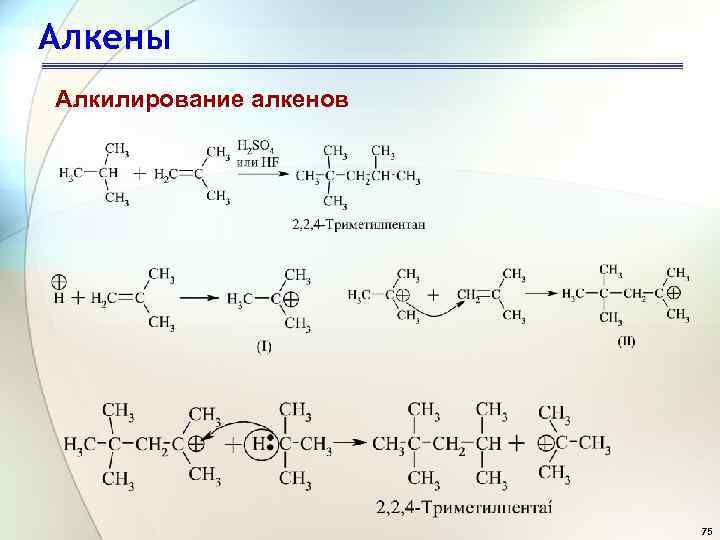 Алкены Алкилирование алкенов 75
Алкены Алкилирование алкенов 75
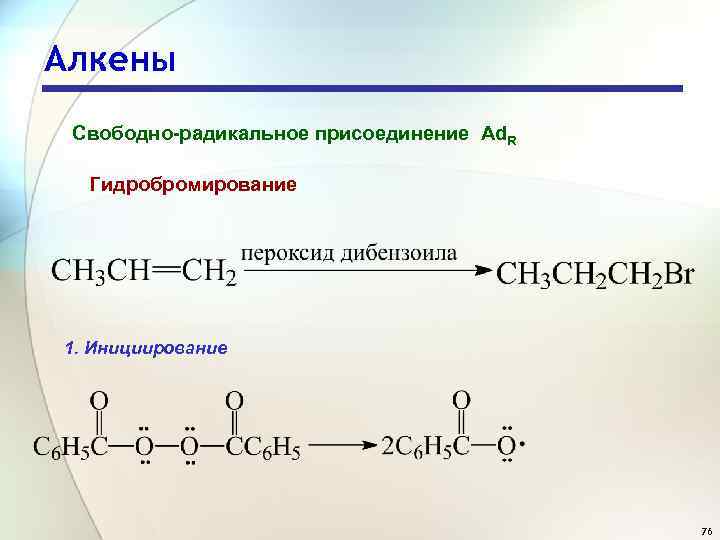 Алкены Свободно-радикальное присоединение Ad. R Гидробромирование 1. Инициирование 76
Алкены Свободно-радикальное присоединение Ad. R Гидробромирование 1. Инициирование 76
 Алкены Свободно-радикальное присоединение Ad. R 2. Рост цепи: 77
Алкены Свободно-радикальное присоединение Ad. R 2. Рост цепи: 77
 Алкены 3. Обрыв 78
Алкены 3. Обрыв 78
 Алкены Свободно-радикальное присоединение Присоединение HBr против правила Марковникова происходит следующим образом: Br (а не Н ) реагирует в первую очередь с -системой и быстрее всего образуется наиболее стабильный радикал. Эффект Хараша, 1929 г. Независимо от механизма реакции в медленной стадии из двух возможных промежуточных частиц более устойчивая образуется быстрее. 79
Алкены Свободно-радикальное присоединение Присоединение HBr против правила Марковникова происходит следующим образом: Br (а не Н ) реагирует в первую очередь с -системой и быстрее всего образуется наиболее стабильный радикал. Эффект Хараша, 1929 г. Независимо от механизма реакции в медленной стадии из двух возможных промежуточных частиц более устойчивая образуется быстрее. 79
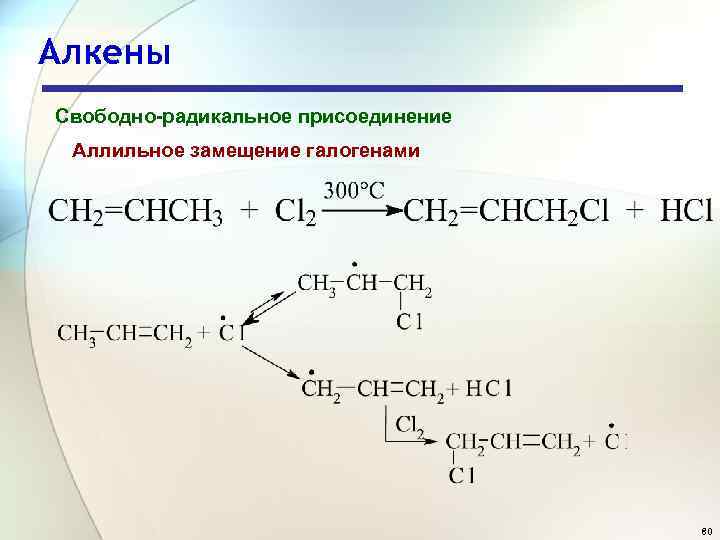 Алкены Свободно-радикальное присоединение Аллильное замещение галогенами 80
Алкены Свободно-радикальное присоединение Аллильное замещение галогенами 80
 Алкены Реакция полимеризации Полимер - это макромолекула, состоящая из очень большого числа повторяющихся звеньев. Он образуется путем последовательного присоединения малых молекул, называемых мономерами. Полимер, получаемый из одинаковых мономеров, называется гомополимером, Полимер, получаемый из двух различных мономеров – сополимером или гетерополимером. n. A –A–A– или An гомополимер m. B + n. A –A–B–B–A–A–B–B–A– сополимер (случайное расположение) 81
Алкены Реакция полимеризации Полимер - это макромолекула, состоящая из очень большого числа повторяющихся звеньев. Он образуется путем последовательного присоединения малых молекул, называемых мономерами. Полимер, получаемый из одинаковых мономеров, называется гомополимером, Полимер, получаемый из двух различных мономеров – сополимером или гетерополимером. n. A –A–A– или An гомополимер m. B + n. A –A–B–B–A–A–B–B–A– сополимер (случайное расположение) 81
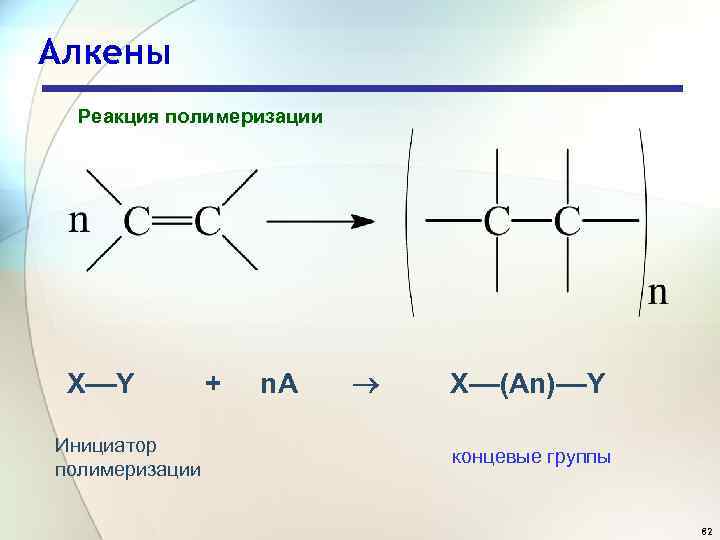 Алкены Реакция полимеризации X––Y + n. A Инициатор полимеризации X––(An)––Y концевые группы 82
Алкены Реакция полимеризации X––Y + n. A Инициатор полимеризации X––(An)––Y концевые группы 82
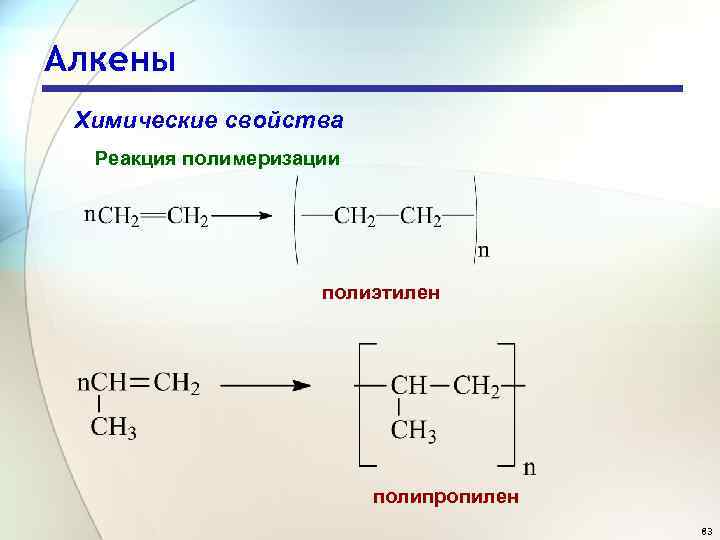 Алкены Химические свойства Реакция полимеризации полиэтилен полипропилен 83
Алкены Химические свойства Реакция полимеризации полиэтилен полипропилен 83
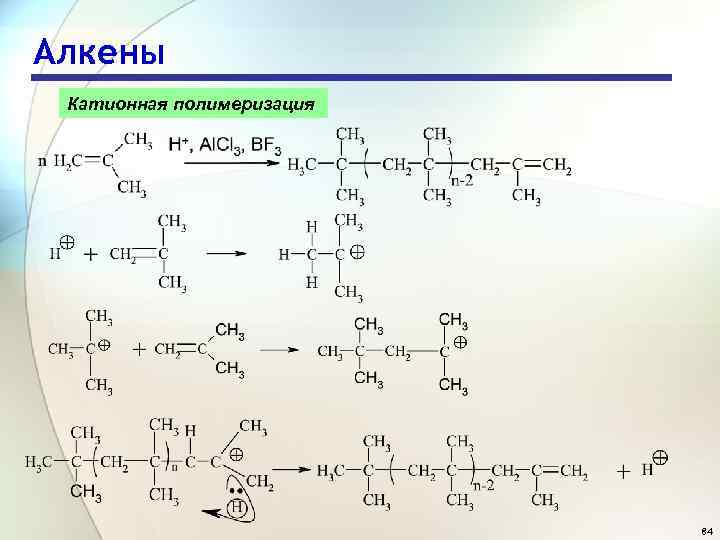 Алкены Катионная полимеризация 84
Алкены Катионная полимеризация 84
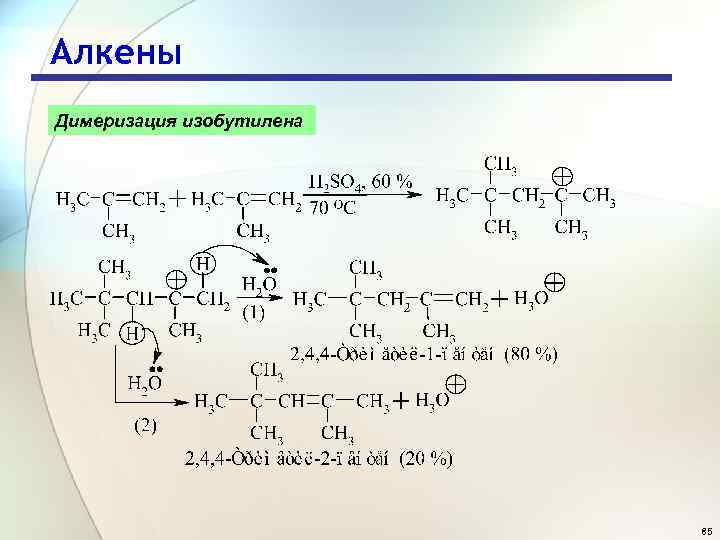 Алкены Димеризация изобутилена 85
Алкены Димеризация изобутилена 85
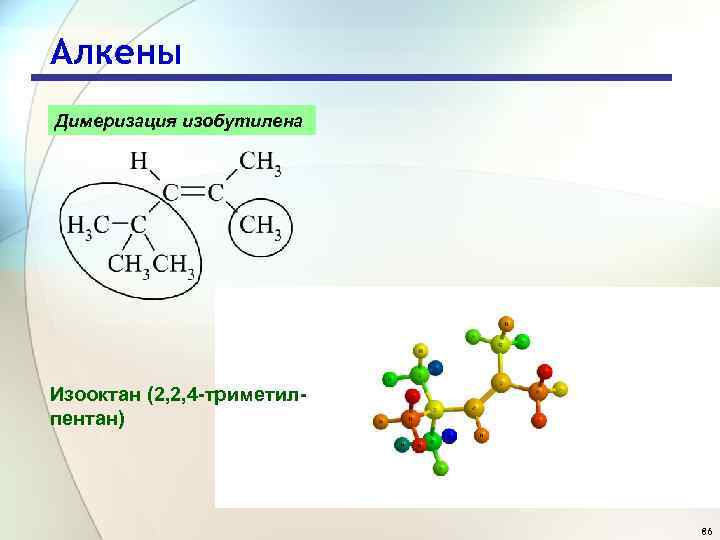 Алкены Димеризация изобутилена Изооктан (2, 2, 4 -триметилпентан) 86
Алкены Димеризация изобутилена Изооктан (2, 2, 4 -триметилпентан) 86
 Алкены Анионная полимеризация 87
Алкены Анионная полимеризация 87
 Алкены Свободнорадикальная полимеризация инициирование цепи зарождение цепи рост цепи 88
Алкены Свободнорадикальная полимеризация инициирование цепи зарождение цепи рост цепи 88
 Алкены Свободнорадикальная полимеризация обрыв цепи рекомбинация диспропорционирование 89
Алкены Свободнорадикальная полимеризация обрыв цепи рекомбинация диспропорционирование 89
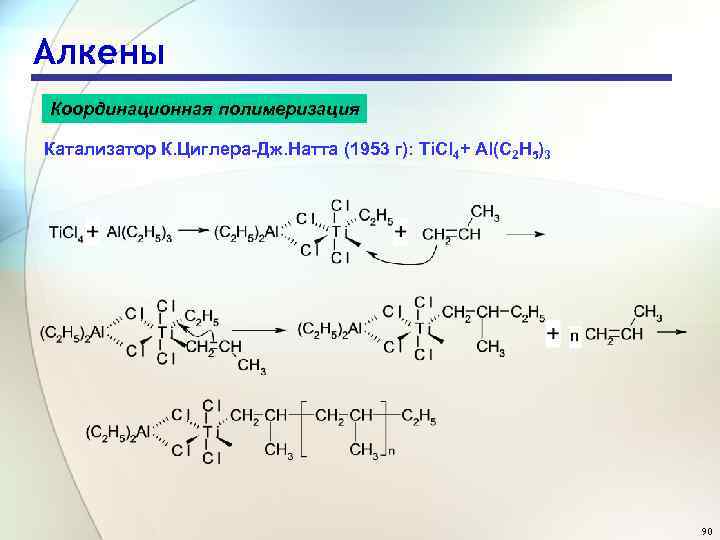 Алкены Координационная полимеризация Катализатор К. Циглера-Дж. Натта (1953 г): Ti. Cl 4+ Al(C 2 H 5)3 90
Алкены Координационная полимеризация Катализатор К. Циглера-Дж. Натта (1953 г): Ti. Cl 4+ Al(C 2 H 5)3 90
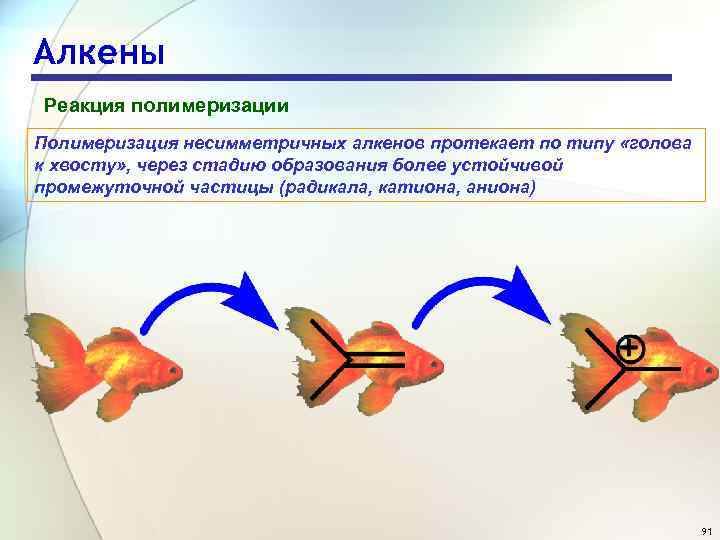 Алкены Реакция полимеризации Полимеризация несимметричных алкенов протекает по типу «голова к хвосту» , через стадию образования более устойчивой промежуточной частицы (радикала, катиона, аниона) 91
Алкены Реакция полимеризации Полимеризация несимметричных алкенов протекает по типу «голова к хвосту» , через стадию образования более устойчивой промежуточной частицы (радикала, катиона, аниона) 91
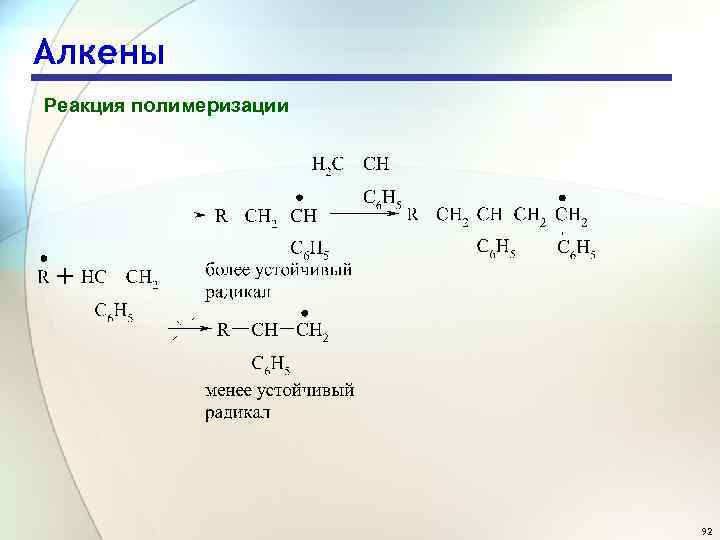 Алкены Реакция полимеризации 92
Алкены Реакция полимеризации 92
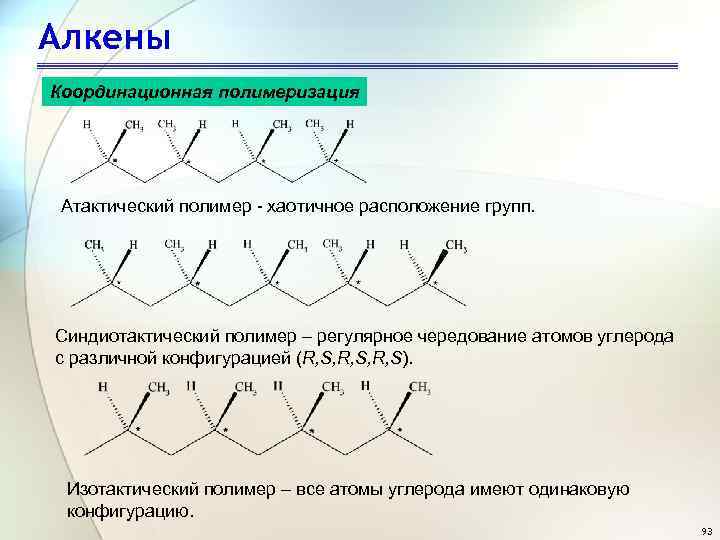 Алкены Координационная полимеризация Атактический полимер - хаотичное расположение групп. Синдиотактический полимер – регулярное чередование атомов углерода с различной конфигурацией (R, S, R, S). Изотактический полимер – все атомы углерода имеют одинаковую конфигурацию. 93
Алкены Координационная полимеризация Атактический полимер - хаотичное расположение групп. Синдиотактический полимер – регулярное чередование атомов углерода с различной конфигурацией (R, S, R, S). Изотактический полимер – все атомы углерода имеют одинаковую конфигурацию. 93
 Алкены Окисление Гидроксилирование (Окисление по Вагнеру 94
Алкены Окисление Гидроксилирование (Окисление по Вагнеру 94
 Алкены ВАГНЕР Егорович (9. XII. 1849 – 27. XI. 1903) 95
Алкены ВАГНЕР Егорович (9. XII. 1849 – 27. XI. 1903) 95
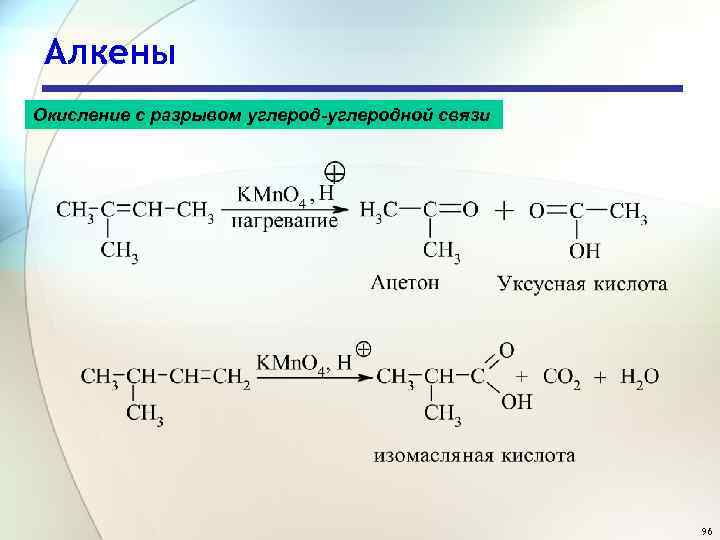 Алкены Окисление с разрывом углерод-углеродной связи 96
Алкены Окисление с разрывом углерод-углеродной связи 96
 Алкены Эпоксидирование (Окисление) Реакция Н. А. Прилежаева 97
Алкены Эпоксидирование (Окисление) Реакция Н. А. Прилежаева 97
 Алкены Прилежаев Николай Александрович (1872— 1944) 98
Алкены Прилежаев Николай Александрович (1872— 1944) 98
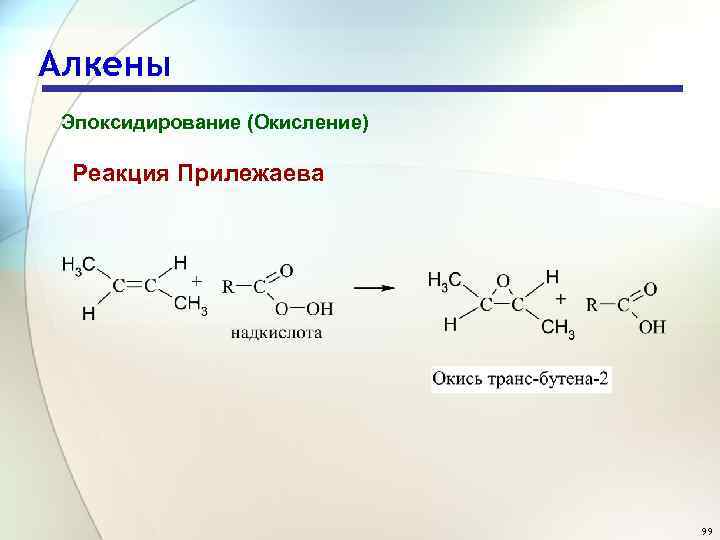 Алкены Эпоксидирование (Окисление) Реакция Прилежаева 99
Алкены Эпоксидирование (Окисление) Реакция Прилежаева 99
 Алкены Окисление Горение C 2 H 4 + 3 O 2 2 CO 2 + 2 H 2 O 100
Алкены Окисление Горение C 2 H 4 + 3 O 2 2 CO 2 + 2 H 2 O 100
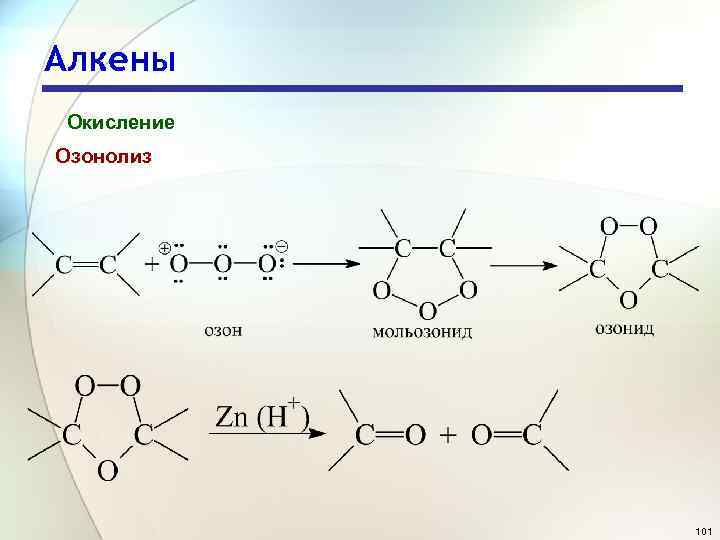 Алкены Окисление Озонолиз 101
Алкены Окисление Озонолиз 101
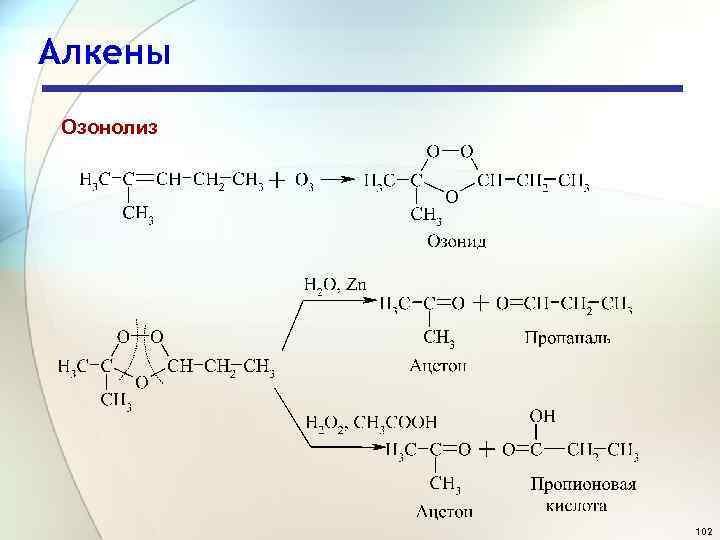 Алкены Озонолиз 102
Алкены Озонолиз 102
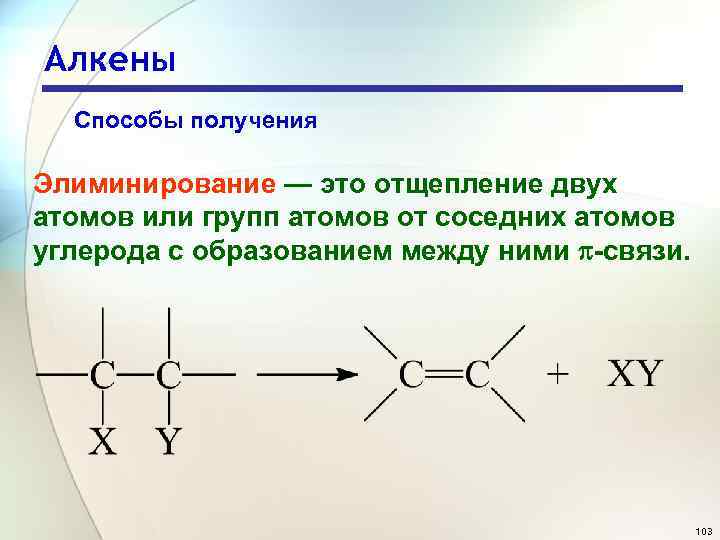 Алкены Способы получения Элиминирование — это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи. 103
Алкены Способы получения Элиминирование — это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи. 103
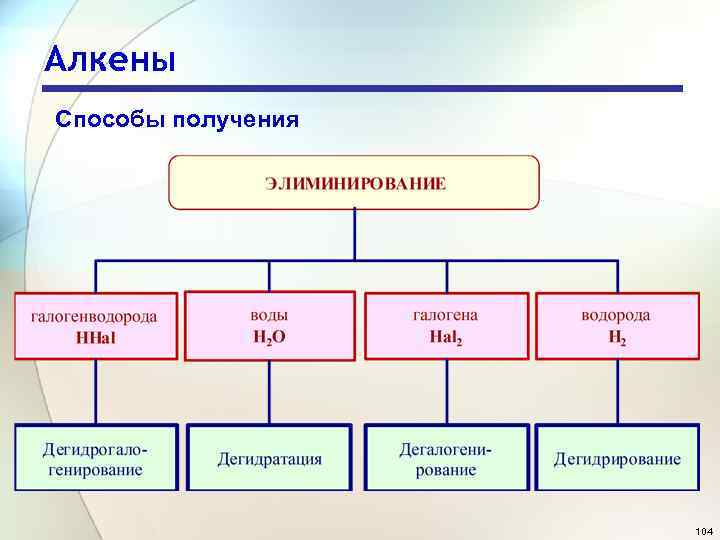 Алкены Способы получения 104
Алкены Способы получения 104
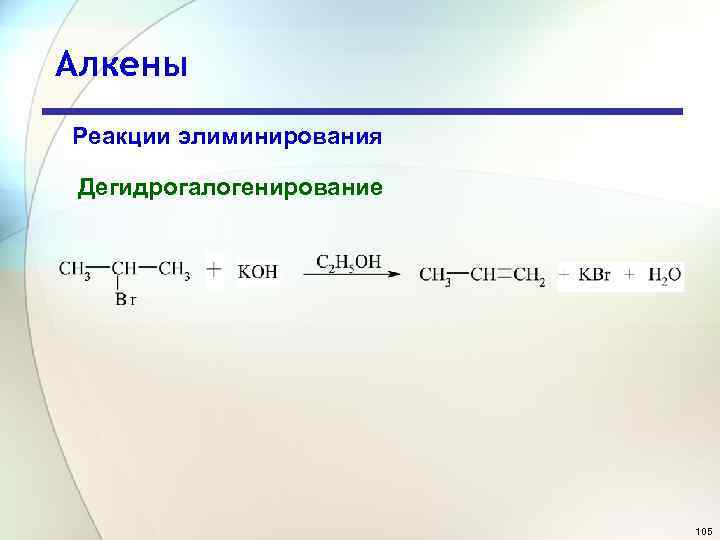 Алкены Реакции элиминирования Дегидрогалогенирование 105
Алкены Реакции элиминирования Дегидрогалогенирование 105
 Алкены Реакции элиминирования Дегидрогалогенирование Правило Зайцева Преобладающим продуктом реакции является наиболее устойчивый, т. е. наиболее алкилированный алкен (правило Зайцева) 106
Алкены Реакции элиминирования Дегидрогалогенирование Правило Зайцева Преобладающим продуктом реакции является наиболее устойчивый, т. е. наиболее алкилированный алкен (правило Зайцева) 106
 Алкены Реакции элиминирования Дегидрогалогенирование ЗАЙЦЕВ Александр Михайлович (Россия) (2. VII. 1841 - 1. IX. 1910) 107
Алкены Реакции элиминирования Дегидрогалогенирование ЗАЙЦЕВ Александр Михайлович (Россия) (2. VII. 1841 - 1. IX. 1910) 107
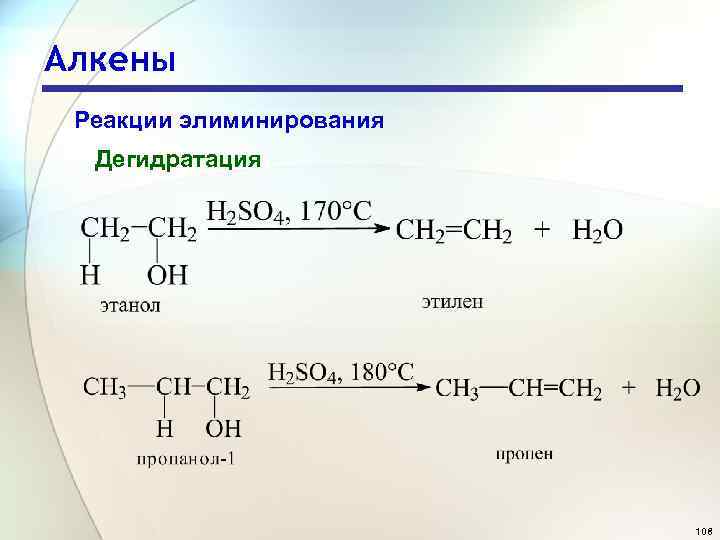 Алкены Реакции элиминирования Дегидратация 108
Алкены Реакции элиминирования Дегидратация 108
 Алкены Реакции элиминирования Дегалогенирование вицинальных дигалогенидов 109
Алкены Реакции элиминирования Дегалогенирование вицинальных дигалогенидов 109
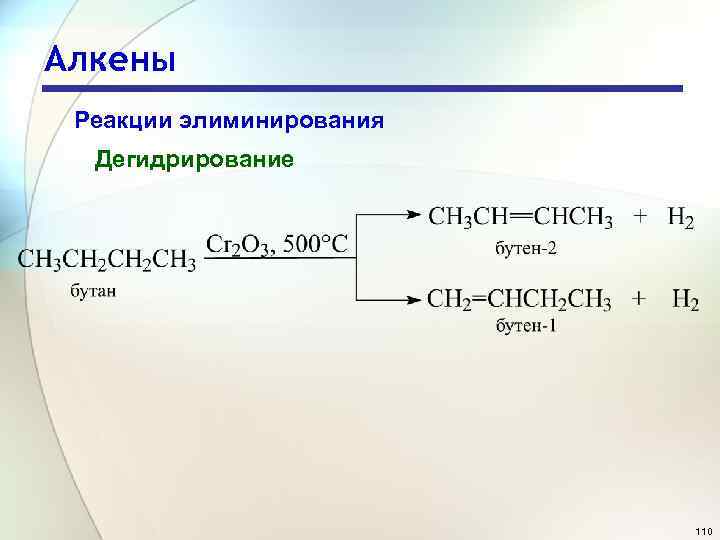 Алкены Реакции элиминирования Дегидрирование 110
Алкены Реакции элиминирования Дегидрирование 110
 Алкены Гидрирование алкинов 111
Алкены Гидрирование алкинов 111
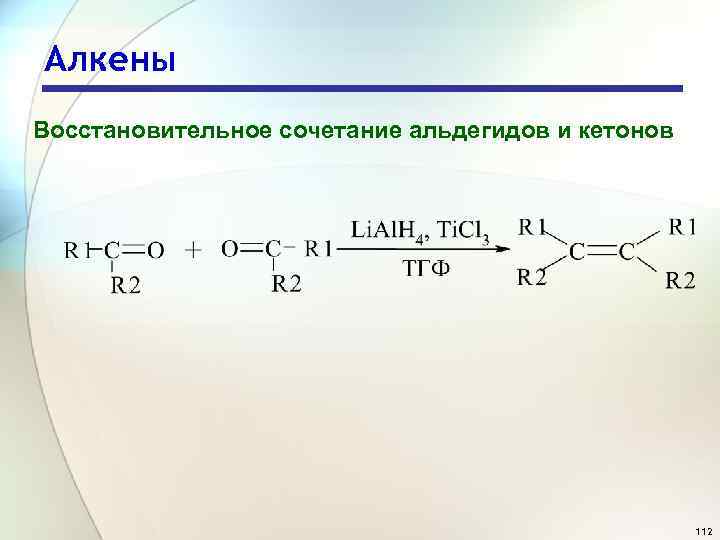 Алкены Восстановительное сочетание альдегидов и кетонов 112
Алкены Восстановительное сочетание альдегидов и кетонов 112
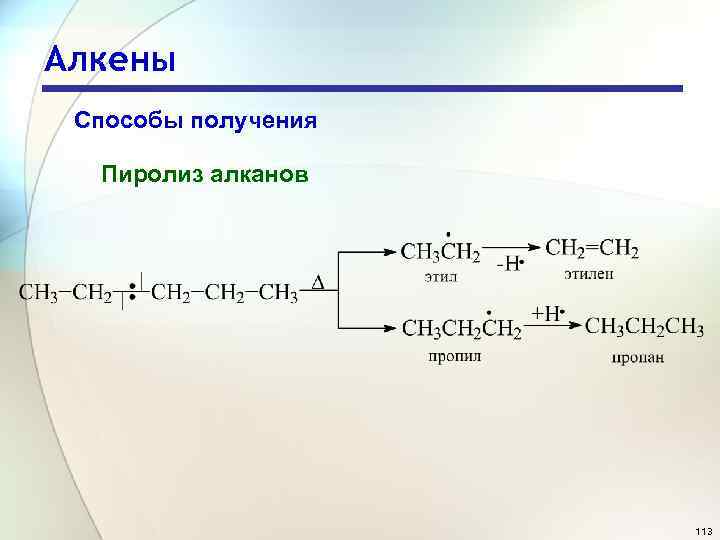 Алкены Способы получения Пиролиз алканов 113
Алкены Способы получения Пиролиз алканов 113


