 АЛКАНЫ (ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ) Эл. Химик Эля Теп
АЛКАНЫ (ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ) Эл. Химик Эля Теп
 Строение алканов Алканы имеют два типа связей С-С и С-Н С-С ковалентная неполярная, С-Н ковалентная слабополярная Все связи одинарные (σ-связи ли сигма-связи) Валентный угол Н-С-Н равен 109º 28´ Эти углеводороды называют предельными , так как они не имеют кратных связей
Строение алканов Алканы имеют два типа связей С-С и С-Н С-С ковалентная неполярная, С-Н ковалентная слабополярная Все связи одинарные (σ-связи ли сигма-связи) Валентный угол Н-С-Н равен 109º 28´ Эти углеводороды называют предельными , так как они не имеют кратных связей
 Гомологический ряд Метан СН 4 Этан С 2 Н 6 Пропан С 3 Н 8 Бутан С 4 Н 10 Пентан С 5 Н 12 Гексан С 6 Н 14 Гептан С 7 Н 16 Октан С 8 Н 18 Нонан С 9 Н 20 Декан С 10 Н 22 Из этого следует , что общая формула алканов Сn. H 2 n+2
Гомологический ряд Метан СН 4 Этан С 2 Н 6 Пропан С 3 Н 8 Бутан С 4 Н 10 Пентан С 5 Н 12 Гексан С 6 Н 14 Гептан С 7 Н 16 Октан С 8 Н 18 Нонан С 9 Н 20 Декан С 10 Н 22 Из этого следует , что общая формула алканов Сn. H 2 n+2
 Изомерия Изомеры – это вещества одинакового качественного и количественного состава, но разные по строению. Алканам присуща структурная изомерия, то есть изменение положения радикалов. Радикалом называют частицу с формулой Cn. H 2 n+1 (для алканов), или еще она называется алкил Изомерия впервые в гомологическом ряду алканов встречается у бутана: н-бутан (нормальный бутан) , изобутан (2 -метилпропан), то есть радикал метил СН 3 соединен со вторым атомом углеродной цепочки, состоящей из трех атомов углерода ( вспоминаем формулу пропана С 3 Н 8)
Изомерия Изомеры – это вещества одинакового качественного и количественного состава, но разные по строению. Алканам присуща структурная изомерия, то есть изменение положения радикалов. Радикалом называют частицу с формулой Cn. H 2 n+1 (для алканов), или еще она называется алкил Изомерия впервые в гомологическом ряду алканов встречается у бутана: н-бутан (нормальный бутан) , изобутан (2 -метилпропан), то есть радикал метил СН 3 соединен со вторым атомом углеродной цепочки, состоящей из трех атомов углерода ( вспоминаем формулу пропана С 3 Н 8)
 Физические свойства Алканы с количеством атомов углерода до 4 включительно – газы С количеством 5 -10 атомов углерода – жидкости Далее – твердые вещества
Физические свойства Алканы с количеством атомов углерода до 4 включительно – газы С количеством 5 -10 атомов углерода – жидкости Далее – твердые вещества
 Химические свойства 1) Крекинг – процесс термического разложения углеводорода, при котором происходит разрыв связей С-С , и образуются вещества с более короткой цепочкой углеродных атомов Пример: СН 3 -СН 2 -СН 3 СН 3 -СН 3 + СН 3 -СН 2 -СН 3
Химические свойства 1) Крекинг – процесс термического разложения углеводорода, при котором происходит разрыв связей С-С , и образуются вещества с более короткой цепочкой углеродных атомов Пример: СН 3 -СН 2 -СН 3 СН 3 -СН 3 + СН 3 -СН 2 -СН 3
 Химические свойства 2) Изомеризация – это процесс , при котором алканы нормального строения превращаются в алканы с разветвленной цепочкой под действием температур или катализаторов. Пример: СН 3 -СН 2 -СН 3 -СН-СН 3
Химические свойства 2) Изомеризация – это процесс , при котором алканы нормального строения превращаются в алканы с разветвленной цепочкой под действием температур или катализаторов. Пример: СН 3 -СН 2 -СН 3 -СН-СН 3
 Химические свойства 3) Дегидрирование – это процесс отщепления водорода под действием катализаторов. Пример: СН 3 -СН 3 СН 2 + Н 2
Химические свойства 3) Дегидрирование – это процесс отщепления водорода под действием катализаторов. Пример: СН 3 -СН 3 СН 2 + Н 2
 Химические свойства 4) Окисление. Пример: СН 4 + 2 О 2 = СО 2 + 2 Н 2 О
Химические свойства 4) Окисление. Пример: СН 4 + 2 О 2 = СО 2 + 2 Н 2 О
 Химические свойства 5) Замещение : Галогенирование – реакция замещения одного и более атомов водорода в молекуле алкана на атом галогена. С хлором и бромом идет на свету и при нагревании. Пример: СН 4 + Сl 2 CH 3 Cl + HCl ( - это квант света) Реакция идет и дальше, пока все атомы водорода не заменятся на атомы хлора.
Химические свойства 5) Замещение : Галогенирование – реакция замещения одного и более атомов водорода в молекуле алкана на атом галогена. С хлором и бромом идет на свету и при нагревании. Пример: СН 4 + Сl 2 CH 3 Cl + HCl ( - это квант света) Реакция идет и дальше, пока все атомы водорода не заменятся на атомы хлора.
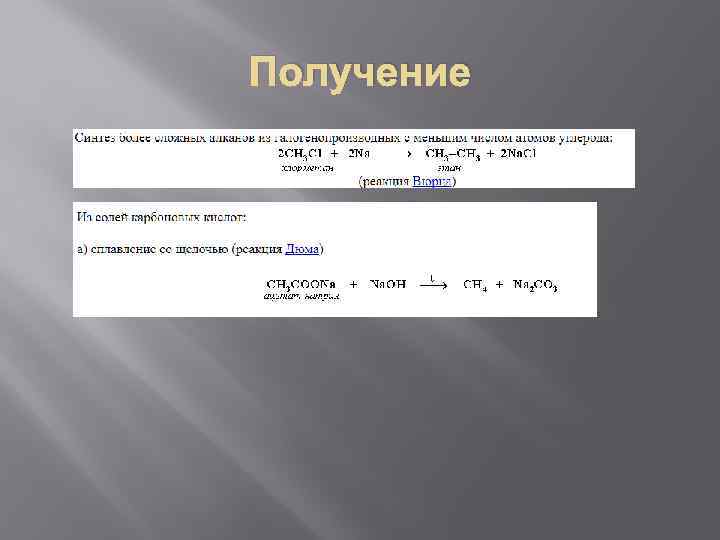
 Получение 1) Крекинг нефти 2) Гидрирование непредельных углеводородов 3) Из синтез-газа ( СО+Н 2) 4) Синтез более сложных алканов из галогенопроизводных с меньшим числом атомов углерода 5) Из солей карбоновых кислот 6) Разложение карбидов металлов водой
Получение 1) Крекинг нефти 2) Гидрирование непредельных углеводородов 3) Из синтез-газа ( СО+Н 2) 4) Синтез более сложных алканов из галогенопроизводных с меньшим числом атомов углерода 5) Из солей карбоновых кислот 6) Разложение карбидов металлов водой
 Получение
Получение
 Применение
Применение
 Задание
Задание
 Спасибо за внимание! Следующая тема: Алкены.
Спасибо за внимание! Следующая тема: Алкены.