2 - Алканы.ppt
- Количество слайдов: 17

АЛКАНЫ (предельные, насыщенные, метановые, парафиновые) Общая формула Сn. H 2 n+2 Алканы – это углеводороды, в молекулах которых все атомы углерода соединены между собой только одинарными σ-связями, а остальные их валентности предельно насыщены атомами водорода. Характеристика σ-связи С-С: энергия 350 к. Дж/моль длина 0, 154 нм валентный угол 109028’ связь ковалентная неполярная

I. Изомерия и номенклатура алканов Гомологический ряд алканов n Брутто-формула Структурная формула Название 1 СН 4 метан 2 С 2 Н 6 СН 3 -СН 3 этан 3 С 3 Н 8 СН 3 -СН 2 -СН 3 пропан 4 С 4 Н 10 СН 3 -СН 2 -СН 3 бутан 5 С 5 Н 12 СН 3 -СН 2 -СН 3 пентан 6 С 6 Н 14 СН 3 -(СН 2)4 -СН 3 гексан 7 С 7 Н 16 СН 3 -(СН 2)5 -СН 3 гептан 8 С 8 Н 18 СН 3 -(СН 2)6 -СН 3 октан 9 СН 3 -(СН 2)7 -СН 3 нонан 10 С 9 Н 20 С 10 Н 22 СН 3 -(СН 2)8 -СН 3 декан 11 С 20 Н 42 СН 3 -(СН 2)18 -СН 3 эйкозан

Систематическая номенклатура 1. Выбираем самую длинную углеродсодержащую цепь – главную цепь. 2. Нумеруем эту цепь так, чтобы радикалы получили наименьшие номера. 3. В случае одинаковых радикалов используем умножающие приставки (ди – 2, три -3, тетра – 4, пента – 5 и т. д. ). 4. Называем радикалы и цифрой указываем их местоположение в главной цепи. Записываем радикалы в алфавитном порядке. 5. Называем главную цепь, в соответствии с количеством углеродных атомов составляющих главную цепь. 1 2 3 4 5 6 2, 4 -диметилгептан 7
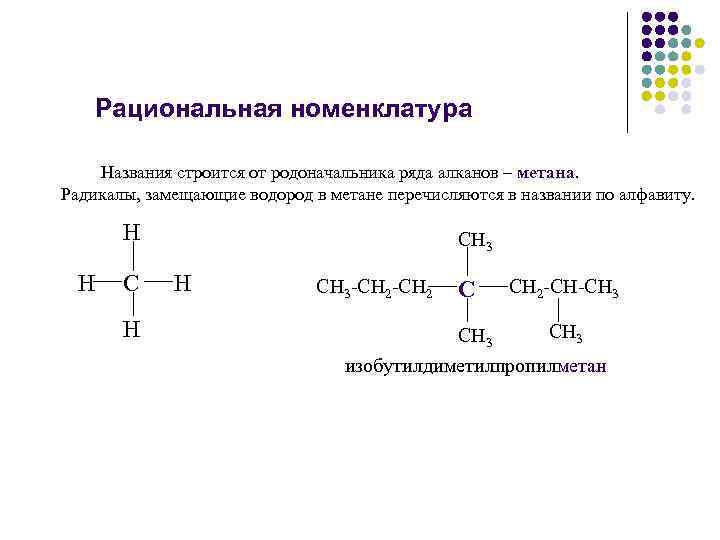
Рациональная номенклатура Названия строится от родоначальника ряда алканов – метана. Радикалы, замещающие водород в метане перечисляются в названии по алфавиту. Н Н СН 3 -СН 2 С СН 3 СН 2 -СН-СН 3 изобутилдиметилпропилметан

II. Общие свойства и строение алканов С – элемент IV группы, 6 е, из них 4 е – валентные, имеет sp 3 -гибридизацию. СН 4 – метан имеет тетраэдрическую модель, 4 σ-связи. Замещение водорода, легче у третичного атома углерода, труднее у вторичного и совсем трудно – у первичного.

III. Природные источники и способы получения алканов А. Природные источники: Природный или попутные газы содержат алканы, в молекулах которых от 1 до 6 атомов углерода, причем основная доля приходится на метан от 75 до 99% по объему. Нефть – природная сложная смесь углеводородов, в основном алканов линейного и разветвленного строения, содержащих в молекулах от 5 до 50 атомов углерода, на алканы приходится от 30 до 85%. Газоконденсаты - жидкие углеводороды, растворенные в газе; Газы процессов переработки нефтяного сырья- газы прямой перегонки; газы термического крекинга и пиролиза; газы каталитического крекинга; газы гидрокрекинга и каталитического риформинга.

Б. Промышленные методы. 1. Химическая переработка каменного угля (1930 г. реакция гидрирования) 2. Каталитическое гидрирование оксида углерода - синтез Фишера-Тропша (1925 г).

В. Синтетические методы – для получения индивидуальных алканов. 3. Гидрирование непредельных углеводородов – алкенов 4. Реакция Вюрца – взаимодействие галогенпроизводных с металлическим натрием. - из одного галогенпроизводного - из двух галогенпроизводных - образуется смесь 3 -х углеводородов

5. Декарбоксилирование (отщепление СО 2) солей карбоновых кислот. СН 3 -СН 2 -С натриевая соль пропионовой кислоты О O-Na + Na-O - H t CH 3 -CH 3 + Na 2 CO 3 этан Образуется углеводород, в котором меньше на один атом углерода, чем в исходной молекуле карбоновой кислоты

IV. Физические свойства Углеводороды состава С 1 -С 4 – в обычных условиях газы, С 5 -С 15 – жидкости, С 16 и выше – твердые вещества. Увеличение молекулярной массы приводит к повышению температуры кипения и температуры плавления, увеличению плотности вещества. Углеводороды с разветвленной цепью кипят при более низкой температуре, чем соответствующие им соединения нормального строения, а температура плавления у изомеров изостроения в ряде случаев имеет более высокие значения.

V. Химические свойства алканов В обычных условиях химически инертны – не взаимодействуют с кислотами щелочами, окислителями, активными металлами. Для алканов характерны реакции: - замещения атомов Н; - расщепления (крекинга) С-С; - окисления. 1. Галогенирование (Cl 2, Br 2) Реакция протекает на свету (УФ-облучение) или при нагревании (300 0 С; термическое хлорирование) В разветвленных алканах с большей скоростью замещается Н у третичного атома С.
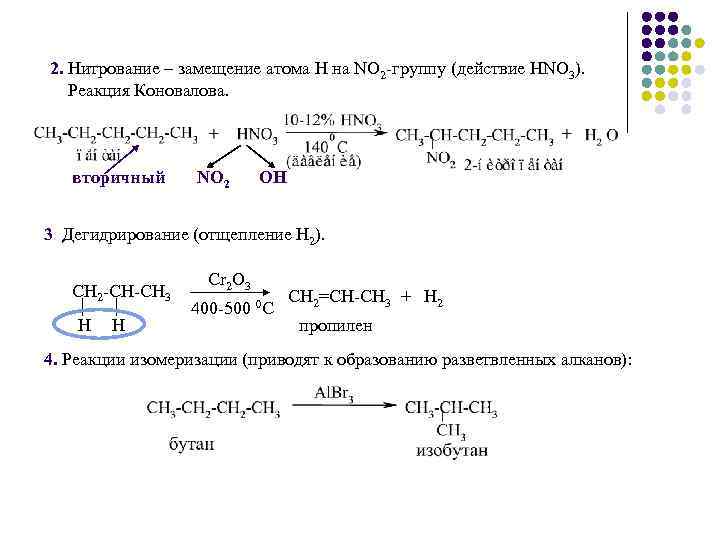
2. Нитрование – замещение атома Н на NO 2 -группу (действие HNO 3). Реакция Коновалова. вторичный NO 2 OH 3. Дегидрирование (отщепление Н 2). СН 2 -СН-СН 3 Н Н Cr 2 O 3 400 -500 0 С СН 2=СН-СН 3 + Н 2 пропилен 4. Реакции изомеризации (приводят к образованию разветвленных алканов):

5. Окисление а) при 20 0 С устойчивы к действию обычных окислителей KMn. O 4, K 2 Cr 2 O 7. б) при высокой температуре происходит сгорание. Сгорание 1 кг СН 4 дает 57 000 к. Дж. в) при средних температурах 110 -130 0 С, на катализаторе (Mn. O 2): 6. Сульфохлорирование и сульфоокисление

7. Пиролиз алканов. При сильном нагревании выше 1000 0 С без доступа воздуха углеводороды полностью разлагаются на углерод и водород – разрыв С-С и С-Н связей. 8. Крекинг – реакции разрыва С-С-связи при высоких температурах (термическое разложение алканов) б) б) а) а)

VI. Применение важнейших представителей алканов Метан СН 4– не обладает ни цветом, ни запахом, плохо растворяется в воде. Используется как топливо: средняя теплотворная способность 1 м 3 природного газа содержащего 95 -98% СН 4 составляет 46 тыс. к. Дж, как химическое сырье: - при пиролизе получают углерод (сажу), используемую в резиновой промышленности, водород в производстве аммиака; - конверсией метана получают синтез-газ (СО и Н 2) используемый для получение бензина. - хлорированием CH 3 Cl, (CH 3)2 Si. Cl 2 –диметилдихлорсилан из него получают силикон, СHCl 3 хлороформ, СCl 4 – растворитель, пятновыводитель, CF 2 Cl 2 – фреон 12 -хладогент; - окислением метана дает метиловый спирт, дальнейшее окисление формальдегид и затем муравьиную кислоту, используется для получение пластмасс.

Этан С 2 Н 6, пропан С 3 Н 8, бутан С 4 Н 10 и пентан С 5 Н 12 используются в технике для получения соответственно этилена, пропилена, дивинила и изопрена. Смесь пропана и бутана – бытовой сжиженный газ. Жидкие углеводороды (С 5 Н 12 – С 16 Н 34) используются как моторное топливо. Октановое число – это условная количественная характеристика детонационных свойств бензина, численно равная процентному (по объему) содержанию изооктана в бинарной смеси с н-гептаном, эквивалентной по детонирующей стойкости испытуемому бензину при стандартных условиях. Качественной характеристикой бензина - октановое число. октан ОЧ=0 пентан ОЧ=62 изооктан ОЧ=100 2, 3 -диметилгексан ОЧ=79 2, 2, 3 -триметилбутан ОЧ=104 2, 2, 3, 3 -тетраметилпентан ОЧ=125 Высшие жидкие и твердые парафины используются как топливо (дизельное), смазочный материал, в виде твердого парафина.

Качество дизельных топлив оценивается с помощью цетановых чисел Цетановое число определяются путем сравнения условий самовоспламенения данного образца топлива с условиями самовоспламенения известной по составу смеси н-цетана и α-метилнафталина н-цетан С 16 Н 34 α-метилнафталин ЦЧ=100 ЦЧ=0 Для дизельного топлива наиболее предпочтительны слаборазветвленные алканы.
2 - Алканы.ppt