Алканы.pptx
- Количество слайдов: 24
 АЛКАНЫ ЛЕКЦИЯ 1
АЛКАНЫ ЛЕКЦИЯ 1
 АЛКАНЫ (ПАРАФИНЫ) Это углеводороды с открытой цепью и содержащие в своем составе одинарные связи С—С Общая формула Cn. H 2 n+2
АЛКАНЫ (ПАРАФИНЫ) Это углеводороды с открытой цепью и содержащие в своем составе одинарные связи С—С Общая формула Cn. H 2 n+2
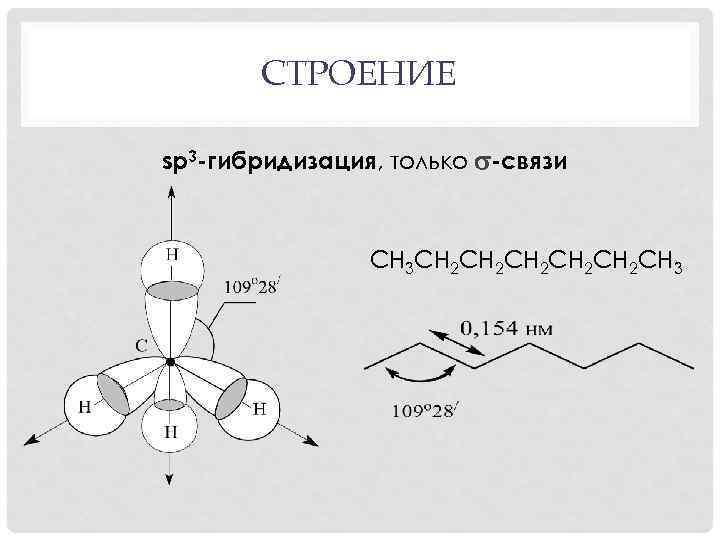 СТРОЕНИЕ sp 3 -гибридизация, только -связи СН 3 СН 2 СН 2 СН 2 СН 3
СТРОЕНИЕ sp 3 -гибридизация, только -связи СН 3 СН 2 СН 2 СН 2 СН 3
 АТОМЫ УГЛЕРОДА • СI – первичный, связан только с одним соседним углеродным атомом; • СII – вторичный, связан с двумя соседними углеродами; • СIII – третичный, связан с тремя соседними углеродными атомами; • СIV – четвертичный, связан с четырьмя соседними углеродами.
АТОМЫ УГЛЕРОДА • СI – первичный, связан только с одним соседним углеродным атомом; • СII – вторичный, связан с двумя соседними углеродами; • СIII – третичный, связан с тремя соседними углеродными атомами; • СIV – четвертичный, связан с четырьмя соседними углеродами.
 РЕАКЦИОННАЯ СПОСОБНОСТЬ Легкость образования свободных радикалов и карбкатионов уменьшается в ряду: третичный > вторичный > первичный > метильный т. к. на диссоциацию (ионизацию) атома углерода требуется затратить больше энергии
РЕАКЦИОННАЯ СПОСОБНОСТЬ Легкость образования свободных радикалов и карбкатионов уменьшается в ряду: третичный > вторичный > первичный > метильный т. к. на диссоциацию (ионизацию) атома углерода требуется затратить больше энергии
 СПОСОБЫ ПОЛУЧЕНИЯ • Из нефти и газа В основном в нефти представлены углеводороды • парафиновые (обычно 30— 35, реже 40— 50 % по объёму) • нафтеновые (25— 75 %) • соединения ароматического ряда (10— 20, реже 35 %) гибридного строения
СПОСОБЫ ПОЛУЧЕНИЯ • Из нефти и газа В основном в нефти представлены углеводороды • парафиновые (обычно 30— 35, реже 40— 50 % по объёму) • нафтеновые (25— 75 %) • соединения ароматического ряда (10— 20, реже 35 %) гибридного строения
 СПОСОБЫ ПОЛУЧЕНИЯ • Гидрирование непредельных соединений • Восстановление галогенуглеводородов
СПОСОБЫ ПОЛУЧЕНИЯ • Гидрирование непредельных соединений • Восстановление галогенуглеводородов
 СПОСОБЫ ПОЛУЧЕНИЯ • Реакция Вюрца Если используются галогенопроизводные с разным числом атомов углерода в цепочке, то образуется смесь алканов 1817 - 1884
СПОСОБЫ ПОЛУЧЕНИЯ • Реакция Вюрца Если используются галогенопроизводные с разным числом атомов углерода в цепочке, то образуется смесь алканов 1817 - 1884
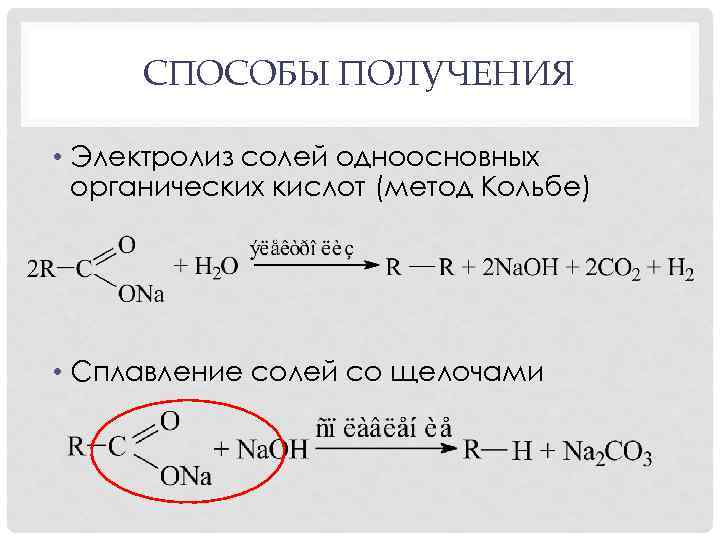 СПОСОБЫ ПОЛУЧЕНИЯ • Электролиз солей одноосновных органических кислот (метод Кольбе) • Сплавление солей со щелочами
СПОСОБЫ ПОЛУЧЕНИЯ • Электролиз солей одноосновных органических кислот (метод Кольбе) • Сплавление солей со щелочами
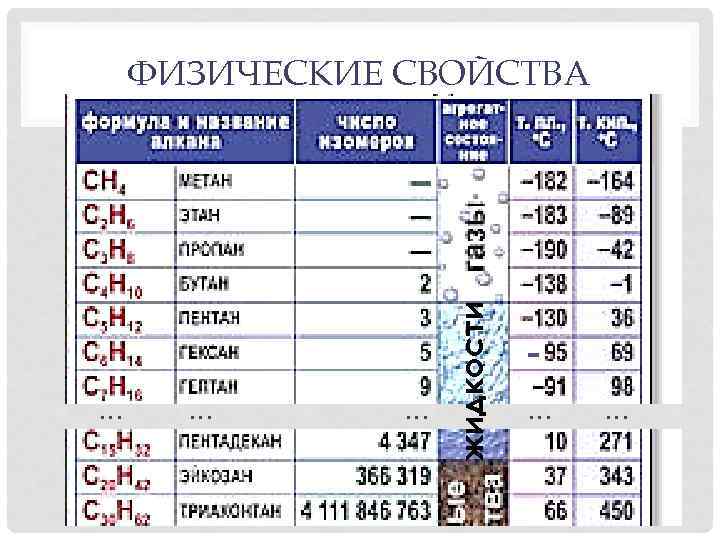 … … … жидкости ФИЗИЧЕСКИЕ СВОЙСТВА … …
… … … жидкости ФИЗИЧЕСКИЕ СВОЙСТВА … …
 ФИЗИЧЕСКИЕ СВОЙСТВА • Метан, этан и высшие гомологи не имеют запаха, средние – обладают запахом бензина. • Все алканы легче воды, их плотность не превышает 0, 8 г/см 3. • Алканы практически не растворимы в воде, но хорошо растворяются в органических неполярных и полярных растворителях.
ФИЗИЧЕСКИЕ СВОЙСТВА • Метан, этан и высшие гомологи не имеют запаха, средние – обладают запахом бензина. • Все алканы легче воды, их плотность не превышает 0, 8 г/см 3. • Алканы практически не растворимы в воде, но хорошо растворяются в органических неполярных и полярных растворителях.
 ХИМИЧЕСКИЕ СВОЙСТВА Для алканов характерны реакции, идущие по радикальному типу – реакции замещения (SR). Реакции присоединения не характерны, поскольку все связи в молекулах алканов насыщены. При обычных условиях алканы не взаимодействуют с кислотами и щелочами, не окисляются KMn. O 4
ХИМИЧЕСКИЕ СВОЙСТВА Для алканов характерны реакции, идущие по радикальному типу – реакции замещения (SR). Реакции присоединения не характерны, поскольку все связи в молекулах алканов насыщены. При обычных условиях алканы не взаимодействуют с кислотами и щелочами, не окисляются KMn. O 4
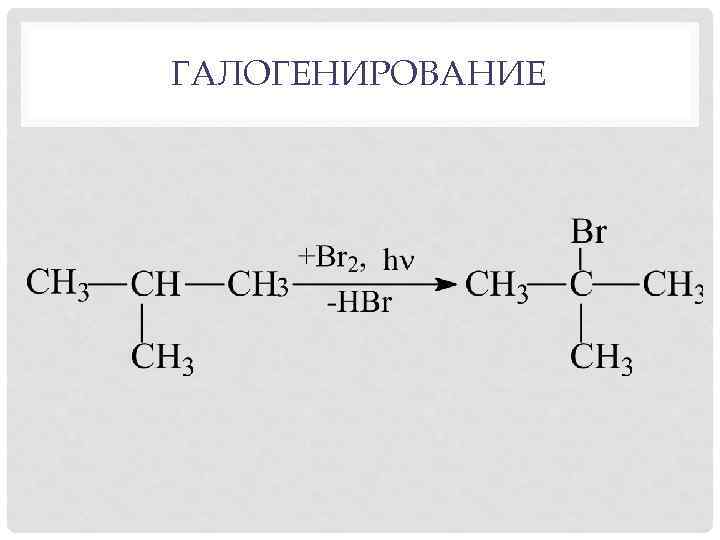 ГАЛОГЕНИРОВАНИЕ
ГАЛОГЕНИРОВАНИЕ
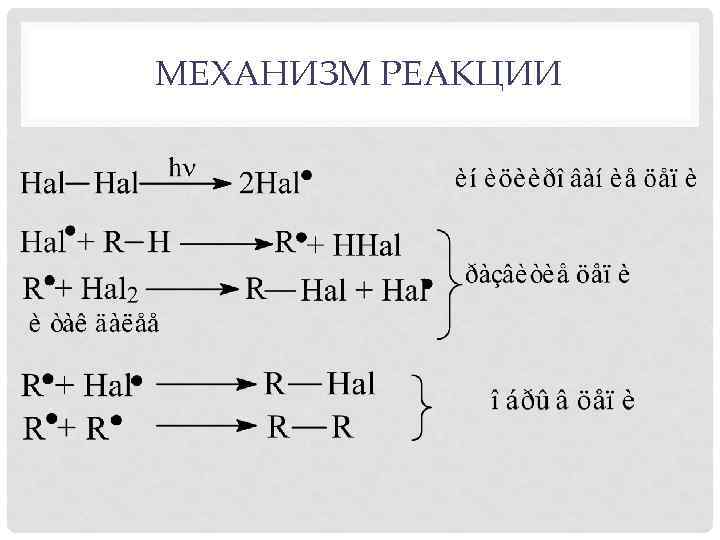 МЕХАНИЗМ РЕАКЦИИ
МЕХАНИЗМ РЕАКЦИИ
 НИТРОВАНИЕ (РЕАКЦИЯ КОНОВАЛОВА) t= 130 -145 C Конц. HNO 3 =10– 15% 1858 - 1906
НИТРОВАНИЕ (РЕАКЦИЯ КОНОВАЛОВА) t= 130 -145 C Конц. HNO 3 =10– 15% 1858 - 1906
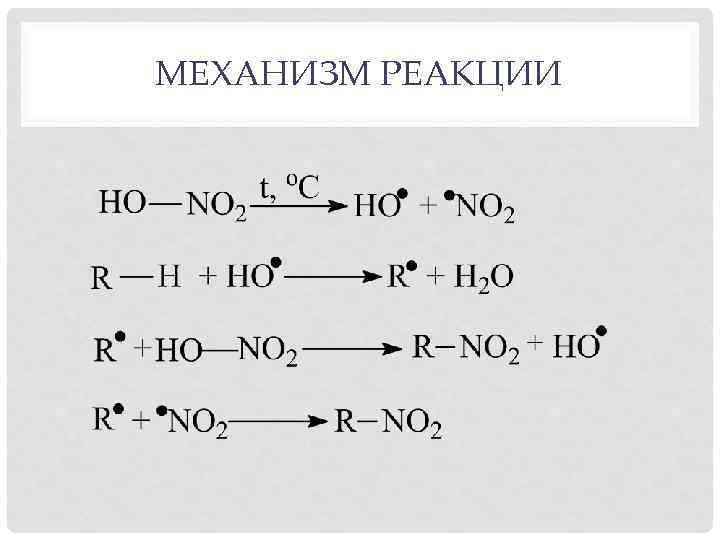 МЕХАНИЗМ РЕАКЦИИ
МЕХАНИЗМ РЕАКЦИИ
 СУЛЬФИРОВАНИЕ • Серной кислотой сульфируют алканы, имеющие более 8 атомов углерода • Замещение протекает преимущественно у вторичного атома углерода из-за пространственных затруднений • Для введения сульфогруппы используют методы сульфохлорирования и сульфоокисления
СУЛЬФИРОВАНИЕ • Серной кислотой сульфируют алканы, имеющие более 8 атомов углерода • Замещение протекает преимущественно у вторичного атома углерода из-за пространственных затруднений • Для введения сульфогруппы используют методы сульфохлорирования и сульфоокисления
 СУЛЬФИРОВАНИЕ • Сульфохлорирование • Сульфоокисление
СУЛЬФИРОВАНИЕ • Сульфохлорирование • Сульфоокисление
 ОКИСЛЕНИЕ • Полное (горение) Cn. H 2 n+2 + (3 n+1)/2 O 2 n CO 2 + (n+1) H 2 O + Q • Неполное (цепное радикальное)
ОКИСЛЕНИЕ • Полное (горение) Cn. H 2 n+2 + (3 n+1)/2 O 2 n CO 2 + (n+1) H 2 O + Q • Неполное (цепное радикальное)
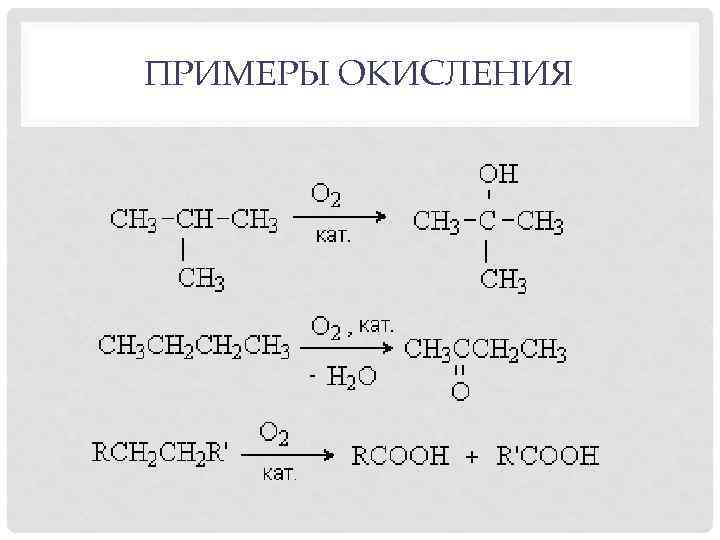 ПРИМЕРЫ ОКИСЛЕНИЯ
ПРИМЕРЫ ОКИСЛЕНИЯ
 КРЕКИНГ - это разложение соединения под действием высокой температуры ΣСисх=ΣСкон
КРЕКИНГ - это разложение соединения под действием высокой температуры ΣСисх=ΣСкон
 КРЕКИНГ Крекинг бывает • термический (при t=500 -600 o. C) • каталитический (при t=400 -500 o. C в присутствии катализаторов). При температуре более 700 о. С происходит пиролиз
КРЕКИНГ Крекинг бывает • термический (при t=500 -600 o. C) • каталитический (при t=400 -500 o. C в присутствии катализаторов). При температуре более 700 о. С происходит пиролиз
 ПРИМЕНЕНИЕ • Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива. • Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей. • Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике. • Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
ПРИМЕНЕНИЕ • Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива. • Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей. • Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике. • Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
 ПРИМЕНЕНИЕ • Паpафин (смесь твеpдых алканов С 19 -С 35) - белая твеpдая масса без запаха и вкуса (т. пл. 50 -70 °C) пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине. • Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти. • Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.
ПРИМЕНЕНИЕ • Паpафин (смесь твеpдых алканов С 19 -С 35) - белая твеpдая масса без запаха и вкуса (т. пл. 50 -70 °C) пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине. • Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти. • Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.


