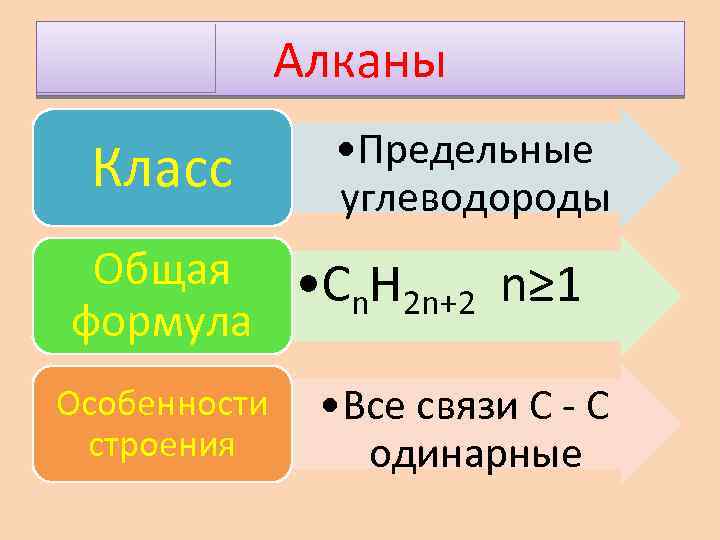
Алканы Класс • Предельные углеводороды Общая • С H n 2 n+2 n≥ 1 формула Особенности строения • Все связи С - С одинарные

Гомологический ряд метана Гомологи – это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СH 2. • • • СН 4 С 2 H 6 C 3 H 8 C 4 H 10 C 5 H 12 метан этан пропан бутан пентан • • • C 6 H 14 C 7 H 16 C 8 H 18 C 9 H 20 C 10 H 22 гексан гептан октан нонан декан
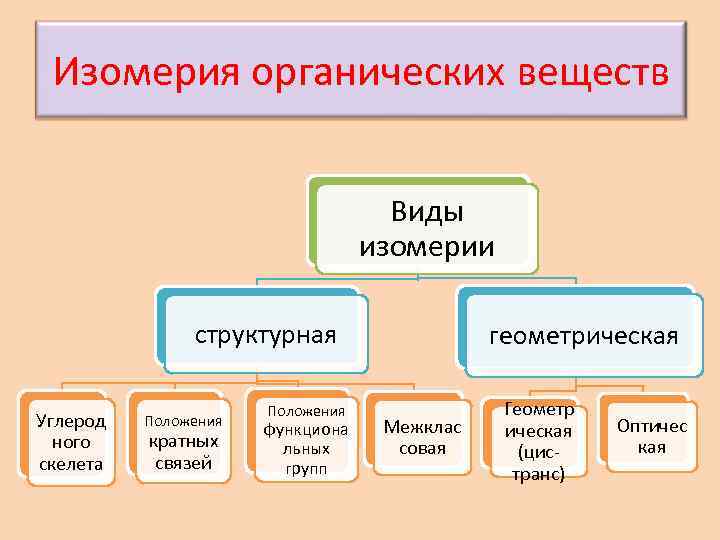
Изомерия органических веществ Виды изомерии структурная Углерод ного скелета Положения кратных связей Положения функциона льных групп геометрическая Межклас совая Геометр ическая (цистранс) Оптичес кая

Изомерия и номенклатура алканов Структурная изомерия: CH 3 – CH - CH 2 - CH 3 │ CH 3 Алгоритм. 1. Выбор главной цепи: CH 3 – CH - CH 2 - CH 3 │ CH 3

Изомерия и номенклатура алканов 2. Нумерация атомов главной цепи: 1 2 3 4 CH 3 – CH - CH 2 - CH 3 │ CH 3
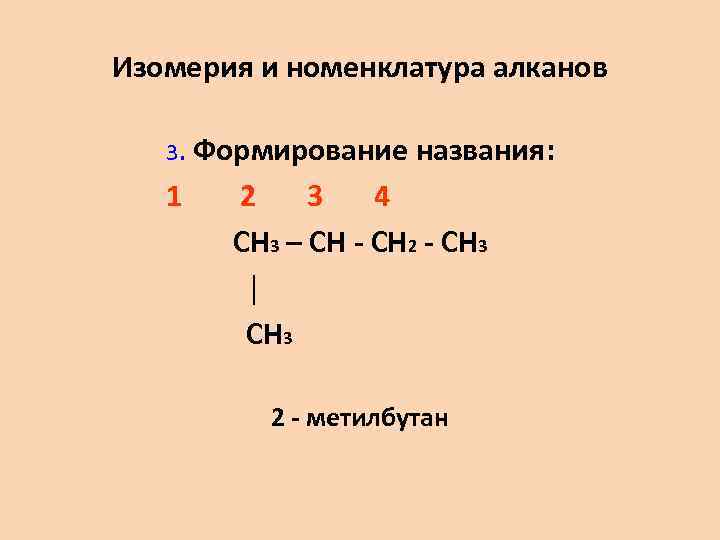
Изомерия и номенклатура алканов 3. Формирование названия: 1 2 3 4 CH 3 – CH - CH 2 - CH 3 │ CH 3 2 - метилбутан

Физические свойства СН 4…C 4 Н 10 – газы T кипения: -161, 6…-0, 5 °C T плавления: -182, 5…-138, 3 °C С 5 Н 12…C 15 Н 32 – жидкости T кипения: 36, 1… 270, 5 °C T плавления: -129, 8… 10 °C С 16 Н 34…и далее – твёрдые вещества T кипения: 287, 5 °C T плавления: 20 °C С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.

Получение алканов Промышленные методы. 1. Газ, нефть. 2. Гидрирование алкенов. C 2 H 4 + Н 2 → C 2 H 6 Лабораторные методы. 1. Гидролиз карбида алюминия Al 4 C 3 + 12 H 2 O → 4 Al(OH)3 + 3 CH 4 2. Реакция Вюрца (удлинение углеродной цепи в 2 раза) 2 СН 3 Сl + 2 Na → CH 3 - CH 3 + 2 Na. Cl 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма) CH 3 COONa + Na. OH → CH 4 + Na 2 CO 3
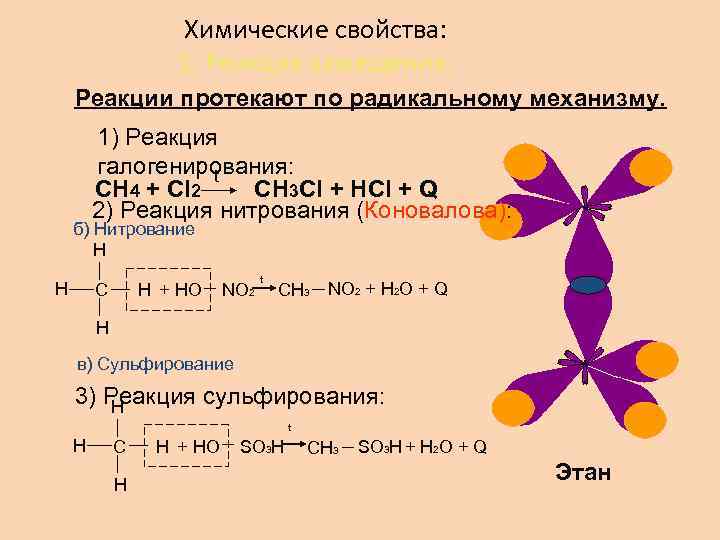
Химические свойства: 1. Реакция замещения. Реакции протекают по радикальному механизму. 1) Реакция галогенирования: t СН 4 + Сl 2 CH 3 Cl + HCl + Q 2) Реакция нитрования (Коновалова): б) Нитрование Н Н С Н + НО NO 2 t СН 3 NO 2 + H 2 O + Q Н в) Сульфирование 3) Реакция сульфирования: Н t Н С Н Н + НО SO 3 H СН 3 SO 3 H + H 2 O + Q Этан
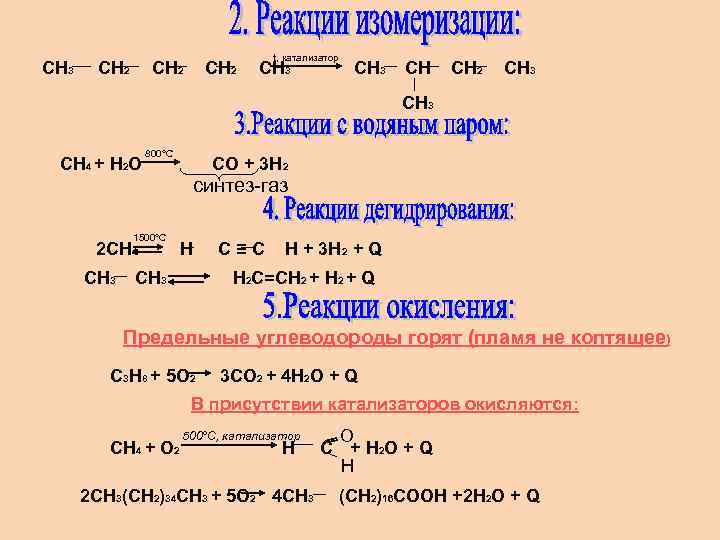
СН 3 СН 2 t, катализатор СН 3 СН СН 2 СН 3 СН 4 + Н 2 О 800°С СО + 3 Н 2 синтез-газ 1500°С 2 СН 4 СН 3 Н СН 3 С≡С Н + 3 Н 2 + Q Н 2 С=СН 2 + Q Предельные углеводороды горят (пламя не коптящее) С 3 Н 8 + 5 О 2 3 СО 2 + 4 Н 2 О + Q В присутствии катализаторов окисляются: СН 4 + О 2 500°С, катализатор Н 2 СН 3(СН 2)34 СН 3 + 5 О 2 4 СН 3 О С + Н 2 О + Q Н (СН 2)16 СООН +2 Н 2 О + Q

Применение алканов 1 -3 – производство сажи (1 – картрижи; 2 – резина; 3 – типографическая краска) 4 -7 – получение органических веществ (4 – растворителей; 5 – хладогентов, используемых в холодильных установках; 6 – метанол; 7 - ацетилен)