алканы.ppt
- Количество слайдов: 31
 АЛКАНЫ Физические и химические свойства, получение и применение.
АЛКАНЫ Физические и химические свойства, получение и применение.
 Вспомните, какие вещества мы называем углеводородами? УГЛЕВОДОРОДЫ – это органические соединения, состоящие из двух химических элементов – УГЛЕРОДА И ВОДОРОДА.
Вспомните, какие вещества мы называем углеводородами? УГЛЕВОДОРОДЫ – это органические соединения, состоящие из двух химических элементов – УГЛЕРОДА И ВОДОРОДА.
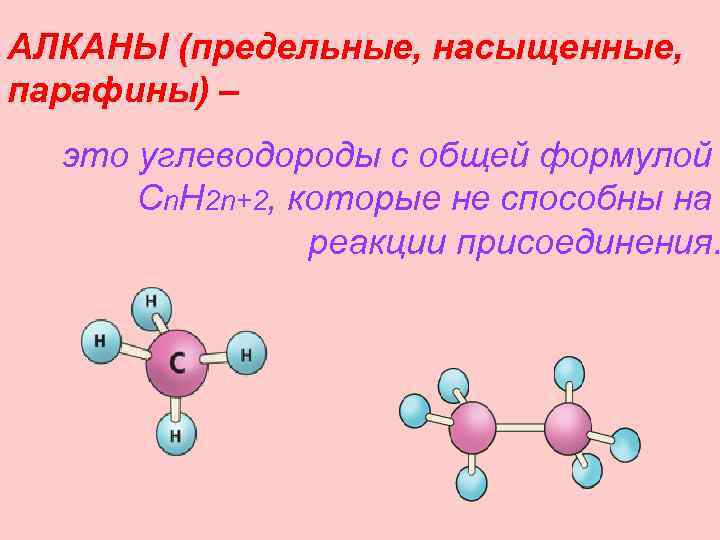 АЛКАНЫ (предельные, насыщенные, парафины) – это углеводороды с общей формулой Cn. H 2 n+2, которые не способны на реакции присоединения.
АЛКАНЫ (предельные, насыщенные, парафины) – это углеводороды с общей формулой Cn. H 2 n+2, которые не способны на реакции присоединения.
 АЛКАНЫ название предельных углеводородов по международной номенклатуре (ИЮПАК). ПАРАФИНЫ исторически сохранившееся название предельных углеводородов (от лат. parrum affinis – малоактивный).
АЛКАНЫ название предельных углеводородов по международной номенклатуре (ИЮПАК). ПАРАФИНЫ исторически сохранившееся название предельных углеводородов (от лат. parrum affinis – малоактивный).
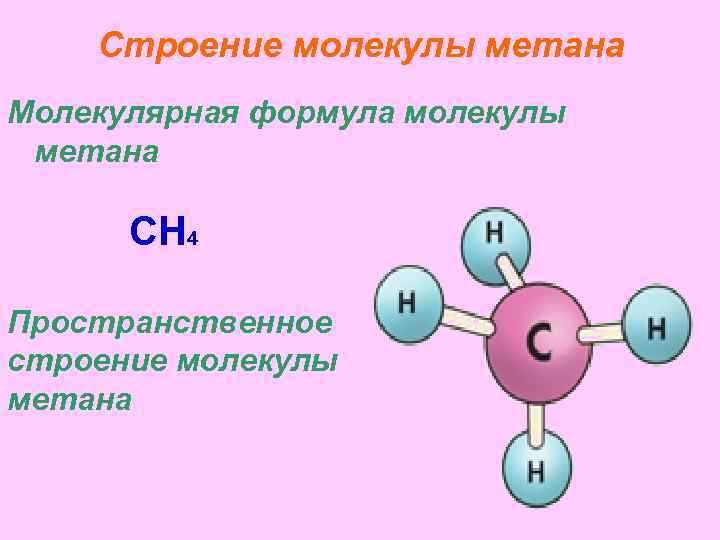 Строение молекулы метана Молекулярная формула молекулы метана CH 4 Пространственное строение молекулы метана
Строение молекулы метана Молекулярная формула молекулы метана CH 4 Пространственное строение молекулы метана
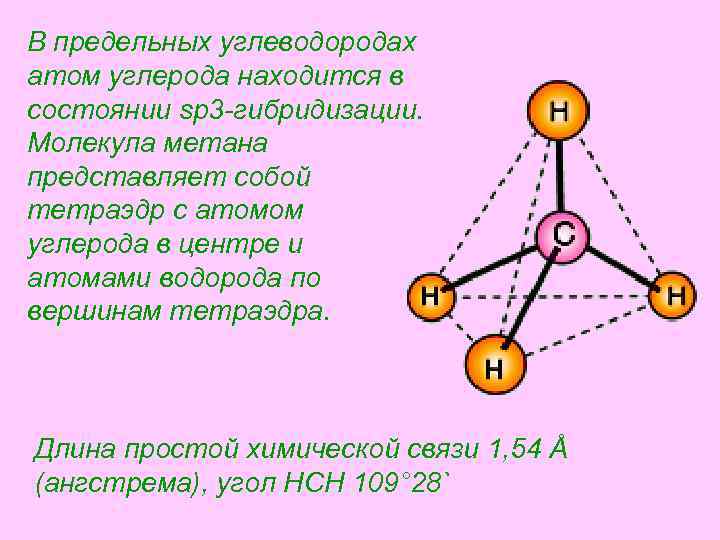 В предельных углеводородах атом углерода находится в состоянии sp 3 -гибридизации. Молекула метана представляет собой тетраэдр с атомом углерода в центре и атомами водорода по вершинам тетраэдра. Длина простой химической связи 1, 54 Å (ангстрема), угол HCH 109° 28`
В предельных углеводородах атом углерода находится в состоянии sp 3 -гибридизации. Молекула метана представляет собой тетраэдр с атомом углерода в центре и атомами водорода по вершинам тетраэдра. Длина простой химической связи 1, 54 Å (ангстрема), угол HCH 109° 28`
 ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Вспомните, какие вещества мы называем гомологами? ГОМОЛОГИ – это вещества со схожими строением и свойствами, но различающиеся по составу на одну или несколько групп CH 2 (гомологическая разность).
ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Вспомните, какие вещества мы называем гомологами? ГОМОЛОГИ – это вещества со схожими строением и свойствами, но различающиеся по составу на одну или несколько групп CH 2 (гомологическая разность).
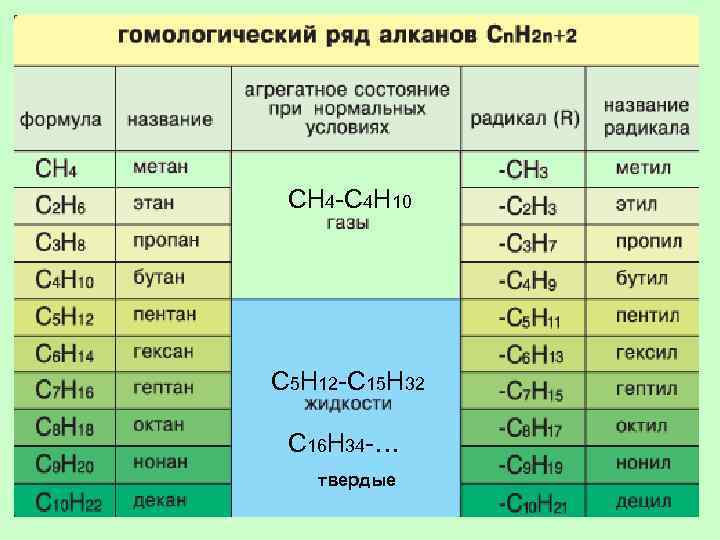 СН 4 -С 4 Н 10 С 5 Н 12 -С 15 Н 32 С 16 Н 34 -… твердые
СН 4 -С 4 Н 10 С 5 Н 12 -С 15 Н 32 С 16 Н 34 -… твердые
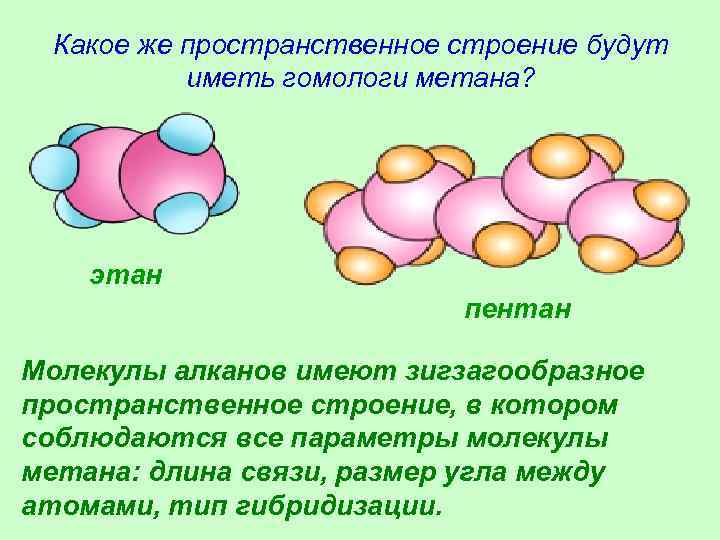 Какое же пространственное строение будут иметь гомологи метана? этан пентан Молекулы алканов имеют зигзагообразное пространственное строение, в котором соблюдаются все параметры молекулы метана: длина связи, размер угла между атомами, тип гибридизации.
Какое же пространственное строение будут иметь гомологи метана? этан пентан Молекулы алканов имеют зигзагообразное пространственное строение, в котором соблюдаются все параметры молекулы метана: длина связи, размер угла между атомами, тип гибридизации.
 ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. НАХОЖДЕНИЕ В ПРИРОДЕ. МЕТАН – газ, без цвета и запаха, почти в 2 раза легче воздуха, мало растворим в воде. Он образуется в природе в результате разложения без доступа воздуха остатков растительных и животных организмов. Поэтому может быть обнаружен в заболоченных водоемах, где появляется в виде пузырьков газа, или накапливается в каменноугольных шахтах, куда выделяется из угольных пластов. В значительном количестве (80 -97%) метан содержится в природном газе и в попутных нефтяных газах.
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. НАХОЖДЕНИЕ В ПРИРОДЕ. МЕТАН – газ, без цвета и запаха, почти в 2 раза легче воздуха, мало растворим в воде. Он образуется в природе в результате разложения без доступа воздуха остатков растительных и животных организмов. Поэтому может быть обнаружен в заболоченных водоемах, где появляется в виде пузырьков газа, или накапливается в каменноугольных шахтах, куда выделяется из угольных пластов. В значительном количестве (80 -97%) метан содержится в природном газе и в попутных нефтяных газах.
 ЭТАН, ПРОПАН И БУТАН входят в состав природного и попутного нефтяного газов. АЛКАНЫ содержатся в нефти.
ЭТАН, ПРОПАН И БУТАН входят в состав природного и попутного нефтяного газов. АЛКАНЫ содержатся в нефти.
 ИЗОМЕРИЯ И НОМЕНКЛАТУРА АЛКАНОВ У алканов наблюдается изомерия углеродного скелета. Чтобы составить название углеводорода с разветвленной цепью, его рассматривают как продукт замещения атомов водорода в нормальном углеводороде углеводородными радикалами. 1. Выделяют в структурной формуле наиболее длинную цепь атомов углерода и нумеруют эти атомы, начиная с того к которому ближе разветвление. 1 2 3 4 5 СН 3 - СН 2 - СН 3 1 2 3 4 СН 3 – СН 3 СН 3
ИЗОМЕРИЯ И НОМЕНКЛАТУРА АЛКАНОВ У алканов наблюдается изомерия углеродного скелета. Чтобы составить название углеводорода с разветвленной цепью, его рассматривают как продукт замещения атомов водорода в нормальном углеводороде углеводородными радикалами. 1. Выделяют в структурной формуле наиболее длинную цепь атомов углерода и нумеруют эти атомы, начиная с того к которому ближе разветвление. 1 2 3 4 5 СН 3 - СН 2 - СН 3 1 2 3 4 СН 3 – СН 3 СН 3
 2. Когда радикалов несколько и они равноудалены от концов главной цепи, то нумерацию начинают с того края, к которому ближе расположен простейший радикал. 3. В названии вещества цифрой указывают, при каком атоме углерода находится радикал и называют его (начиная с простейшего). Если радикалы повторяются, то номер повторяют по числу этого радикала, а перед названием радикала приписывают приставку от греческого числительного ( «ди» -2, «три» -3, «тетра» -4 и т. д. )
2. Когда радикалов несколько и они равноудалены от концов главной цепи, то нумерацию начинают с того края, к которому ближе расположен простейший радикал. 3. В названии вещества цифрой указывают, при каком атоме углерода находится радикал и называют его (начиная с простейшего). Если радикалы повторяются, то номер повторяют по числу этого радикала, а перед названием радикала приписывают приставку от греческого числительного ( «ди» -2, «три» -3, «тетра» -4 и т. д. )
 4. Если радикалов несколько, то цифрами указывают каждого из них. 5. Завершают название алкана по числу атомов углерода в нумерованной цепи.
4. Если радикалов несколько, то цифрами указывают каждого из них. 5. Завершают название алкана по числу атомов углерода в нумерованной цепи.
 Физические свойства. Алканы - бесцветные вещества, нерастворимые в воде. В обычных условиях они химически инертны, так как все связи в их молекулах образованы с участием sp 3 -гибридных орбиталей атома углерода и являются очень прочными. В реакции присоединения алканы не вступают: все связи атомов углерода полностью насыщены. С 1 -С 4 – газы С 5 -С 15 – жидкости с С 16 – твёрдые вещества (парафин)
Физические свойства. Алканы - бесцветные вещества, нерастворимые в воде. В обычных условиях они химически инертны, так как все связи в их молекулах образованы с участием sp 3 -гибридных орбиталей атома углерода и являются очень прочными. В реакции присоединения алканы не вступают: все связи атомов углерода полностью насыщены. С 1 -С 4 – газы С 5 -С 15 – жидкости с С 16 – твёрдые вещества (парафин)
 1. Без изменения углеродного скелета. а) гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля). CH 3–CH=CH–CH 3+H 2 ––kat→CH 3–CH 2–CH 3 (циклопропан) + H 2 ––Pd→ CH 3 –CH 2 –CH 3 2. С увеличением углеродного скелета. б) Реакция Вюрца, заключающаяся в действии металлического натрия на моногалогенопроизводные углеводородов. 2 CH 3–CH 2 Br + 2 Na→CH 3–CH 2–CH 3 + 2 Na. Br
1. Без изменения углеродного скелета. а) гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля). CH 3–CH=CH–CH 3+H 2 ––kat→CH 3–CH 2–CH 3 (циклопропан) + H 2 ––Pd→ CH 3 –CH 2 –CH 3 2. С увеличением углеродного скелета. б) Реакция Вюрца, заключающаяся в действии металлического натрия на моногалогенопроизводные углеводородов. 2 CH 3–CH 2 Br + 2 Na→CH 3–CH 2–CH 3 + 2 Na. Br
 в) Реакция Вюрца – Гриньяра CH 3 -Cl + Mg - эфир→ CH 3 -Mg-Cl + Cl-CH 2 -CH 3 → CH 3 -CH 2 -CH 3 + Mg. Cl 2 г) Электролиз по Кольбе э. ток на аноде на катоде 2 CH 3 -COONa + 2 H 2 O → CH 3 -CH 3 + 2 CO 2 + H 2 +2 Na. OH 3. С уменьшением углеродной цепи. д) В лабораторной практике их получают при сплавлении солей карбоновых кислот со щелочами. CH 3 COONa(тв) + Na. OH(тв) ––t°→ CH 4 + Na 2 CO 3 4. Метан также можно получить гидролизом карбида алюминия. Al 4 C 3 + 12 H 2 O → 3 CH 4 + 4 Al(OH)3
в) Реакция Вюрца – Гриньяра CH 3 -Cl + Mg - эфир→ CH 3 -Mg-Cl + Cl-CH 2 -CH 3 → CH 3 -CH 2 -CH 3 + Mg. Cl 2 г) Электролиз по Кольбе э. ток на аноде на катоде 2 CH 3 -COONa + 2 H 2 O → CH 3 -CH 3 + 2 CO 2 + H 2 +2 Na. OH 3. С уменьшением углеродной цепи. д) В лабораторной практике их получают при сплавлении солей карбоновых кислот со щелочами. CH 3 COONa(тв) + Na. OH(тв) ––t°→ CH 4 + Na 2 CO 3 4. Метан также можно получить гидролизом карбида алюминия. Al 4 C 3 + 12 H 2 O → 3 CH 4 + 4 Al(OH)3
 Запомните! • • • Алканы получают: 1. Из нефти; 2. Из природного и попутного газа; 3. Из солей карбоновых кислот (реакция Дюма); 4. Из галогеналканов (синтезы Вюрца и Вюрца-Гриньяра); 5. Электролизом по Кольбе.
Запомните! • • • Алканы получают: 1. Из нефти; 2. Из природного и попутного газа; 3. Из солей карбоновых кислот (реакция Дюма); 4. Из галогеналканов (синтезы Вюрца и Вюрца-Гриньяра); 5. Электролизом по Кольбе.
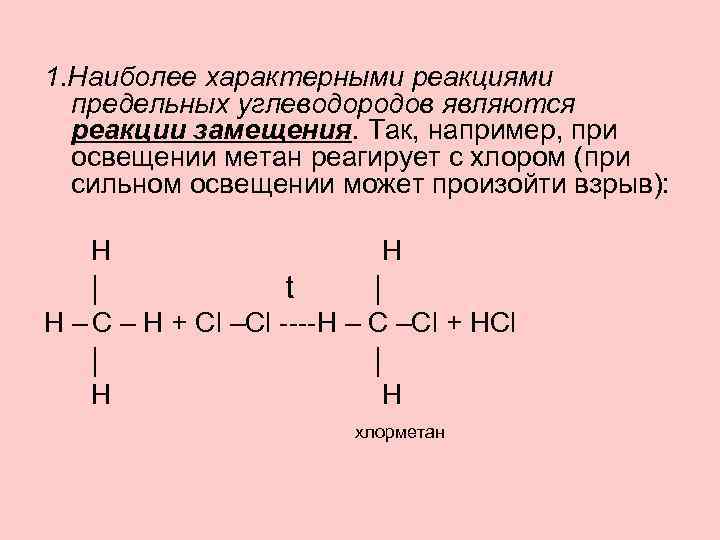 1. Наиболее характерными реакциями предельных углеводородов являются реакции замещения. Так, например, при освещении метан реагирует с хлором (при сильном освещении может произойти взрыв): H | H t | H – C – H + Cl –Cl ----H – C –Cl + HCl | H хлорметан
1. Наиболее характерными реакциями предельных углеводородов являются реакции замещения. Так, например, при освещении метан реагирует с хлором (при сильном освещении может произойти взрыв): H | H t | H – C – H + Cl –Cl ----H – C –Cl + HCl | H хлорметан
 • 2. Все предельные углеводороды горят с образованием оксида углерода (IV) и воды. Метан горит бесцветным пламенем, с выделением теплоты: CH 4+2 O 2=CO 2+H 2 O+880 к. Дж 3. При сильном нагревании(выше 1000 градусов) без доступа воздуха предельные углеводороды разлагаются: CH 4 ----C+2 H 2 Если метан нагреть до более высокой температуры (1500 градусов), то реакция происходит так: 2 CH 4 ---- C 2 H 2 +3 H 2 ацетилен 4. Углеводороды нормального строения под влиянием катализаторов и при нагревании подвергаются реакциям изомеризации и превращаются в углеводороды разветвленного строения: CH 3 - CH 2 - CH 3 ---- CH 3 - CH 2 - CH 3 | CH 3
• 2. Все предельные углеводороды горят с образованием оксида углерода (IV) и воды. Метан горит бесцветным пламенем, с выделением теплоты: CH 4+2 O 2=CO 2+H 2 O+880 к. Дж 3. При сильном нагревании(выше 1000 градусов) без доступа воздуха предельные углеводороды разлагаются: CH 4 ----C+2 H 2 Если метан нагреть до более высокой температуры (1500 градусов), то реакция происходит так: 2 CH 4 ---- C 2 H 2 +3 H 2 ацетилен 4. Углеводороды нормального строения под влиянием катализаторов и при нагревании подвергаются реакциям изомеризации и превращаются в углеводороды разветвленного строения: CH 3 - CH 2 - CH 3 ---- CH 3 - CH 2 - CH 3 | CH 3
 Химические свойства алканов. Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия. Для них свойственны реакции замещения водородных атомов и расщепления. Эти реакции вследствие прочности связей C–C и C–H протекают или при нагревании, или на свету, или с применением катализаторов.
Химические свойства алканов. Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия. Для них свойственны реакции замещения водородных атомов и расщепления. Эти реакции вследствие прочности связей C–C и C–H протекают или при нагревании, или на свету, или с применением катализаторов.
 I. Реакции замещения 1) Галогенирование –замещение атома водорода атомом галогена. Она протекает обычно на свету или при нагревании. Замещение атома водорода галогеном легче всего идет у менее гидрогенизированного третичного атома углерода, затем у вторичного и в последнюю очередь у первичного. CH 4 + Cl 2 → CH 3 Cl + HCl CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl CHCl 3 + Cl 2 → CCl 4 + HCl
I. Реакции замещения 1) Галогенирование –замещение атома водорода атомом галогена. Она протекает обычно на свету или при нагревании. Замещение атома водорода галогеном легче всего идет у менее гидрогенизированного третичного атома углерода, затем у вторичного и в последнюю очередь у первичного. CH 4 + Cl 2 → CH 3 Cl + HCl CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl CHCl 3 + Cl 2 → CCl 4 + HCl
 2) При нагревании их до 140°С с разбавленной (10%-ной) азотной кислотой под давлением Осуществляется реакция нитрования – замещение атома водорода нитрогруппой (реакция М. И. Коновалова). t, p CH 3–CH(CH 3)–CH 3 +HO-NO 2 →CH 3 -C (CH 3)–CH 3 + H 2 O | NO 2 3) Сульфирование – замещение атома водорода сульфогруппой. При нагревании конц. серная кислота ( «дымящаяся» ) дает с высшими парафинами сульфокислоты. R-H + H 2 SO 4 → R-SO 3 H + H 2 O
2) При нагревании их до 140°С с разбавленной (10%-ной) азотной кислотой под давлением Осуществляется реакция нитрования – замещение атома водорода нитрогруппой (реакция М. И. Коновалова). t, p CH 3–CH(CH 3)–CH 3 +HO-NO 2 →CH 3 -C (CH 3)–CH 3 + H 2 O | NO 2 3) Сульфирование – замещение атома водорода сульфогруппой. При нагревании конц. серная кислота ( «дымящаяся» ) дает с высшими парафинами сульфокислоты. R-H + H 2 SO 4 → R-SO 3 H + H 2 O
 Запомните! • Для алканов характерны реакции замещения атомов водорода на другие атомы или группы атомов. • В этих реакциях водород никогда не выделяется, а образуется галогеноводород. • Замещение у алканов идет в первую очередь по менее гидрогенизированному атому углерода.
Запомните! • Для алканов характерны реакции замещения атомов водорода на другие атомы или группы атомов. • В этих реакциях водород никогда не выделяется, а образуется галогеноводород. • Замещение у алканов идет в первую очередь по менее гидрогенизированному атому углерода.
 II. Термическое превращение алканов 1. При высокой температуре в присутствии катализаторов предельные углеводороды подвергаются расщеплению, которое называется крекингом. CH 3–CH 2–CH 3 –– 400°C→ CH 3–CH 3 + CH 2=CH 2 2. Дегидрирование – отщепление водорода с образованием непредельных углеводородов. Так, метан при 1500ºС приводит к ацетилену. 2 CH 4 –– 1500°C→ H–C≡C–H + 3 H 2 (Kat Ni) C 2 H 6 –– 500 -600°C→ C 2 H 4 + H 2 (Kat Pt)
II. Термическое превращение алканов 1. При высокой температуре в присутствии катализаторов предельные углеводороды подвергаются расщеплению, которое называется крекингом. CH 3–CH 2–CH 3 –– 400°C→ CH 3–CH 3 + CH 2=CH 2 2. Дегидрирование – отщепление водорода с образованием непредельных углеводородов. Так, метан при 1500ºС приводит к ацетилену. 2 CH 4 –– 1500°C→ H–C≡C–H + 3 H 2 (Kat Ni) C 2 H 6 –– 500 -600°C→ C 2 H 4 + H 2 (Kat Pt)
 3. Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации – перестройке углеродного скелета с образованием алканов разветвленного строения. t°, Al. Cl 3 CH 3–CH 2–CH 3 →CH 3–CH–CH 2 - CH 3 | CH 3
3. Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации – перестройке углеродного скелета с образованием алканов разветвленного строения. t°, Al. Cl 3 CH 3–CH 2–CH 3 →CH 3–CH–CH 2 - CH 3 | CH 3
 III. Окисление В обычных условиях алканы устойчивы к действию кислорода и окислителей. При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и выделяя большое количество тепла. CH 4 + 2 O 2 ––пламя→ CO 2 + 2 H 2 O C 5 H 12 + 8 O 2 ––пламя→ 5 CO 2 + 6 H 2 O
III. Окисление В обычных условиях алканы устойчивы к действию кислорода и окислителей. При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и выделяя большое количество тепла. CH 4 + 2 O 2 ––пламя→ CO 2 + 2 H 2 O C 5 H 12 + 8 O 2 ––пламя→ 5 CO 2 + 6 H 2 O
 ЗАДАНИЕ. Дайте названия следующим углеводородам по международной номенклатуре. СН 3 2, 2 - диметилбутан СН 3 – СН 2 – СН 3 – СН 3 СН 3 С 2 Н 5 СН 3 2, 4 – диметил - 3 – этилпентан
ЗАДАНИЕ. Дайте названия следующим углеводородам по международной номенклатуре. СН 3 2, 2 - диметилбутан СН 3 – СН 2 – СН 3 – СН 3 СН 3 С 2 Н 5 СН 3 2, 4 – диметил - 3 – этилпентан
 Найдите изомеры среди представленных веществ:
Найдите изомеры среди представленных веществ:
 - составьте все возможные изомеры гексана - составьте и решите уравнения реакций: 1. Окисление пентана 2. Галогенирование этана.
- составьте все возможные изомеры гексана - составьте и решите уравнения реакций: 1. Окисление пентана 2. Галогенирование этана.
 ДОМАШНЕЕ ЗАДАНИЕ: учить конспект, закончить уравнения реакций
ДОМАШНЕЕ ЗАДАНИЕ: учить конспект, закончить уравнения реакций


