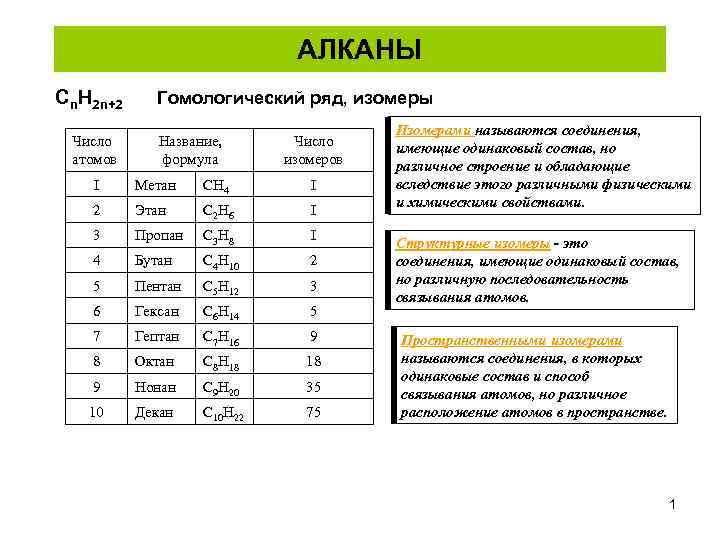
 АЛКАНЫ Cn. H 2 n+2 Число атомов Гомологический ряд, изомеры Название, формула Число изомеров I Метан Н 4 С I 2 Этан 2 H 6 C I 3 Пропан 3 H 8 C I 4 Бутан 4 Н 10 С 2 5 Пентан 5 Н 12 С 3 6 Гексан С 6 Н 14 5 7 Гептан С 7 Н 16 9 8 Октан С 8 Н 18 18 9 Нонан С 9 Н 20 35 10 Декан С 10 Н 22 75 Изомерами называются соединения, имеющие одинаковый состав, но различное строение и обладающие вследствие этого различными физическими и химическими свойствами. Структурные изомеры - это соединения, имеющие одинаковый состав, но различную последовательность связывания атомов. Пространственными изомерами называются соединения, в которых одинаковые состав и способ связывания атомов, но различное расположение атомов в пространстве. 1
АЛКАНЫ Cn. H 2 n+2 Число атомов Гомологический ряд, изомеры Название, формула Число изомеров I Метан Н 4 С I 2 Этан 2 H 6 C I 3 Пропан 3 H 8 C I 4 Бутан 4 Н 10 С 2 5 Пентан 5 Н 12 С 3 6 Гексан С 6 Н 14 5 7 Гептан С 7 Н 16 9 8 Октан С 8 Н 18 18 9 Нонан С 9 Н 20 35 10 Декан С 10 Н 22 75 Изомерами называются соединения, имеющие одинаковый состав, но различное строение и обладающие вследствие этого различными физическими и химическими свойствами. Структурные изомеры - это соединения, имеющие одинаковый состав, но различную последовательность связывания атомов. Пространственными изомерами называются соединения, в которых одинаковые состав и способ связывания атомов, но различное расположение атомов в пространстве. 1
 2
2
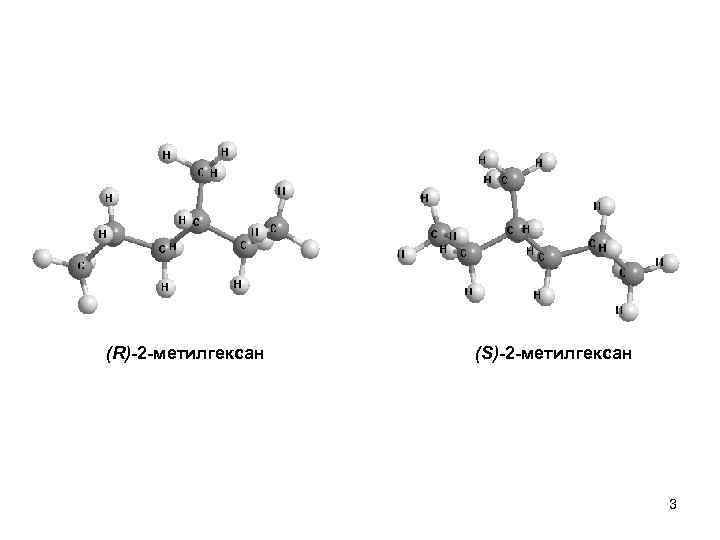 (R)-2 -метилгексан (S)-2 -метилгексан 3
(R)-2 -метилгексан (S)-2 -метилгексан 3
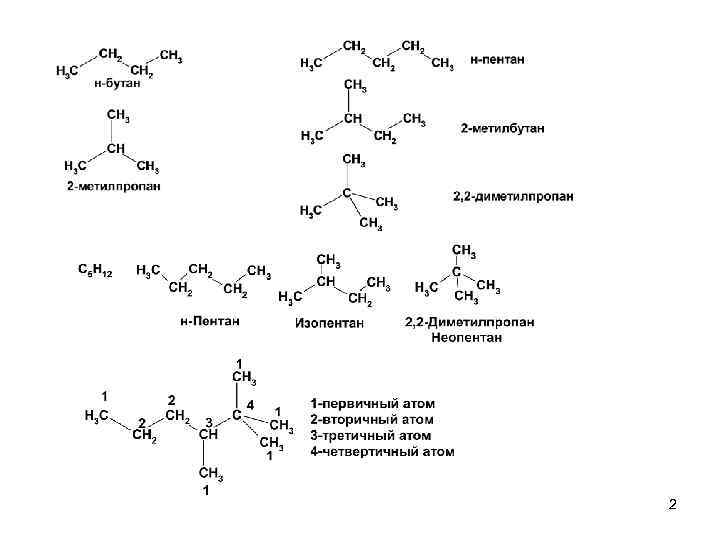
 Номенклатура IUPAC 1. Корень названия – наиболее длинная цепь углеродных атомов 2. Боковые цепи называют по названию групп (радикалов), которые перечисляют в алфавитном порядке. 3. Положение боковых цепей обозначают цифрами. Нумерация наиболее длинной цепи начинается с конца, ближайшего к первому разветвлению. Если есть две или более одинаковых боковых цепей (заместителей), то цифра повторяется столько раз, сколько есть одинаковых заместителей. 4. Количество одинаковых боковых цепей обозначают греческими числительными: ди-, три-, тетра-, пента- и. т. д. Название структурного радикала образуется заменой суффикса –ан на –ил. 4
Номенклатура IUPAC 1. Корень названия – наиболее длинная цепь углеродных атомов 2. Боковые цепи называют по названию групп (радикалов), которые перечисляют в алфавитном порядке. 3. Положение боковых цепей обозначают цифрами. Нумерация наиболее длинной цепи начинается с конца, ближайшего к первому разветвлению. Если есть две или более одинаковых боковых цепей (заместителей), то цифра повторяется столько раз, сколько есть одинаковых заместителей. 4. Количество одинаковых боковых цепей обозначают греческими числительными: ди-, три-, тетра-, пента- и. т. д. Название структурного радикала образуется заменой суффикса –ан на –ил. 4
 Природные источники алканов Природный газ (75 -90% СН 4). Нефть (С 1 -С 40). Каменный уголь (ароматические и гетероциклические соединения). Методы синтеза алканов Метод Фишера-Тропша Гидрирование (ожижение) угля 5
Природные источники алканов Природный газ (75 -90% СН 4). Нефть (С 1 -С 40). Каменный уголь (ароматические и гетероциклические соединения). Методы синтеза алканов Метод Фишера-Тропша Гидрирование (ожижение) угля 5
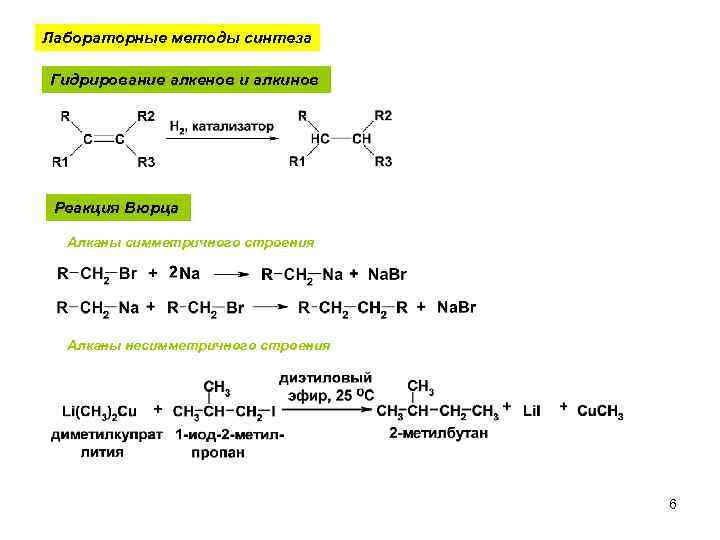 Лабораторные методы синтеза Гидрирование алкенов и алкинов Реакция Вюрца Алканы симметричного строения Алканы несимметричного строения 6
Лабораторные методы синтеза Гидрирование алкенов и алкинов Реакция Вюрца Алканы симметричного строения Алканы несимметричного строения 6
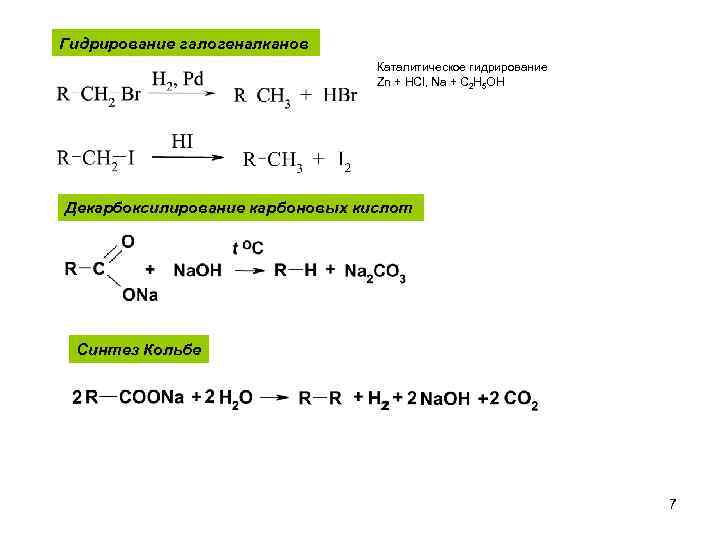 Гидрирование галогеналканов Каталитическое гидрирование Zn + HCl, Na + С 2 H 5 OH Декарбоксилирование карбоновых кислот Синтез Кольбе 7
Гидрирование галогеналканов Каталитическое гидрирование Zn + HCl, Na + С 2 H 5 OH Декарбоксилирование карбоновых кислот Синтез Кольбе 7
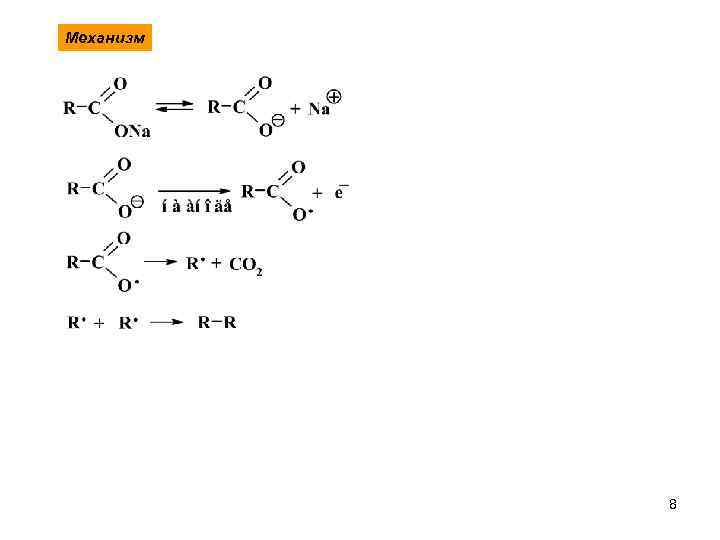 Механизм 8
Механизм 8
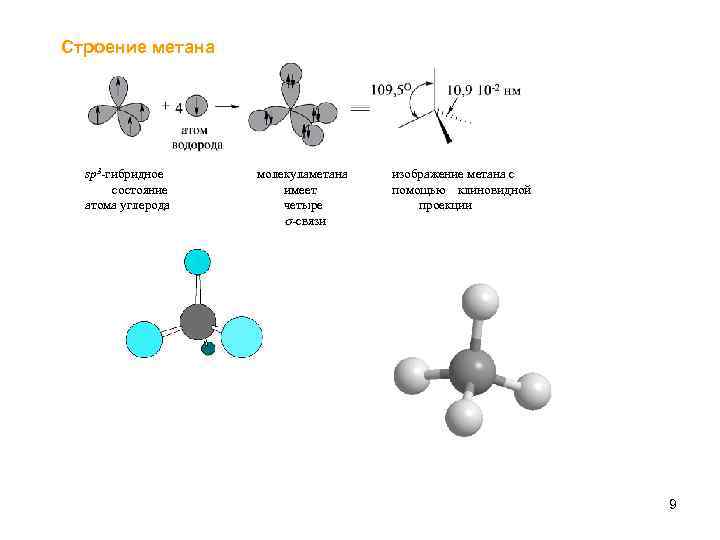 Строение метана sp 3‑гибридное состояние атома углерода молекула етана м имеет четыре -связи изображение метана с помощью клиновидной проекции 9
Строение метана sp 3‑гибридное состояние атома углерода молекула етана м имеет четыре -связи изображение метана с помощью клиновидной проекции 9
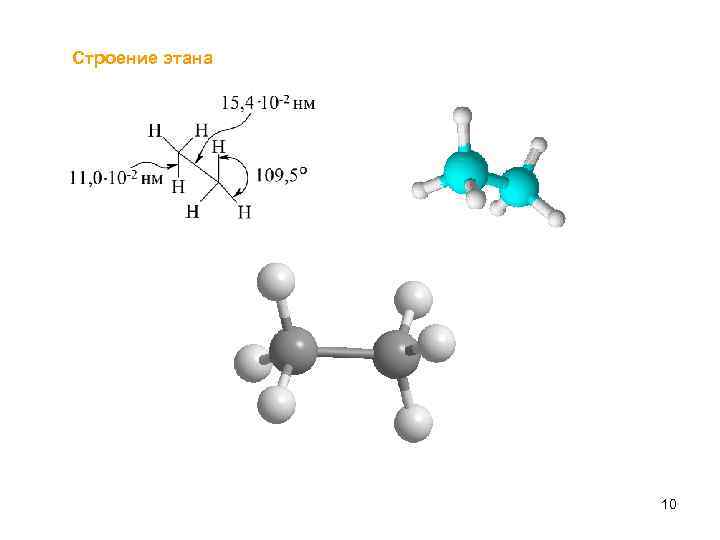 Строение этана 10
Строение этана 10
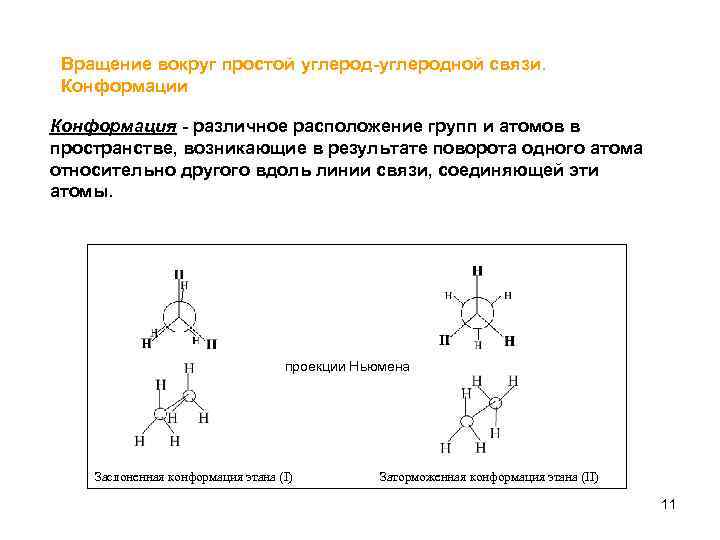 Вращение вокруг простой углерод-углеродной связи. Конформации Конформация - различное расположение групп и атомов в пространстве, возникающие в результате поворота одного атома относительно другого вдоль линии связи, соединяющей эти атомы. проекции Ньюмена Заслоненная конформация этана (I) Заторможенная конформация этана (II) 11
Вращение вокруг простой углерод-углеродной связи. Конформации Конформация - различное расположение групп и атомов в пространстве, возникающие в результате поворота одного атома относительно другого вдоль линии связи, соединяющей эти атомы. проекции Ньюмена Заслоненная конформация этана (I) Заторможенная конформация этана (II) 11
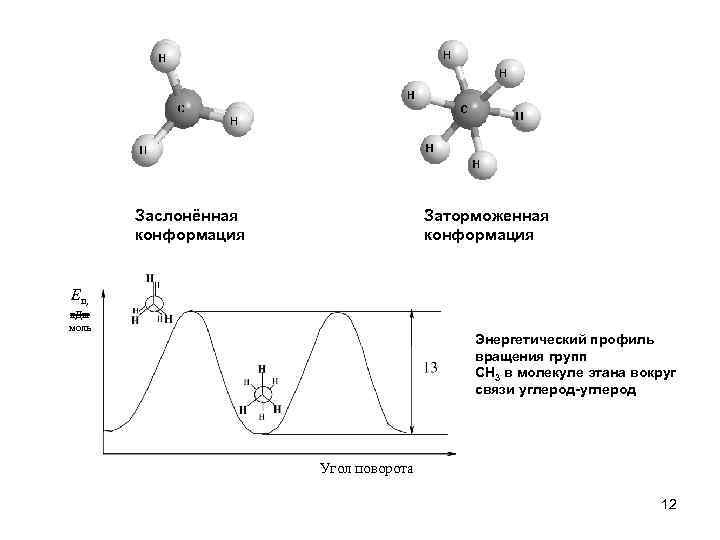 Заслонённая конформация Заторможенная конформация Еп, к. Дж моль Энергетический профиль вращения групп CH 3 в молекуле этана вокруг связи углерод-углерод Угол поворота 12
Заслонённая конформация Заторможенная конформация Еп, к. Дж моль Энергетический профиль вращения групп CH 3 в молекуле этана вокруг связи углерод-углерод Угол поворота 12
 13
13
 Химические свойства Алканы – малополярные и слабополяризуемые соединения Гетеролитический (а) и гомолитический (б) разрыв связей С–Н в метане: а) СН 4 СН 3+ + Нº Нº = 1313· 103 Дж/моль б) СН 4 СН 3 + Нº Нº = 435· 103 Дж/моль в) H 3 C-CH 3 СН 3 + Нº Нº = 365· 103 Дж/моль Характерными реакциями алканов является свободнорадикальное замещение SR незаряженного атома водорода при действии незаряженных свободнорадикальных реагентов: атомов хлора и брома при галогенировании, NO 2 при нитровании и т. д. Хлорирование и бромирование метана. 14
Химические свойства Алканы – малополярные и слабополяризуемые соединения Гетеролитический (а) и гомолитический (б) разрыв связей С–Н в метане: а) СН 4 СН 3+ + Нº Нº = 1313· 103 Дж/моль б) СН 4 СН 3 + Нº Нº = 435· 103 Дж/моль в) H 3 C-CH 3 СН 3 + Нº Нº = 365· 103 Дж/моль Характерными реакциями алканов является свободнорадикальное замещение SR незаряженного атома водорода при действии незаряженных свободнорадикальных реагентов: атомов хлора и брома при галогенировании, NO 2 при нитровании и т. д. Хлорирование и бромирование метана. 14
 Механизм реакции Радикально-цепной, SR F 2 > CI 2 > Вr 2 > I 2 Реакционная способность галогенов убывает Число циклов 10 - 10000 Ингибиторы – вещества, тормозящие химические реакции. В случае SR реакции ингибитор взаимодействует с радикалами и превращает их в частицы с низкой реакционной способностью. 15
Механизм реакции Радикально-цепной, SR F 2 > CI 2 > Вr 2 > I 2 Реакционная способность галогенов убывает Число циклов 10 - 10000 Ингибиторы – вещества, тормозящие химические реакции. В случае SR реакции ингибитор взаимодействует с радикалами и превращает их в частицы с низкой реакционной способностью. 15
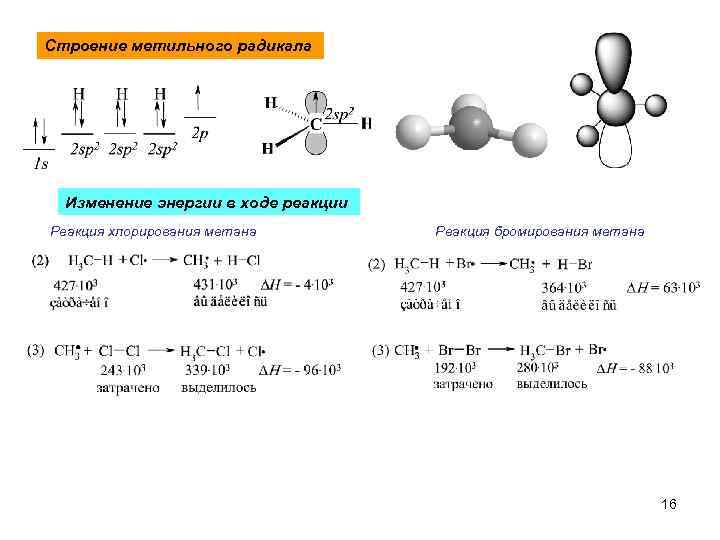 Строение метильного радикала Изменение энергии в ходе реакции Реакция хлорирования метана Реакция бромирования метана 16
Строение метильного радикала Изменение энергии в ходе реакции Реакция хлорирования метана Реакция бромирования метана 16
 Энергетическая диаграмма реакции. Связь энергии активации с экзотермичностью. тетраэдрический атом углерода углерод становится почти плоским ИСХОДНЫЕ СОЕДИНЕНИЯ ПЕРЕХОДНОЕ СОСТОЯНИЕ неспаренный электрон одновременно принадлежит атомам хлора и углерода плоский метильный радикал КОНЕЧНЫЕ ПРОДУКТЫ 17
Энергетическая диаграмма реакции. Связь энергии активации с экзотермичностью. тетраэдрический атом углерода углерод становится почти плоским ИСХОДНЫЕ СОЕДИНЕНИЯ ПЕРЕХОДНОЕ СОСТОЯНИЕ неспаренный электрон одновременно принадлежит атомам хлора и углерода плоский метильный радикал КОНЕЧНЫЕ ПРОДУКТЫ 17
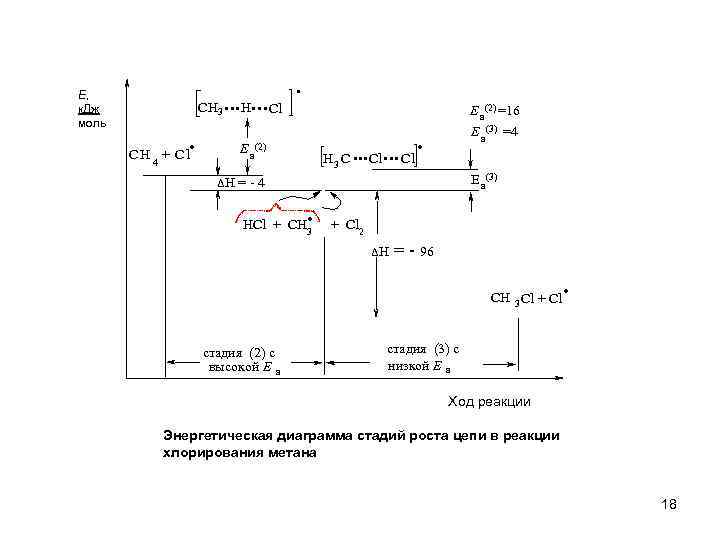 Е, к. Дж моль CH 3 . C H 4 + C l . . . H. . . Cl . E a (2) ΔH = - 4 H 3 C E a(2) =16 . . . Cl. E a(3) =4 E a (3) . HCl + CH 3 + Cl 2 ΔH = - 96 . CH 3 Cl + Cl стадия (2) с высокой Е а стадия (3) с низкой Е а Ход реакции Энергетическая диаграмма стадий роста цепи в реакции хлорирования метана 18
Е, к. Дж моль CH 3 . C H 4 + C l . . . H. . . Cl . E a (2) ΔH = - 4 H 3 C E a(2) =16 . . . Cl. E a(3) =4 E a (3) . HCl + CH 3 + Cl 2 ΔH = - 96 . CH 3 Cl + Cl стадия (2) с высокой Е а стадия (3) с низкой Е а Ход реакции Энергетическая диаграмма стадий роста цепи в реакции хлорирования метана 18
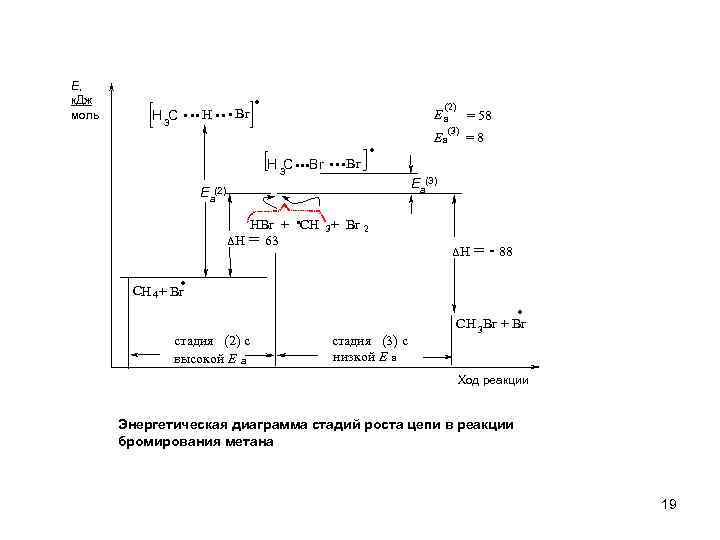 Е, к. Дж моль H 3 C . . . H. . . Br. (2) H 3 C . . . Br Ea = 58 (3) = 8 Ea(3) Ea(2) HBr + CH 3 + Br 2 ΔH = 63 . ΔH = - 88 CH 4 + Br стадия (2) с высокой Е а . стадия (3) с низкой Е а CH 3 Br + Br Ход реакции Энергетическая диаграмма стадий роста цепи в реакции бромирования метана 19
Е, к. Дж моль H 3 C . . . H. . . Br. (2) H 3 C . . . Br Ea = 58 (3) = 8 Ea(3) Ea(2) HBr + CH 3 + Br 2 ΔH = 63 . ΔH = - 88 CH 4 + Br стадия (2) с высокой Е а . стадия (3) с низкой Е а CH 3 Br + Br Ход реакции Энергетическая диаграмма стадий роста цепи в реакции бромирования метана 19
 В свободнорадикальных реакциях углеводородов энергия активации уменьшается с увеличением экзотермичности. В свободнорадикальном процессе реакция образования свободного алкильного радикала является самой медленной, стадией определяющей скорость процесса. Еп, EH-Cl =431 к. Дж моль EH-Br =364 . C H 3 + H Br 75 16 H 3 C -H + C l. H 3 C -H + Br. 4 63 Следовательно, различие в значениях тепловых эффектов Н обусловлено различием в энергиях связей 67 (431 -364) галоген-водород. Реакционная способность галогена по отношению к метану зависит от энергии связи галоген-водород. . C H 3 + HCl Ход реакции 20
В свободнорадикальных реакциях углеводородов энергия активации уменьшается с увеличением экзотермичности. В свободнорадикальном процессе реакция образования свободного алкильного радикала является самой медленной, стадией определяющей скорость процесса. Еп, EH-Cl =431 к. Дж моль EH-Br =364 . C H 3 + H Br 75 16 H 3 C -H + C l. H 3 C -H + Br. 4 63 Следовательно, различие в значениях тепловых эффектов Н обусловлено различием в энергиях связей 67 (431 -364) галоген-водород. Реакционная способность галогена по отношению к метану зависит от энергии связи галоген-водород. . C H 3 + HCl Ход реакции 20
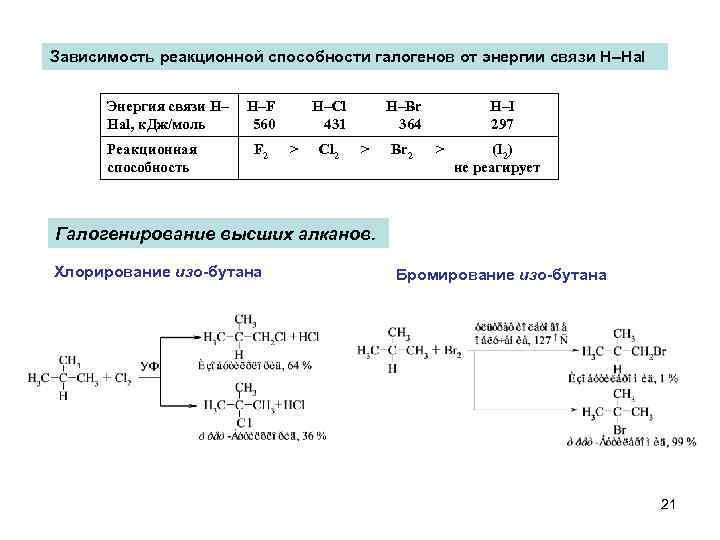 Зависимость реакционной способности галогенов от энергии связи H–Hal Энергия связи H– Hal, к. Дж/моль Реакционная способность H–F 560 F 2 H–Cl 431 > Cl 2 H–Br 364 > Br 2 H–I 297 > (I 2) не реагирует Галогенирование высших алканов. Хлорирование изо-бутана Бромирование изо-бутана 21
Зависимость реакционной способности галогенов от энергии связи H–Hal Энергия связи H– Hal, к. Дж/моль Реакционная способность H–F 560 F 2 H–Cl 431 > Cl 2 H–Br 364 > Br 2 H–I 297 > (I 2) не реагирует Галогенирование высших алканов. Хлорирование изо-бутана Бромирование изо-бутана 21
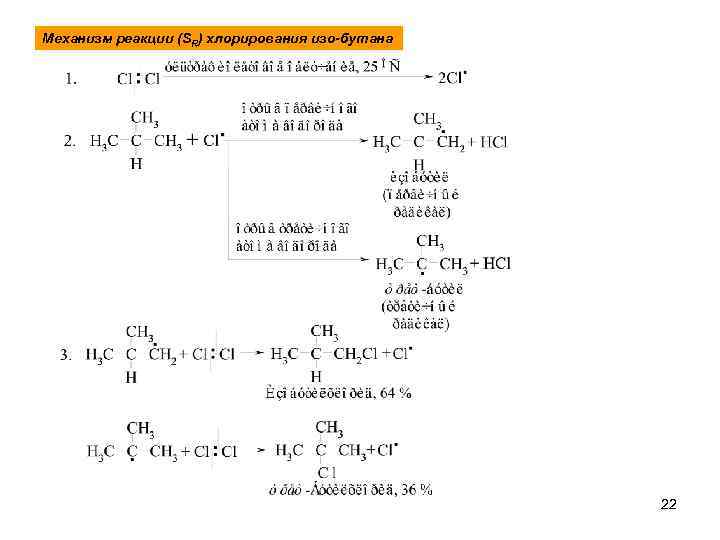 Механизм реакции (SR) хлорирования изо-бутана 22
Механизм реакции (SR) хлорирования изо-бутана 22
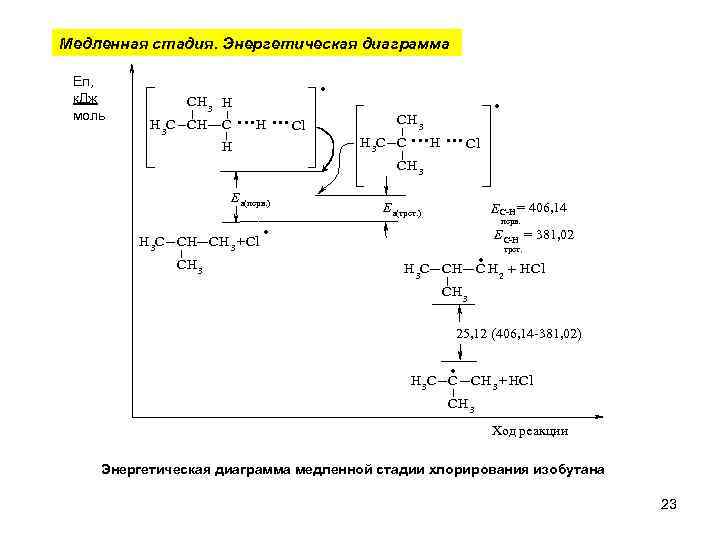 Медленная стадия. Энергетическая диаграмма Еп, к. Дж моль CH 3 H H 3 C CH C . . H. . . Cl CH 3 H 3 C C H . . H. . . Cl CH 3 Е а(перв. ) H 3 C CH CH 3 +Cl CH 3 . Е а(трет. ) ЕС-Н = 406, 14 перв. . Е С-Н = 381, 02 трет. C H 2 + H Cl H 3 C CH CH 3 25, 12 (406, 14 -381, 02) . H 3 C C CH 3 + H Cl CH 3 Ход реакции Энергетическая диаграмма медленной стадии хлорирования изобутана 23
Медленная стадия. Энергетическая диаграмма Еп, к. Дж моль CH 3 H H 3 C CH C . . H. . . Cl CH 3 H 3 C C H . . H. . . Cl CH 3 Е а(перв. ) H 3 C CH CH 3 +Cl CH 3 . Е а(трет. ) ЕС-Н = 406, 14 перв. . Е С-Н = 381, 02 трет. C H 2 + H Cl H 3 C CH CH 3 25, 12 (406, 14 -381, 02) . H 3 C C CH 3 + H Cl CH 3 Ход реакции Энергетическая диаграмма медленной стадии хлорирования изобутана 23
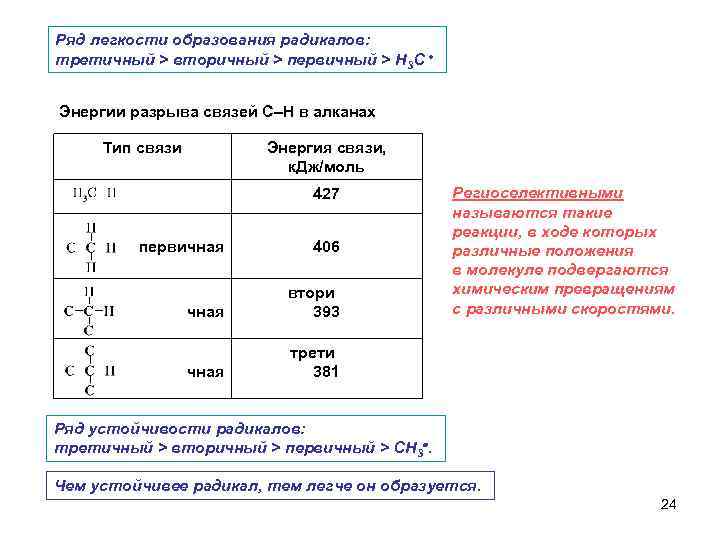 Ряд легкости образования радикалов: третичный > вторичный > первичный > Н 3 С Энергии разрыва связей С–Н в алканах Тип связи Энергия связи, к. Дж/моль 427 первичная 406 чная втори 393 чная Региоселективными называются такие реакции, в ходе которых различные положения в молекуле подвергаются химическим превращениям с различными скоростями. трети 381 Ряд устойчивости радикалов: третичный > вторичный > первичный > СН 3. Чем устойчивее радикал, тем легче он образуется. 24
Ряд легкости образования радикалов: третичный > вторичный > первичный > Н 3 С Энергии разрыва связей С–Н в алканах Тип связи Энергия связи, к. Дж/моль 427 первичная 406 чная втори 393 чная Региоселективными называются такие реакции, в ходе которых различные положения в молекуле подвергаются химическим превращениям с различными скоростями. трети 381 Ряд устойчивости радикалов: третичный > вторичный > первичный > СН 3. Чем устойчивее радикал, тем легче он образуется. 24
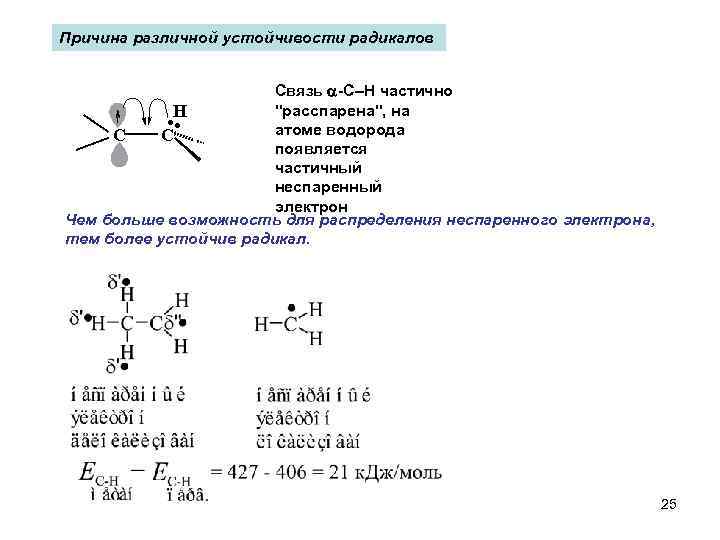 Причина различной устойчивости радикалов Связь -C–H частично "расспарена", на H атоме водорода C C появляется частичный неспаренный электрон Чем больше возможность для распределения неспаренного электрона, тем более устойчив радикал. . . 25
Причина различной устойчивости радикалов Связь -C–H частично "расспарена", на H атоме водорода C C появляется частичный неспаренный электрон Чем больше возможность для распределения неспаренного электрона, тем более устойчив радикал. . . 25
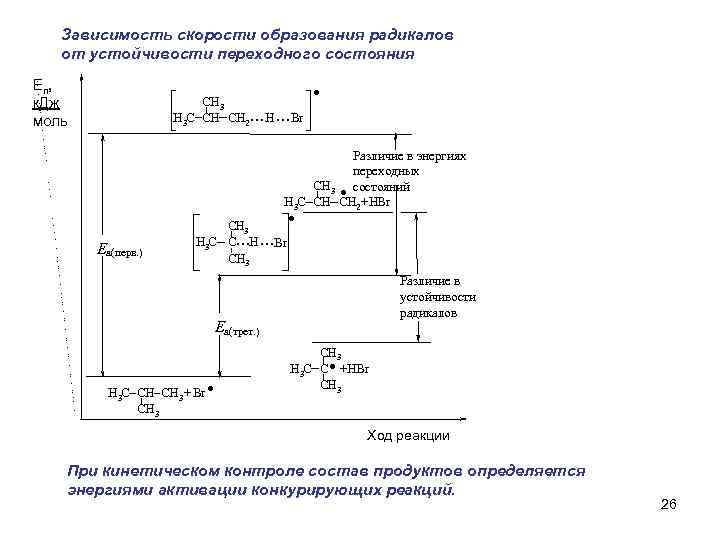 Зависимость скорости образования радикалов от устойчивости переходного состояния Еп, к. Дж моль CH 3 H 3 C CH CH 2 . . . H. . . Br . Различие в энергиях переходных CH 3 состояний H 3 C CH CH 2+ HBr Еа(перв. ) CH 3 H 3 C C H CH 3 . . . . Br Еа(трет. ) . H 3 C CH CH 3 + Br CH 3 Различие в устойчивости радикалов . CH 3 H 3 C C +HBr CH 3 Ход реакции При кинетическом контроле состав продуктов определяется энергиями активации конкурирующих реакций. 26
Зависимость скорости образования радикалов от устойчивости переходного состояния Еп, к. Дж моль CH 3 H 3 C CH CH 2 . . . H. . . Br . Различие в энергиях переходных CH 3 состояний H 3 C CH CH 2+ HBr Еа(перв. ) CH 3 H 3 C C H CH 3 . . . . Br Еа(трет. ) . H 3 C CH CH 3 + Br CH 3 Различие в устойчивости радикалов . CH 3 H 3 C C +HBr CH 3 Ход реакции При кинетическом контроле состав продуктов определяется энергиями активации конкурирующих реакций. 26
 Расчет реакционной способности различных связей С–Н и состава продуктов галогенирования алканов Реакционная способность первичной, вторичной, третичной связей С–Н в алканах: в реакции хлорирования 1: 3, 8: 5, 0; в реакции бромирования 1: 82: 1600 (газ. фаза, 200 ОС, при температуре около 300 ºС соотношение скоростей реакций различных С–Н связей с хлором приближается к 1: 1: 1, т. е. состав продуктов монохлорирования будет соответствовать статистическому распределению. ) Соотношение активности первичных и вторичных С-Н-связей (44/6) : (56/2) = 7, 33 : 28 = 1 : 3, 8. Соотношение активностей первичной и третичной С–Н-связей: (64, 3/9): (35, 7/1) = 7, 1 : 35, 7 = 1 : 5, 0 27
Расчет реакционной способности различных связей С–Н и состава продуктов галогенирования алканов Реакционная способность первичной, вторичной, третичной связей С–Н в алканах: в реакции хлорирования 1: 3, 8: 5, 0; в реакции бромирования 1: 82: 1600 (газ. фаза, 200 ОС, при температуре около 300 ºС соотношение скоростей реакций различных С–Н связей с хлором приближается к 1: 1: 1, т. е. состав продуктов монохлорирования будет соответствовать статистическому распределению. ) Соотношение активности первичных и вторичных С-Н-связей (44/6) : (56/2) = 7, 33 : 28 = 1 : 3, 8. Соотношение активностей первичной и третичной С–Н-связей: (64, 3/9): (35, 7/1) = 7, 1 : 35, 7 = 1 : 5, 0 27
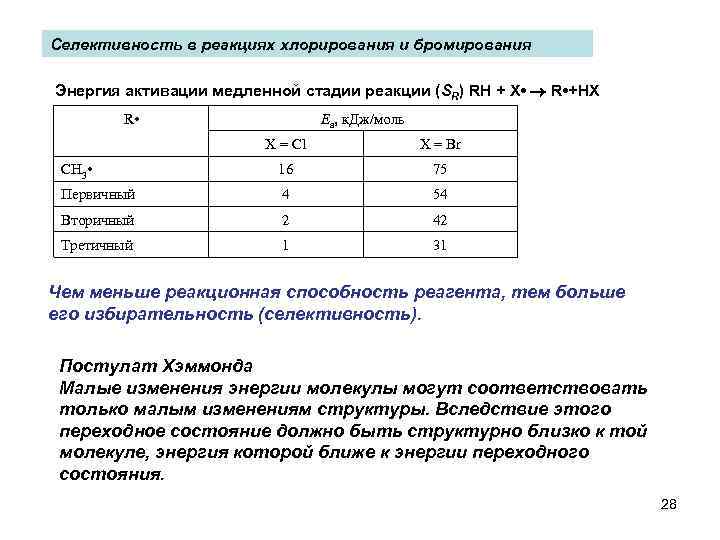 Селективность в реакциях хлорирования и бромирования Энергия активации медленной стадии реакции (SR) RH + Х • R • +HX R • Еа, к. Дж/моль X = Cl X = Br CH 3 • 16 75 Первичный 4 54 Вторичный 2 42 Третичный 1 31 Чем меньше реакционная способность реагента, тем больше его избирательность (селективность). Постулат Хэммонда Малые изменения энергии молекулы могут соответствовать только малым изменениям структуры. Вследствие этого переходное состояние должно быть структурно близко к той молекуле, энергия которой ближе к энергии переходного состояния. 28
Селективность в реакциях хлорирования и бромирования Энергия активации медленной стадии реакции (SR) RH + Х • R • +HX R • Еа, к. Дж/моль X = Cl X = Br CH 3 • 16 75 Первичный 4 54 Вторичный 2 42 Третичный 1 31 Чем меньше реакционная способность реагента, тем больше его избирательность (селективность). Постулат Хэммонда Малые изменения энергии молекулы могут соответствовать только малым изменениям структуры. Вследствие этого переходное состояние должно быть структурно близко к той молекуле, энергия которой ближе к энергии переходного состояния. 28
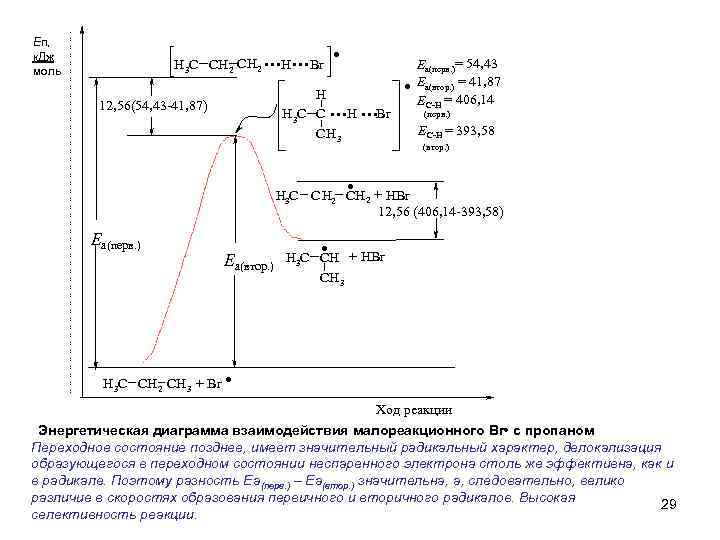 Еп, к. Дж моль H 3 C CH 2 . . H. . . Br H H H 3 C C CH 3 . . . Br 12, 56(54, 43 -41, 87) . . = 54, 43 Еа(перв. ) Еа(втор. ) = 41, 87 ЕС-Н = 406, 14 (перв. ) ЕС-Н = 393, 58 (втор. ) H 3 C CH 2 + HBr 12, 56 (406, 14 -393, 58) Еа(перв. ) H 3 C CH 2 CH 3 + Br . Еа(втор. ) H 3 C CH + HBr CH 3 . Ход реакции Энергетическая диаграмма взаимодействия малореакционного Br • с пропаном Переходное состояние позднее, имеет значительный радикальный характер, делокализация образующегося в переходном состоянии неспаренного электрона столь же эффективна, как и в радикале. Поэтому разность Еа(перв. ) – Еа(втор. ) значительна, а, следовательно, велико различие в скоростях образования первичного и вторичного радикалов. Высокая 29 селективность реакции.
Еп, к. Дж моль H 3 C CH 2 . . H. . . Br H H H 3 C C CH 3 . . . Br 12, 56(54, 43 -41, 87) . . = 54, 43 Еа(перв. ) Еа(втор. ) = 41, 87 ЕС-Н = 406, 14 (перв. ) ЕС-Н = 393, 58 (втор. ) H 3 C CH 2 + HBr 12, 56 (406, 14 -393, 58) Еа(перв. ) H 3 C CH 2 CH 3 + Br . Еа(втор. ) H 3 C CH + HBr CH 3 . Ход реакции Энергетическая диаграмма взаимодействия малореакционного Br • с пропаном Переходное состояние позднее, имеет значительный радикальный характер, делокализация образующегося в переходном состоянии неспаренного электрона столь же эффективна, как и в радикале. Поэтому разность Еа(перв. ) – Еа(втор. ) значительна, а, следовательно, велико различие в скоростях образования первичного и вторичного радикалов. Высокая 29 селективность реакции.
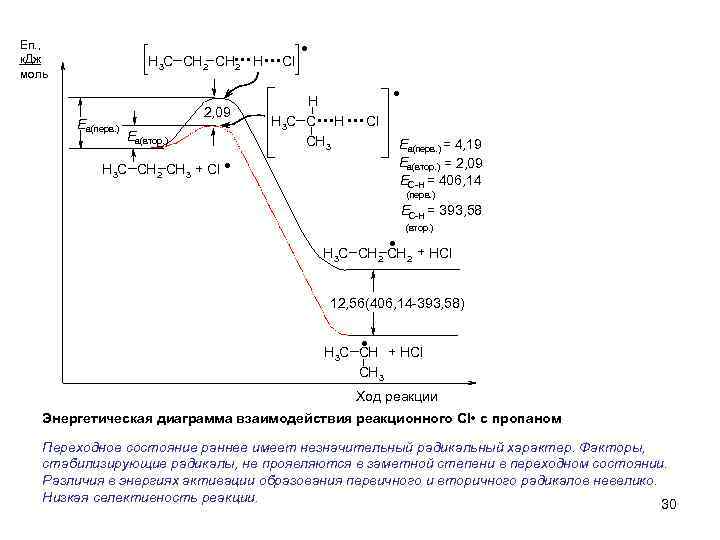 Еп. , к. Дж моль H 3 C CH 2 Еа(перв. ) CH. . . Cl 2 2, 09 Еа(втор. ) H 3 C CH 2 CH 3 + Cl . . H H 3 C C H CH 3 . . . Cl . Еа(перв. ) = 4, 19 Еа(втор. ) = 2, 09 ЕС-Н = 406, 14 (перв. ) . ЕС-Н = 393, 58 (втор. ) H 3 C CH 2 + HCl 12, 56(406, 14 -393, 58) . H 3 C CH + HCl CH 3 Ход реакции Энергетическая диаграмма взаимодействия реакционного Cl • с пропаном Переходное состояние раннее имеет незначительный радикальный характер. Факторы, стабилизирующие радикалы, не проявляются в заметной степени в переходном состоянии. Различия в энергиях активации образования первичного и вторичного радикалов невелико. Низкая селективность реакции. 30
Еп. , к. Дж моль H 3 C CH 2 Еа(перв. ) CH. . . Cl 2 2, 09 Еа(втор. ) H 3 C CH 2 CH 3 + Cl . . H H 3 C C H CH 3 . . . Cl . Еа(перв. ) = 4, 19 Еа(втор. ) = 2, 09 ЕС-Н = 406, 14 (перв. ) . ЕС-Н = 393, 58 (втор. ) H 3 C CH 2 + HCl 12, 56(406, 14 -393, 58) . H 3 C CH + HCl CH 3 Ход реакции Энергетическая диаграмма взаимодействия реакционного Cl • с пропаном Переходное состояние раннее имеет незначительный радикальный характер. Факторы, стабилизирующие радикалы, не проявляются в заметной степени в переходном состоянии. Различия в энергиях активации образования первичного и вторичного радикалов невелико. Низкая селективность реакции. 30
 Влияние факторов, отвечающих за различие в устойчивости переходных состояний, будет сильнее в случае позднего (близкого к конечным продуктам) переходного состояния, т. е. когда реагент малореакционноспоcобен. Нитрование (SR) Жидкофазное нитрование: 10 -20%-ная HNO 3, 150 ОС (М. И. Коновалов, 1888 г. ) Парофазное нитрование: HNO 3(конц. ), 420 -430 ОС (Хесс, 1936 г. ) Механизм нитрования метана азотной кислотой (SR-свободнорадикальный, нецепной) ●NO 2 - Относительно стабильный радикал, его концентрация высока 31
Влияние факторов, отвечающих за различие в устойчивости переходных состояний, будет сильнее в случае позднего (близкого к конечным продуктам) переходного состояния, т. е. когда реагент малореакционноспоcобен. Нитрование (SR) Жидкофазное нитрование: 10 -20%-ная HNO 3, 150 ОС (М. И. Коновалов, 1888 г. ) Парофазное нитрование: HNO 3(конц. ), 420 -430 ОС (Хесс, 1936 г. ) Механизм нитрования метана азотной кислотой (SR-свободнорадикальный, нецепной) ●NO 2 - Относительно стабильный радикал, его концентрация высока 31
 Сульфоокисление (SR) В реакциях сульфоокисления и сульфохлорирования замещению не подвергаются атомы водорода при третичном углероде из-за пространственных затруднений для подхода реагента с большим объемом. Cульфохлорирование (SR) Механизм сульфохлорирования (SR радикально цепной) 32
Сульфоокисление (SR) В реакциях сульфоокисления и сульфохлорирования замещению не подвергаются атомы водорода при третичном углероде из-за пространственных затруднений для подхода реагента с большим объемом. Cульфохлорирование (SR) Механизм сульфохлорирования (SR радикально цепной) 32
 Окисление Сгорание – в присутствии большого избытка кислорода Контролируемое окисление Инициатор Термическое разложение алканов, крекинг 33
Окисление Сгорание – в присутствии большого избытка кислорода Контролируемое окисление Инициатор Термическое разложение алканов, крекинг 33
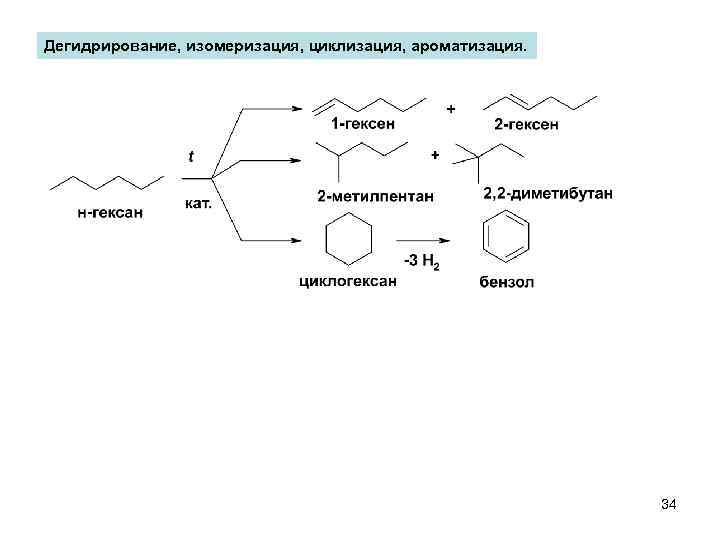 Дегидрирование, изомеризация, циклизация, ароматизация. 34
Дегидрирование, изомеризация, циклизация, ароматизация. 34
 Ионные реакции алканов Реакции алканов с электрофильными реагентами: протоном H+, карбокатионами CH 3+ и др. , ионом нитрония NO 2+. Электрофильное алкилирование 35
Ионные реакции алканов Реакции алканов с электрофильными реагентами: протоном H+, карбокатионами CH 3+ и др. , ионом нитрония NO 2+. Электрофильное алкилирование 35


