 АЛКАНЫ Cn. H 2 n+2 Алехина Е. А.
АЛКАНЫ Cn. H 2 n+2 Алехина Е. А.
 Содержание • • • Строение алканов Физические свойства алканов Химические свойства алканов Синтез алканов Экологические последствия Литература Алехина Е. А.
Содержание • • • Строение алканов Физические свойства алканов Химические свойства алканов Синтез алканов Экологические последствия Литература Алехина Е. А.
 Строение алканов 3 p 1 s гибр-я выравнивание формы и энергии C 2 s ↑↓ C* 2 px 2 py 2 pz ↑ ↑ 2 s ↑ sp 3 - гибридизация 2 px 2 py 2 pz ↑ ↑ ↑ Л. Полинг считает, что в реакциях атом углерода возбуждается, и его конформация меняется. 1929 -1932 гг. Л. Полинг создает теорию гибридизации. Алехина Е. А.
Строение алканов 3 p 1 s гибр-я выравнивание формы и энергии C 2 s ↑↓ C* 2 px 2 py 2 pz ↑ ↑ 2 s ↑ sp 3 - гибридизация 2 px 2 py 2 pz ↑ ↑ ↑ Л. Полинг считает, что в реакциях атом углерода возбуждается, и его конформация меняется. 1929 -1932 гг. Л. Полинг создает теорию гибридизации. Алехина Е. А.
 Строение алканов Параметры молекул алканов 109° 28’ 0, 154 нм 0, 244 нм Алехина Е. А. 0, 11 нм
Строение алканов Параметры молекул алканов 109° 28’ 0, 154 нм 0, 244 нм Алехина Е. А. 0, 11 нм
 Строение алканов С-С связь Есв = 0, 348 к. Дж/моль μ(дип. момент) = 0 Н 3 С–СН 3 - max С-Н связь Есв = 415 к. Дж/моль μ(дип. момент) = 0, 4 Н–СН 3 - max Наименее прочная связь у третичного атома углерода, что делает эту связь наиболее уязвимой при химических реакциях. Алехина Е. А.
Строение алканов С-С связь Есв = 0, 348 к. Дж/моль μ(дип. момент) = 0 Н 3 С–СН 3 - max С-Н связь Есв = 415 к. Дж/моль μ(дип. момент) = 0, 4 Н–СН 3 - max Наименее прочная связь у третичного атома углерода, что делает эту связь наиболее уязвимой при химических реакциях. Алехина Е. А.
 Изомерия алканов Структурная Углеродного скелета Пространственная Конформационная
Изомерия алканов Структурная Углеродного скелета Пространственная Конформационная
 Конформационная изомерия алканов. Энергетические барьеры вращения СН 3– группы по связи –С 2–С 3–, проекции Ньюмена для четырех различных конформеров Простая σ-связь допускает вращение окружающих ее атомных группировок. Молекулы органических соединений благодаря тепловому движению непрерывно меняют свою форму. Отдельные состояния, через которые проходят эти молекулы, получили название конформацией. Изомеры, возникающие при вращении по σ-связи называются поворотными изомерами или конформерами. Конформеры имеют одну и ту же структурную форму, но разную устойчивость. Некоторые энергетически более выгодны. В таких состояниях молекулы пребывают большое время. Следовательно, вращение не свободное, оно заторможено в предпочтительных состояниях. Алехина Е. А.
Конформационная изомерия алканов. Энергетические барьеры вращения СН 3– группы по связи –С 2–С 3–, проекции Ньюмена для четырех различных конформеров Простая σ-связь допускает вращение окружающих ее атомных группировок. Молекулы органических соединений благодаря тепловому движению непрерывно меняют свою форму. Отдельные состояния, через которые проходят эти молекулы, получили название конформацией. Изомеры, возникающие при вращении по σ-связи называются поворотными изомерами или конформерами. Конформеры имеют одну и ту же структурную форму, но разную устойчивость. Некоторые энергетически более выгодны. В таких состояниях молекулы пребывают большое время. Следовательно, вращение не свободное, оно заторможено в предпочтительных состояниях. Алехина Е. А.
 Конформационная изомерия этана а б Заторможенный конформер в г Заслоненный конформер а, в – перспективные формы; б, г – проекционные формы Ньюмена. Алехина Е. А.
Конформационная изомерия этана а б Заторможенный конформер в г Заслоненный конформер а, в – перспективные формы; б, г – проекционные формы Ньюмена. Алехина Е. А.
 Конформационная изомерия этана
Конформационная изомерия этана
 Конформационная изомерия бутана Трансоидный конформер с min содержанием энергии Цисоидный конформер с max содержанием энергии Частично заторможенный конформер Частично заслоненный конформер Алехина Е. А.
Конформационная изомерия бутана Трансоидный конформер с min содержанием энергии Цисоидный конформер с max содержанием энергии Частично заторможенный конформер Частично заслоненный конформер Алехина Е. А.
 Конформационная изомерия бутана
Конформационная изомерия бутана
 Физические свойства алканов Первые четыре члена гомологического ряда алканов в нормальных условиях являются газами, От пентана до пентадекана – жидкостями, Начиная с гексадекана – твердые вещества. Для бытовых целей обычно используют пропанбутановую смесь, которая легко сжижается при небольших давлениях. Газообразные и твердые алканы не имеют запаха, жидкие имеют характерный бензино-керосиновый запах. Запах бытового газа связан с очень малыми добавками серосодержащих соединений, которые специально вводят для обнаружения утечки газа. Высокая летучесть и испаряемость жидких алканов приводит к образованию взрывоопасных концентраций их паров в закрытых помещениях. Алехина Е. А.
Физические свойства алканов Первые четыре члена гомологического ряда алканов в нормальных условиях являются газами, От пентана до пентадекана – жидкостями, Начиная с гексадекана – твердые вещества. Для бытовых целей обычно используют пропанбутановую смесь, которая легко сжижается при небольших давлениях. Газообразные и твердые алканы не имеют запаха, жидкие имеют характерный бензино-керосиновый запах. Запах бытового газа связан с очень малыми добавками серосодержащих соединений, которые специально вводят для обнаружения утечки газа. Высокая летучесть и испаряемость жидких алканов приводит к образованию взрывоопасных концентраций их паров в закрытых помещениях. Алехина Е. А.
 Химические свойства алканов Ионные реакции Радикальные реакции Алехина Е. А.
Химические свойства алканов Ионные реакции Радикальные реакции Алехина Е. А.
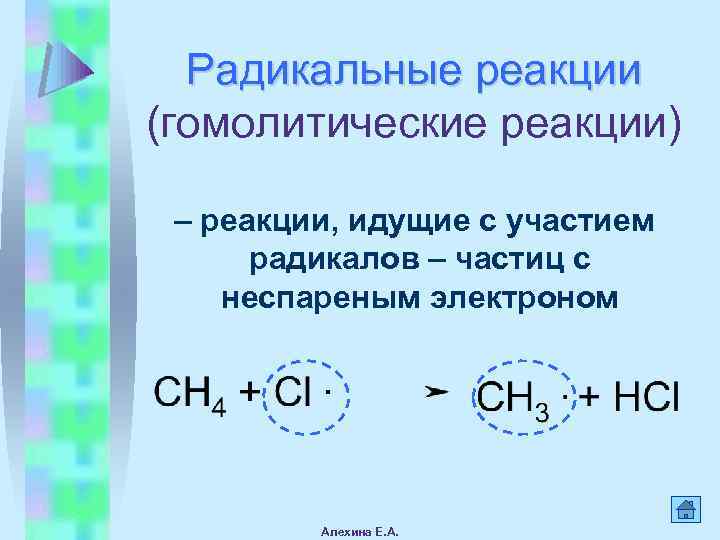 Радикальные реакции (гомолитические реакции) – реакции, идущие с участием радикалов – частиц с неспареным электроном Алехина Е. А.
Радикальные реакции (гомолитические реакции) – реакции, идущие с участием радикалов – частиц с неспареным электроном Алехина Е. А.
 Радикальные реакции имеют цепной характер Стадии цепных реакций 1. Инициирование (зарождение) цепи 2. Рост (продолжение)цепи 3. Обрыв (элонгация) цепи Алехина Е. А.
Радикальные реакции имеют цепной характер Стадии цепных реакций 1. Инициирование (зарождение) цепи 2. Рост (продолжение)цепи 3. Обрыв (элонгация) цепи Алехина Е. А.
 Типы реакций радикального замещения SR галогенирование нитрование сульфохлорирование окисление сульфоокисление Алехина Е. А.
Типы реакций радикального замещения SR галогенирование нитрование сульфохлорирование окисление сульфоокисление Алехина Е. А.
 SR Галогенирование Алканы взаимодействуют со всеми Hal. Скорость реакции возрастает от I к F. F > CI > Br > I F и CI – наиболее практическое значение. Реакция с фтором (F 2) энергетически выгодна. CH 4 + 4 F 2 → CF 4 + 4 HF N 2 Алехина Е. А.
SR Галогенирование Алканы взаимодействуют со всеми Hal. Скорость реакции возрастает от I к F. F > CI > Br > I F и CI – наиболее практическое значение. Реакция с фтором (F 2) энергетически выгодна. CH 4 + 4 F 2 → CF 4 + 4 HF N 2 Алехина Е. А.
 SR Галогенирование Хлор реагируют с алканами на свету, t (300 °С) или Kat. Реакция идет последовательно: +CI 2 -HCI CH 4 + CI 2 → CH 3 CI → CH 2 CI 2 → CHCI 3 → CCI 4 -HCI энергетически реакция менее выгодна, чем со F 2 CH 4 + CI 2 – скорость меньше, чем при реакции – СН(СН 3)2 + Cl 2 Kat: S, I 2, Cu. CI 2, Sb. CI 2, Sn. CI 2, AICI 3 и др. Катализаторы – это вещества, которые при реакции образуют свободные радикалы. Алехина Е. А.
SR Галогенирование Хлор реагируют с алканами на свету, t (300 °С) или Kat. Реакция идет последовательно: +CI 2 -HCI CH 4 + CI 2 → CH 3 CI → CH 2 CI 2 → CHCI 3 → CCI 4 -HCI энергетически реакция менее выгодна, чем со F 2 CH 4 + CI 2 – скорость меньше, чем при реакции – СН(СН 3)2 + Cl 2 Kat: S, I 2, Cu. CI 2, Sb. CI 2, Sn. CI 2, AICI 3 и др. Катализаторы – это вещества, которые при реакции образуют свободные радикалы. Алехина Е. А.
 SR Галогенирование Инициирование hν Рост цепи Обрыв цепи Механизм хлорирования метана предложен Н. Н. Семеновым Алехина Е. А.
SR Галогенирование Инициирование hν Рост цепи Обрыв цепи Механизм хлорирования метана предложен Н. Н. Семеновым Алехина Е. А.
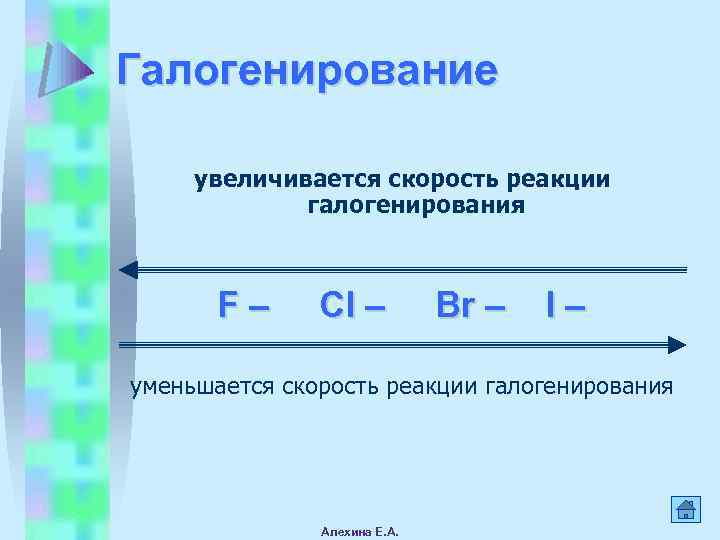 Галогенирование увеличивается скорость реакции галогенирования F– Cl – Br – I– уменьшается скорость реакции галогенирования Алехина Е. А.
Галогенирование увеличивается скорость реакции галогенирования F– Cl – Br – I– уменьшается скорость реакции галогенирования Алехина Е. А.
 Галогенирование ГАЛОГЕНИРОВАНИЕ ВЫСШИХ АЛКАНОВ Алехина Е. А.
Галогенирование ГАЛОГЕНИРОВАНИЕ ВЫСШИХ АЛКАНОВ Алехина Е. А.
 Галогенирование ГАЛОГЕНИРОВАНИЕ ВЫСШИХ АЛКАНОВ увеличивается легкость образования радикалов Третичный радикал Вторичный радикал Первичный радикал СН 3 увеличивается устойчивость радикалов Чем устойчивее радикал, тем легче он образуется! Алехина Е. А.
Галогенирование ГАЛОГЕНИРОВАНИЕ ВЫСШИХ АЛКАНОВ увеличивается легкость образования радикалов Третичный радикал Вторичный радикал Первичный радикал СН 3 увеличивается устойчивость радикалов Чем устойчивее радикал, тем легче он образуется! Алехина Е. А.
 Галогенирование h۷ 29% 48% 99% 1% h۷ Алехина Е. А.
Галогенирование h۷ 29% 48% 99% 1% h۷ Алехина Е. А.
 Галогенирование Йодирование практически неосуществимо даже при повышенной температуре. Каталитическое галогенирование цепному ионному механизму: идет CI : CI + AICI 3 → AICI 4‾ + CI+ + H : CH 3 → CH 3+ + HCI CH 3+ + CI : CI → CI : CH 3 + CI+ Алехина Е. А. по
Галогенирование Йодирование практически неосуществимо даже при повышенной температуре. Каталитическое галогенирование цепному ионному механизму: идет CI : CI + AICI 3 → AICI 4‾ + CI+ + H : CH 3 → CH 3+ + HCI CH 3+ + CI : CI → CI : CH 3 + CI+ Алехина Е. А. по
 Нитрование М. И. Коновалов (1858– 1906) Реакции нитрования впервые разработал Михаил Иванович Коновалов в 1888 г. и нитровал разбавленной азотной кислотой при температуре 100 °С. Алехина Е. А.
Нитрование М. И. Коновалов (1858– 1906) Реакции нитрования впервые разработал Михаил Иванович Коновалов в 1888 г. и нитровал разбавленной азотной кислотой при температуре 100 °С. Алехина Е. А.
 Нитрование парофазное жидкофазное (t = 250 -500 °С, > υ реакции ) (t ≤ 100 °С, < υ реакции ) Реакция протекает по свободнорадикальному цепному механизму. При этом образуется смесь продуктов. Алехина Е. А.
Нитрование парофазное жидкофазное (t = 250 -500 °С, > υ реакции ) (t ≤ 100 °С, < υ реакции ) Реакция протекает по свободнорадикальному цепному механизму. При этом образуется смесь продуктов. Алехина Е. А.
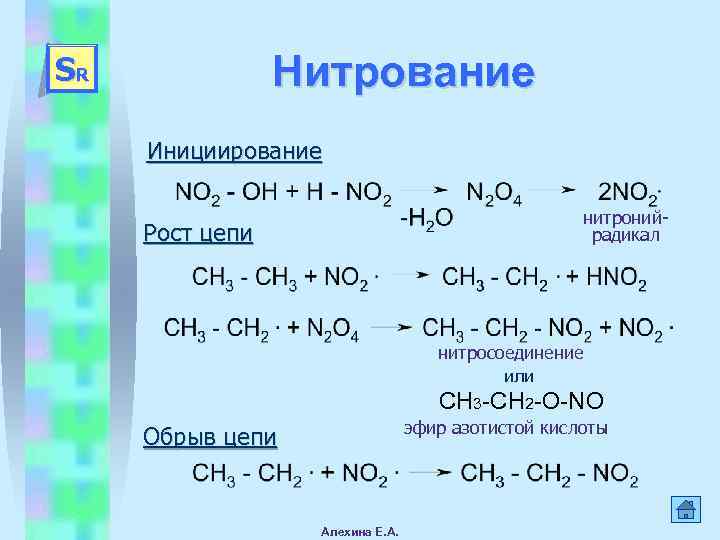 Нитрование SR Инициирование нитронийрадикал Рост цепи нитросоединение или СH 3 -СН 2 -О-NO эфир азотистой кислоты Обрыв цепи Алехина Е. А.
Нитрование SR Инициирование нитронийрадикал Рост цепи нитросоединение или СH 3 -СН 2 -О-NO эфир азотистой кислоты Обрыв цепи Алехина Е. А.
 Нитрование HNO 3 t °C Наиболее легко разрывается C–H связь у максимально замещенного атома, следовательно, у варианта г), выход больше. Алехина Е. А.
Нитрование HNO 3 t °C Наиболее легко разрывается C–H связь у максимально замещенного атома, следовательно, у варианта г), выход больше. Алехина Е. А.
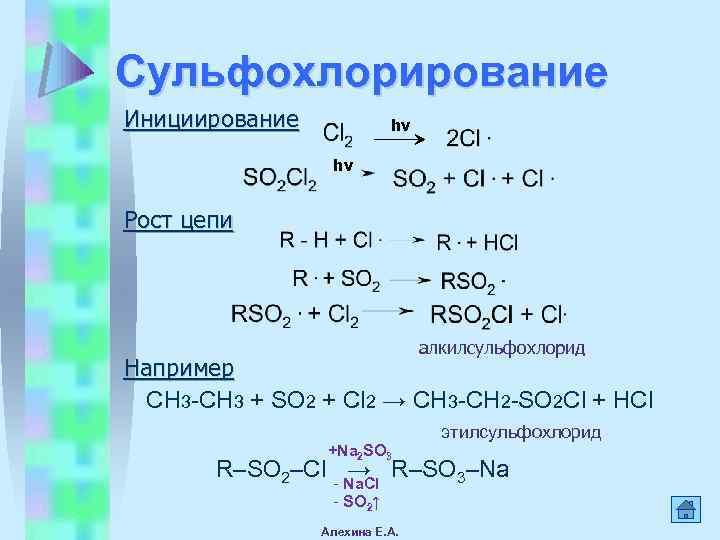 Сульфохлорирование Инициирование hν hν Рост цепи алкилсульфохлорид Например СН 3 -СH 3 + SO 2 + Cl 2 → СН 3 -СН 2 -SO 2 Cl + HCl этилсульфохлорид +Na 2 SO 3 R–SO 2–CI → R–SO 3–Na - Na. CI - SO 2↑ Алехина Е. А.
Сульфохлорирование Инициирование hν hν Рост цепи алкилсульфохлорид Например СН 3 -СH 3 + SO 2 + Cl 2 → СН 3 -СН 2 -SO 2 Cl + HCl этилсульфохлорид +Na 2 SO 3 R–SO 2–CI → R–SO 3–Na - Na. CI - SO 2↑ Алехина Е. А.
 Сульфоокисление I способ t R-H + НО-SO 3 Н → R-SO 3 H + H 2 O алкилсульфокислота II способ t 2 R-H + 2 SO 2 + O 2 → 2 R-SO 3 H алкилсульфокислота Например t 2 СН 3 -СH 3 + 2 SO 2 + O 2 → 2 СН 3 -СН 2 -SO 3 H этилсульфокислота Алехина Е. А.
Сульфоокисление I способ t R-H + НО-SO 3 Н → R-SO 3 H + H 2 O алкилсульфокислота II способ t 2 R-H + 2 SO 2 + O 2 → 2 R-SO 3 H алкилсульфокислота Например t 2 СН 3 -СH 3 + 2 SO 2 + O 2 → 2 СН 3 -СН 2 -SO 3 H этилсульфокислота Алехина Е. А.
 Окисление Инициирование О=О → О – О Рост цепи R-H + О – О → R + HО – О R + O 2 → R-О-O R-H + R-О-O → [R-О-OН] + R R-O-H [O] R(c-1)-COOH Алехина Е. А.
Окисление Инициирование О=О → О – О Рост цепи R-H + О – О → R + HО – О R + O 2 → R-О-O R-H + R-О-O → [R-О-OН] + R R-O-H [O] R(c-1)-COOH Алехина Е. А.
![Окисление Например (СН 3)3 СН + О 2 → [(СН 3)3 С-О-О-Н] → (СН Окисление Например (СН 3)3 СН + О 2 → [(СН 3)3 С-О-О-Н] → (СН](https://present5.com/presentation/93156842_163220550/image-32.jpg) Окисление Например (СН 3)3 СН + О 2 → [(СН 3)3 С-О-О-Н] → (СН 3)3 С-ОН изобутан гидроперекись изобутана третбутанол СН 3 -СН 2 -СН 3 + О 2 → [СН 3 -СН(OOH)-СН 2 -СН 3] н –бутан гидроперекись вторбутана → СН 3 -СO-СН 2 -СН 3 + H 2 O бутанон Алехина Е. А.
Окисление Например (СН 3)3 СН + О 2 → [(СН 3)3 С-О-О-Н] → (СН 3)3 С-ОН изобутан гидроперекись изобутана третбутанол СН 3 -СН 2 -СН 3 + О 2 → [СН 3 -СН(OOH)-СН 2 -СН 3] н –бутан гидроперекись вторбутана → СН 3 -СO-СН 2 -СН 3 + H 2 O бутанон Алехина Е. А.
 Расщепление алканов Это реакции, осуществляющиеся благодаря разрыву С–С связей, при этом из высокомолекулярных углеводородов образуется смесь низкомолекулярных углеводородов. Термический крекинг а) жидкофазный для тяжелого сырья (мазута): t = 470 -490 °С, р = 20 -60 атм – легкий; t = 530 -550 °С, р = 20 -60 атм – глубокий для газойля и соляровой фракции. б) парофазный: t = 600 -620 °С, атмосферное давление. Алехина Е. А.
Расщепление алканов Это реакции, осуществляющиеся благодаря разрыву С–С связей, при этом из высокомолекулярных углеводородов образуется смесь низкомолекулярных углеводородов. Термический крекинг а) жидкофазный для тяжелого сырья (мазута): t = 470 -490 °С, р = 20 -60 атм – легкий; t = 530 -550 °С, р = 20 -60 атм – глубокий для газойля и соляровой фракции. б) парофазный: t = 600 -620 °С, атмосферное давление. Алехина Е. А.
 Термический крекинг Свободные радикалы, образующиеся при термокрекинге, способны к следующим основным химическим превращениям: 1. Распад радикала: β α R–CH 2 • → R • + CH 2=CH 2 2. Реакция диспропорционирования: β α 2 R–CH 2 • → R–CH=CH 2 + R–CH 2–CH 3 3. Соединение радикалов: R–CH 2 • + • CH 2–R → R–(CH 2)4–R Такая закономерность преобразования радикалов получила название β-правило стабилизации. Алехина Е. А.
Термический крекинг Свободные радикалы, образующиеся при термокрекинге, способны к следующим основным химическим превращениям: 1. Распад радикала: β α R–CH 2 • → R • + CH 2=CH 2 2. Реакция диспропорционирования: β α 2 R–CH 2 • → R–CH=CH 2 + R–CH 2–CH 3 3. Соединение радикалов: R–CH 2 • + • CH 2–R → R–(CH 2)4–R Такая закономерность преобразования радикалов получила название β-правило стабилизации. Алехина Е. А.
 Термический крекинг В процессе крекинга могут образовываться пер-, втор-, трет- радикалы: > > Устойчивость Это объясняется способностью С–С связей участвовать в делокализации валентного электрона. Алехина Е. А.
Термический крекинг В процессе крекинга могут образовываться пер-, втор-, трет- радикалы: > > Устойчивость Это объясняется способностью С–С связей участвовать в делокализации валентного электрона. Алехина Е. А.
 Термический крекинг При термокрекинге образуются углеводороды как с такой же длиной связи, так и с укороченной. С –Н СН 3–СН 2–СН 2 • → СН 3–СН 2–СН 3 + СН 2=СН 2 СН 3–СН 2–СН=СН 2 –С а) СН 4 + СН 3–СН 2–СН=СН 2 б) СН 3–СН 2 • → СН 2=СН 2 + СН 3–СН=СН 2 СН 3–СН 2–СН 3 С Алехина Е. А.
Термический крекинг При термокрекинге образуются углеводороды как с такой же длиной связи, так и с укороченной. С –Н СН 3–СН 2–СН 2 • → СН 3–СН 2–СН 3 + СН 2=СН 2 СН 3–СН 2–СН=СН 2 –С а) СН 4 + СН 3–СН 2–СН=СН 2 б) СН 3–СН 2 • → СН 2=СН 2 + СН 3–СН=СН 2 СН 3–СН 2–СН 3 С Алехина Е. А.
 Пиролиз t = 650 -700 °С, атмосферное давление приводят к образованию ароматических углеводородов с выходом 15%, газообразные алканы и алкены. Основными процессами при крекинге и пиролизе являются: 1. дегидрогенизация; 2. разрыв С–С связи; 3. промежуточные продукты R; 4. механизм ЕR. Алехина Е. А.
Пиролиз t = 650 -700 °С, атмосферное давление приводят к образованию ароматических углеводородов с выходом 15%, газообразные алканы и алкены. Основными процессами при крекинге и пиролизе являются: 1. дегидрогенизация; 2. разрыв С–С связи; 3. промежуточные продукты R; 4. механизм ЕR. Алехина Е. А.
 Каталитический крекинг t = 450 -500 °C Kat: AICI 3, Cr 2 O 3, Mo. S и алюмосиликаты. Крекинг протекает по гетеролитическому ионному механизму, через стадию образования карбоновых катионов. Наблюдается процесс изомеризации: Пример: или Преимущества: высокий выход бензинов и их высокое октановое число. Алехина Е. А.
Каталитический крекинг t = 450 -500 °C Kat: AICI 3, Cr 2 O 3, Mo. S и алюмосиликаты. Крекинг протекает по гетеролитическому ионному механизму, через стадию образования карбоновых катионов. Наблюдается процесс изомеризации: Пример: или Преимущества: высокий выход бензинов и их высокое октановое число. Алехина Е. А.
 Риформинг Процессы каталитического крекинга с одновременным каталитическим облагораживанием низкооктано-вых бензинов с использованием катализаторов: Гидроформинг Платформинг Каталитический крекинг в присутствии водорода, t = 350 -450 °С, р = 30 -140 атм, Kat: Mo, Ni. Каталитический крекинг, осуществляющийся с помощью Pd, Pt на алюмосиликатах. Алехина Е. А.
Риформинг Процессы каталитического крекинга с одновременным каталитическим облагораживанием низкооктано-вых бензинов с использованием катализаторов: Гидроформинг Платформинг Каталитический крекинг в присутствии водорода, t = 350 -450 °С, р = 30 -140 атм, Kat: Mo, Ni. Каталитический крекинг, осуществляющийся с помощью Pd, Pt на алюмосиликатах. Алехина Е. А.
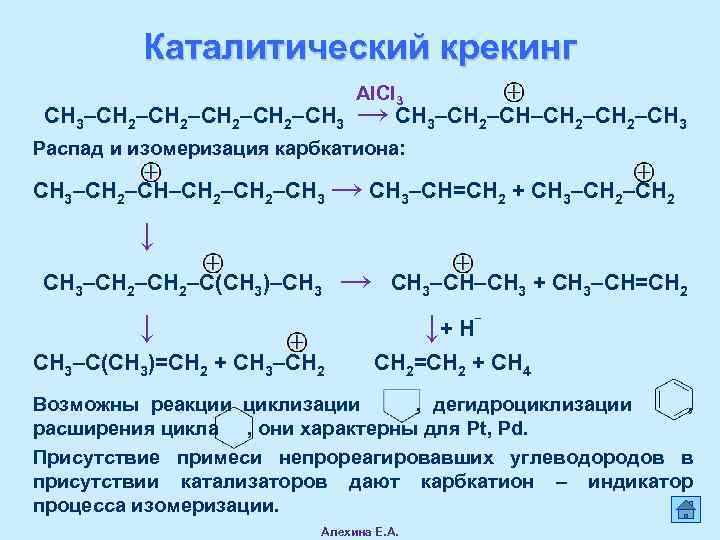 Каталитический крекинг СН 3–СН 2–СН 3 AICI 3 → СН 3–СН 2–СН 3 Распад и изомеризация карбкатиона: СН 3–СН 2–СН 3 → СН 3–СН=СН 2 + СН 3–СН 2 ↓ СН 3–СН 2–С(СН 3)–СН 3 → СН 3–СН–СН 3 + СН 3–СН=СН 2 ↓ ↓+ Н‾ СН 3–С(СН 3)=СН 2 + СН 3–СН 2=СН 2 + СН 4 Возможны реакции циклизации , дегидроциклизации , расширения цикла , они характерны для Pt, Pd. Присутствие примеси непрореагировавших углеводородов в присутствии катализаторов дают карбкатион – индикатор процесса изомеризации. Алехина Е. А.
Каталитический крекинг СН 3–СН 2–СН 3 AICI 3 → СН 3–СН 2–СН 3 Распад и изомеризация карбкатиона: СН 3–СН 2–СН 3 → СН 3–СН=СН 2 + СН 3–СН 2 ↓ СН 3–СН 2–С(СН 3)–СН 3 → СН 3–СН–СН 3 + СН 3–СН=СН 2 ↓ ↓+ Н‾ СН 3–С(СН 3)=СН 2 + СН 3–СН 2=СН 2 + СН 4 Возможны реакции циклизации , дегидроциклизации , расширения цикла , они характерны для Pt, Pd. Присутствие примеси непрореагировавших углеводородов в присутствии катализаторов дают карбкатион – индикатор процесса изомеризации. Алехина Е. А.
 Синтез алканов 1. Лабораторные методы Реакция Дюма (1831) Ж. Б. А. Дюма (1800 – 1884) Укорочение углеродной цепи при нагревании солей карбоновых кислот (щелочного или щелочно-земельного металла) с гидроксидами натрия, бария, натронной известью (Na. OH + Ca. O), алкоголятами натрия идет отщепление СО 2 с образованием алкана, соединяющего на один атом углерода меньше, чем исходная кислота. CH 3 COONa + Na. OH → CH 4 + Na 2 CO 3 Алехина Е. А.
Синтез алканов 1. Лабораторные методы Реакция Дюма (1831) Ж. Б. А. Дюма (1800 – 1884) Укорочение углеродной цепи при нагревании солей карбоновых кислот (щелочного или щелочно-земельного металла) с гидроксидами натрия, бария, натронной известью (Na. OH + Ca. O), алкоголятами натрия идет отщепление СО 2 с образованием алкана, соединяющего на один атом углерода меньше, чем исходная кислота. CH 3 COONa + Na. OH → CH 4 + Na 2 CO 3 Алехина Е. А.
 Лабораторные методы Реакция Кольбе (1849) А. В. Г. Кольбе (1818 -1884) Позволяет получить симметричные алканы через промежуточное образование радикалов электролизом натриевых или калиевых солей карбоновых кислот. CH 3 CH 2 COONa ⇄ CH 3 CH 2 COO‾ + Na+ CH 3 CH 2 COO‾ - e → CH 3 CH 2 CH 2 COO • → CH 3 CH 2 • + CO 2 CH 3 CH 2 • + CH 3 CH 2 • → CH 3(CH 2)4 CH 3 ∑: СH 3 COONa + Na. OH → CH 4 + Na 2 CO 3 Алехина Е. А.
Лабораторные методы Реакция Кольбе (1849) А. В. Г. Кольбе (1818 -1884) Позволяет получить симметричные алканы через промежуточное образование радикалов электролизом натриевых или калиевых солей карбоновых кислот. CH 3 CH 2 COONa ⇄ CH 3 CH 2 COO‾ + Na+ CH 3 CH 2 COO‾ - e → CH 3 CH 2 CH 2 COO • → CH 3 CH 2 • + CO 2 CH 3 CH 2 • + CH 3 CH 2 • → CH 3(CH 2)4 CH 3 ∑: СH 3 COONa + Na. OH → CH 4 + Na 2 CO 3 Алехина Е. А.
 Лабораторные методы Реакция Вюрца (1855) реакция с изменением углеродного скелета. Ш. А. Вюрц (1817 - 1884) реакционная способность натрийорганических соединений затрудняют исследование механизма реакции, SN 2 возможен радикальный механизм, через (C 2 H 5)‾Na + C 2 H 5 -Br -Na. Br C 2 H 5–C 2 аниона. → промежуточное образование H 5 Если R ≠ R 1 , то смесь производств: R-R; R∑ CH 3 CH 1; -Br-R 12 Na + Br-CH 2 CH 3 → C 2 H 5–C 2 H 5 + 2 Na. Br R 2 R 1 + – трудно разделить. Исключительно C 2 H 5 Br + 2 Na → (C 2 H 5)‾Na+высокая + Na. Br Побочная реакция: E 2 C 2 H 5 Na + HCH 2 Br → C 2 H 6 + C 2 H 4 + Na. Br Алехина Е. А.
Лабораторные методы Реакция Вюрца (1855) реакция с изменением углеродного скелета. Ш. А. Вюрц (1817 - 1884) реакционная способность натрийорганических соединений затрудняют исследование механизма реакции, SN 2 возможен радикальный механизм, через (C 2 H 5)‾Na + C 2 H 5 -Br -Na. Br C 2 H 5–C 2 аниона. → промежуточное образование H 5 Если R ≠ R 1 , то смесь производств: R-R; R∑ CH 3 CH 1; -Br-R 12 Na + Br-CH 2 CH 3 → C 2 H 5–C 2 H 5 + 2 Na. Br R 2 R 1 + – трудно разделить. Исключительно C 2 H 5 Br + 2 Na → (C 2 H 5)‾Na+высокая + Na. Br Побочная реакция: E 2 C 2 H 5 Na + HCH 2 Br → C 2 H 6 + C 2 H 4 + Na. Br Алехина Е. А.
 Лабораторные методы Реакция Клемменсена (1913) Восстановление карбонильной группы альдегидов или кетонов до метиловой под действием амальгаммы Zn и HCI(конц). Применяется для получения алканов из жирно-ароматических кетонов. Алехина Е. А.
Лабораторные методы Реакция Клемменсена (1913) Восстановление карбонильной группы альдегидов или кетонов до метиловой под действием амальгаммы Zn и HCI(конц). Применяется для получения алканов из жирно-ароматических кетонов. Алехина Е. А.
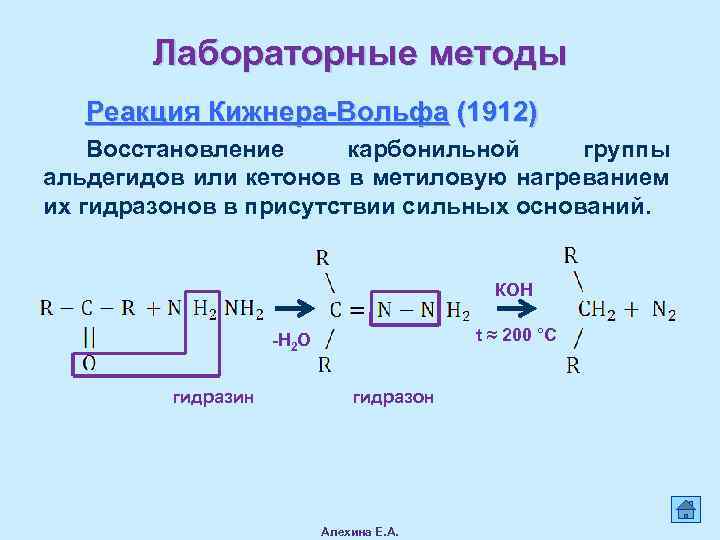 Лабораторные методы Реакция Кижнера-Вольфа (1912) Восстановление карбонильной группы альдегидов или кетонов в метиловую нагреванием их гидразонов в присутствии сильных оснований. КОН t ≈ 200 °C -Н 2 О гидразин гидразон Алехина Е. А.
Лабораторные методы Реакция Кижнера-Вольфа (1912) Восстановление карбонильной группы альдегидов или кетонов в метиловую нагреванием их гидразонов в присутствии сильных оснований. КОН t ≈ 200 °C -Н 2 О гидразин гидразон Алехина Е. А.
 2. Промышленные методы Ф. К. Р. Бергиус Гидрогенизация угля (процесс Бергиуса) Каменный (1884 – 1949) уголь доводят до порошкообразного состояния, добавляют катализатор Fe (до 2%) и доводят до получения алканов под давлением. Kat. Fe n. C + (n+1)H 2 → Cn. H 2 n+2 + циклоалканы 450 °C, 300 атм Получают бензин, дизельное топливо, сжиженный газ. Алехина Е. А.
2. Промышленные методы Ф. К. Р. Бергиус Гидрогенизация угля (процесс Бергиуса) Каменный (1884 – 1949) уголь доводят до порошкообразного состояния, добавляют катализатор Fe (до 2%) и доводят до получения алканов под давлением. Kat. Fe n. C + (n+1)H 2 → Cn. H 2 n+2 + циклоалканы 450 °C, 300 атм Получают бензин, дизельное топливо, сжиженный газ. Алехина Е. А.
 Промышленные методы Франц Фишер (1877– 1947) Ганс Тропш (1899– 1935) Синтез Фишера-Тропша (1923) Kat СН 4 + Н 2 О t, → СО + 3 Н 2 синтез-газ Алехина Е. А. p<20 атм, t → -H 2 O Kat: Co, Mo Сn. H 2 n+2 + др. углеводороды
Промышленные методы Франц Фишер (1877– 1947) Ганс Тропш (1899– 1935) Синтез Фишера-Тропша (1923) Kat СН 4 + Н 2 О t, → СО + 3 Н 2 синтез-газ Алехина Е. А. p<20 атм, t → -H 2 O Kat: Co, Mo Сn. H 2 n+2 + др. углеводороды
 Промышленные методы Синтез Фишера-Тропша (1923) Модификацией процесса может быть синтез алканов через промежуточное получение метанола. 2 СН 3 ОН → СН 3 ОСН 3 + Н 2 О СН 3 ОСН 3 → Сn. H 2 n+2 + Н 2 О Алехина Е. А.
Промышленные методы Синтез Фишера-Тропша (1923) Модификацией процесса может быть синтез алканов через промежуточное получение метанола. 2 СН 3 ОН → СН 3 ОСН 3 + Н 2 О СН 3 ОСН 3 → Сn. H 2 n+2 + Н 2 О Алехина Е. А.
 Промышленные методы Гидрирование алкенов R–CH=CH 2 + H 2 Kat R–CH 2–CH 3 → Kat: Pt, Pd, Ni, Cu. O, Cr 2 O 3 Впервые предложено С. А. Фокиным Восстановление галогенпроизводных водородом и йодоводородом 78 ри 2 H 5 CI + H 2 → C 2[Pd]+ HCI H 6 C 2 H 5 I + HI → C 2 H 6 + I 2 Алехина Е. А.
Промышленные методы Гидрирование алкенов R–CH=CH 2 + H 2 Kat R–CH 2–CH 3 → Kat: Pt, Pd, Ni, Cu. O, Cr 2 O 3 Впервые предложено С. А. Фокиным Восстановление галогенпроизводных водородом и йодоводородом 78 ри 2 H 5 CI + H 2 → C 2[Pd]+ HCI H 6 C 2 H 5 I + HI → C 2 H 6 + I 2 Алехина Е. А.
 Промышленные методы Крекинг Образуются более простые алканы и дополнительно алкены. t °C СН 3–СН 2–СН 3 → СН 3–СН 3 + СН 2=СН 2 Изомеризация Алехина Е. А.
Промышленные методы Крекинг Образуются более простые алканы и дополнительно алкены. t °C СН 3–СН 2–СН 3 → СН 3–СН 3 + СН 2=СН 2 Изомеризация Алехина Е. А.
 Экологические последствия Загрязнение алканами атмосферы, почвы, водоемов, подземных вод в значительных масштабах происходит при добыче нефти, газа, транспортировке жидких и газообразных углеводородов, переработке, производстве, применении углеводородов. Алехина Е. А.
Экологические последствия Загрязнение алканами атмосферы, почвы, водоемов, подземных вод в значительных масштабах происходит при добыче нефти, газа, транспортировке жидких и газообразных углеводородов, переработке, производстве, применении углеводородов. Алехина Е. А.
 Литература 1. Алёхина Е. А. , Шалыгин С. П Радикальные реакции галогенирования // Химия в школе, 2009, № 8, с. 51 -54. 2. Алёхина Е. А. , Шалыгин С. П. Реакции радикального замещения водорода в алканах // Химия в школе, 2011, № 5, с. 56 -61. 3. Грандберг И. И. Органическая химия. – М. : Высшая школа, 2001. – 480 с. 4. Ким А. М. Органическая химия. – Новосибирск: Сиб. унив. изд-во, 2004. – 842 с. 5. Органическая химия. В 2 кн. / Под ред. Н. А. Тюкавкиной. – М. : Дрофа, 2003. – Кн. 1: Основной курс. – 640 с. : ил. 6. Травень В. Ф. Органическая химия. В 2 -х т. – М. : Академкнига, 2005. 7. Шабаров Ю. С. Органическая химия: в 2 -х кн. : Учебник для вузов. 2 -е изд. , испр. – М. : Химия, 1996. Алехина Е. А.
Литература 1. Алёхина Е. А. , Шалыгин С. П Радикальные реакции галогенирования // Химия в школе, 2009, № 8, с. 51 -54. 2. Алёхина Е. А. , Шалыгин С. П. Реакции радикального замещения водорода в алканах // Химия в школе, 2011, № 5, с. 56 -61. 3. Грандберг И. И. Органическая химия. – М. : Высшая школа, 2001. – 480 с. 4. Ким А. М. Органическая химия. – Новосибирск: Сиб. унив. изд-во, 2004. – 842 с. 5. Органическая химия. В 2 кн. / Под ред. Н. А. Тюкавкиной. – М. : Дрофа, 2003. – Кн. 1: Основной курс. – 640 с. : ил. 6. Травень В. Ф. Органическая химия. В 2 -х т. – М. : Академкнига, 2005. 7. Шабаров Ю. С. Органическая химия: в 2 -х кн. : Учебник для вузов. 2 -е изд. , испр. – М. : Химия, 1996. Алехина Е. А.


