004 Алканы.ppt
- Количество слайдов: 58

АЛКАНЫ

Цель: выявить особенности строения и свойств алканов. Результаты урока • Воспроизводить план характеристики класса органических веществ на примере алканов. • Отличать формулы алканов от формул других орг. соединений. • Приводить гомологический ряд алканов и объяснять причину изменения физ. свойств его представителей. • Объяснять особенности строения алканов.

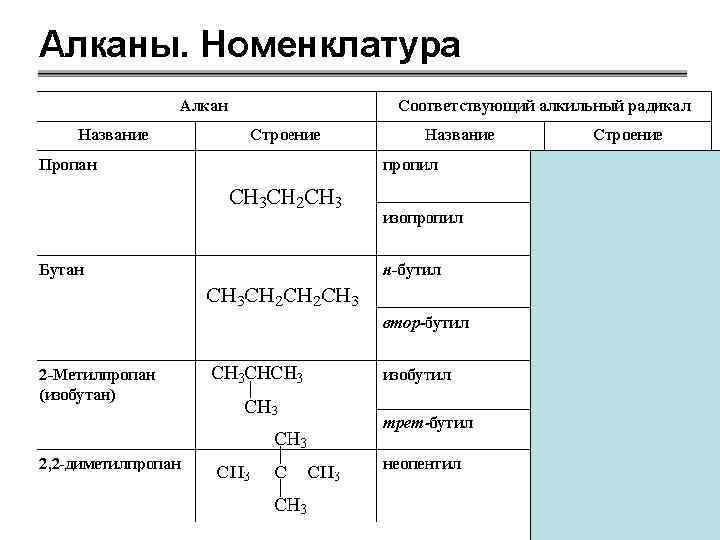
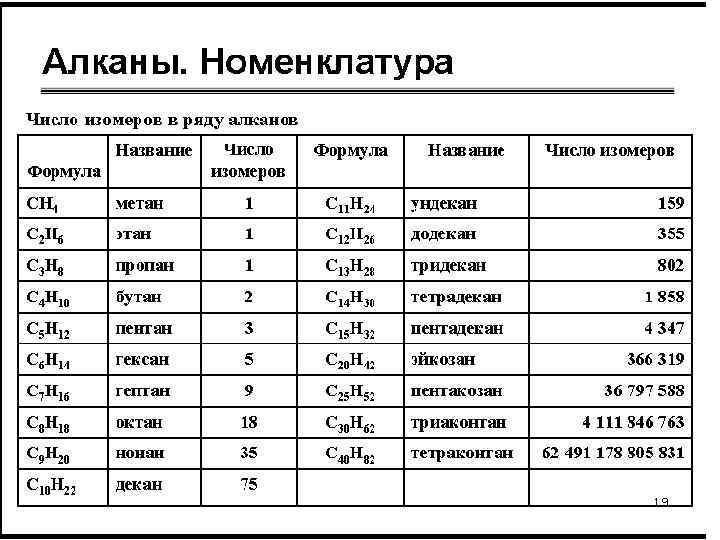
План характеристики класса 1. 2. 3. 4. 5. Определение Гомологический ряд, общая формула Номенклатура Изомерия Химическое, электронное и пространственное строение 6. Тип разрыва связей 7. Химические свойства 8. Качественные реакции 9. Способы получения: лабораторный, промышленный 10. Использование отдельных представителей 11. Генетическая связь с представителями других классов
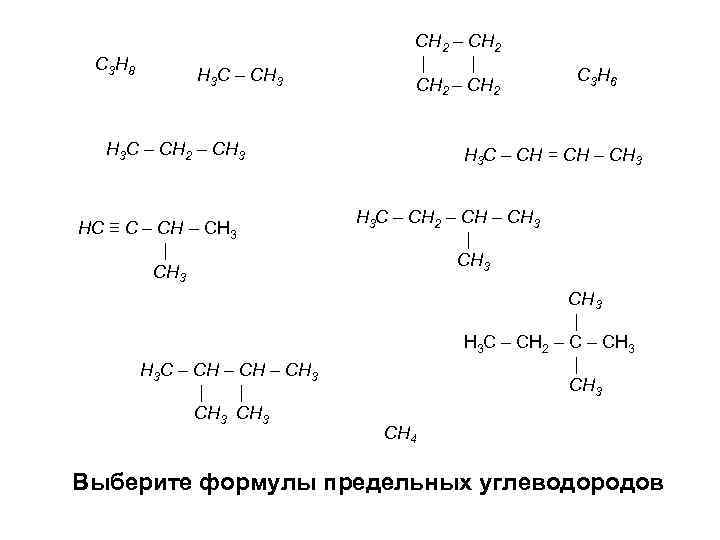
C 3 H 8 H 3 C – CH 3 СН 2 – СН 2 | | СН 2 – СН 2 H 3 C – CH 2 – CH 3 НС ≡ С – СН 3 | СН 3 Н 3 С – СН 3 | | СН 3 C 3 H 6 H 3 C – CH = CH – CH 3 Н 3 С – СН 2 – СН 3 | Н 3 С – СН 2 – СН 3 | СН 3 CH 4 Выберите формулы предельных углеводородов

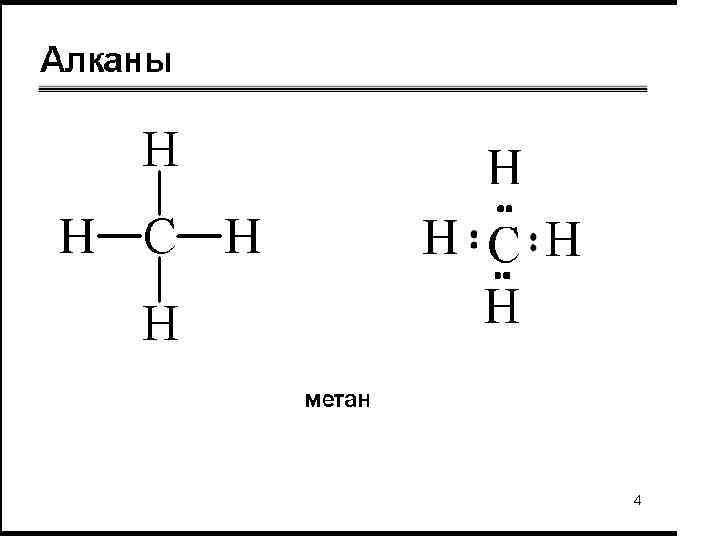
Общая формула: Cn. H 2 n + 2










Сравнение гомологов и алканов: Изомеры Состав Строение Свойства Гомологи
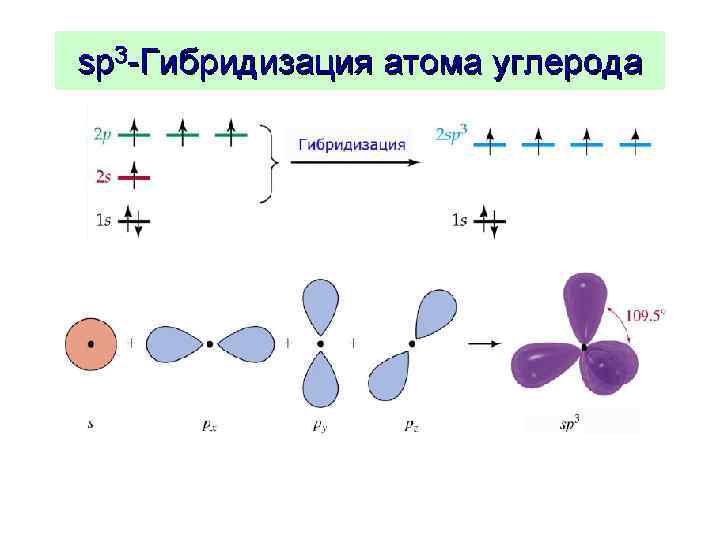




Химические свойства алканов

Цель: на основе химического, электронного и пространственного строения алканов спрогнозировать возможные типы реакций с их участием Результат урока § объяснять тип разрыва хим. связи в алканах; § объяснять причину участия алканов в определенных реакциях … § записывать уравнения реакций с участием алканов; § разъяснять механизм реакции …

Особенности строения алканов Причина Следствие Образованы ковалентными (σ)-связями между элементами с маленькой разницей ЭО Прочная Возможен разрыв в жестких условиях: высокая температура, облучение, катализатор Малополярная Гомолитический способ разрыва связи Насыщенная Возможность вступления в реакции замещения, разложения, изомеризации

Вывод: • Алканы при обычных условиях химически инертны • Реакции возможны только в жестких условиях • Вступают в реакции замещения, разложения, изомеризации, окисления • Механизм реакций преимущественно радикальный









ТИПЫ РЕАКЦИЙ ОКИСЛЕНИЯ Полное окисление (горение) Каталитическое окисление кислородом Препаративное окисление KMn. O 4 K 2 Cr 2 O 7 H 2 O 2 Mn. O 2 и другие

АЛКАНЫ И ЦИКЛОАЛКАНЫ При внесении в открытое пламя алканы горят. При этом в избытке кислорода происходит их полное окисление до СО 2, где углерод имеет высшую степень окисления +4, и воды. Уравнение реакции горения алканов в общем виде:

АЛКАНЫ И ЦИКЛОАЛКАНЫ При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления. Тогда образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, нулевая степень окисления).

АЛКАНЫ И ЦИКЛОАЛКАНЫ Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–С и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. Например, при повышенной Т на медном катализаторе метан окисляется до метанола: 2 СН 4+О 2 2 СН 3 ОН А при неполном окислении бутана (разрыв связи С 2–С 3) получают уксусную кислоту: Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С 12–С 18, которые используются для получения моющих средств и поверхностно-активных веществ.


АЛКАНЫ И ЦИКЛОАЛКАНЫ Основным способом переработки метана является его конверсия окисление водяным паром, кислородом или оксидом углерода (IV) в присутствии катализатора и при высокой температуре: СН 4 + H 2 O CO + 3 H 2 CH 4 + 1/2 O 2 CO + 2 H 2 CH 4 + CO 2 2 CO + 2 H 2 В результате этих реакций образуется синтез-газ (водяной газ) — ценное сырье для получения многих органических соединений (углеводородов, метилового и других спиртов и т. д. ).





СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ





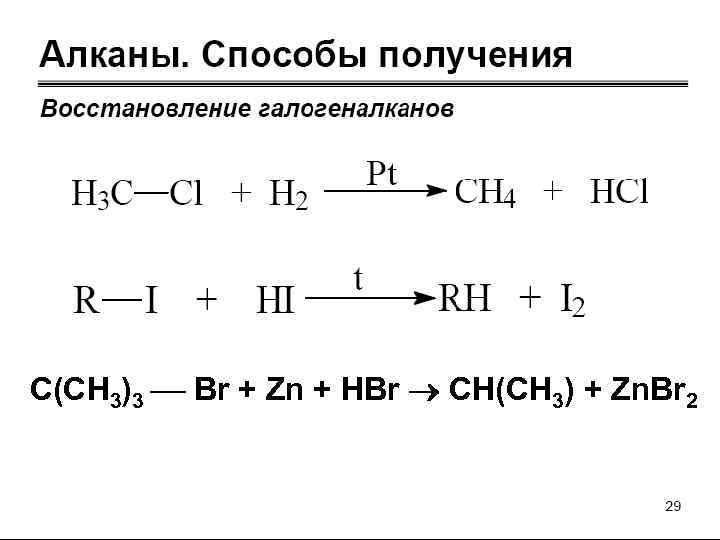
C(CH 3)3 Br + Zn + HBr CH(CH 3) + Zn. Br 2



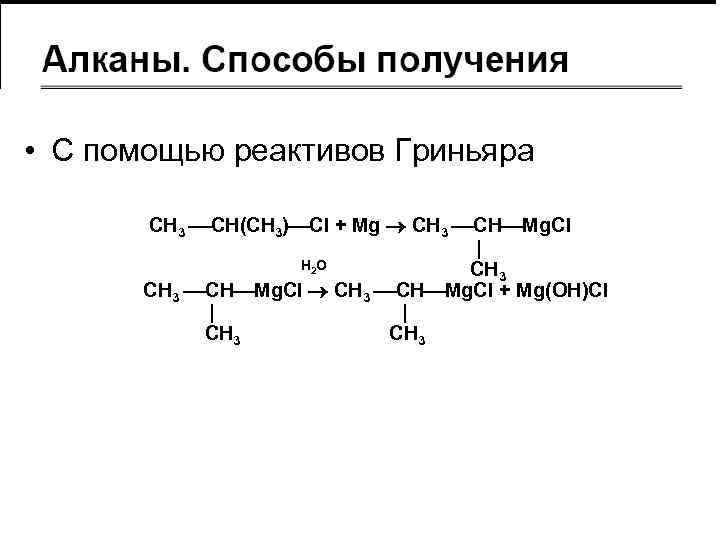
• С помощью реактивов Гриньяра CH 3 CH(CH 3) Cl + Mg CH 3 CH Mg. Cl H 2 O CH 3 CH Mg. Cl + Mg(OH)Cl CH 3

НАЗОВИТЕ СЛЕДУЮЩИЕ УГЛЕВОДОРОДЫ

СОСТАВЬТЕ СТРУКТУРНЫЕ ФОРМУЛЫ СЛЕДУЮЩИХ ВЕЩЕСТВ 2, 2, 4 -триметилпентан 2, 2, 3, 3 -тетраметилбутан 3 -этил, 3 -изопропилгексан 2, 5 -диметилгексан 2, 2, 3, 4 тетраметилпентан 3 -пропилнонан

САМОСТОЯТЕЛЬНАЯ РАБОТА
004 Алканы.ppt