1132733.ppt
- Количество слайдов: 15

АЛКАНДАР Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
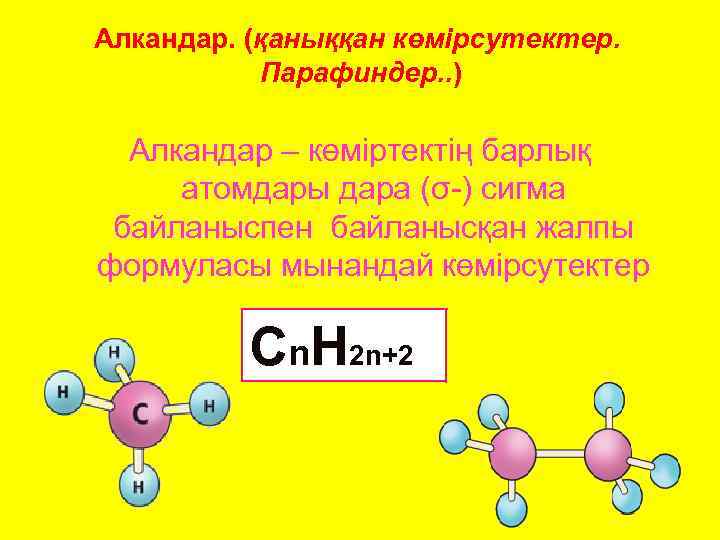
Алкандар. (қаныққан көмірсутектер. Парафиндер. . ) Алкандар – көміртектің барлық атомдары дара (σ-) сигма байланыспен байланысқан жалпы формуласы мынандай көмірсутектер Cn. H 2 n+2

АЛКАНДАР қаныққан көмірсутектердің халықаралық номенклатура (ИЮПАК) бойынша атауы. ПАРАФИНДЕР қаныққан көмірсутектердің тарихи атауы ( лат. parrum affinis – аз белсенді малоактивный).
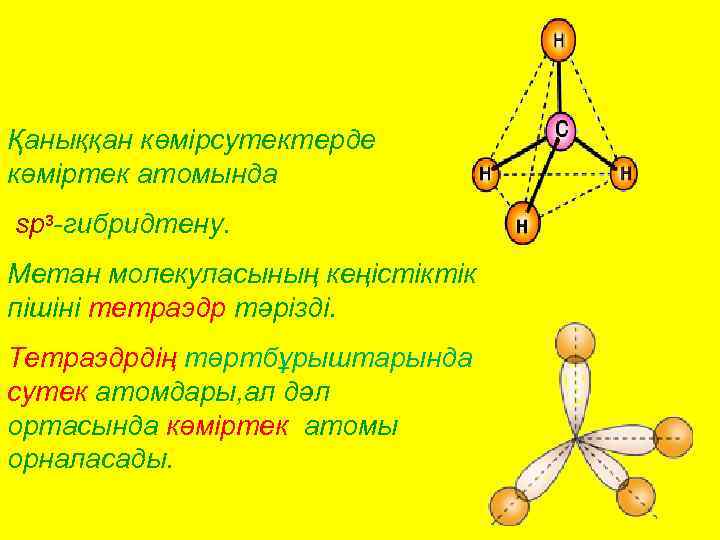
Қаныққан көмірсутектерде көміртек атомында sp 3 -гибридтену. Метан молекуласының кеңістіктік пішіні тетраэдр тәрізді. Тетраэдрдің төртбұрыштарында сутек атомдары, ал дәл ортасында көміртек атомы орналасады.

Метанның гомологтық қатары Гомологтар – құрылысы мен қасиеті ұқсас , бір немесе бірнеше СH 2. тобына айырмасы бар жалпы формуласы бірдей заттар • • • СН 4 С 2 H 6 C 3 H 8 C 4 H 10 C 5 H 12 метан этан пропан бутан пентан • • • C 6 H 14 C 7 H 16 C 8 H 18 C 9 H 20 C 10 H 22 гексан гептан октан нонан декан
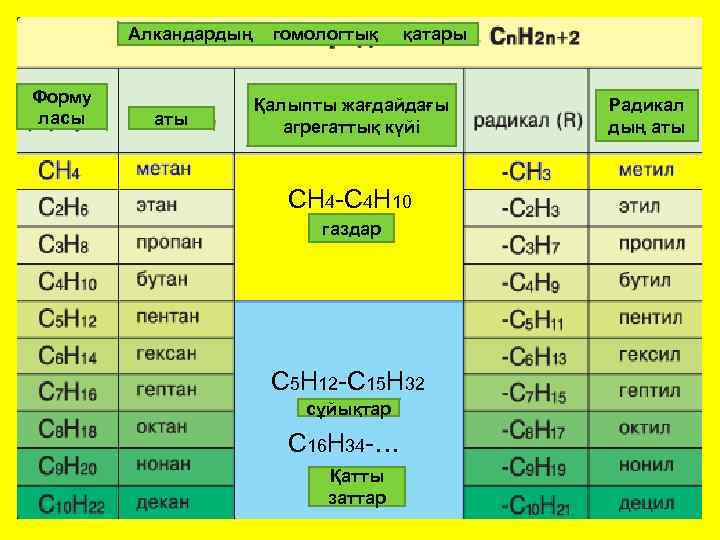
Алкандардың Форму ласы аты гомологтық қатары Қалыпты жағдайдағы агрегаттық күйі СН 4 -С 4 Н 10 газдар С 5 Н 12 -С 15 Н 32 сұйықтар С 16 Н 34 -… Қатты твердые заттар Радикал дың аты
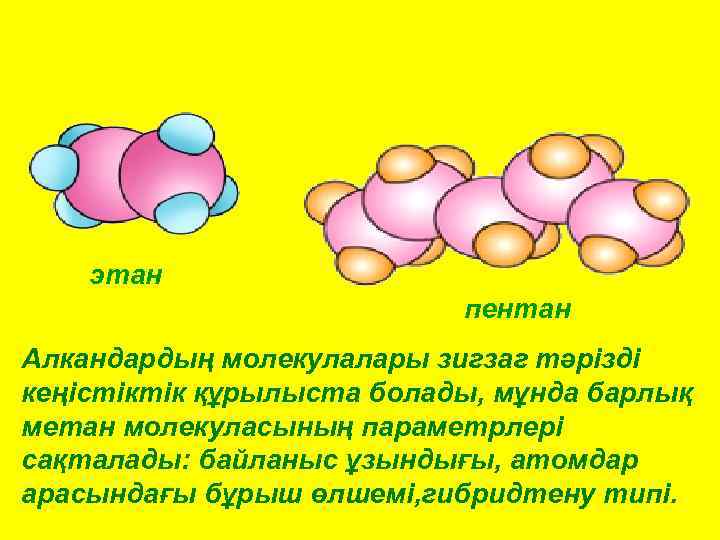
этан пентан Алкандардың молекулалары зигзаг тәрізді кеңістіктік құрылыста болады, мұнда барлық метан молекуласының параметрлері сақталады: байланыс ұзындығы, атомдар арасындағы бұрыш өлшемі, гибридтену типі.
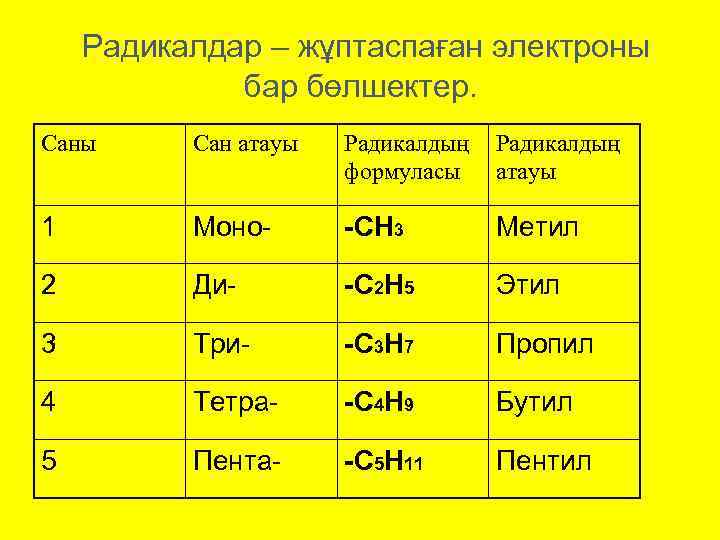
Радикалдар – жұптаспаған электроны бар бөлшектер. Саны Сан атауы Радикалдың формуласы Радикалдың атауы 1 Моно- -СН 3 Метил 2 Ди- -С 2 Н 5 Этил 3 Три- -С 3 Н 7 Пропил 4 Тетра- -С 4 Н 9 Бутил 5 Пента- -С 5 Н 11 Пентил
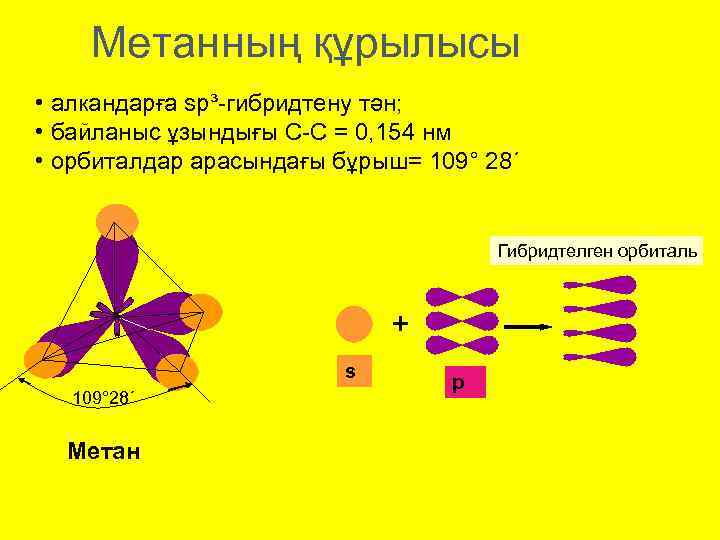
Метанның құрылысы • алкандарға sp³-гибридтену тән; • байланыс ұзындығы С-С = 0, 154 нм • орбиталдар арасындағы бұрыш= 109° 28´ Гибридтелген орбиталь + s 109° 28´ Метан р

Физикалық қасиеттері СН 4…C 4 Н 10 – газдар Tқайнау: -161, 6…-0, 5 °C T балқу: -182, 5…-138, 3 °C С 5 Н 12…C 15 Н 32 –сұйықтар T қайнау: 36, 1… 270, 5 °C Tбалқу: -129, 8… 10 °C С 16 Н 34…ары қарай қатты заттар T қайнау: 287, 5 °C T балқу: 20 °C Салыстырмалы молекулалық массаларының өсу ретіне қарай қайнау, балқу температуралары артады

АЛКАНДАРДЫҢ ФИЗИКАЛЫҚ ҚАСИЕТТЕРІ. ТАБИҒАТТА КЕЗДЕСУІ. МЕТАН – газ, түссіз, иіссіз , ауадан 2 есеге дерлік жеңіл, суда аз ериді. Ол табиғатта ауа өтпейтін жерде өсімдіктер мен жануарлардың қалдықтарының ыдырауы нәтижесінде түзіледі. Сондықтан батпақталған су қоймаларында кездеседі, онда газ көпіршіктері түрінде көрінеді , немесе таскөмір шахталарында жиналады, көмір пластарынан бөлінген. Негізінен (8097%) метан табиғи газда және мұнайға серік газдарда болады.

ЭТАН, ПРОПАН МЕН БУТАН табиғи газдың және мұнайға серік газдардың құрамына кіреді. АЛКАНДАР мұнайда болады. Салыстырмалы молекулалық массалары өскен сайын сандық қатынастарының сапаға өтуі байқалады: агрегаттық күйі өзгереді, қайнау және балқу температуралары, тығыздық тары біртіндеп артады.

Алынуы 1) Өнеркәсіпте а) мұнай өнімдерін крекингілеу : C 16 H 34 → C 8 H 18 + C 8 H 16 2) Зертханада: а) карбидті гидролиздеу: Al 4 C 3 +12 H 2 O = 3 CH 4 + 4 Al(OH)3↓ б) Вюрц реакциясы: C 2 H 5 Cl + 2 Na → C 4 H 10 + 2 Na. Cl в) карбон қышқылының натрий тұздарын декарбоксилдеу СН 3 СООNa + 2 Na. ОН → СН 4 ↑ + Nа 2 СО 3

СН 3 СН 2 t, катализатор СН 3 СН СН 2 СН 3 СН 4 + Н 2 О 800°С СО + 3 Н 2 синтез-газ 1500°С 2 СН 4 СН 3 Н СН 3 С≡С Н + 3 Н 2 + Q Н 2 С=СН 2 + Q Қаныққан көмірсутектер оттегі жеткілікті болғанда көмірленбей жанады) С 3 Н 8 + 5 О 2 3 СО 2 + 4 Н 2 О + Q Катализаторт қатысында тотығады: СН 4 + О 2 500°С, катализатор Н 2 СН 3(СН 2)34 СН 3 + 5 О 2 4 СН 3 О С + Н 2 О + Q Н (СН 2)16 СООН +2 Н 2 О + Q

Алкандардың қолданылуы Отын ретінде кеңінен қолданылады, іштен жанатын двигательдердің отыны
1132733.ppt