диены проф.ppt
- Количество слайдов: 20
 Алкадиены
Алкадиены
 Диеновые углеводороды (алкадиены) - ациклические углеводороды, содержащие в молекуле двойные связи между атомами углерода. 2 = связи – суффикс – диен Общая формула: Сn. H 2 n-2 C 3 H 4 - пропадиен (аллен) СН 2 = СН 2 C 4 H 6 - бутадиен СН 2 = СН – СН = СН 2
Диеновые углеводороды (алкадиены) - ациклические углеводороды, содержащие в молекуле двойные связи между атомами углерода. 2 = связи – суффикс – диен Общая формула: Сn. H 2 n-2 C 3 H 4 - пропадиен (аллен) СН 2 = СН 2 C 4 H 6 - бутадиен СН 2 = СН – СН = СН 2
 Номенклатура алкадиенов Правила: 1. Главная цепь должна содержать обе двойные связи. 2. Нумерацию ведут с того конца, где ближе кратная связь. 3. Называют заместители и указывают атомы углерода, от которого они отходят. 4. Указывают название алкадиена и атомы углерода, от которых образована двойная связь.
Номенклатура алкадиенов Правила: 1. Главная цепь должна содержать обе двойные связи. 2. Нумерацию ведут с того конца, где ближе кратная связь. 3. Называют заместители и указывают атомы углерода, от которого они отходят. 4. Указывают название алкадиена и атомы углерода, от которых образована двойная связь.
 Классификация алкадиенов 1. Алкадиены с кумулированными (примыкающими) связями: СН 2 = СН – СН 3 Бутадиен-1, 2 2. Алкадиены с изолированными связями: СН 2 = СН – СН 2 – СН = СН 2 Пентадиен-1, 4 3. Алкадиены с сопряженными связями: СН 2 = СН – СН = СН 2 Бутадиен-1, 3
Классификация алкадиенов 1. Алкадиены с кумулированными (примыкающими) связями: СН 2 = СН – СН 3 Бутадиен-1, 2 2. Алкадиены с изолированными связями: СН 2 = СН – СН 2 – СН = СН 2 Пентадиен-1, 4 3. Алкадиены с сопряженными связями: СН 2 = СН – СН = СН 2 Бутадиен-1, 3
 Алкадиены с кумулированным расположением двойных связей (аллены) • Углеводороды, содержащие двойные связи , находящиеся возле соседних атомов углерода. 1 2 3 4 СН 2 =С=СН-СН 3 бутадиен -1, 2
Алкадиены с кумулированным расположением двойных связей (аллены) • Углеводороды, содержащие двойные связи , находящиеся возле соседних атомов углерода. 1 2 3 4 СН 2 =С=СН-СН 3 бутадиен -1, 2
 Сопряженные алкадиены • Углеводороды, содержащие двойные связи, между которыми находится одна одинарная связь. 1 2 3 4 5 6 СН 3 -СН=СН-СН 3 1 гексадиен-2, 4 2 3 4 СН 2 =СН-СН=СН 2 бутадиен -1, 3 (дивинил)
Сопряженные алкадиены • Углеводороды, содержащие двойные связи, между которыми находится одна одинарная связь. 1 2 3 4 5 6 СН 3 -СН=СН-СН 3 1 гексадиен-2, 4 2 3 4 СН 2 =СН-СН=СН 2 бутадиен -1, 3 (дивинил)
 Алкадиены с изолированными двойными связями • Углеводороды, содержащие двойные связи , между которыми находится несколько одинарных связей. 8 7 6 5 4 3 2 1 СН 3–СН 2 -СН=СН-СН 2 -СН=СН 2 октадиен-1, 5
Алкадиены с изолированными двойными связями • Углеводороды, содержащие двойные связи , между которыми находится несколько одинарных связей. 8 7 6 5 4 3 2 1 СН 3–СН 2 -СН=СН-СН 2 -СН=СН 2 октадиен-1, 5
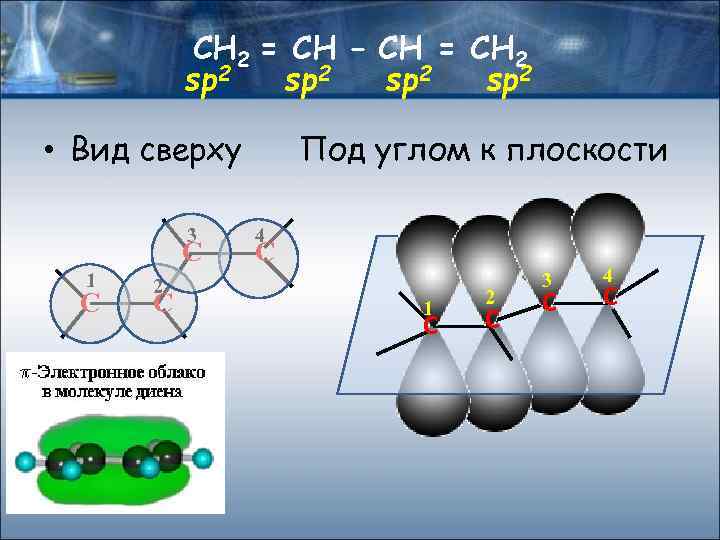 СН 2 = СН – СН = СН 2 sp 2 • Вид сверху 3 C 1 C Под углом к плоскости 4 C 2 C 1 С 2 С 3 С 4 С
СН 2 = СН – СН = СН 2 sp 2 • Вид сверху 3 C 1 C Под углом к плоскости 4 C 2 C 1 С 2 С 3 С 4 С
 ИЗОМЕРИЯ АЛКАДИЕНОВ 1. Структурная: а) изомерия углеродного скелета б) изомерия положения двойных связей. 2. Пространственная: а)цис-транс изомерия 3. Межклассовая изомерия (алкины)
ИЗОМЕРИЯ АЛКАДИЕНОВ 1. Структурная: а) изомерия углеродного скелета б) изомерия положения двойных связей. 2. Пространственная: а)цис-транс изомерия 3. Межклассовая изомерия (алкины)
 ЗАДАНИЕ 2: назвать вещество и составить формулы изомеров каждого вида : СН 3 -СН-СН=С-СН 2 -СН 3
ЗАДАНИЕ 2: назвать вещество и составить формулы изомеров каждого вида : СН 3 -СН-СН=С-СН 2 -СН 3
 Химические свойства 1. Галогенирование СН 2=СН-СН=СН 2 + Br 2 4 1 3 2 2 1 СН 2 - СН –СН=СН 2 Br Br 3, 4 -дибромбутен-1 1 4 CH 2 - CH = CH- CH 2 Br Br 1, 4 - дибромбутен-2
Химические свойства 1. Галогенирование СН 2=СН-СН=СН 2 + Br 2 4 1 3 2 2 1 СН 2 - СН –СН=СН 2 Br Br 3, 4 -дибромбутен-1 1 4 CH 2 - CH = CH- CH 2 Br Br 1, 4 - дибромбутен-2
 Химические свойства 2. Гидрирование + H 2 СН 2=СН СН=СН 2 СН СН СН 2 СН 3 СН=СН СН 3 бутен-2 Н Н В присутствии катализатора получается продукт полного гидрирования: t, Ni СН 2=СН СН=СН 2 + 2 Н 2 СН 3 СН 2 СН 3 бутан
Химические свойства 2. Гидрирование + H 2 СН 2=СН СН=СН 2 СН СН СН 2 СН 3 СН=СН СН 3 бутен-2 Н Н В присутствии катализатора получается продукт полного гидрирования: t, Ni СН 2=СН СН=СН 2 + 2 Н 2 СН 3 СН 2 СН 3 бутан
 Химические свойства 3. Гидрогалогенирование СН 2=СН-СН=СН 2+HBr → CH 3 -CH=CH-CH 2 Br 1 -бромбутен-2
Химические свойства 3. Гидрогалогенирование СН 2=СН-СН=СН 2+HBr → CH 3 -CH=CH-CH 2 Br 1 -бромбутен-2
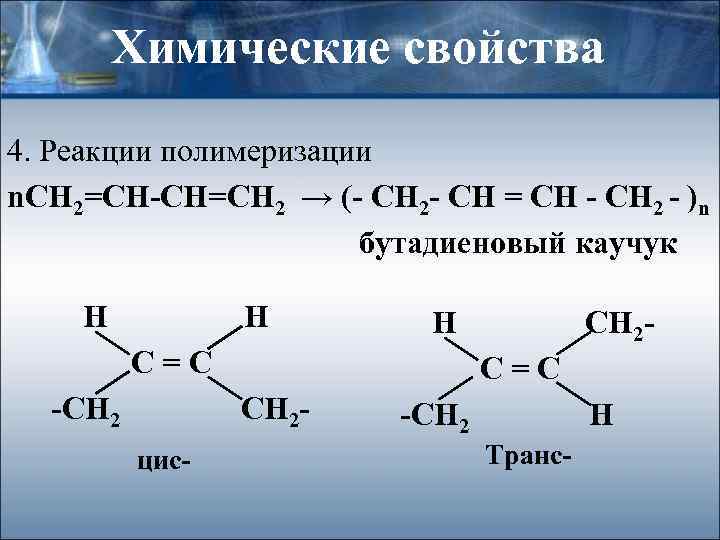 Химические свойства 4. Реакции полимеризации n. СН 2=СН-СН=СН 2 → (- CH 2 - CH = CH - CH 2 - )n бутадиеновый каучук Н Н Н С=С -СН 2 С=С СН 2 - цис- СН 2 - -СН 2 Н Транс-
Химические свойства 4. Реакции полимеризации n. СН 2=СН-СН=СН 2 → (- CH 2 - CH = CH - CH 2 - )n бутадиеновый каучук Н Н Н С=С -СН 2 С=С СН 2 - цис- СН 2 - -СН 2 Н Транс-
 Химические свойства 5. Алкадиены горят 2 С 4 Н 6 + 11 О 2 → 8 СО 2 + 6 Н 2 О + Q
Химические свойства 5. Алкадиены горят 2 С 4 Н 6 + 11 О 2 → 8 СО 2 + 6 Н 2 О + Q
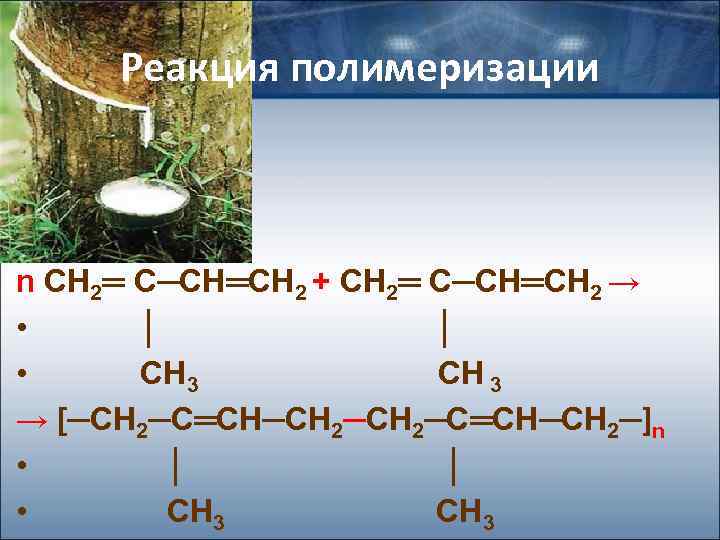 Реакция полимеризации n СН 2═ С─СН═СН 2 + СН 2═ С─СН═СН 2 → • │ │ • СН 3 → [─СН 2─С═СН─СН 2─]n • │ │ • СН 3
Реакция полимеризации n СН 2═ С─СН═СН 2 + СН 2═ С─СН═СН 2 → • │ │ • СН 3 → [─СН 2─С═СН─СН 2─]n • │ │ • СН 3
 Вулканизация каучука –это присоединение серы по месту двойной связи , при нагревании. ─СН 2─С═СН─СН 2─СН 2─С═СН─СН 2─… │ │ │ СН 3 + n. S→
Вулканизация каучука –это присоединение серы по месту двойной связи , при нагревании. ─СН 2─С═СН─СН 2─СН 2─С═СН─СН 2─… │ │ │ СН 3 + n. S→
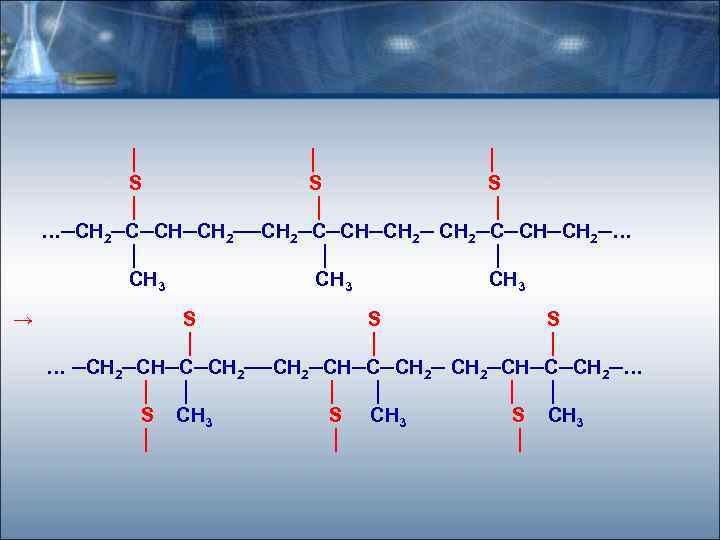 │ │ │ S S S │ │ │ …─СН 2─С─СН─СН 2─… │ │ │ СН 3 → S S S │ │ │ … ─СН 2─СН─С─СН 2─… │ │ │ S СН 3 │ │ │
│ │ │ S S S │ │ │ …─СН 2─С─СН─СН 2─… │ │ │ СН 3 → S S S │ │ │ … ─СН 2─СН─С─СН 2─… │ │ │ S СН 3 │ │ │
 Резина получается в процессе вулканизации, когда каучук при высоком давлении и температуре химически связывается с серой. ЕСЛИ ДОБАВИТЬ СЕРЫ БОЛЬШЕ, ЧЕМ ЕЕ ТРЕБУЕТСЯ, ТО ПОЛУЧАЕТСЯ ЭБОНИТ – ТВЕРДЫЙ НЕЭЛАСТИЧНЫЙ МАТЕРИАЛ.
Резина получается в процессе вулканизации, когда каучук при высоком давлении и температуре химически связывается с серой. ЕСЛИ ДОБАВИТЬ СЕРЫ БОЛЬШЕ, ЧЕМ ЕЕ ТРЕБУЕТСЯ, ТО ПОЛУЧАЕТСЯ ЭБОНИТ – ТВЕРДЫЙ НЕЭЛАСТИЧНЫЙ МАТЕРИАЛ.
 Общие способы получения диенов аналогичны способам получения алкенов. 1. Постадийное дегидрирование алканов: H 3 C-CH 2 -CH 3 H 2 C=CH-CH=CH 2 H 3 C-CH 2 -CH=CH 2 2. Дегидратация и дегидрирование спиртов (Метод Лебедева) 2 H 3 C-CH 2 -OH H 2 C=CH-CH=CH 2 + 2 H 20 + H 2
Общие способы получения диенов аналогичны способам получения алкенов. 1. Постадийное дегидрирование алканов: H 3 C-CH 2 -CH 3 H 2 C=CH-CH=CH 2 H 3 C-CH 2 -CH=CH 2 2. Дегидратация и дегидрирование спиртов (Метод Лебедева) 2 H 3 C-CH 2 -OH H 2 C=CH-CH=CH 2 + 2 H 20 + H 2


