Алифатические спирты
















 Алифатические спирты
Алифатические спирты
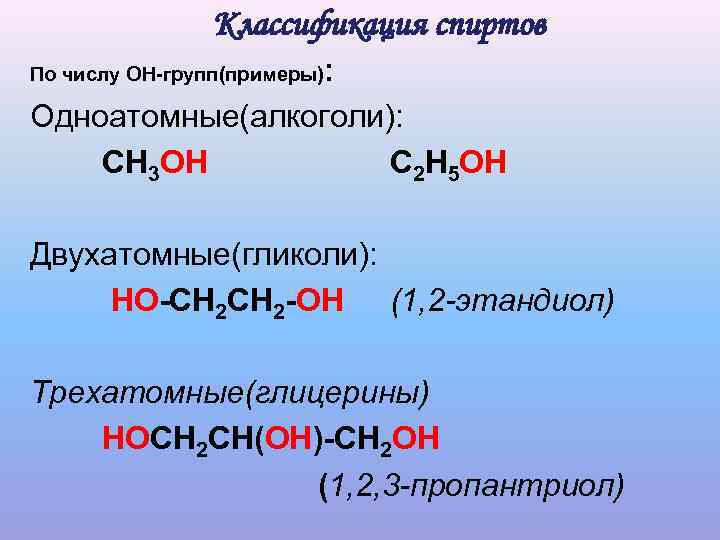
 Классификация спиртов : По числу ОН-групп(примеры) Одноатомные(алкоголи): СН 3 ОН С 2 Н 5 ОН Двухатомные(гликоли): НО-СН 2 -ОН (1, 2 -этандиол) Трехатомные(глицерины) HOCH 2 CH(OH)-CH 2 OH (1, 2, 3 -пропантриол)
Классификация спиртов : По числу ОН-групп(примеры) Одноатомные(алкоголи): СН 3 ОН С 2 Н 5 ОН Двухатомные(гликоли): НО-СН 2 -ОН (1, 2 -этандиол) Трехатомные(глицерины) HOCH 2 CH(OH)-CH 2 OH (1, 2, 3 -пропантриол)
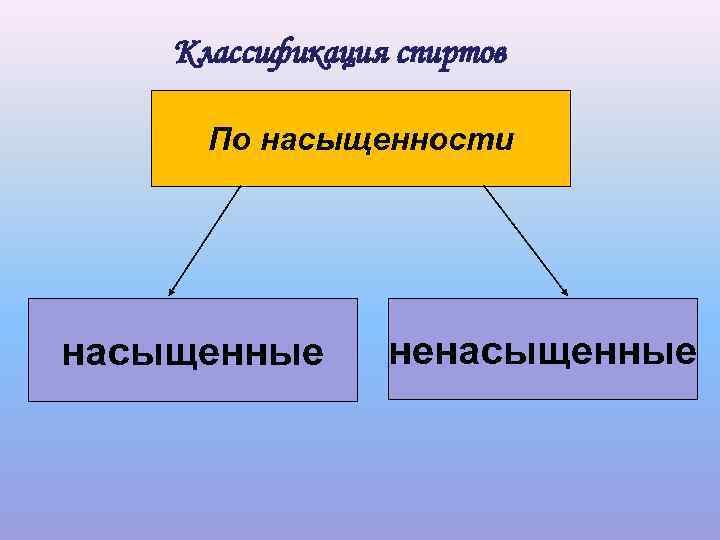
 Классификация спиртов По насыщенности насыщенные ненасыщенные
Классификация спиртов По насыщенности насыщенные ненасыщенные
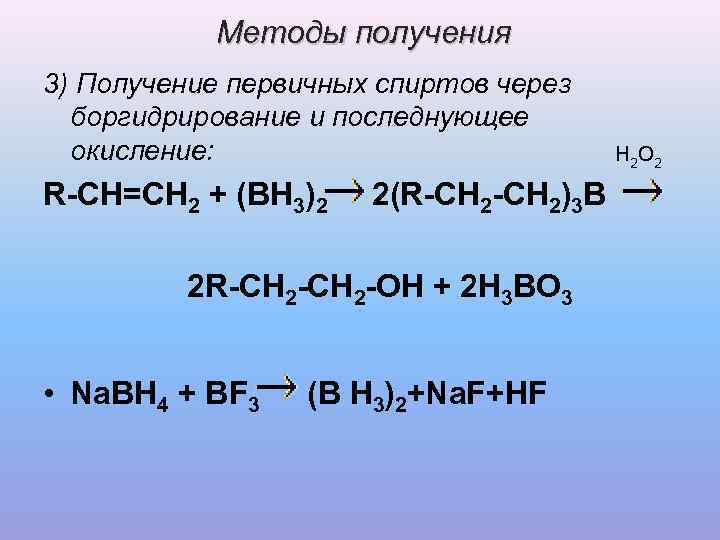
 Методы получения 3) Получение первичных спиртов через боргидрирование и последнующее окисление: H 2 O 2 R-CH=CH 2 + (BH 3)2 2(R-CH 2)3 B 2 R-CH 2 -OH + 2 H 3 BO 3 • Na. BH 4 + BF 3 (B H 3)2+Na. F+HF
Методы получения 3) Получение первичных спиртов через боргидрирование и последнующее окисление: H 2 O 2 R-CH=CH 2 + (BH 3)2 2(R-CH 2)3 B 2 R-CH 2 -OH + 2 H 3 BO 3 • Na. BH 4 + BF 3 (B H 3)2+Na. F+HF
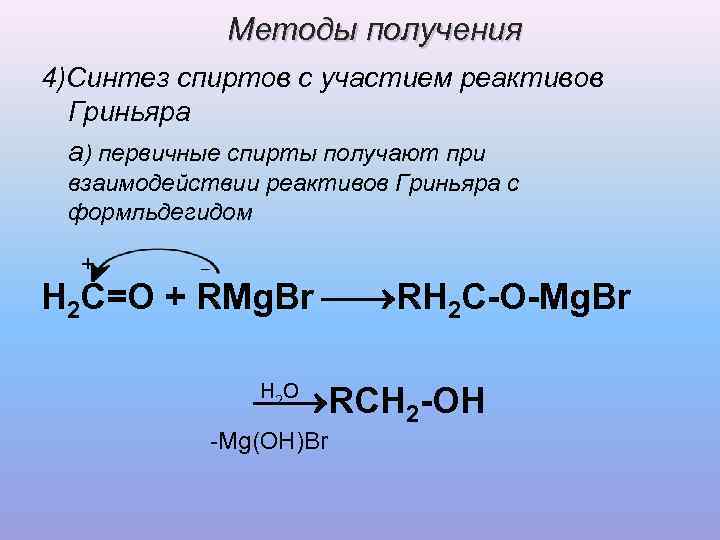
 Методы получения 4)Синтез спиртов с участием реактивов Гриньяра а) первичные спирты получают при взаимодействии реактивов Гриньяра с формльдегидом + _ H 2 C=O + RMg. Br RH 2 C-O-Mg. Br H 2 O RCH 2 -OH -Mg(OH)Br
Методы получения 4)Синтез спиртов с участием реактивов Гриньяра а) первичные спирты получают при взаимодействии реактивов Гриньяра с формльдегидом + _ H 2 C=O + RMg. Br RH 2 C-O-Mg. Br H 2 O RCH 2 -OH -Mg(OH)Br
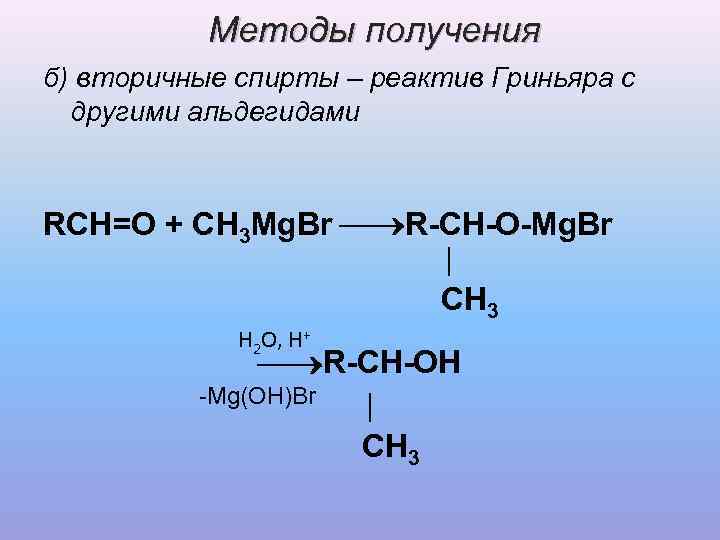
 Методы получения б) вторичные спирты – реактив Гриньяра с другими альдегидами RCH=O + CH 3 Mg. Br R-CН-O-Mg. Br │ CH 3 H 2 O, H+ R-CH-OH -Mg(OH)Br │ CH 3
Методы получения б) вторичные спирты – реактив Гриньяра с другими альдегидами RCH=O + CH 3 Mg. Br R-CН-O-Mg. Br │ CH 3 H 2 O, H+ R-CH-OH -Mg(OH)Br │ CH 3
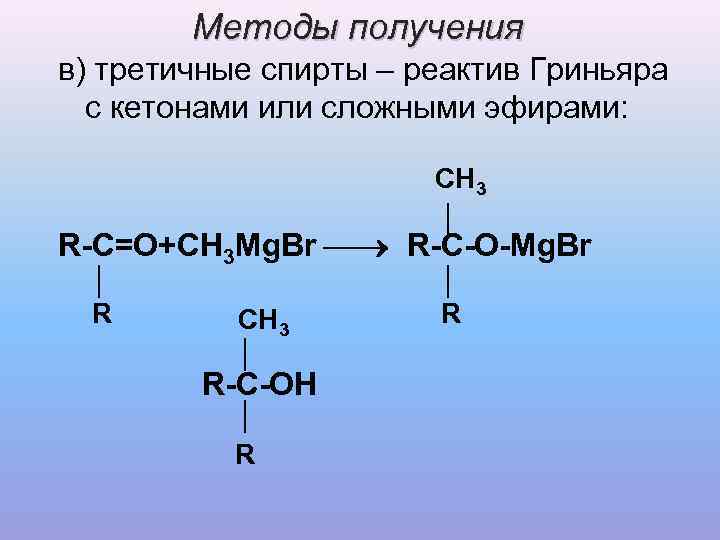
 Методы получения в) третичные спирты – реактив Гриньяра с кетонами или сложными эфирами: CH 3 │ R-C=O+CH 3 Mg. Br R-C-O-Mg. Br │ R CH 3 R │ R-C-OH │ R
Методы получения в) третичные спирты – реактив Гриньяра с кетонами или сложными эфирами: CH 3 │ R-C=O+CH 3 Mg. Br R-C-O-Mg. Br │ R CH 3 R │ R-C-OH │ R
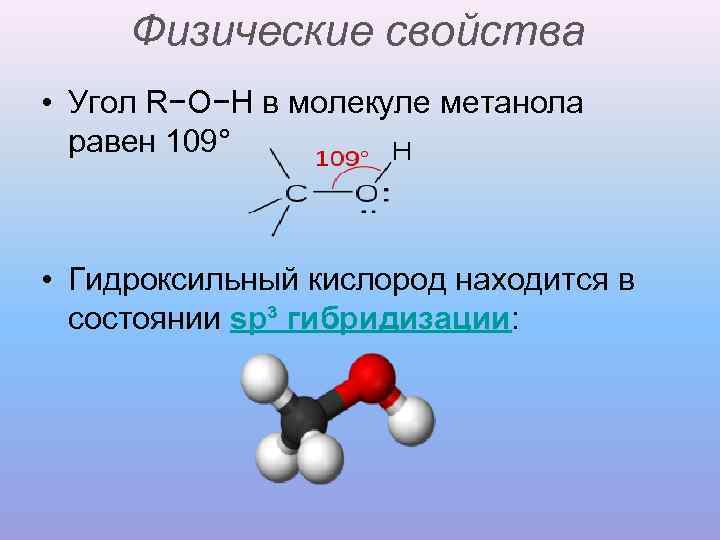
 Физические свойства • Угол R−O−H в молекуле метанола равен 109° • Гидроксильный кислород находится в состоянии sp³ гибридизации:
Физические свойства • Угол R−O−H в молекуле метанола равен 109° • Гидроксильный кислород находится в состоянии sp³ гибридизации:
 Физические свойства Спирты(алканолы)-негазообразные С 1 -С 3 – жидкости с резким запахом, хорошо растворимы в воде С 4 -С 9 – маслянистообразные жидкости с неприятным запахом, трудно растворимые в воде С 10 -Сn – твердые вещества, без запаха, плохо растворимые в воде.
Физические свойства Спирты(алканолы)-негазообразные С 1 -С 3 – жидкости с резким запахом, хорошо растворимы в воде С 4 -С 9 – маслянистообразные жидкости с неприятным запахом, трудно растворимые в воде С 10 -Сn – твердые вещества, без запаха, плохо растворимые в воде.
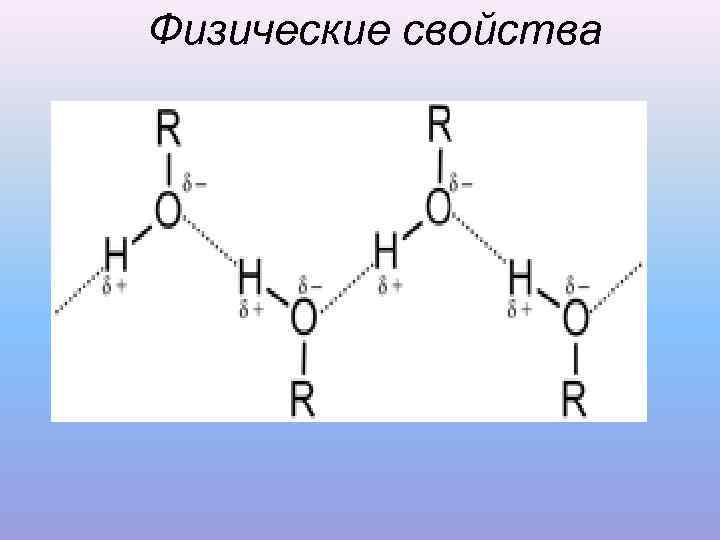
 Физические свойства • t кипения возрастают с увеличением Мr • первичные спирты кипят при более высоких t, а плавятся при более низких t, чем их разветвленные изомеры • плотность спиртов <1 • t плавления спиртов – выше, чем у углеводородов и галогеналканов. Это объясняется образованием ассоциатов молекул за счет межмолекулярных водородных связей.
Физические свойства • t кипения возрастают с увеличением Мr • первичные спирты кипят при более высоких t, а плавятся при более низких t, чем их разветвленные изомеры • плотность спиртов <1 • t плавления спиртов – выше, чем у углеводородов и галогеналканов. Это объясняется образованием ассоциатов молекул за счет межмолекулярных водородных связей.
 Физические свойства
Физические свойства
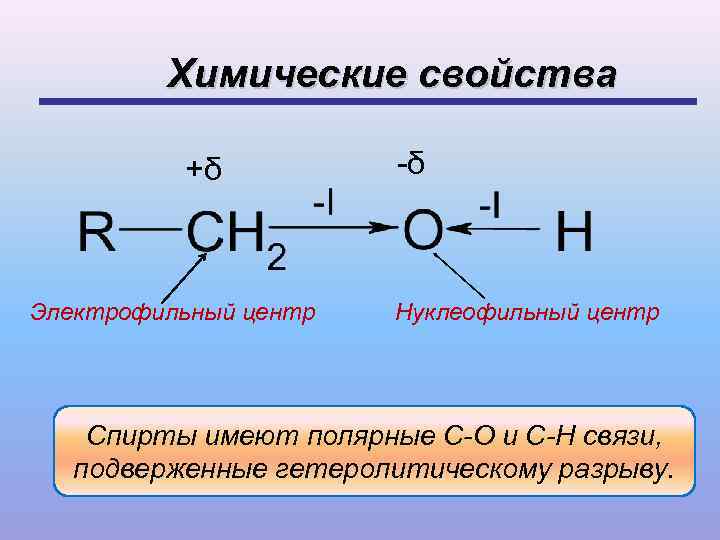
 Химические свойства +δ -δ Электрофильный центр Нуклеофильный центр Спирты имеют полярные С-О и С-Н связи, подверженные гетеролитическому разрыву.
Химические свойства +δ -δ Электрофильный центр Нуклеофильный центр Спирты имеют полярные С-О и С-Н связи, подверженные гетеролитическому разрыву.
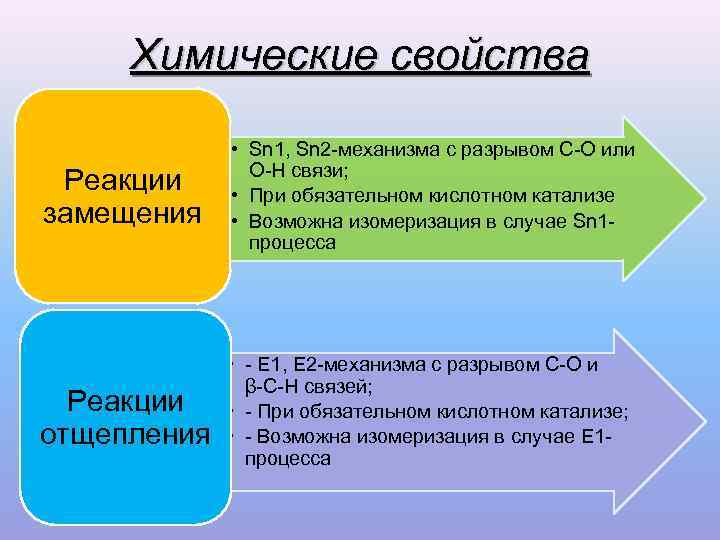
 Химические свойства • Sn 1, Sn 2 -механизма с разрывом С-О или О-Н связи; Реакции • При обязательном кислотном катализе замещения • Возможна изомеризация в случае Sn 1 - процесса • - Е 1, Е 2 -механизма с разрывом С-О и β-C-Н связей; Реакции • - При обязательном кислотном катализе; отщепления • - Возможна изомеризация в случае Е 1 - процесса
Химические свойства • Sn 1, Sn 2 -механизма с разрывом С-О или О-Н связи; Реакции • При обязательном кислотном катализе замещения • Возможна изомеризация в случае Sn 1 - процесса • - Е 1, Е 2 -механизма с разрывом С-О и β-C-Н связей; Реакции • - При обязательном кислотном катализе; отщепления • - Возможна изомеризация в случае Е 1 - процесса
 Химические свойства Спирты амфотерны, проявляют кислотные и основные свойства. Ряд кислотности: НС≡СН < NH 3 < ROH < H 2 O < RCOOH Кислотность снижается с ростом молекулярной массы и разветвлённостью молекулы. Основность изменяется в обратном ряду CH 3 OH > CH 3 CH 2 CH 2 OH > (CH 3)2 CHOH > (CH 3)3 COH .
Химические свойства Спирты амфотерны, проявляют кислотные и основные свойства. Ряд кислотности: НС≡СН < NH 3 < ROH < H 2 O < RCOOH Кислотность снижается с ростом молекулярной массы и разветвлённостью молекулы. Основность изменяется в обратном ряду CH 3 OH > CH 3 CH 2 CH 2 OH > (CH 3)2 CHOH > (CH 3)3 COH .
 Химические свойства 1. а) Cпирты как кислоты с щелочными и щелочноземельными металлами, сильными основаниями образуют соли - алкоголяты С щелочами реакция обратима
Химические свойства 1. а) Cпирты как кислоты с щелочными и щелочноземельными металлами, сильными основаниями образуют соли - алкоголяты С щелочами реакция обратима
 Химические свойства 1. б) Спирты как основания с минеральными кислотами на холоду образуют оксониевые соли : ROH + HBr → ROH 2+. Br - → ROH 2+ + Br – Оксониевый ион t 0 ROH 2+ → R+ + H 2 O Оксониевые соли : • при сильном разбавлении разлагаются на исходные спирт и кислоту; • при нагревании отщепляют воду с образованием карбокатиона.
Химические свойства 1. б) Спирты как основания с минеральными кислотами на холоду образуют оксониевые соли : ROH + HBr → ROH 2+. Br - → ROH 2+ + Br – Оксониевый ион t 0 ROH 2+ → R+ + H 2 O Оксониевые соли : • при сильном разбавлении разлагаются на исходные спирт и кислоту; • при нагревании отщепляют воду с образованием карбокатиона.
 Химические свойства 2. Дегидратация спиртов а) Внутримолекулярная дегидратация: - реакция отщепления (Е) с образованием алкенов; - в присутствии концентрированной кислоты при нагревании.
Химические свойства 2. Дегидратация спиртов а) Внутримолекулярная дегидратация: - реакция отщепления (Е) с образованием алкенов; - в присутствии концентрированной кислоты при нагревании.
 Химические свойства Дегидратация идет преимущественно по правилу Зайцева – с образованием более замещенного алкена (водород отщепляется от менее гидрогенизированного β-С-атома (направление I):
Химические свойства Дегидратация идет преимущественно по правилу Зайцева – с образованием более замещенного алкена (водород отщепляется от менее гидрогенизированного β-С-атома (направление I):
 Химические свойства б) Межмолекулярная дегидратация: - В условиях кислотного катализа, нагревания с образованием простых эфиров; - Реакция нуклеофильного замещения Sn 1, Sn 2 – типа; - При Sn 1 -процессе возможна изомеризация промежуточного карбокатиона в более стабильный за счет 1, 2 -гидридного или алкильного сдвига
Химические свойства б) Межмолекулярная дегидратация: - В условиях кислотного катализа, нагревания с образованием простых эфиров; - Реакция нуклеофильного замещения Sn 1, Sn 2 – типа; - При Sn 1 -процессе возможна изомеризация промежуточного карбокатиона в более стабильный за счет 1, 2 -гидридного или алкильного сдвига
 Присоединение спиртов к алкенам (АN) -При Аn 1 -процессе возможна изомеризация промежуточного карбокатиона в более стабильный за счет 1, 2 -гидридного или алкильного сдвига
Присоединение спиртов к алкенам (АN) -При Аn 1 -процессе возможна изомеризация промежуточного карбокатиона в более стабильный за счет 1, 2 -гидридного или алкильного сдвига
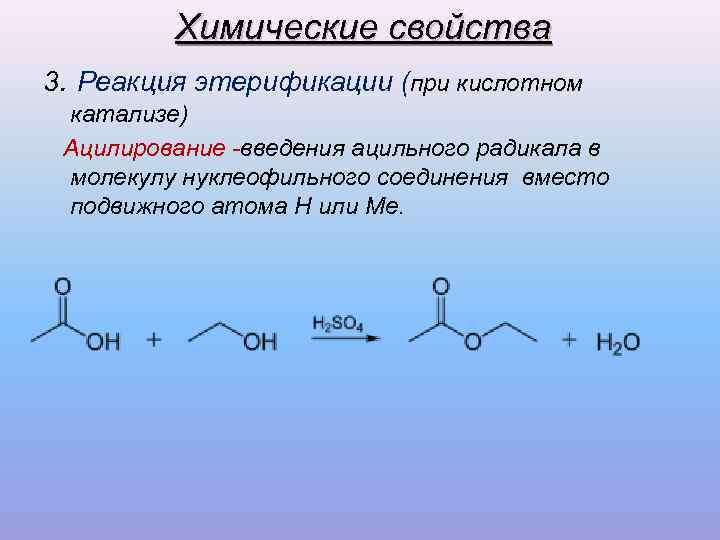
 Химические свойства 3. Реакция этерификации (при кислотном катализе) Ацилирование -введения ацильного радикала в молекулу нуклеофильного соединения вместо подвижного атома Н или Ме.
Химические свойства 3. Реакция этерификации (при кислотном катализе) Ацилирование -введения ацильного радикала в молекулу нуклеофильного соединения вместо подвижного атома Н или Ме.
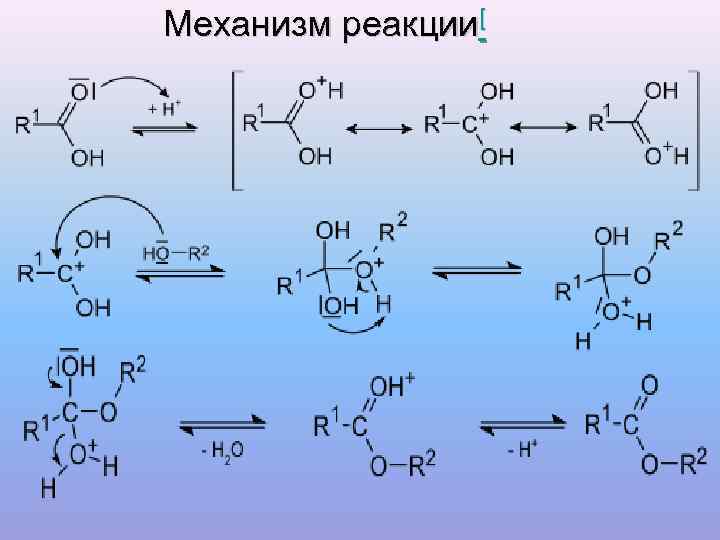
 Механизм реакции[
Механизм реакции[
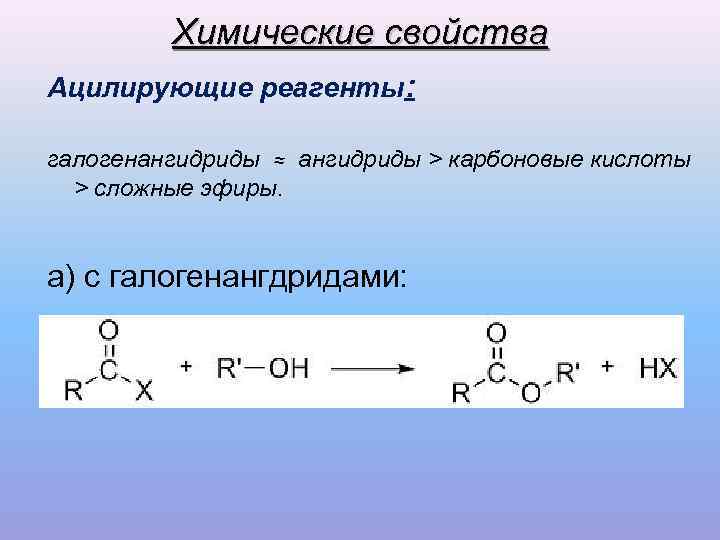
 Химические свойства Ацилирующие реагенты: галогенангидриды ≈ ангидриды > карбоновые кислоты > сложные эфиры. а) с галогенангдридами:
Химические свойства Ацилирующие реагенты: галогенангидриды ≈ ангидриды > карбоновые кислоты > сложные эфиры. а) с галогенангдридами:
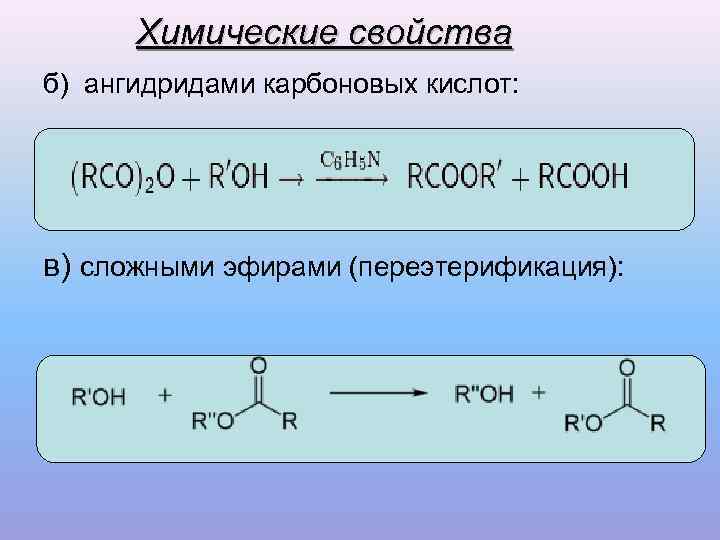
 Химические свойства б) ангидридами карбоновых кислот: в) сложными эфирами (переэтерификация):
Химические свойства б) ангидридами карбоновых кислот: в) сложными эфирами (переэтерификация):
 Химические свойства 4. Галогенирование спиртов а) галогеноводородами: Из-за обратимости реакции, галогенводород берется в избытке.
Химические свойства 4. Галогенирование спиртов а) галогеноводородами: Из-за обратимости реакции, галогенводород берется в избытке.
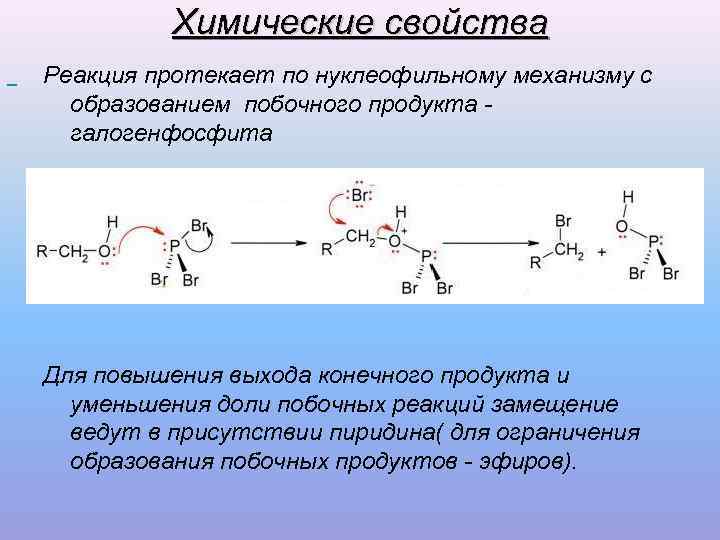
 Химические свойства Реакция протекает по нуклеофильному механизму образованием побочного продукта - с галогенфосфита Для повышения выхода конечного продукта и уменьшения доли побочных реакций замещение ведут в присутствии пиридина( для ограничения образования побочных продуктов - эфиров).
Химические свойства Реакция протекает по нуклеофильному механизму образованием побочного продукта - с галогенфосфита Для повышения выхода конечного продукта и уменьшения доли побочных реакций замещение ведут в присутствии пиридина( для ограничения образования побочных продуктов - эфиров).
 Химические свойства 5. Взаимодейтсвие спиртов с магнийорганическими соединениями: ROH + CH 3 Mg. I → RO-Mg. I + CH 4 По объему выделенного метана устанавливают содержание спирта в исходном образце, либо число ОН- групп в молекуле.
Химические свойства 5. Взаимодейтсвие спиртов с магнийорганическими соединениями: ROH + CH 3 Mg. I → RO-Mg. I + CH 4 По объему выделенного метана устанавливают содержание спирта в исходном образце, либо число ОН- групп в молекуле.
 Химические свойства 6. Окисление спиртов а) Каталитическое: t =300 -500ºC, каt = Ag, Cu, Pt, Pd, Co
Химические свойства 6. Окисление спиртов а) Каталитическое: t =300 -500ºC, каt = Ag, Cu, Pt, Pd, Co
 Химические свойства б) окисление сильными окислителями Первичные спирты образуют альдегиды, которые доокисляются в карбоновые кислоты. Вторичные спирты образуют кетоны, способные окисляться до кислоты и спирта. Третичные спирты устойчивы к действию окислителей, окисляются - в жестких условиях
Химические свойства б) окисление сильными окислителями Первичные спирты образуют альдегиды, которые доокисляются в карбоновые кислоты. Вторичные спирты образуют кетоны, способные окисляться до кислоты и спирта. Третичные спирты устойчивы к действию окислителей, окисляются - в жестких условиях
 Химические свойства 7. Дегидрирование каталитическое: Kat: Cu, Pt, Pd, Ni, Co; t=100 -180ºC R-CH 2 -OH→R-C(O)H +H 2 первичный альдегид R-CH(R’)-OH → R-C(O)-R’ вторичный кетон
Химические свойства 7. Дегидрирование каталитическое: Kat: Cu, Pt, Pd, Ni, Co; t=100 -180ºC R-CH 2 -OH→R-C(O)H +H 2 первичный альдегид R-CH(R’)-OH → R-C(O)-R’ вторичный кетон

