12 Галогенпроизв. алканов.Спирты. Эфиры.pptx
- Количество слайдов: 45
 Алифатические соединения. Галогенпроизводные предельных углеводородов. Спирты. Эфиры
Алифатические соединения. Галогенпроизводные предельных углеводородов. Спирты. Эфиры
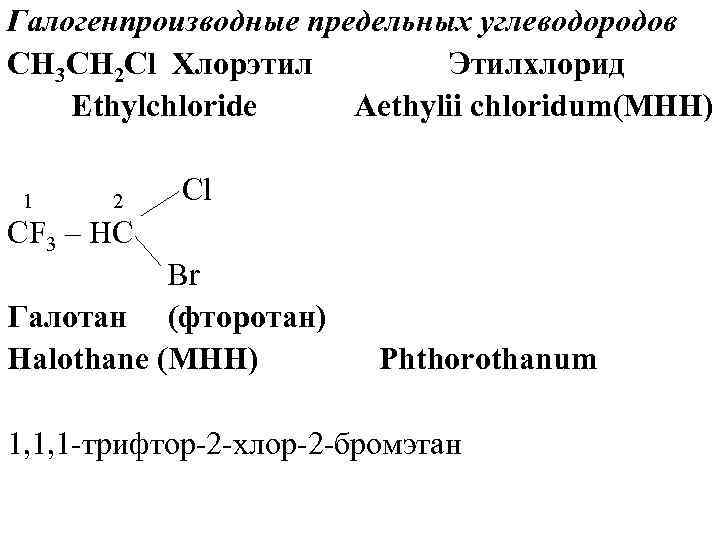 Галогенпроизводные предельных углеводородов CH 3 CH 2 Cl Хлорэтил Этилхлорид Ethylchloride Aethylii chloridum(МНН) 1 2 Cl CF 3 – HC Br Галотан (фторотан) Halothane (МНН) Phthorothanum 1, 1, 1 -трифтор-2 -хлор-2 -бромэтан
Галогенпроизводные предельных углеводородов CH 3 CH 2 Cl Хлорэтил Этилхлорид Ethylchloride Aethylii chloridum(МНН) 1 2 Cl CF 3 – HC Br Галотан (фторотан) Halothane (МНН) Phthorothanum 1, 1, 1 -трифтор-2 -хлор-2 -бромэтан
 Получение Хлорэтил С 2 Н 5 ОН + НСI → С 2 Н 5 СI + Н 2 О Галотан (фторотан) F 3 C – CH 2 CI + Br 2 → F 3 C – CHCIBr + HBr физические константы: 1) температурные пределы перегонки (Ткип. ) 2) плотность. Хлорэтил Ткип 12 - 13°, ρ – ареометром Фторотан (галотан) Ткип 49 -51°, ρ – пикнометром.
Получение Хлорэтил С 2 Н 5 ОН + НСI → С 2 Н 5 СI + Н 2 О Галотан (фторотан) F 3 C – CH 2 CI + Br 2 → F 3 C – CHCIBr + HBr физические константы: 1) температурные пределы перегонки (Ткип. ) 2) плотность. Хлорэтил Ткип 12 - 13°, ρ – ареометром Фторотан (галотан) Ткип 49 -51°, ρ – пикнометром.
 3)Для отличия галотана от хлороформа ρ галотана = 1, 865 – 1, 870 ρ СНСI 3 = 1, 470 ρ H 2 SO 4 к = 1, 8300 галотан в нижнем слое, а хлороформ - в верхнем. для галотана дополнительно: 1. показатель преломления – качественная и количественная оценка. 2. ИК спектр Реакции на ЛВ после минерализации Условия зависят от прочности связи С – Hal фтор – хлор – бром – йод.
3)Для отличия галотана от хлороформа ρ галотана = 1, 865 – 1, 870 ρ СНСI 3 = 1, 470 ρ H 2 SO 4 к = 1, 8300 галотан в нижнем слое, а хлороформ - в верхнем. для галотана дополнительно: 1. показатель преломления – качественная и количественная оценка. 2. ИК спектр Реакции на ЛВ после минерализации Условия зависят от прочности связи С – Hal фтор – хлор – бром – йод.
 1) ФС хлорэтила спиртовым раствором гидроксида калия при нагревании to C 2 H 5 Cl + KOH → C 2 H 5 OH + KCl HN 03 СI + Ag. NO 3 → Ag. СI↓ + NO 3 белый твор. осадок 2)ФС Галотан с помощью расплавленного металлического натрия.
1) ФС хлорэтила спиртовым раствором гидроксида калия при нагревании to C 2 H 5 Cl + KOH → C 2 H 5 OH + KCl HN 03 СI + Ag. NO 3 → Ag. СI↓ + NO 3 белый твор. осадок 2)ФС Галотан с помощью расплавленного металлического натрия.
 ализариновый красный + нитрат циркония бесцветный нефармакопейные реакции на фторид-ионы – обесцвечивание раствора роданида железа Fe(SCN)3 + 6 Na. F → Na 3[Fe. F 6] + 3 Na. SCN красный бесцветный –осаждение кальция хлоридом 2 F- + Ca 2+ → Ca. F 2 ↓ белый осадок
ализариновый красный + нитрат циркония бесцветный нефармакопейные реакции на фторид-ионы – обесцвечивание раствора роданида железа Fe(SCN)3 + 6 Na. F → Na 3[Fe. F 6] + 3 Na. SCN красный бесцветный –осаждение кальция хлоридом 2 F- + Ca 2+ → Ca. F 2 ↓ белый осадок
 чистота Хлорэтил 2)этанол – недопустимая примесь – реакция йодоформной пробы Фторотан 2) недопустимые СI- и Br- с Ag. NO 3 не должно быть опалесценции 3) недопустимые свободные СI 2 и Br 2 - KI и крахмал не должно появляться синее окрашивание (I 2)
чистота Хлорэтил 2)этанол – недопустимая примесь – реакция йодоформной пробы Фторотан 2) недопустимые СI- и Br- с Ag. NO 3 не должно быть опалесценции 3) недопустимые свободные СI 2 и Br 2 - KI и крахмал не должно появляться синее окрашивание (I 2)
 5) 0, 01% раствор тимола– стабилизатор в галотане определяют калориметрически д. б. в интервале 0, 008 -0, 012%. Количественное определение хлорэтила и фторотана по ФС не предусмотрено
5) 0, 01% раствор тимола– стабилизатор в галотане определяют калориметрически д. б. в интервале 0, 008 -0, 012%. Количественное определение хлорэтила и фторотана по ФС не предусмотрено
 Спирты 2. 2 C 2 H 5 OH + 2 Na → 2 C 2 H 5 ONa + H 2↑ 3. Сложные и простые эфиры 2 R – CH 2 – OH → R – CH 2 – O – CH 2 – R 4. Окисление первичных и вторичных спиртов
Спирты 2. 2 C 2 H 5 OH + 2 Na → 2 C 2 H 5 ONa + H 2↑ 3. Сложные и простые эфиры 2 R – CH 2 – OH → R – CH 2 – O – CH 2 – R 4. Окисление первичных и вторичных спиртов
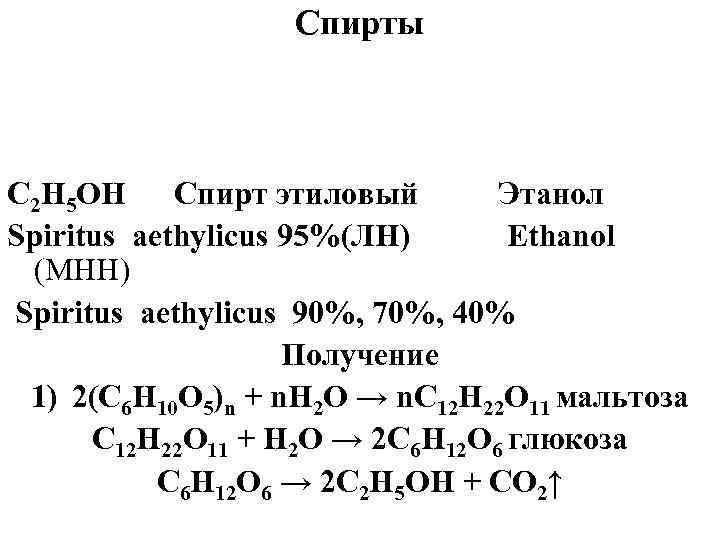 Спирты C 2 H 5 OH Спирт этиловый Этанол Spiritus aethylicus 95%(ЛН) Ethanol (МНН) Spiritus aethylicus 90%, 70%, 40% Получение 1) 2(С 6 Н 10 О 5)n + n. H 2 O → n. C 12 H 22 O 11 мальтоза C 12 H 22 O 11 + Н 2 О → 2 С 6 Н 12 О 6 глюкоза С 6 Н 12 О 6 → 2 С 2 Н 5 ОН + СО 2↑
Спирты C 2 H 5 OH Спирт этиловый Этанол Spiritus aethylicus 95%(ЛН) Ethanol (МНН) Spiritus aethylicus 90%, 70%, 40% Получение 1) 2(С 6 Н 10 О 5)n + n. H 2 O → n. C 12 H 22 O 11 мальтоза C 12 H 22 O 11 + Н 2 О → 2 С 6 Н 12 О 6 глюкоза С 6 Н 12 О 6 → 2 С 2 Н 5 ОН + СО 2↑
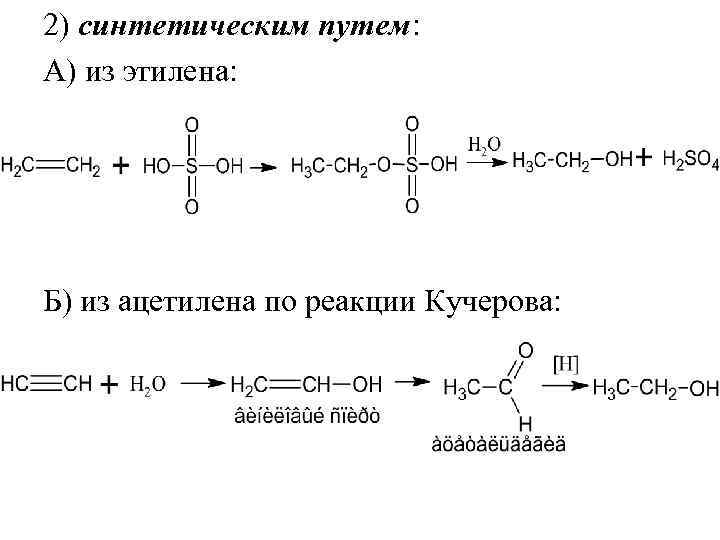 2) синтетическим путем: А) из этилена: Б) из ацетилена по реакции Кучерова:
2) синтетическим путем: А) из этилена: Б) из ацетилена по реакции Кучерова:
 Подлинность Физические показатели и константы подлинности Структура латинское Объемна Т кип, о. С и название я доля, химическое % название 1 2 3 4 C 2 H 5 OH Spiritus 95 -96 78 Спирт aethylicus этиловый 95% этанол C 2 H 5 OH Spiritus Спирт aethylicus 90 -91 этиловый 90% 70 -71 этанол 70% 39. 5 -40. 5 40% Плотность, г/см 3 5 0. 812 -0. 808 0. 830 -0. 826 0. 886 -0. 883 0. 949 -0. 947
Подлинность Физические показатели и константы подлинности Структура латинское Объемна Т кип, о. С и название я доля, химическое % название 1 2 3 4 C 2 H 5 OH Spiritus 95 -96 78 Спирт aethylicus этиловый 95% этанол C 2 H 5 OH Spiritus Спирт aethylicus 90 -91 этиловый 90% 70 -71 этанол 70% 39. 5 -40. 5 40% Плотность, г/см 3 5 0. 812 -0. 808 0. 830 -0. 826 0. 886 -0. 883 0. 949 -0. 947
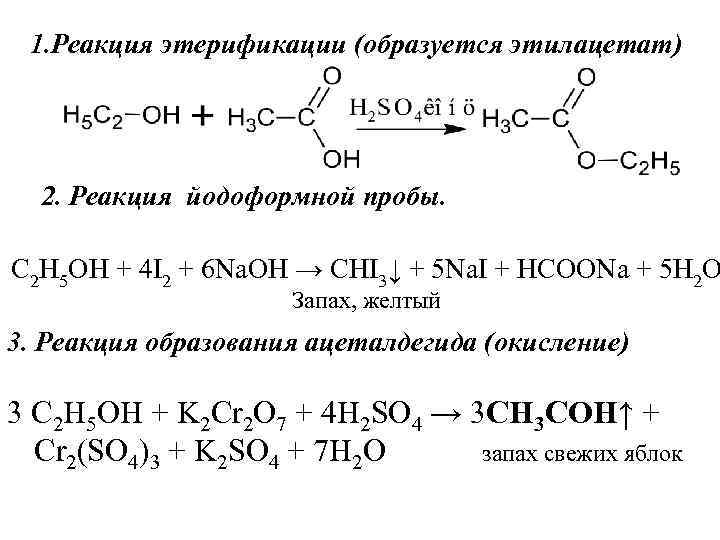 1. Реакция этерификации (образуется этилацетат) 2. Реакция йодоформной пробы. C 2 H 5 OH + 4 I 2 + 6 Na. OH → CHI 3↓ + 5 Na. I + HCOONa + 5 H 2 O Запах, желтый 3. Реакция образования ацеталдегида (окисление) 3 C 2 H 5 OH + K 2 Cr 2 O 7 + 4 H 2 SO 4 → 3 CH 3 COH↑ + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O запах свежих яблок
1. Реакция этерификации (образуется этилацетат) 2. Реакция йодоформной пробы. C 2 H 5 OH + 4 I 2 + 6 Na. OH → CHI 3↓ + 5 Na. I + HCOONa + 5 H 2 O Запах, желтый 3. Реакция образования ацеталдегида (окисление) 3 C 2 H 5 OH + K 2 Cr 2 O 7 + 4 H 2 SO 4 → 3 CH 3 COH↑ + Cr 2(SO 4)3 + K 2 SO 4 + 7 H 2 O запах свежих яблок
 Специфические примеси 1. Допустимое содержание примеси альдегидов с фуксинсернистой кислотой
Специфические примеси 1. Допустимое содержание примеси альдегидов с фуксинсернистой кислотой
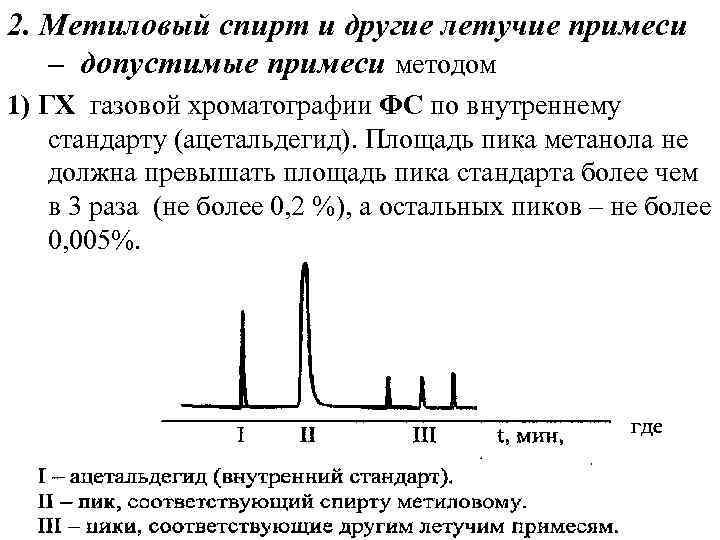 2. Метиловый спирт и другие летучие примеси – допустимые примеси методом 1) ГХ газовой хроматографии ФС по внутреннему стандарту (ацетальдегид). Площадь пика метанола не должна превышать площадь пика стандарта более чем в 3 раза (не более 0, 2 %), а остальных пиков – не более 0, 005%.
2. Метиловый спирт и другие летучие примеси – допустимые примеси методом 1) ГХ газовой хроматографии ФС по внутреннему стандарту (ацетальдегид). Площадь пика метанола не должна превышать площадь пика стандарта более чем в 3 раза (не более 0, 2 %), а остальных пиков – не более 0, 005%.
 2) методом ГЖХ на приборе с пламенноионизационным детектором, используя в качестве внутреннего стандарта уксусный альдегид. 3) По МФ реакция окисления калия перманганатом в присутствии фосфорной кислоты до формальдегида, который открывают хромотроповой кислотой (фиолетовое окрашивание) 5 CH 3 OH + 2 KMn. O 4 + 3 H 3 PO 4 → 5 HCOH + 2 Mn. HPO 4 + K 2 HPO 4 + 8 H 2 O
2) методом ГЖХ на приборе с пламенноионизационным детектором, используя в качестве внутреннего стандарта уксусный альдегид. 3) По МФ реакция окисления калия перманганатом в присутствии фосфорной кислоты до формальдегида, который открывают хромотроповой кислотой (фиолетовое окрашивание) 5 CH 3 OH + 2 KMn. O 4 + 3 H 3 PO 4 → 5 HCOH + 2 Mn. HPO 4 + K 2 HPO 4 + 8 H 2 O

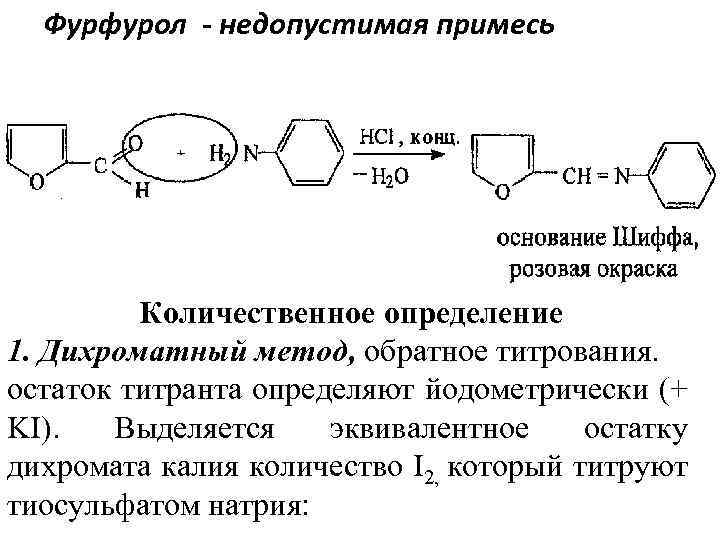 Фурфурол - недопустимая примесь Количественное определение 1. Дихроматный метод, обратное титрования. остаток титранта определяют йодометрически (+ KI). Выделяется эквивалентное остатку дихромата калия количество I 2, который титруют тиосульфатом натрия:
Фурфурол - недопустимая примесь Количественное определение 1. Дихроматный метод, обратное титрования. остаток титранта определяют йодометрически (+ KI). Выделяется эквивалентное остатку дихромата калия количество I 2, который титруют тиосульфатом натрия:
 3 C 2 H 5 OH + 2 K 2 Cr 2 O 7 + 8 HNO 3 → Cr(NO 3)3 избыток + 3 CH 3 COH + KNO 3 + 7 H 2 O K 2 Cr 2 O 7 + 6 KI + 14 HNO 3 → 2 Cr(NO 3)3 + 3 I 2 остаток +8 KNO 3 + 7 H 2 O 3 I 2 + 6 Na 2 S 2 O 3 → 6 Na. I + 3 Na 2 S 4 O 6 Кстех = 3/2; Титрант УЧ (1/6 K 2 Cr 2 O 7) fэкв = Кстех· УЧ= 3/2· 1/6 = 1/4 ;
3 C 2 H 5 OH + 2 K 2 Cr 2 O 7 + 8 HNO 3 → Cr(NO 3)3 избыток + 3 CH 3 COH + KNO 3 + 7 H 2 O K 2 Cr 2 O 7 + 6 KI + 14 HNO 3 → 2 Cr(NO 3)3 + 3 I 2 остаток +8 KNO 3 + 7 H 2 O 3 I 2 + 6 Na 2 S 2 O 3 → 6 Na. I + 3 Na 2 S 4 O 6 Кстех = 3/2; Титрант УЧ (1/6 K 2 Cr 2 O 7) fэкв = Кстех· УЧ= 3/2· 1/6 = 1/4 ;
 2. метод ацетилирования (косвенный) – образование сложных эфиров с уксусным ангидридом в среде безводного пиридина при кипячении. остаток уксусного ангидрида гидролизуют (2 -ая реакция). Уксусная кислота, выделившаяся в 1 ой и 2 -ой реакциях, титруется раствором гидроксида натрия. Параллельно проводят контрольный опыт. Разница объемов натрия гидроксида в контрольном и основном опытах берется для расчетов.
2. метод ацетилирования (косвенный) – образование сложных эфиров с уксусным ангидридом в среде безводного пиридина при кипячении. остаток уксусного ангидрида гидролизуют (2 -ая реакция). Уксусная кислота, выделившаяся в 1 ой и 2 -ой реакциях, титруется раствором гидроксида натрия. Параллельно проводят контрольный опыт. Разница объемов натрия гидроксида в контрольном и основном опытах берется для расчетов.
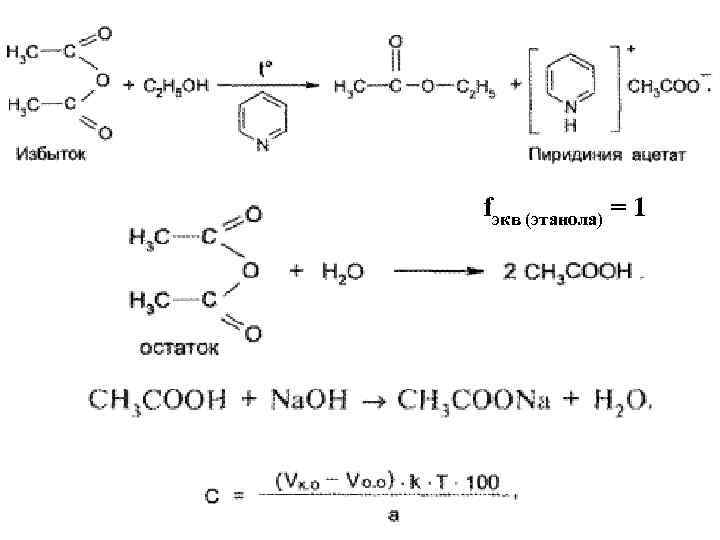 fэкв (этанола) = 1
fэкв (этанола) = 1
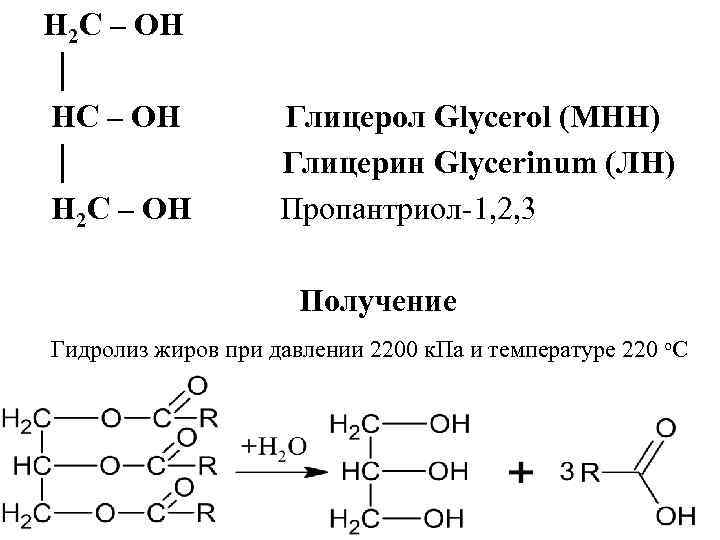 H 2 C – OH │ HC – OH Глицерол Glycerol (МНН) │ Глицерин Glycerinum (ЛН) H 2 C – OH Пропантриол-1, 2, 3 Получение Гидролиз жиров при давлении 2200 к. Па и температуре 220 о. С
H 2 C – OH │ HC – OH Глицерол Glycerol (МНН) │ Глицерин Glycerinum (ЛН) H 2 C – OH Пропантриол-1, 2, 3 Получение Гидролиз жиров при давлении 2200 к. Па и температуре 220 о. С
 МНН, Объемная латинское доля, % название 2 Glycerol Glycerinum 3 88 -91 Т кип. , о. С Плотность, г/см 3 4 5 290 1, 223 -1, 233
МНН, Объемная латинское доля, % название 2 Glycerol Glycerinum 3 88 -91 Т кип. , о. С Плотность, г/см 3 4 5 290 1, 223 -1, 233
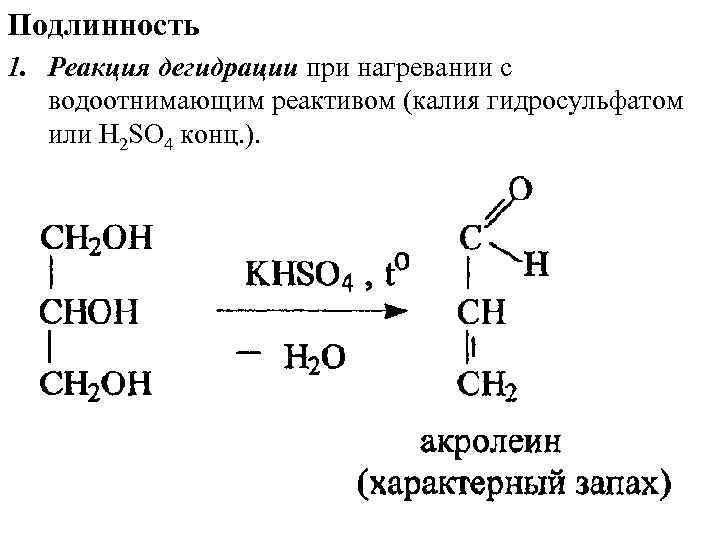 Подлинность 1. Реакция дегидрации при нагревании с водоотнимающим реактивом (калия гидросульфатом или H 2 SO 4 конц. ).
Подлинность 1. Реакция дегидрации при нагревании с водоотнимающим реактивом (калия гидросульфатом или H 2 SO 4 конц. ).
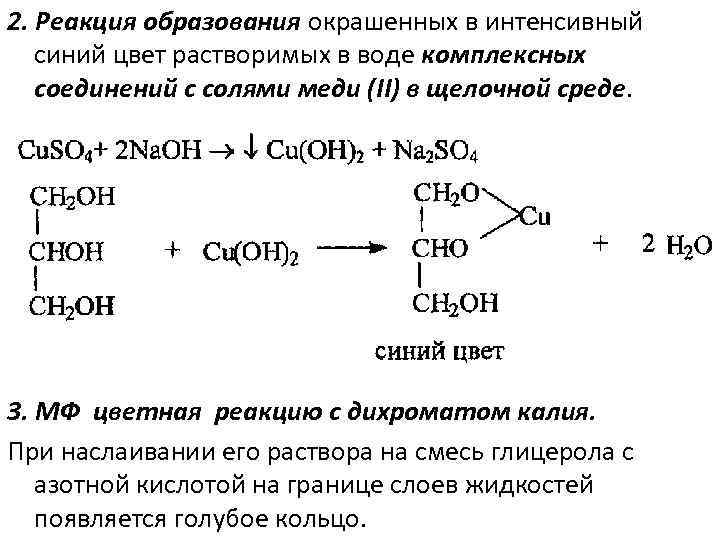 2. Реакция образования окрашенных в интенсивный синий цвет растворимых в воде комплексных соединений с солями меди (II) в щелочной среде. 3. МФ цветная реакцию с дихроматом калия. При наслаивании его раствора на смесь глицерола с азотной кислотой на границе слоев жидкостей появляется голубое кольцо.
2. Реакция образования окрашенных в интенсивный синий цвет растворимых в воде комплексных соединений с солями меди (II) в щелочной среде. 3. МФ цветная реакцию с дихроматом калия. При наслаивании его раствора на смесь глицерола с азотной кислотой на границе слоев жидкостей появляется голубое кольцо.
 Чистота акролеин и другие восстанавливающие вещества – недопустимая примесь. Количественное определение Перйодатный метод (ФС) титрант- йодная кислота, обратный. Остаток йодной кислоты HIO 4 и образующуюся в эквивалентном количестве по отношению к глицеролу йодноватую кислоту HIO 3 определяют йодометрически (+ KI) в среде H 2 SO 4.
Чистота акролеин и другие восстанавливающие вещества – недопустимая примесь. Количественное определение Перйодатный метод (ФС) титрант- йодная кислота, обратный. Остаток йодной кислоты HIO 4 и образующуюся в эквивалентном количестве по отношению к глицеролу йодноватую кислоту HIO 3 определяют йодометрически (+ KI) в среде H 2 SO 4.
 +7 +5 2 HIO 4 + 14 KI + 7 H 2 SO 4 → 8 I 2 + 7 K 2 SO 4 + 8 H 2 O остаток 2 HIO 3 + 10 KI + 5 H 2 SO 4 → 6 I 2 + 5 K 2 SO 4+ 6 H 2 O I 2 + 2 Na 2 SO 3 → 2 Na. I + Na 2 S 4 O 6 fэкв (глицерина) = ½·½=¼ Параллельно проводят контрольный опыт. Содержание глицерина должно быть от 84% до 88%.
+7 +5 2 HIO 4 + 14 KI + 7 H 2 SO 4 → 8 I 2 + 7 K 2 SO 4 + 8 H 2 O остаток 2 HIO 3 + 10 KI + 5 H 2 SO 4 → 6 I 2 + 5 K 2 SO 4+ 6 H 2 O I 2 + 2 Na 2 SO 3 → 2 Na. I + Na 2 S 4 O 6 fэкв (глицерина) = ½·½=¼ Параллельно проводят контрольный опыт. Содержание глицерина должно быть от 84% до 88%.
 По МФ кислоту муравьиную оттитровывают раствором натрия гидроксида. Параллельно проводят контрольный опыт НСООН + Na. OH → HCOONa + H 2 O fэкв (глицерина) = 1 нефармакопейные методы 1. По плотности растворов 2. Рефрактометрически 3. Метод ацетилирования – косвенный способ алкалиметрии по реакции этерификации.
По МФ кислоту муравьиную оттитровывают раствором натрия гидроксида. Параллельно проводят контрольный опыт НСООН + Na. OH → HCOONa + H 2 O fэкв (глицерина) = 1 нефармакопейные методы 1. По плотности растворов 2. Рефрактометрически 3. Метод ацетилирования – косвенный способ алкалиметрии по реакции этерификации.
 Кстех = 1/3; Раствор гидроксида натрия РЧ (1) fэкв = Кстех · РЧ= 1/3· 1 = 1/3; Параллельно проводят контрольный опыт, данные которого учитывают при расчете:
Кстех = 1/3; Раствор гидроксида натрия РЧ (1) fэкв = Кстех · РЧ= 1/3· 1 = 1/3; Параллельно проводят контрольный опыт, данные которого учитывают при расчете:
 Простые и сложные алифатические эфиры R – O – R 1 В химическом отношении мало реакционноспособны. 1) способны легко окисляться до пероксидов 2) способны к образованию оксониевых солей с конц. кислотами ( часто окрашены-димедрол), атом кислорода простого эфира имеет 2 пары свободных электронов, которые притягивают к себе протон кислот. Оксониевые соли легко разлагаются под действием воды.
Простые и сложные алифатические эфиры R – O – R 1 В химическом отношении мало реакционноспособны. 1) способны легко окисляться до пероксидов 2) способны к образованию оксониевых солей с конц. кислотами ( часто окрашены-димедрол), атом кислорода простого эфира имеет 2 пары свободных электронов, которые притягивают к себе протон кислот. Оксониевые соли легко разлагаются под действием воды.
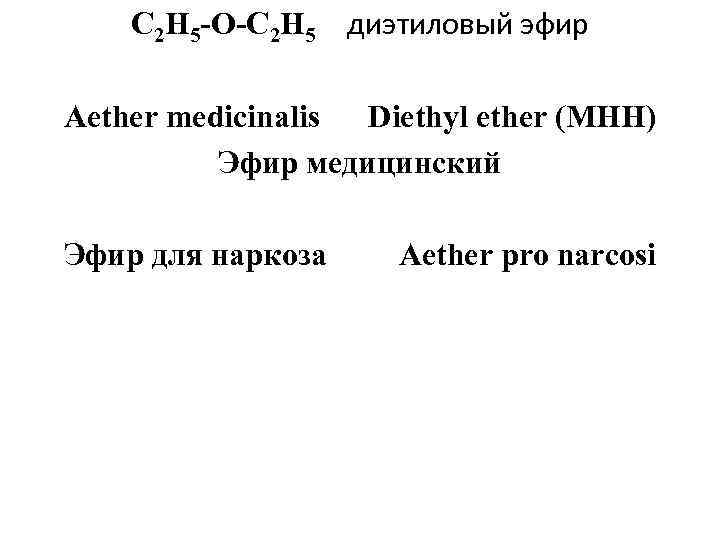 С 2 Н 5 -О-С 2 Н 5 диэтиловый эфир Aether medicinalis Diethyl ether (МНН) Эфир медицинский Эфир для наркоза Aether pro narcosi
С 2 Н 5 -О-С 2 Н 5 диэтиловый эфир Aether medicinalis Diethyl ether (МНН) Эфир медицинский Эфир для наркоза Aether pro narcosi
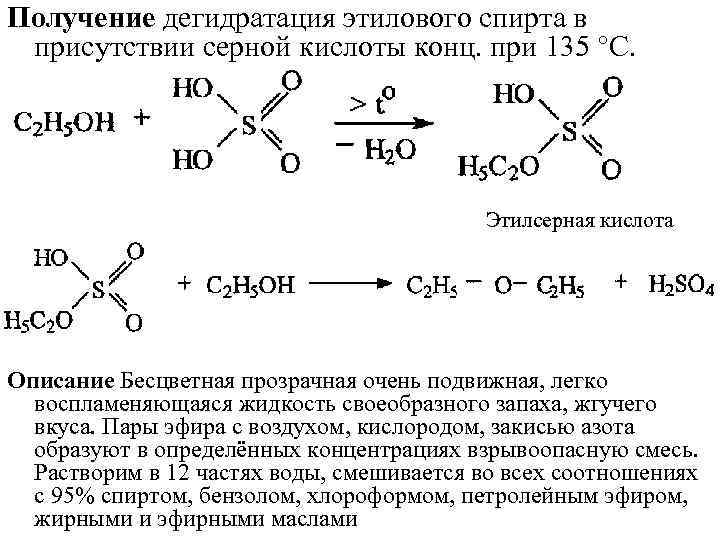 Получение дегидратация этилового спирта в присутствии серной кислоты конц. при 135 °С. Этилсерная кислота Описание Бесцветная прозрачная очень подвижная, легко воспламеняющаяся жидкость своеобразного запаха, жгучего вкуса. Пары эфира с воздухом, кислородом, закисью азота образуют в определённых концентрациях взрывоопасную смесь. Растворим в 12 частях воды, смешивается во всех соотношениях с 95% спиртом, бензолом, хлороформом, петролейным эфиром, жирными и эфирными маслами
Получение дегидратация этилового спирта в присутствии серной кислоты конц. при 135 °С. Этилсерная кислота Описание Бесцветная прозрачная очень подвижная, легко воспламеняющаяся жидкость своеобразного запаха, жгучего вкуса. Пары эфира с воздухом, кислородом, закисью азота образуют в определённых концентрациях взрывоопасную смесь. Растворим в 12 частях воды, смешивается во всех соотношениях с 95% спиртом, бензолом, хлороформом, петролейным эфиром, жирными и эфирными маслами
 Подлинность 1) Температурные пределы перегонки. Т кип. , о. С. 34 -35 2) Плотность, г/см 3 0, 713 -0, 714 В химическом отношении мало реакционноспособны. 1) способны легко окисляться до пероксидов 2) способны к образованию оксониевых солей с конц. кислотами ( часто окрашены-димедрол) атом кислорода простого эфира имеет 2 пары свободных электронов, которые притягивают к себе протон кислот. Оксониевые соли легко разлагаются под действием воды.
Подлинность 1) Температурные пределы перегонки. Т кип. , о. С. 34 -35 2) Плотность, г/см 3 0, 713 -0, 714 В химическом отношении мало реакционноспособны. 1) способны легко окисляться до пероксидов 2) способны к образованию оксониевых солей с конц. кислотами ( часто окрашены-димедрол) атом кислорода простого эфира имеет 2 пары свободных электронов, которые притягивают к себе протон кислот. Оксониевые соли легко разлагаются под действием воды.
 Чистота - Кислотность - Нелетучий остаток (минеральные примеси). Определяют методом высушивания не б. 0, 001 г – Перекиси, с калия йодидом не д. б. пожелтения водного и эфирного слоя С 2 Н 5– О – О–С 2 Н 5 + 2 КУ → У 2 + С 2 Н 5– О–С 2 Н 5 + 2 КОН – альдегиды – с реактивом Несслера. допускается лишь слабая опалесценция, изменение окраски и помутнения не д. б. В медицинском- допускается желто – бурая окраска и помутнение. CH 3 - C + 3 KOH + K 2 Hg. I 4 → Hg↓ +CH 3 COOK + H 4 KI+ 2 H 2 O
Чистота - Кислотность - Нелетучий остаток (минеральные примеси). Определяют методом высушивания не б. 0, 001 г – Перекиси, с калия йодидом не д. б. пожелтения водного и эфирного слоя С 2 Н 5– О – О–С 2 Н 5 + 2 КУ → У 2 + С 2 Н 5– О–С 2 Н 5 + 2 КОН – альдегиды – с реактивом Несслера. допускается лишь слабая опалесценция, изменение окраски и помутнения не д. б. В медицинском- допускается желто – бурая окраска и помутнение. CH 3 - C + 3 KOH + K 2 Hg. I 4 → Hg↓ +CH 3 COOK + H 4 KI+ 2 H 2 O
 - примесь посторонних пахнущих веществ (сивушный масел) устанавливают, выпаривая 10 мл эфира, который постепенно приливают на фильтровальную бумагу: недолжно оставаться постороннего запаха. - примесь кислот (уксусная, сернистая, серная кислота) нейтрализуют водное извлечение по ф/ф (не >0, 08 мл 0, 02 н Na. OH) В эфире для наркоза определяют воду с пикриновой кислотой. Она растворяется в воде, содержащейся в эфире, и окрашивает раствор. Или реактивом Фишера.
- примесь посторонних пахнущих веществ (сивушный масел) устанавливают, выпаривая 10 мл эфира, который постепенно приливают на фильтровальную бумагу: недолжно оставаться постороннего запаха. - примесь кислот (уксусная, сернистая, серная кислота) нейтрализуют водное извлечение по ф/ф (не >0, 08 мл 0, 02 н Na. OH) В эфире для наркоза определяют воду с пикриновой кислотой. Она растворяется в воде, содержащейся в эфире, и окрашивает раствор. Или реактивом Фишера.
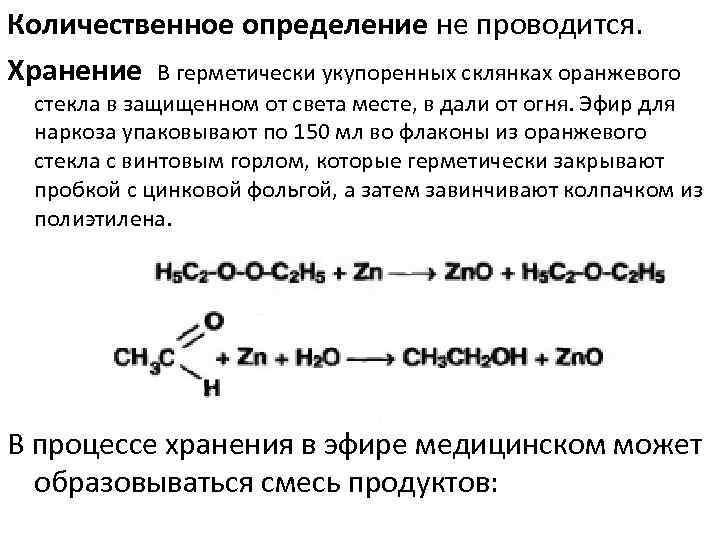 Количественное определение не проводится. Хранение В герметически укупоренных склянках оранжевого стекла в защищенном от света месте, в дали от огня. Эфир для наркоза упаковывают по 150 мл во флаконы из оранжевого стекла с винтовым горлом, которые герметически закрывают пробкой с цинковой фольгой, а затем завинчивают колпачком из полиэтилена. В процессе хранения в эфире медицинском может образовываться смесь продуктов:
Количественное определение не проводится. Хранение В герметически укупоренных склянках оранжевого стекла в защищенном от света месте, в дали от огня. Эфир для наркоза упаковывают по 150 мл во флаконы из оранжевого стекла с винтовым горлом, которые герметически закрывают пробкой с цинковой фольгой, а затем завинчивают колпачком из полиэтилена. В процессе хранения в эфире медицинском может образовываться смесь продуктов:
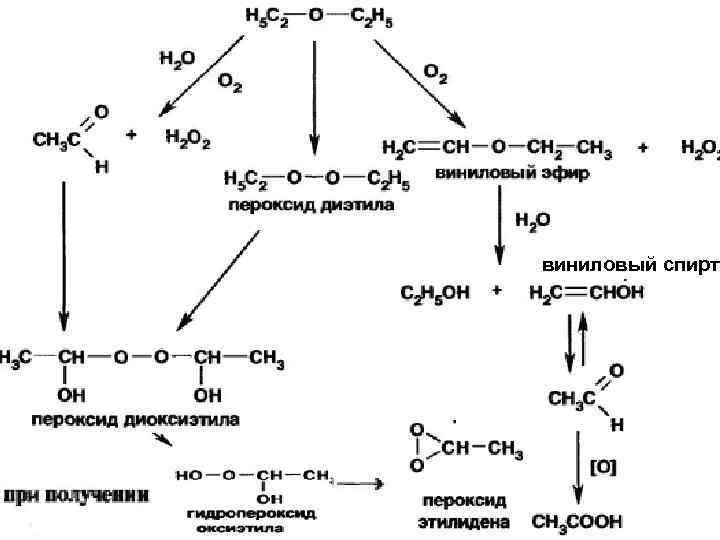 виниловый спирт
виниловый спирт
 Применение: Эфир медицинский – растворитель в химическом анализе, входит в состав наружных лекарственных форм. Эфир для наркоза – для ингаляционного наркоза.
Применение: Эфир медицинский – растворитель в химическом анализе, входит в состав наружных лекарственных форм. Эфир для наркоза – для ингаляционного наркоза.
 сложные эфиры Нитроглицерин Nitroglycerin (МНН) Nitroglycerinum (ЛН) Тринитрат глицирина Подлинность 1. Реакция щелочного гидролиза с последующим образованием акролеина→острый характерный запах, если к продуктам щелочного гидролиза добавить гидросульфат калия и нагреть,
сложные эфиры Нитроглицерин Nitroglycerin (МНН) Nitroglycerinum (ЛН) Тринитрат глицирина Подлинность 1. Реакция щелочного гидролиза с последующим образованием акролеина→острый характерный запах, если к продуктам щелочного гидролиза добавить гидросульфат калия и нагреть,
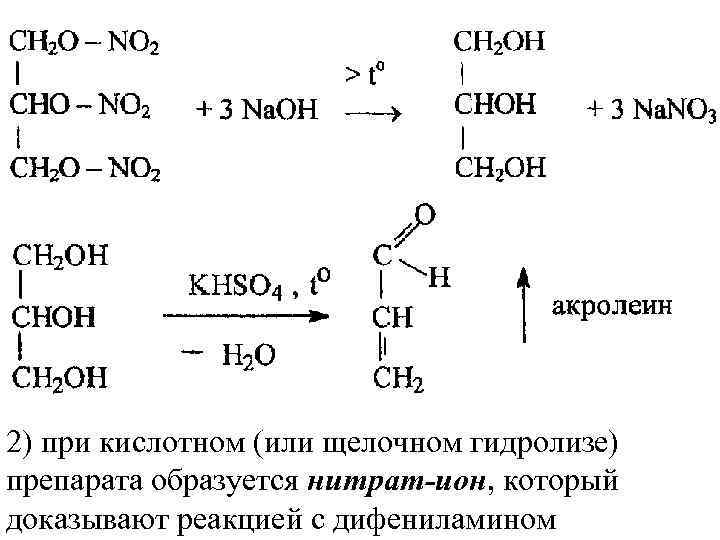 2) при кислотном (или щелочном гидролизе) препарата образуется нитрат-ион, который доказывают реакцией с дифениламином
2) при кислотном (или щелочном гидролизе) препарата образуется нитрат-ион, который доказывают реакцией с дифениламином
 Количественное определение 1) алкалиметрия, основана на реакции омыления в присутствии Н 2 О 2, при этом одновременно идет гидролиз и окисление продуктов гидролиза 2)Спектрофотометрия в ВО спектра. Метод основан на кислотном гидролизе и на нитровании реактива - фенолдисульфоновой кислоты (I), выделившейся при гидролизе азотной кислотой. С раствором аммиака - образуется ацисоль орто-хиноидной структуры (III) желтой окраски. Измеряют D при λ=410 нм. 3) ВЭЖХ
Количественное определение 1) алкалиметрия, основана на реакции омыления в присутствии Н 2 О 2, при этом одновременно идет гидролиз и окисление продуктов гидролиза 2)Спектрофотометрия в ВО спектра. Метод основан на кислотном гидролизе и на нитровании реактива - фенолдисульфоновой кислоты (I), выделившейся при гидролизе азотной кислотой. С раствором аммиака - образуется ацисоль орто-хиноидной структуры (III) желтой окраски. Измеряют D при λ=410 нм. 3) ВЭЖХ

 Хранение небольшими количествами, в хорошо укупоренных склянках, в прохладном, защищенном от света месте, вдали от огня. При хранении следует соблюдать большую осторожность, т. к. от удара или при нагревании до 180˚С взрывается в следствии разложения с образованием большого количества газов: 4 С 3 Н 5(ОNО 2)3 → 6 N 2↑ + 12 СО 2↑ + 10 Н 2 О Пролитый следует сразу же залить раствором гидроксида калия или карбонатом натрия для гидролиза препарата: С 3 Н 5(ОNО 2)3 + 3 КОН → С 3 Н 5(ОН)3 + 3 КNО 3 При работе с препаратом необходимо знать, что при соприкосновении нитроглицерина или его растворов (даже в малых количествах) с кожей и слизистой оболочкой может вызвать сильные головные боли.
Хранение небольшими количествами, в хорошо укупоренных склянках, в прохладном, защищенном от света месте, вдали от огня. При хранении следует соблюдать большую осторожность, т. к. от удара или при нагревании до 180˚С взрывается в следствии разложения с образованием большого количества газов: 4 С 3 Н 5(ОNО 2)3 → 6 N 2↑ + 12 СО 2↑ + 10 Н 2 О Пролитый следует сразу же залить раствором гидроксида калия или карбонатом натрия для гидролиза препарата: С 3 Н 5(ОNО 2)3 + 3 КОН → С 3 Н 5(ОН)3 + 3 КNО 3 При работе с препаратом необходимо знать, что при соприкосновении нитроглицерина или его растворов (даже в малых количествах) с кожей и слизистой оболочкой может вызвать сильные головные боли.
 Применение Спазмолитическое и коронарорасширяющее средство (антиангинальное средство). Применяют чаще сублингвально для купирования приступов стенокардии. Установлено, что нитроглицерин является пролекарством, которое в организме превращается в нитрат-ион. Нитрат-ион восстанавливается гемоглобином крови и железосодержащими ферментами в монооксид азота: NО 3 - + 3 Fе 2+ + 4 Н+ → NО + 3 Fе 3+ + Н 2 О За это открытие в 1998 году была присуждена нобелевская премия.
Применение Спазмолитическое и коронарорасширяющее средство (антиангинальное средство). Применяют чаще сублингвально для купирования приступов стенокардии. Установлено, что нитроглицерин является пролекарством, которое в организме превращается в нитрат-ион. Нитрат-ион восстанавливается гемоглобином крови и железосодержащими ферментами в монооксид азота: NО 3 - + 3 Fе 2+ + 4 Н+ → NО + 3 Fе 3+ + Н 2 О За это открытие в 1998 году была присуждена нобелевская премия.
 Лекарственные формы нитроглицерина: - пероральные: таблетки нитрогранулонга мите – 2, 9 мг и форте – 5, 2 мг; нитрокор – 6, 5 мг в микрокапсулах, сустак мите (2, 6 мг) и форте (2, 6 и 6, 5 мг); - трансдермальные: нитро 2% мазь, мазь нитронг, пластыри и диски депонит, нитродерм ТТS, нитродиск, трансдерм-нитро; - аэрозольные: нитролингвал-аэрозоль; - буккальные: тринитролонг (1, 2, 4 мг); сусардин и сускард (1, 2, 3, 5, мг), - для внутривенных инъекций (ампулированный 0, 1%-ный раствор в изотоническом растворе глюкозы
Лекарственные формы нитроглицерина: - пероральные: таблетки нитрогранулонга мите – 2, 9 мг и форте – 5, 2 мг; нитрокор – 6, 5 мг в микрокапсулах, сустак мите (2, 6 мг) и форте (2, 6 и 6, 5 мг); - трансдермальные: нитро 2% мазь, мазь нитронг, пластыри и диски депонит, нитродерм ТТS, нитродиск, трансдерм-нитро; - аэрозольные: нитролингвал-аэрозоль; - буккальные: тринитролонг (1, 2, 4 мг); сусардин и сускард (1, 2, 3, 5, мг), - для внутривенных инъекций (ампулированный 0, 1%-ный раствор в изотоническом растворе глюкозы


