Клеточная биология 2013.ppt
- Количество слайдов: 26

Алексей Юрьевич Лупатов, к. б. н.
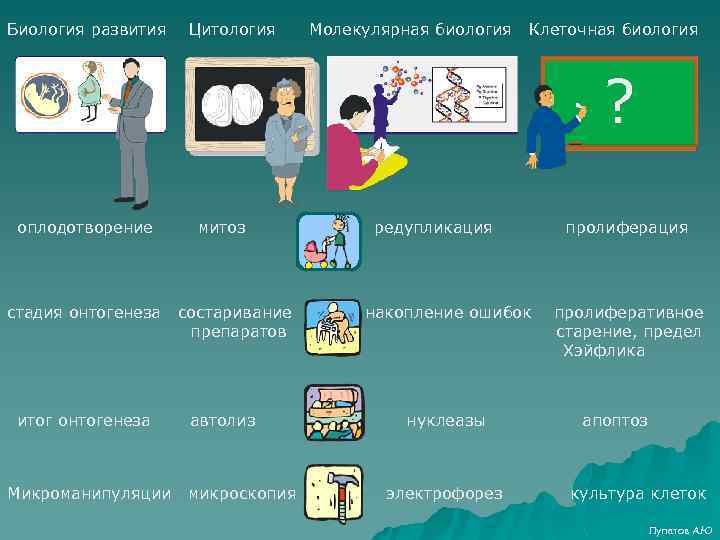
Биология развития Цитология Молекулярная биология Клеточная биология ? оплодотворение стадия онтогенеза итог онтогенеза Микроманипуляции митоз состаривание препаратов автолиз микроскопия редупликация накопление ошибок нуклеазы электрофорез пролиферация пролиферативное старение, предел Хэйфлика апоптоз культура клеток Лупатов А. Ю

Клеточная биология изучает только эукариотические клетки многоклеточных организмов!!! Внутриклеточные процессы рассматриваются как функционирование целостных наноструктур и наномеханизмов без привлечения методов анализа, используемых в химии и физике. Словарный запас клеточного биолога Пролиферация, сигнальные пути (каскады), факторы роста, рецепторные тирозинкиназы, G-белки, адапторные молекулы, онкогены и протоонкогены, антионкогены, МАР-киназы, циклины и их ингибиторы, пролиферативное старение, иммортализация, теломераза, апоптоз, каспазы и др. Лупатов А. Ю
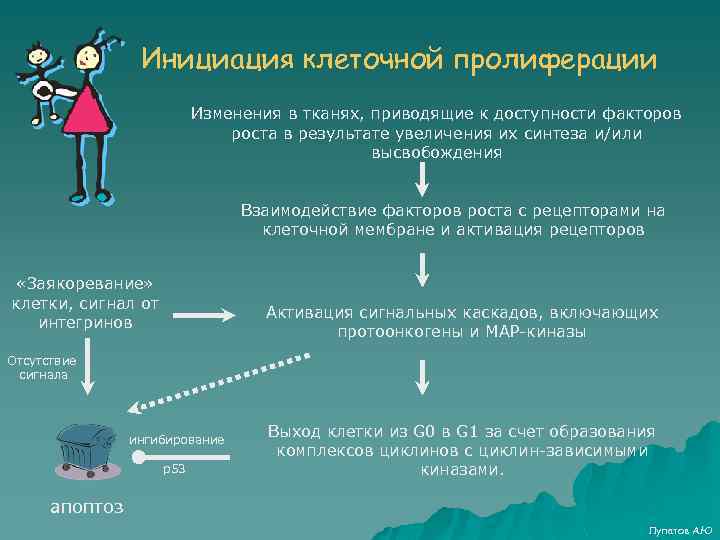
Инициация клеточной пролиферации Изменения в тканях, приводящие к доступности факторов роста в результате увеличения их синтеза и/или высвобождения Взаимодействие факторов роста с рецепторами на клеточной мембране и активация рецепторов «Заякоревание» клетки, сигнал от интегринов Активация сигнальных каскадов, включающих протоонкогены и МАР-киназы Отсутствие сигнала ингибирование p 53 Выход клетки из G 0 в G 1 за счет образования комплексов циклинов с циклин-зависимыми киназами. апоптоз Лупатов А. Ю
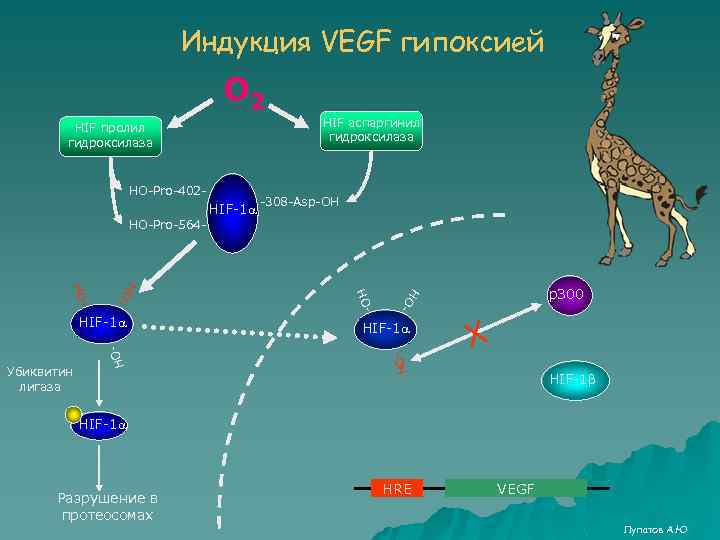
Индукция VEGF гипоксией О 2 HIF аспаргинил гидроксилаза HIF пролил гидроксилаза HО-Pro-402 - HIF-1 a -308 -Asp-OH HО-Pro-564 - - HIF-1 a HО- HO - Убиквитин лигаза HО HO HО HIF-1 a р300 Х HIF-1 b HIF-1 a Разрушение в протеосомах HRE VEGF Лупатов А. Ю
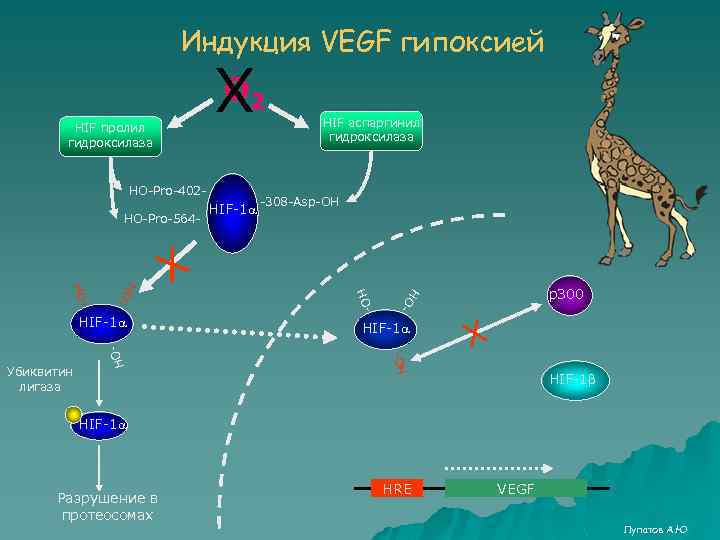
Индукция VEGF гипоксией О Х 2 HО-Pro-402 HО-Pro-564 - - HО- р300 HO - Убиквитин лигаза -308 -Asp-OH HО HO HО HIF-1 a Х HIF-1 a HIF аспаргинил гидроксилаза HIF-1 a HО- HIF пролил гидроксилаза Х HIF-1 b HIF-1 a Разрушение в протеосомах HRE VEGF Лупатов А. Ю
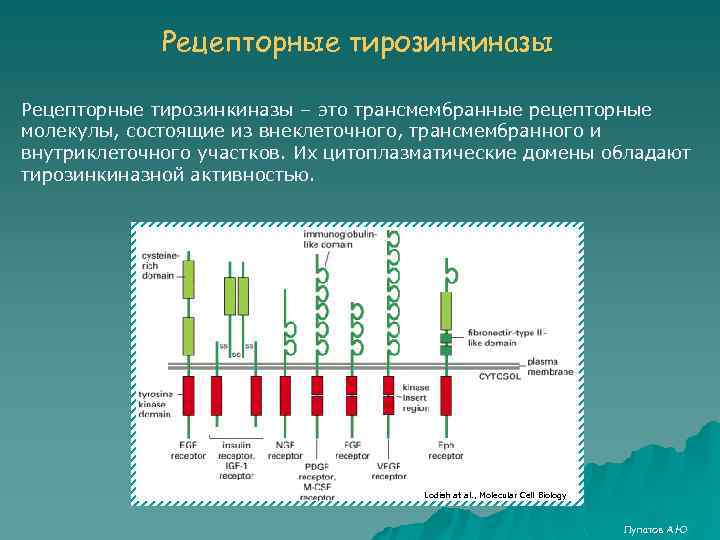
Рецепторные тирозинкиназы – это трансмембранные рецепторные молекулы, состоящие из внеклеточного, трансмембранного и внутриклеточного участков. Их цитоплазматические домены обладают тирозинкиназной активностью. Lodish at al. , Molecular Cell Biology Лупатов А. Ю
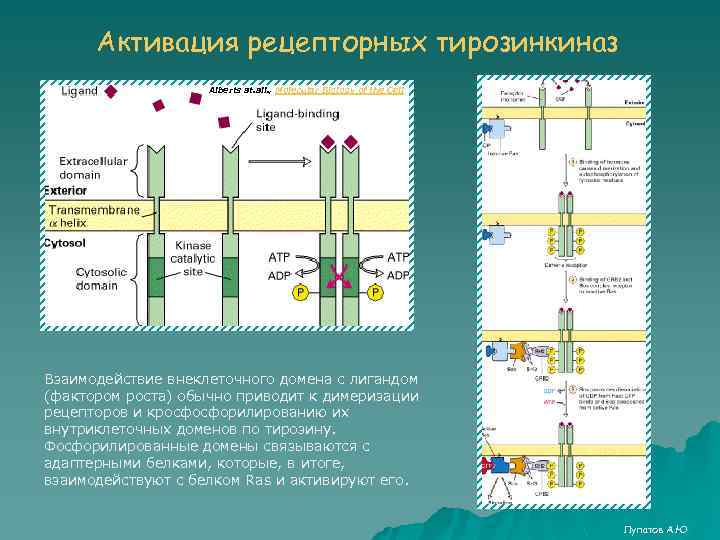
Активация рецепторных тирозинкиназ Alberts at. all. , Molecular Biology of the Cell Взаимодействие внеклеточного домена с лигандом (фактором роста) обычно приводит к димеризации рецепторов и кросфосфорилированию их внутриклеточных доменов по тирозину. Фосфорилированные домены связываются с адаптерными белками, которые, в итоге, взаимодействуют с белком Ras и активируют его. Лупатов А. Ю
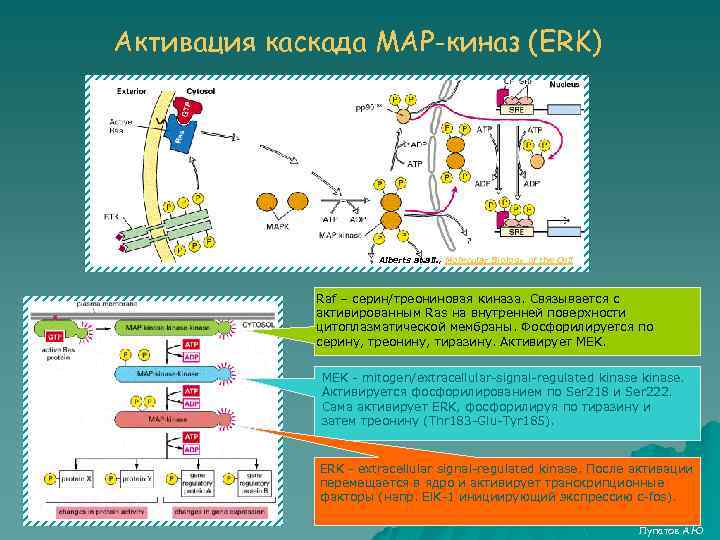
Активация каскада MAP-киназ (ERK) Alberts at. all. , Molecular Biology of the Cell Raf – серин/треониновая киназа. Связывается с активированным Ras на внутренней поверхности цитоплазматической мембраны. Фосфорилируется по серину, треонину, тиразину. Активирует MEK - mitogen/extracellular-signal-regulated kinase. Активируется фосфорилированием по Ser 218 и Ser 222. Сама активирует ERK, фосфорилируя по тиразину и затем треонину (Thr 183 -Glu-Tyr 185). ERK - extracellular signal-regulated kinase. После активации перемещается в ядро и активирует транскрипционные факторы (напр. El. K-1 инициирующий экспрессию c-fos). Лупатов А. Ю
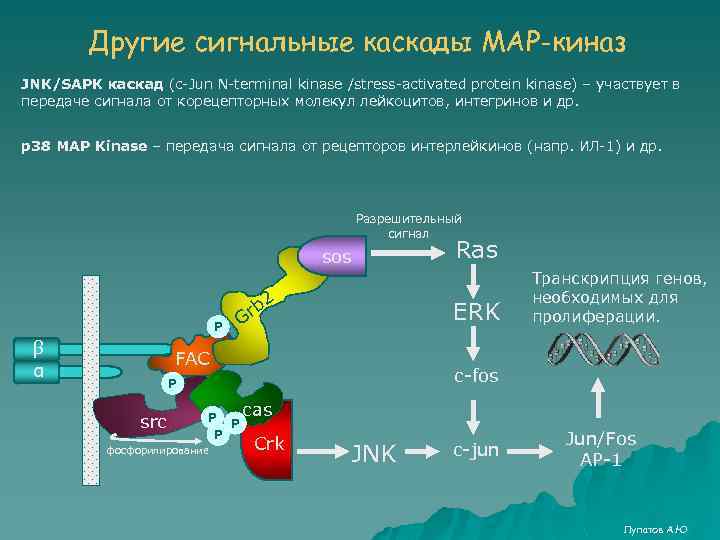
Другие сигнальные каскады MAP-киназ JNK/SAPK каскад (c-Jun N-terminal kinase /stress-activated protein kinase) – участвует в передаче сигнала от корецепторных молекул лейкоцитов, интегринов и др. p 38 MAP Kinase – передача сигнала от рецепторов интерлейкинов (напр. ИЛ-1) и др. Разрешительный сигнал sos 2 P β α b Gr ERK FAC P P cas P фосфорилирование Транскрипция генов, необходимых для пролиферации. c-fos P src Ras Crk JNK c-jun Jun/Fos AP-1 Лупатов А. Ю
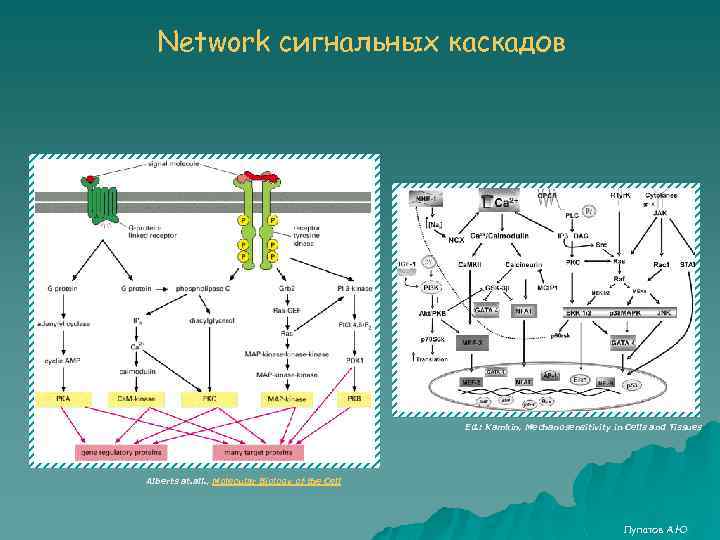
Network сигнальных каскадов Ed. : Kamkin, Mechanosensitivity in Cells and Tissues Alberts at. all. , Molecular Biology of the Cell Лупатов А. Ю
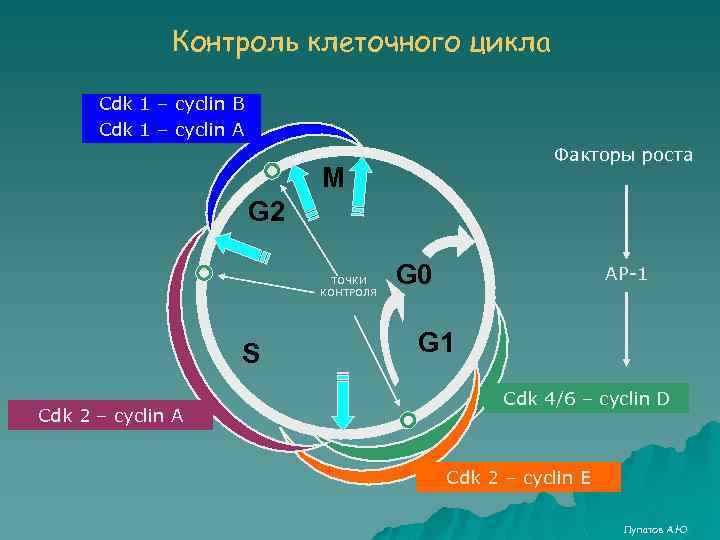
Контроль клеточного цикла Cdk 1 – cyclin B Cdk 1 – cyclin A Факторы роста M G 2 ТОЧКИ КОНТРОЛЯ S Cdk 2 – cyclin A G 0 AP-1 G 1 Cdk 4/6 – cyclin D Cdk 2 – cyclin E Лупатов А. Ю
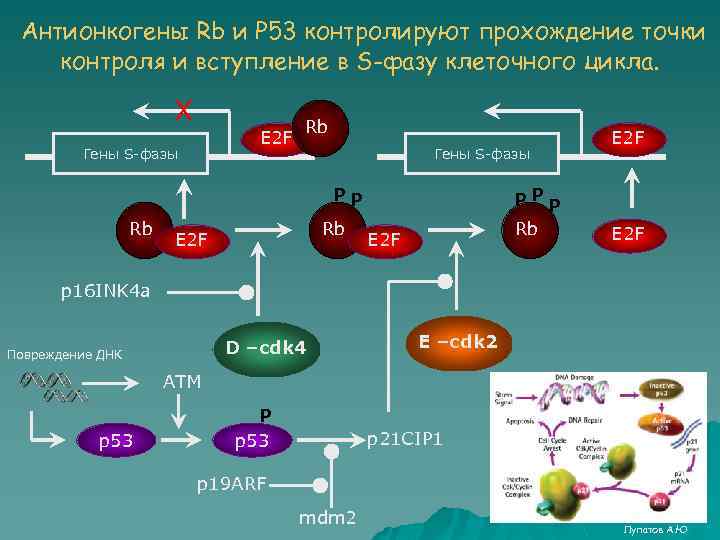
Антионкогены Rb и Р 53 контролируют прохождение точки контроля и вступление в S-фазу клеточного цикла. Х E 2 F Гены S-фазы Rb Гены S-фазы PP Rb Rb E 2 F PPP Rb E 2 F p 16 INK 4 a D –cdk 4 Повреждение ДНК E –cdk 2 ATM p 53 P p 53 p 21 CIP 1 p 19 ARF mdm 2 Лупатов А. Ю

Подведем итоги 1. Клетка пролиферирует в ответ на сигнал, инициируемый фактором роста – белковой молекулой, взаимодействующей со специфическим рецептором на клеточной мембране. 2. В качестве рецепторов часто выступают рецепторные тиразинкиназы (RTK), которые аутофосфорилируются после взаимодействия с лигандом и активируют каскад митоген-активируемых протеинкиназ (МАР-киназ) 3. Существует как минимум 3 каскада МАР-киназ: ERK, JNK/SAPK и p 38 MAP кinase. Помимо них известно еще множество сигнальных путей, стимулирующих пролиферацию, выживание или апоптоз. Одна RTK может стимулировать сразу несколько путей. 4. Сигнальный каскад МАР-киназ представляет собой цепь последовательных фосфорилирований, а его участники выступают в качестве протоонкогенов, поскольку мутации в них могут приводить к злокачественной трансформации клетки. 5. Контроль прохождения фаз клеточного цикла осуществляется комплексами циклин/циклин-зависимая киназа (cyclin- Cdk), уникальными для каждой стадии клеточного цикла и активирующими синтез белков, необходимых на этих стадиях. Конечным результатом активации МАР-киназ является инициация синтеза циклина, ответственного за вступление в S-фазу. 6. Антионкогены Rb и p 53 являются ключевыми негативными регуляторами вступления клетки в S-фазу. Rb контролирует фактор транскрипции генов S-фазы, а р53 предотвращает вступление в S-фазу, при необходимости репарации ДНК или индукции апоптоза. Лупатов А. Ю
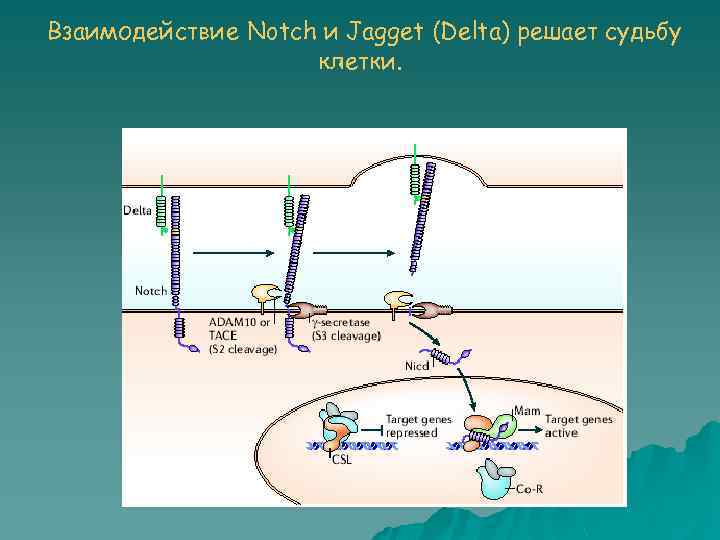
Взаимодействие Notch и Jagget (Delta) решает судьбу клетки.

Программированная клеточная смерть (апоптоз) Здесь покоится клетка, безвременно ушедшая от нас по причине апоптоза Некроз – гибель клетки в результате повреждения. Апоптоз – гибель клетки в результате реализации специально заложенной программы. Апоптоз осуществляется, когда клетка больше не нужна (эмбриогенез, терминация иммунного ответа и др. ) либо потенциально опасна для организма (заражена вирусом, повреждена ДНК, находится на пути злокачественной трансформации и др. ) Лупатов А. Ю
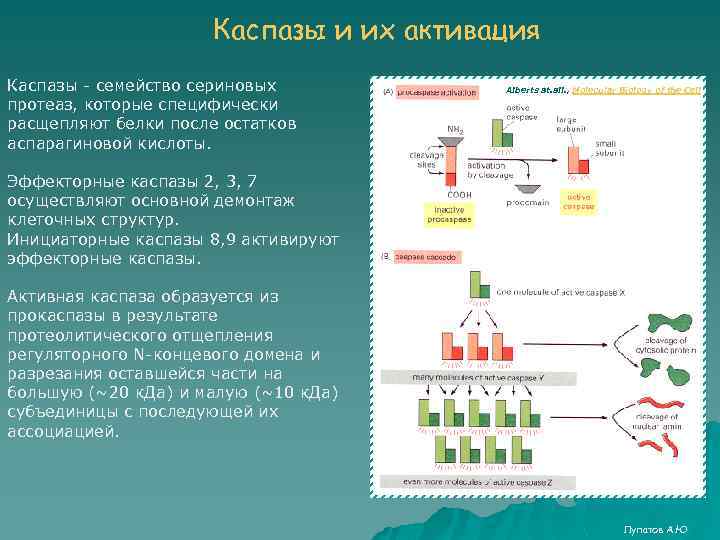
Каспазы и их активация Каспазы - семейство сериновых протеаз, которые специфически расщепляют белки после остатков аспарагиновой кислоты. Alberts at. all. , Molecular Biology of the Cell Эффекторные каспазы 2, 3, 7 осуществляют основной демонтаж клеточных структур. Инициаторные каспазы 8, 9 активируют эффекторные каспазы. Активная каспаза образуется из прокаспазы в результате протеолитического отщепления регуляторного N-концевого домена и разрезания оставшейся части на большую (~20 к. Да) и малую (~10 к. Да) субъединицы с последующей их ассоциацией. Лупатов А. Ю
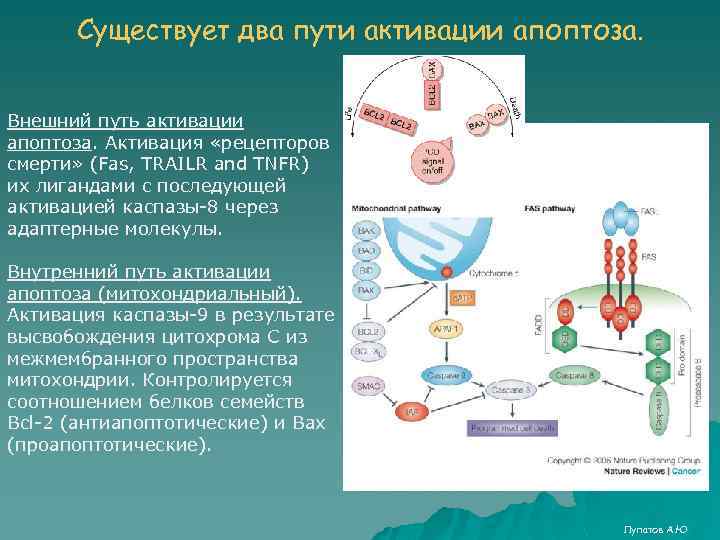
Существует два пути активации апоптоза. Внешний путь активации апоптоза. Активация «рецепторов смерти» (Fas, TRAILR and TNFR) их лигандами с последующей активацией каспазы-8 через адаптерные молекулы. Внутренний путь активации апоптоза (митохондриальный). Активация каспазы-9 в результате высвобождения цитохрома С из межмембранного пространства митохондрии. Контролируется соотношением белков семейств Bcl-2 (антиапоптотические) и Bax (проапоптотические). Лупатов А. Ю
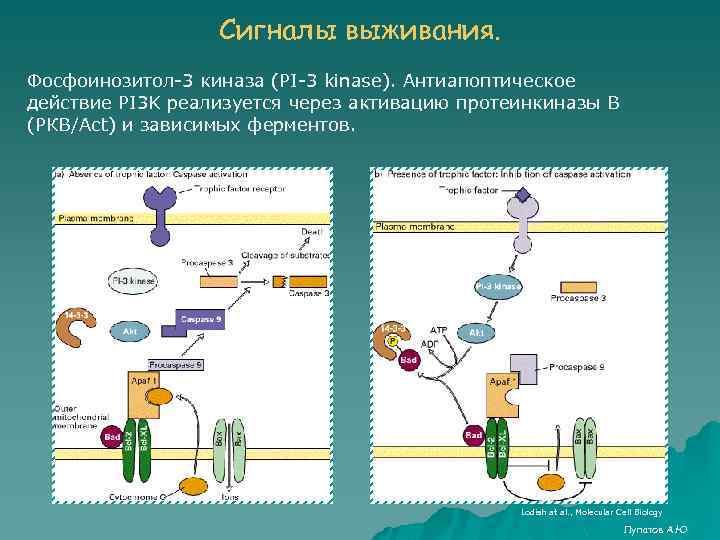
Сигналы выживания. Фосфоинозитол-3 киназа (PI-3 kinase). Антиапоптическое действие PI 3 K реализуется через активацию протеинкиназы В (РКВ/Act) и зависимых ферментов. Lodish at al. , Molecular Cell Biology Лупатов А. Ю

Подведем итоги 1. Апоптоз избавляет организм от ненужных и потенциально опасных клеток. 2. Существует два взаимосвязанных пути апоптоза. Внешний – активация апоптоза через «рецепторы смерти» , и внутренний – в результате высвобождения цитохрома С из митохондрий. 3. Эффект апоптоза реализуется благодаря активации каскада каспаз – протеолитических ферментов, образующихся из прокаспаз в результате их протеолитического расщепления. 4. Антионкоген р53 является ключевым позитивным регулятором апоптоза. Активный р53 выступает в качестве транскрипционного фактора проапоптотических генов. Кроме того, цитоплазматический р53 может проникать в митохондрии, активируя высвобождение цитохрома С. 5. Существуют сигнальные пути, активация которых предотвращает вступление клетки в апоптоз. Один из основных «сигналов выживания» реализуется через PI 3 -киназу и РКВ. Лупатов А. Ю
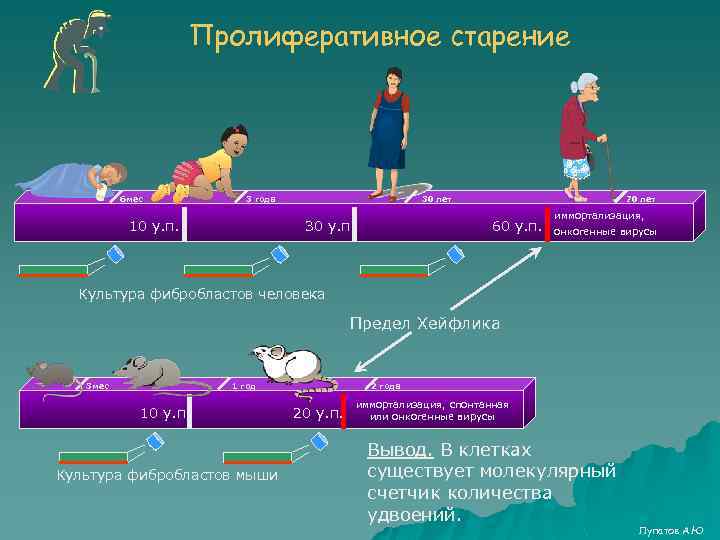
Пролиферативное старение 6 мес 3 года 10 у. п. 30 лет 30 у. п. 70 лет 60 у. п. иммортализация, онкогенные вирусы Культура фибробластов человека Предел Хейфлика 3 мес 1 год 10 у. п. Культура фибробластов мыши 2 года 20 у. п. иммортализация, спонтанная или онкогенные вирусы Вывод. В клетках существует молекулярный счетчик количества удвоений. Лупатов А. Ю

Гипотеза маргинотомии В 1971 г. А. М. Оловников предложил принцип маргинотомии в матричном синтезе полинуклеотидов. Постепенное укорачивание ДНК (недорепликация) ограничивает пролиферативный потенциал клеток и может служить основой "счетчика" клеточных делений в опытах Хейфлика.
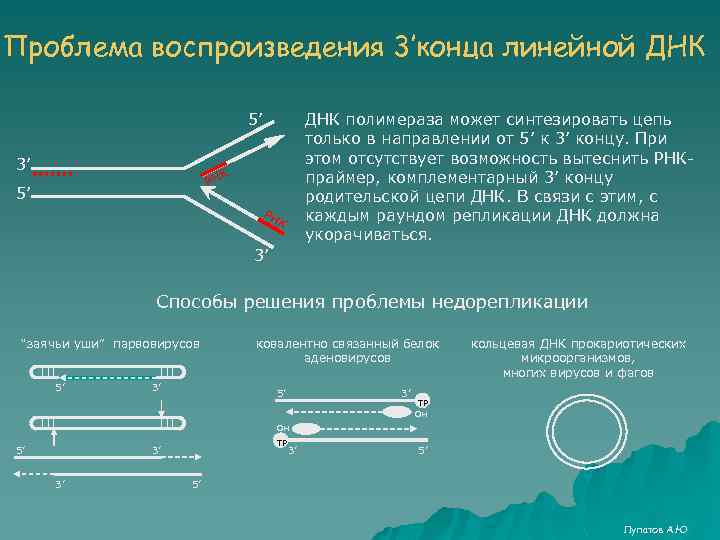
Проблема воспроизведения 3’конца линейной ДНК 5’ 3’ ДНК полимераза может синтезировать цепь только в направлении от 5’ к 3’ концу. При этом отсутствует возможность вытеснить РНКпраймер, комплементарный 3’ концу родительской цепи ДНК. В связи с этим, с каждым раундом репликации ДНК должна укорачиваться. К РН 5’ РН К 3’ Способы решения проблемы недорепликации “заячьи уши” парвовирусов 5’ 3’ ковалентно связанный белок аденовирусов 5’ 3’ кольцевая ДНК прокариотических микроорганизмов, многих вирусов и фагов TP он он 5’ TP 3’ 3’ 3’ 5’ 5’ Лупатов А. Ю

А как решают проблему недорепликации эукариоты? Никак! Они не обращают на нее внимание. Теломеры позвоночных -TTAGGG-TTAGGG-TTAGGG-3’ -AATCCC-AATCCC-5’ С каждым раундом репликации теломеры укорачиваются, функционируя как счетчик числа клеточных удвоений. Но если не бороться с недорепликацией, то организмы будут стареть не только в процессе онтогенеза, но и в процессе филогенеза!!! Существует фермент теломераза, который активен в герменативных и эмбриональных стволовых клетках. h. TERT – каталитическая субъединица, подвержена регуляции транскрипции. h. TR – рибонуклеопротеин, содержащий РНК, комплементарную теломерному повтору. Конститутивно экспрессируется. h. TERT 5’ 3’- h. TR -TTAGGG-TTAGGG-3’ Лупатов А. Ю
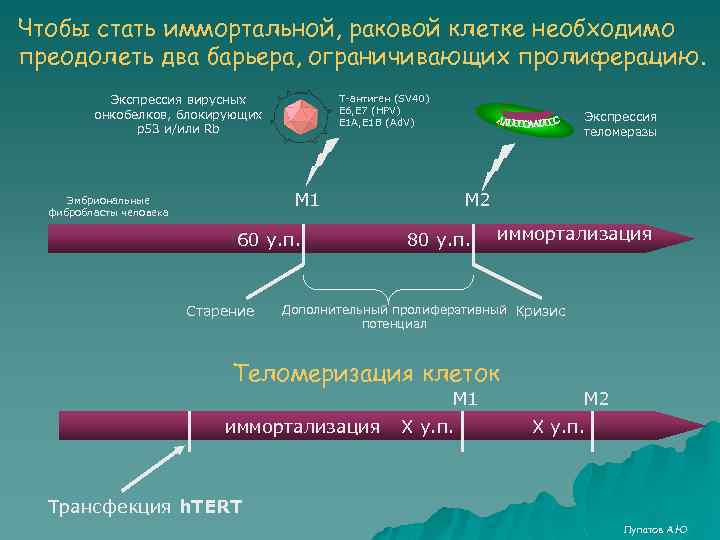
Чтобы стать иммортальной, раковой клетке необходимо преодолеть два барьера, ограничивающих пролиферацию. Экспрессия вирусных онкобелков, блокирующих р53 и/или Rb Т-антиген (SV 40) E 6, E 7 (HPV) E 1 A, E 1 B (Ad. V) Экспрессия теломеразы М 1 Эмбриональные фибробласты человека 60 у. п. Старение М 2 80 у. п. иммортализация Дополнительный пролиферативный Кризис потенциал Теломеризация клеток М 1 иммортализация X у. п. М 2 X у. п. Трансфекция h. TERT Лупатов А. Ю

Подведем итоги 1. В отличие от G 0, состояние пролиферативного старения характеризуется необратимой остановкой клеточной пролиферации после прохождения определенного количества делений. Клетки не отвечают на стимуляцию факторами роста, но устойчивы к апоптозу. 2. Отсчет количества клеточных удвоений осуществляется благодаря недорепликации теломер – тандемно повторяющихся на концах хромосом последованельностей TTAGGG (у позвоночных). 3. Некоторые типы клеток (герминальные, раковые) имеют неограниченный пролиферативный потенциал. Он обусловлен экспрессией фермента теломеразы – обратной транскриптазы, которая считывает теломерный повтор с РНК- матрицы, имеющейся в ее малой субъединице. 4. При пролиферативном старении выделяют как минимум две точки. Точка М 1 соответствует пределу Хэйфлика, запускается в результате укорачивания теломер до определенной величины и обусловлена функциональной активностью р53 (эпителиальные клетки) или р53 и Rb (клетки соединительной ткани). Прохождение М 1 возможно в результате экспрессии онкобелков ДНК содержащих онкогенных вирусов, связывающих р53 и/или Rb. Точка М 2 является результатом укорачивания теломер до критического уровня. Прохождение точки М 2 возможно после активации теломеразы. 5. Теломеризация клеток (искусственное введение гена h. TER) позволяет иммортализовать культуру. При этом клетки по другим признакам мало отличаются от нормальных. Это связано с тем, что в них не нарушается М 1 и М 2 механизмы. Клетки просто не достигают М 1 из-за стабилизации длинны теломер. 6. Лупатов А. Ю
Клеточная биология 2013.ppt