ацетальдегид.ppt
- Количество слайдов: 58

АЛЬДЕГИДЫ Химические свойства Для карбонильных соединений характерны реакции различных типов: · присоединение по карбонильной группе · полимеризация; · конденсация; · восстановление и окисление. I. Реакции присоединения 1. Присоединение водорода (восстановление): R CH=O + H 2 Т, Ni→ R CH 2 OH первичный спирт 1
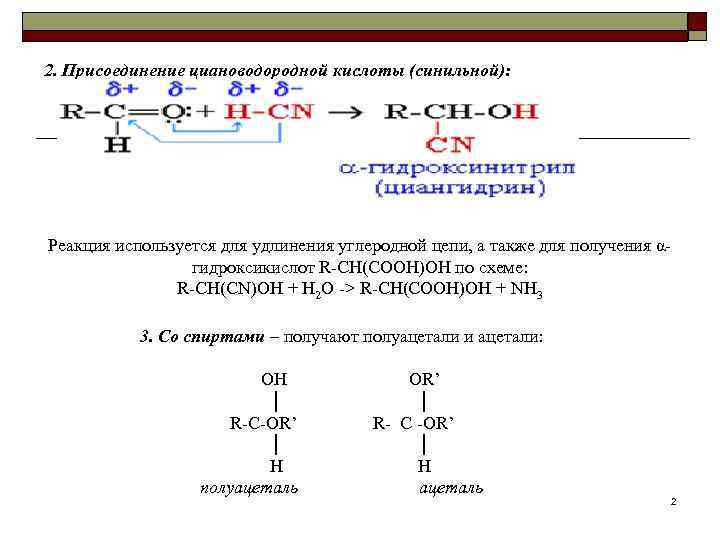
2. Присоединение циановодородной кислоты (синильной): Реакция используется для удлинения углеродной цепи, а также для получения α гидроксикислот R CH(COOH)OH по схеме: R CH(CN)OH + H 2 O > R CH(COOH)OH + NH 3 3. Со спиртами – получают полуацетали и ацетали: OH OR’ │ │ R C OR’ R C OR’ │ │ H H полуацеталь ацеталь 2

ПОЛУАЦЕТАЛИ соединения, в которых атом углерода связан с гидроксильной и алкоксильной ( OR) группами. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя: 3

СH 3 CH=O + 2 CH 3 OH H+↔ CH 3 –CH OCH 3 + H 2 O I ОCH 3 АЦЕТАЛИ соединения, в которых атом углерода связан с двумя алкоксильными ( OR) группами. 4. Присоединение реактива Гриньяра (используется для получения первичных спиртов, кроме метанола): R X(р-р в диэтиловом эфире) + Mg стружка → R Mg X (реактив Гриньяра) + Q R – алкильный или арильный радикал; Х – это галоген. HCH=O + CH 3 -Mg-Cl → CH 3 -CH 2 -O-Mg-Cl (присоединение) CH 3 -CH 2 -O-Mg-Cl + H 2 O → CH 3 -CH 2 -OH + Mg(OH)Cl (гидролиз ) 4

II. Реакции окисления 1. Реакция серебряного зеркала – качественная реакция на альдегидную группу: R CH=O + Ag 2 O NH 3→ R COOH + 2 Ag↓ карбоновая кислота 2. Окисление гидроксидом меди(II): R-CH=O + 2 Сu(OH)2 t → R-COOH + Cu 2 O +2 H 2 O голубой красный III. Реакции замещения С галогенами: CH 3 CH=O + Cl 2 → Cl CH 2 CH=O + HCl хлоруксусный альдегид 5

IV. Реакции полимеризации n CH 2=O t, kat → ( CH 2 O )n полиформальдегид V. Реакции поликонденсации n H CH=O + (n+1) C 6 H 5 OH t, kat→ n. H 2 O + [ C 6 H 3(OH) CH 2 C 6 H 3(OH) ]n фенолформальдегидная смола 6

ФОРМАЛЬДЕГИД, СВОЙСТВА И ПРИМЕНЕНИЕ Формальдегид НСНО представляет собой в безводном со стоянии есцветный б газ с острым раздражающим запахом (т. конд. — 19°С при « 0, 1 МПа). При хранении он легко полимеризуется и нередко выпускается в виде твердого полимера — параформальдегида (параформ), который легко деполимеризуется. Параформ является линейным полимером с повторяющимися оксиметиленовыми звеньями (число их от 8 до 100): Большей частью формальдегид выпускают в виде 37 % го вод ного раствора, называемого формалином. В нем формальдегид присутствует в виде гидрата НСНО Н 20 и низкомолекулярных полимеров (полиоксиметиленгликоли). Во избежание более глубокой полимеризации и выпадения осадка к формалину добавляют 7— 12% (масс. ) метанола в качестве 7

ПРИМЕНЕНИЕ 1. Производство стабилизаторов полимеров и масел. Антиоксидант 2246, получаемый конденсацией о-трет-бутш-п-крезола с формальдегидом 2. Получение диаминодифенилметанов. Конденсация формальдегида с анилином Реакцию проводят, нагревая формалин с анилином, и получают смесь главным образом диаминодифенилметана и триамина. Ее применяют для получения ди 8 и триизоцианата. .

3. Получение ДДТ. это Ди хлорфенилтрихлорметилметан. Получение конденсация хлорбензола с хлоралем (трихлорацетальдегидом) при катализе концентрированной серной кислотой или олеумом: Введение хлорметильной группы в ароматическое ядро достигается при действии формалина (или параформальдегида) и соляной кислоты на ароматический углеводород: ДДТ был основным инсектицидом Его использование ограничено из за высокой токсичности, способности долго удерживаться на обработанной почве и накапливаться в организме животных, птиц и человека. Сегодня применение запрещено. 4. Реакция хлорметилирования. Введение хлорметильной группы в ароматическое ядро достигается при действии формалина (или параформальдегида) и соляной кислоты на ароматический углеводород: 9

Хлорметилированием бензола в присутствии солянокислого раствора Zn. Cl 2 в промышленности получают бензилхлорид: но этот способ менее выгоден, чем хлорирование толуола/ Реакция хлорметилирования используется для получения анионообменных смол. Для этого хлорметильную группу вводят в сшитый сополимер, содержащий ароматические ядра, и затем замещают атом хлора на четвертичную аммониевую группу: 10
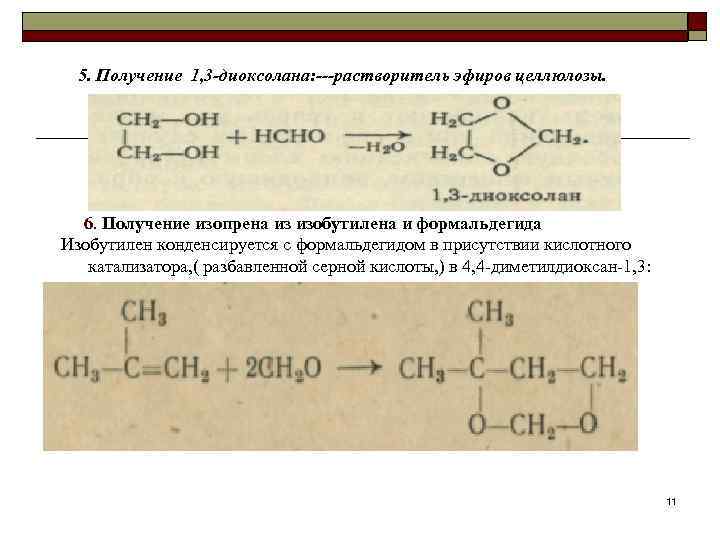
5. Получение 1, 3 -диоксолана: ---растворитель эфиров целлюлозы. 6. Получение изопрена из изобутилена и формальдегида Изобутилен конденсируется с формальдегидом в присутствии кислотного катализатора, ( разбавленной серной кислоты, ) в 4, 4 диметилдиоксан 1, 3: 11

Каталитический гидролиз и дегидратация 4, 4 диметилдиоксана 1, 3 до изопрена на твердом катализаторе фосфатного типа, например на фосфате кальция: 7. Получение пентаэритрита Формальдегид конденсируется с ацетальдегидом, последовательно образуя такие продукты: При катализе щелочами и избытке формальдегида протекает реакция окисления восстановления и получается пентаэритрит 12

Пентаэритрит представляет собой кристаллическое вещество, плавящееся при 260, 5 °С. Он имеет ряд областей применения— для получения взрывчатого вещества пентрита C(CH 2 ONО 2)4, алкидных полимеров (путем поликонденсации с фталевым ангидридом), пластификаторов (эфиры пентаэри трита и высших карбоновых кислот) и других продуктов. 8. Другие пути использования формальдегида: получение фенолформальдегидных смол; получение мочевино формальдегидных (карбамидных) смол; полиоксиметиленовые полимеры; синтез лекарственных средств (уротропин); дезинфицирующее средство; консервант биологических препаратов (благодаря способности свертывать белок). 13
Производство формальдегида 1. Основное количество получается из метанола: 1 а. Дегидрирование метанола, совмещенное с частичным окислением, 1 б. Окисление метанола в избытке воздуха. 2. Окисление низших парафинов 14

Совмещенное дегидрирование и окисление метанола. Дегидрирование первичных спиртов, в том числе метанола, менее благоприятно по сравнению с вторичными спиртами по условиям равновесия и селективности реакции. По этой причине, а также с целью устранения эндотермичности процесса осуществили совмещенное дегидрирование и окисление метанола Можно так подобрать соотношение этих реакций, что суммарная реакция будет экзотермична настолько, чтобы возместить потери тепла в окружающую среду и нагреть исходную смесь до нужной температуры. Это достигается, когда процесс на 55 % идет через окисление и на 45 % через дегидрирование, и тогда процесс можно осуществить в адиабатических реакторах, не имеющих поверхностей теплообмена. В этом состоит одно из преимуществ совмещенного процесса окисления и дегидрирования спиртов. При указанном соотношении реакций дегидрирования и окисления исходная паровоздушная смесь должна содержать 45% (об. ) метанола, что находится за верхним пределом взрываемости метанола в воздухе [34, 7 % (об. )]. 15

Побочные процессы: более глубокое окисление дегидрирование и гидрирование. Образуются: оксид углерода, муравьиная кислота, вода и метан: Окислительное дегидрирование проводят при недостатке кислорода, поэтому глубокое окисление не получает значительного развития. В то же время само дегидрирование, инициируемое кислородом, протекает быстрее, и все ранее упомянутые побочные реакции не так заметны, как при дегидрировании других первичных спиртов. Это позволяет проводить реакцию при более высокой температуре (500— 600°С), большой скорости и времени контакта 0, 01— 0, 03 с. Выход формальдегида на пропущенное сырье достигает 80— 85 % при степени конверсии метанола 85— 90 % • Добавление воды к исходному метанолу повышает выход и степень конверсии, по видимому, в результате разложения ацеталей. Катализаторы металлическая медь (в виде сетки или стружек) или серебро, осажденное на А 1203. Последний катализатор более эффективный и широко 16 применяется в промышленности.
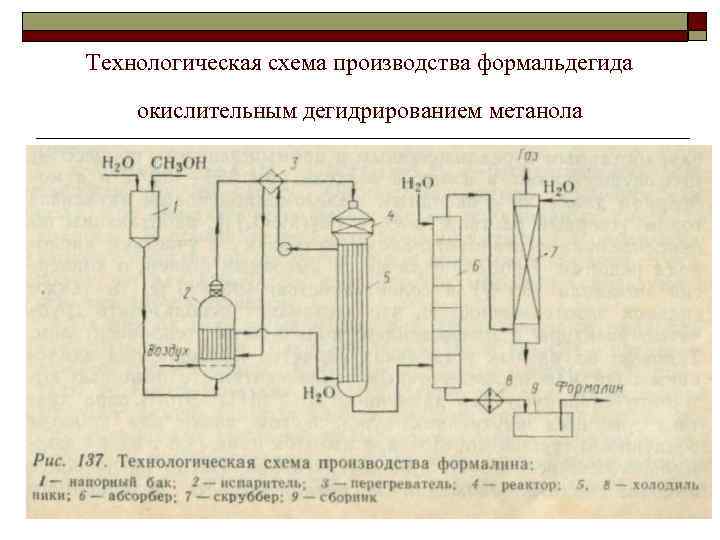
Технологическая схема производства формальдегида окислительным дегидрированием метанола 17

Описание схемы Метанол, содержащий 10— 12% воды, из напорного бака 1 непрерывно поступает в испаритель 2. Туда же через распределительное устройство подают воздух, очищенный от пыли и других загрязнений. Воздух барботирует через слой водного мета нола в нижней части испарителя и насыщается его парами. В 1 л образующейся паровоздушной смеси должно содержаться « 0, 5 г метанола. Поддержание такого состава смеси очень важно для обеспечения взрывобезопасности и нормального протекания процесса. Поэтому работа испарительной системы полностью автоматизирована: поддерживают постоянные уровень жидкости в испарителе, ее температуру (48— 50°С) и скорость подачи воздуха, благодаря чему обеспечиваются необходимые температурный режим и степень конверсии в адиабатическом реакторе Паровоздушная смесь проходит брызгоуловитель, находя щийся в 18 верхней части испарителя, затем перегреватель 3 и по ступает в реактор , в средней части которого находится 4 ката лизатор. Реакционные газы сразу же попадают в подконтактный холодильник 5 (смонтирован вместе с реактором), где происхо дит быстрое охлаждение смеси и предотвращается распад фор мальдегида. В разных схемах охлаждение осуществляют про точной водой или паровым конденсатом, когда холодильник иг рает роль генератора пара низкого, среднего или даже высокого давления. Полученный пар (или горячая вода) служит для пе регрева поступающей смеси в 18 перегревателе 3 и для обогрева испарителя 2.

Охлажденные реакционные газы поступают в абсорбер 6, выполненный в виде тарельчатой колонны; жидкость на тарелках охлаждают внутренними или выносными холодильниками (на схеме не изображены). Абсорбер орошают таким количеством воды, чтобы в кубе получился 36— 37 % й формалин. Стадии абсорбции и разделения продуктов оформляют двумя разными способами. По одному из них в абсорбере поглощают как формальдегид, так и непревращенный метанол, который содержится в продуктах реакции в количестве, как раз достаточном для стабилизации формальдегида. В этом случае верхнюю тарелку абсорбера охлаждают рассолом, а колонна 7 служит лишь для санитарной очистки газа, в то время как для получения безметанольного формалина (требуемого иногда для различных целей) необходима установка для отгонки метанола. При втором способе в абсорбере поглощают преимущественно формальдегид; тогда скруббер 7 служит для абсорбции метанола, который отгоняют от воды и возвращают на реакцию. В обоих случаях формалин из куба абсорбера 6 охлаждают в холодильнике 8 и собирают в сборнике 9. 19

Окисление метанола в формальдегид Условия: избыток воздуха , Т 350— 430 °С, атмосферное давление, оксидный железомолибденовый катализатор [твердый раствор Мо 03 в Fe 2(Mo 04)3], работающим по окислительно восстановительному механизму с участием кислорода решетки. Особенности процесса: высокая степень конверсии метанола (99%) и селективность (95— 96%), сильная экзотермичность. Реактор синтеза: трубчатые реакторы с охлаждением подходящим теплоносителем: кипящая под давлением вода или промежуточный теплоноситель, с помощью которого генерируют пар давлением до 3 МПа. Недостаток процесса: высокие капиталовложения и металлоемкость реакционногоузла, меньшая производительность катализатора. Процесс окисления метанола в формальдегид получает все более широкое распространение из за снижения затрат сырья, высоких степени конверсии метанола и энерготехнологической эффективности производства. 20

Получение формальдегида окислением низших парафинов Промышленный способ получения формальдегида окислением метана: Процесс проводят при температуре 450 °C и давлении 1— 2 МПа, в качестве катализатора применяется фосфат алюминия Природный газ, по прогнозам, будет основным углеводородным ресурсом не только для энергетики, но и для химической промышленности XXI века. Современная газохимия пока не способна серьезно конкурировать с существующими процессами на основе нефтяного сырья. Создание высокорентабельных одностадийных процессов получения ценных химических продуктов, в том числе формальдегида, из углеводородных газов позволило бы совершить серьезный прорыв в этой области, превратив природный газ в сырье для получения и других химических продуктов. 21

С точки зрения доступности и дешевизны сырья, а также простоты технологии, получение формальдегида прямым окислением природного газа, состоящего, в основном, из метана, кислородом воздуха заслуживает предпочтения перед сравнительно сложным и многостадийным синтезом формальдегида через метанол, что видно из схемы: природный газ > синтез газ ¦ метанол >¦ формальдегид Однако на практике получение формальдегида окислением метана сопряжено с целым рядом трудностей, важнейшие из которых связаны с недостаточной устойчивостью формальдегида в условиях реакции. Известно, что некатализированное (неинициированное) окисление метана с заметной скоростью происходит при температуре выше 600 °С (под вакуумом выше 540 °С В то же время термическое разложение формальдегида наблюдается уже при 400 °С. Образовавшийся формальдегид в присутствии кислорода, легко подвергается дальнейшему окислению. В силу этих причин на практике окисление метана, даже в присутствии инициаторов проводят при малых значениях конверсии, причем и в этих условиях селективность образования формальдегида невысока. 22

Гомогенное окисление метана типичная свободнорадикальная реакция. В отсутствии инициаторов реакция характеризуется наличием индукционного периода. Для устранения или уменьшения последнего к метано воздушной смеси добавляют вещества, легко распадающиеся на свободные радикалы — чаще всего азотную кислоту или оксид азота (II), озон, пероксид водорода, галогены, галогеноводороды и галогеналкиды, летучие алкилы свинца и тд. В качестве инициатора рекомендуется применять диметиловый эфир, не загрязняющий продукты реакции посторонними примесями. Для облегчения зарождения цепей на стенках реактора последние обрабатываются раствором борной кислоты и ее производных. Реакция ускоряется также под влиянием УФ излучения> ультразвука, тихого электрического разряда , водородного пламени и плазменной струи. В последнем случае в качестве окислителя применяют диоксид углерода. 23

При 500— 7000 C ускоряющее действие на превращение метана, по видимому, оказывают многие твердые материалы, например алюмосиликаты, кварц и т. п. , благодаря наличию геометрически и энергетически неоднородных участков поверхности и, в особенности, кислотных центров. Реакцию можно проводить как в стационарном, так и в кипящем слое. Для повышения активности алюмосиликаты пропитывают растворами кислот, например фосфорной, борной Значительное число работ посвящено применению контактов, на которые нанесены оксиды различных элементов, главным образом металлов. Найдено, что каталитическая активность металлов меняется в ряду: Fe 203> >Zn. O>V 205>Ni 203>Mo 03>Cu. O>Cd. O>Bi 203>Cr 203. Контакт, представляющий собою шарики из алюмосиликата диаметром 0, 75 мм (катализатор для крекинга нефтепродуктов), на которые было нанесено 1, 5% оксида железа(III), обеспечивал выход формальдегида 1, 8— 1, 9% на пропущенный метан, а катализатор с 3— 7% оксида магния 2, 1— 2, 3%. Несколько более высокие показатели были получены с катализатором, в котором в качестве носителя применялся алюмосиликат, содержащий 10— 11% 24

Окисление углеводородов C 2—C 4 в сравнении с окислением метана имеет много общего хотя и характеризуется некоторыми специфическими особенностями. Как и в случае метана, процесс проводят в области выше верхнего предела взрывных концентраций углеводородов. Выход формальдегида несколько возрастает при замене воздуха чистым кислородом одновременно увеличивается количество и других продуктов окисления. Доля формальдегида, образующегося при окислении бутана, несколько выше по сравнению с пропаном и изобутаном. Более высокая реакционная способность позволяет проводить реакцию при значительно более низких температурах, как правило, не выше 400— 480°С. В результате этого удается в значительной мере избежать образования продуктов полного окисления, т. е. оксида и диоксида углерода. Селективность образования формальдегида мало отличается от окисления метанола, поскольку в силу самого строения молекул углеводородов C 2—C 4 при их окислительной конверсии образуется практически весь ассортимент соответствующих альдегидов, кетонов, спиртов и т. д. 25 Для преимущественного образования соединений того или иного класса успешно применяют различные многофункциональные катализаторы.

АЦЕТАЛЬДЕГИД. СВОЙСТВА, Применение Вещество представляет собой бесцветную жидкость с резким запахом, хорошо растворяется в воде, спирте, эфире. Температура кипения (20, 2 °C) Химические свойства—Слайд 1 5 26
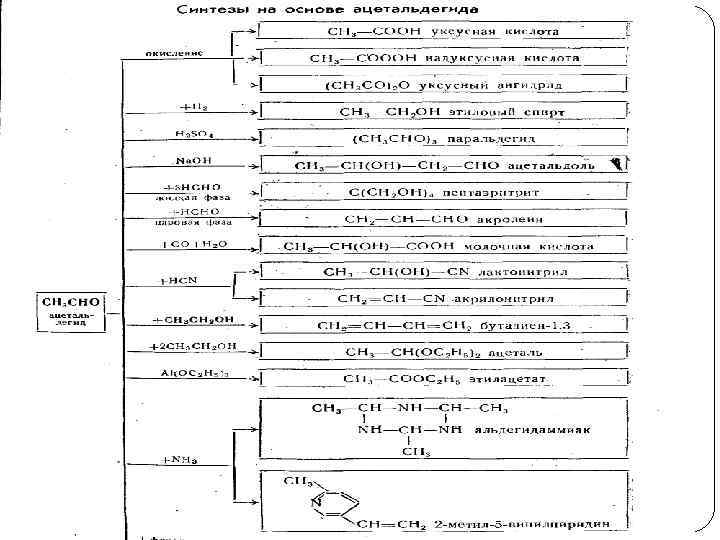
27

ПОЛУЧЕНИЕ АЦЕТАЛЬДЕГИДА 1. Гидратация ацетилена( по Кучерову) 2. Производство ацетальдегида из этилена 3. Получение ацетальдегида окислительным дегидрированием этилового спирта 4. Каталитическое дегидрирование этилового спирта 5. Получение ацетальдегида из ацетилена через бутилвиниловый эфир 28

Гидратация ацетилена( по Кучерову) Жидкая фаза, барботаж ацетилена через 10— 20% ю серную кислоту, содержащую 0, 5— 0, 6 % Hg. O, который находится в растворе в виде Hg. S 04. Реакция практически необратима. Считают, что образуется комплекс ацетилена с Hg 2+, дальнейшие превращения которого ведут к получению ацетальдегида: 29

Протекают два побочных процесса конденсация ацетальдегида с образованием кротонового альдегида и смол восстановление ацетальдегидом солей ртути с превращением их в неактивную форму: Развитие побочных реакций можно уменьшить, снижая концентрацию альдегида в реакционной жидкости. путем непрерывной отдувки образовавшегося ацетальдегида в токе непревращенного ацетилена, который подают на реакцию в 2— 2, 5 кратном избытке. Для предотвращения восстановления ртутных солей и их быстрого дезактивирования в реакционный раствор добавляют соль трехвалентного железа, которая способна окислять восстановленную форму ртути снова в двухвалентное состояние: 30

Соль железа добавляют в избытке по отношению к ртути (~4% в расчете на Fe 20 з), поэтому катализаторный раствор работает достаточно длительное время. Однако в нем постепенно накапливаются соли двухвалентного железа, и раствор направляют на регенерацию, состоящую в окислении азотной кислотой. Несмотря на все эти мероприятия, ртуть все же теряется в виде шлама вместе с продуктами осмоления. Ее расход составляет 1, 0— 1, 5 кг на 1 т ацетальдегида. Схема реакционного узла жидкофазной гидратации ацетилена 31

рис. 64, а. Реактор пустотелая колонна, футерованная кислотоупорными плитками и имеющая в верхней расширенной части слой насадки, играющей роль брызгоуловителя. Реактор заполнен катализаторной жидкостью, через которую барботирует ацетилен, вводимый в низ колонны. Реактор не имеет поверхностей теплообмена и работает при 90°С автотермически: выделяющееся тепло отводится за счет испарения воды, которая конденсируется в обратном холодильнике и возвращается в реактор. Часть катализаторного раствора непрерывно отводят на регенерацию и заменяют регенерированным раствором. Из газофазовой смеси, выходящей из реакционного узла, абсорбируют водой ацетальдегид, возвращают ацетилен на реакцию, а водный раствор ацетальдегида подвергают ректификации. Недостаток способа применении токсичных и дорогостоящих ртутных солей в качестве катализаторов. 32

Гидратация с нертутными катализаторами. 33 Катализаторы фосфорная кислота, фосфаты магния, цинка и кадмия. Они менее активны по сравнению с ртутными солями и работают лишь при высоких температурах как гетерогенные катализаторы. Практическое применение нашла смесь состава Cd. HP 04·Ca 3(P 04)2. обладающая кислотными свойствами и содержащая металл той же группы периодической системы, что и ртуть. Эта смесь активна при 350— 400 °С. При газофазной гидратации ацетилена невозможно удалять ацетальдегид по мере его образования, вследствие чего побочная реакция кротоновой конденсации становится особенно опасной. Она имеет более высокую энергию активации по сравнению с гидратацией, поэтому один из способов повышения селективности состоит в устранении перегрева и организации оптималь ного теплового режима процесса. Другой способ — применение большого избытка водяного пара и поддержание неполной конверсии ацетилена в реакторе, что ускоряет гидратацию, замедляя в то же время кротоновую конденсацию альдегида. При объемном соотношении водяного пара и ацетилена, равном (7— 10): 1, и 40— 50% й степени конверсии ацетилена выход ацетальдегида составляет 89%. а побочно образуется 6— 7% кротонового альдегида, 0, 5— 1 % уксусной кислоты и 0, 3 % ацетона.

Газофазную гидратацию ацетилена проводят в колонном аппарате с несколькими сплошными слоями катализатора (см. рис. 64, 6). Предварительно нагретую смесь водяных паров и ацетилена вводят в верхнюю часть реактора, а снизу отводят реакционные газы на конденсацию и разделение. Аппарат не имеет поверхностей теплообмена — съем выделяющегося тепла осуществляют за счет испарения водного конденсата, вбрызгиваемого в пространство между слоями катализатора. Они разделены, кроме того, колпачковыми тарелками, препятствующими попаданию брызг в последующие слои катализатора. Недостаток газофазного процесса: низкого выход ацетальдегида небольшой срок службы катализатора — его приходится регенерировать каждые 100 ч. С учетом этого общий срок службы катализатора составляет всего 2500 ч. 34

Производство ацетальдегида из этилена. Синтез ацетальдегида из этилена в 1960 г. Получение карбонильных соединений из олефинов основано на стехиометрической реакции хлорида палладия с олефинами, при которой Pd. Cl 2 восстанавливается до металла: Была создана окислительно восстановительная система, в которой палладий быстро окисляется, т. е. непрерывно регенерируется в активной форме. : если в раствор добавить соль двухвалентной меди( или железа), она окисляет палладий, переходя в одновалентную медь, легко окисляемую кислородом. Иными словами, соли меди служат переносчиками кислорода: Обе эти реакции эффективно протекают в кислотной среде, в которой хлорид палладия находится в 35 форме H 2 Pd. Cl 4.

Механизм процесса включает промежуточные стадии замещения хлор- анионов в координационной сфере палладиевого комплекса молекулами олефина и воды (этим вызвано замедляющее влияние больших концентраций хлор анионов). Координационный комплекс хлорида палладия с олефином и водой обратимо отщепляет протон, чем объясняется торможение реакции при значительных концентрациях ионов водорода. гидроксидный ион атакует один из ненасыщенных углеродных атомов олефина с одновременной миграцией гидрид-иона к соседнему атому С и выделением металлического палладия. Схема на след. слайде: 36
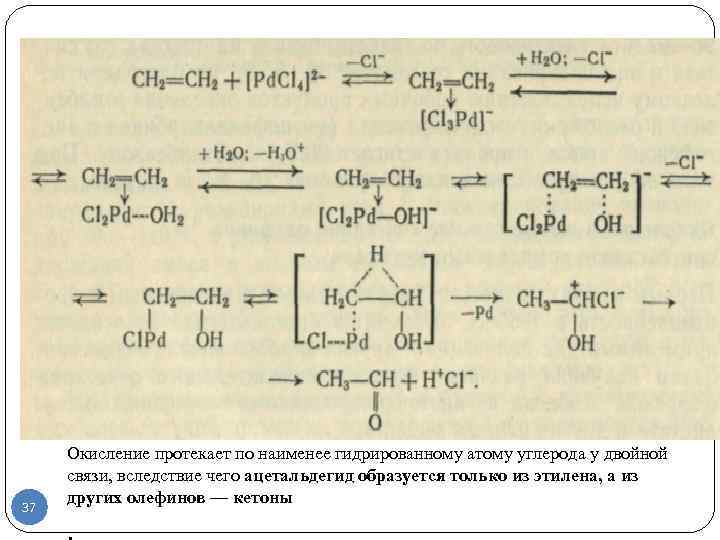
37 Окисление протекает по наименее гидрированному атому углерода у двойной связи, вследствие чего ацетальдегид образуется только из этилена, а из других олефинов — кетоны

Производство ацетальдегида из этилена. При этом процессе важно достигнуть соответствия: между скоростями окисления этилена на Pd. Cl 2, окисления восстановленной формы палладия с помощью 38 Си. С 12 и окисления Си 2 С 12 кислородом. Самой медленной стадией является последняя, поэтому катализаторный раствор должен содержать избыток медных солей. хорошие результаты получаются со слабым солянокислым раствором, содержащим 0, 3— 0, 5 % Pd. Cl 2 и 10— 25 % Си. С 12, к кото рому для регулирования р. Н среды добавлено 2— 3 % ацетата меди. С этим раствором все стадии протекают достаточно интенсивно при 100— 130°С, для поддержания реакционной смеси в жидком состоянии требуется повышенное давление (0, 3— 1 МПа), которое одновременно способствует интенсификации процесса.
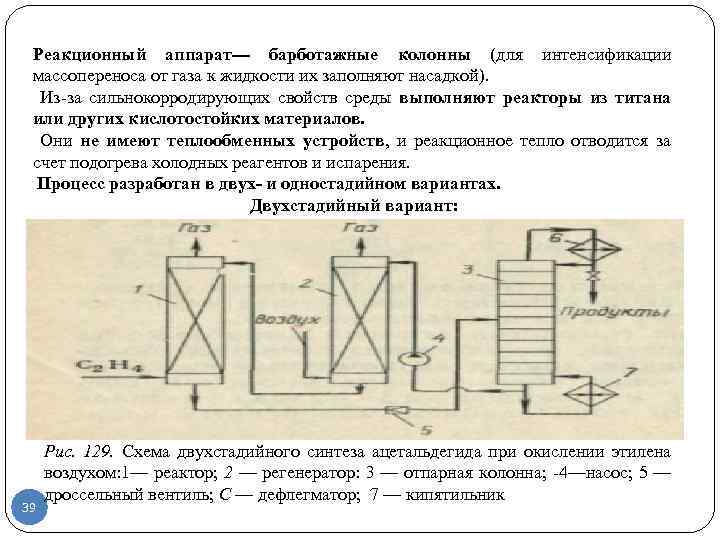
Реакционный аппарат барботажные колонны (для интенсификации массопереноса от газа к жидкости их заполняют насадкой). Из за сильнокорродирующих свойств среды выполняют реакторы из титана или других кислотостойких материалов. Они не имеют теплообменных устройств, и реакционное тепло отводится за счет подогрева холодных реагентов и испарения. Процесс разработан в двух и одностадийном вариантах. Двухстадийный вариант: 39 Рис. 129. Схема двухстадийного синтеза ацетальдегида при окислении этилена воздухом: 1— реактор; 2 — регенератор: 3 — отпарная колонна; 4—насос; 5 — дроссельный вентиль; С — дефлегматор; 7 — кипятильник

ОПИСАНИЕ СХЕМЫ ДВУХСТАДИЙНОГО ВАРИАНТА окисление этилена катализаторным раствором и регенерацию последнего воздухом проводят в двух разных аппаратах (рис. 129). В реактор 1 с кислотоупорной насадкой подают этилен и регенерированный катализаторный раствор, причем реакцию ведут до почти полной конверсии этилена при 0, 8— 0, 9 МПа и 100— 115 °С. Полученный раствор ацетальдегида в восстановленном катализаторном растворе дросселируют и направляют в отпарную колонну 3, где отгоняют ацетальдегид и растворенные газы, поступающие на дальнейшее разделение. Катализаторный раствор с низа отпарной колонны подают насосом при « 1 МПа в регенератор 2; туда вводят воздух, окисляющий ион металла до высшего валентного состояния. Регенерированный раствор возвращают в реактор 1. Достоинства этого варианта — его безопасность (ввиду разделения стадий, на которых присутствуют этилен и воздух) и использование воздуха в качестве окислителя. 40
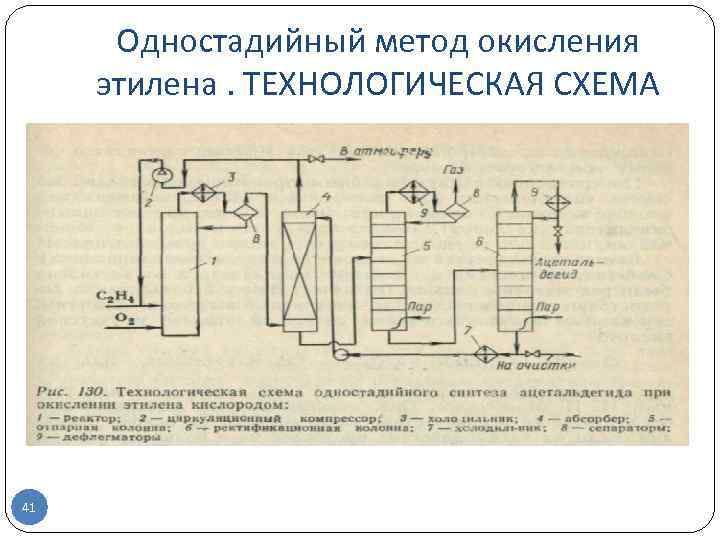
Одностадийный метод окисления этилена. ТЕХНОЛОГИЧЕСКАЯ СХЕМА 41

ОПИСАНИЕ СХЕМЫ В одностадийном методе окисление этилена и регенерация катализатора совмещены в одном аппарате Для избежания образования взрывоопасных смесей, ведут процесс в избытке этилена, возвращаемого затем на реакцию. Это делает необходимым применять в качестве окислителя не воздух, а технический кислород, конверсия которого в реакторе должна быть почти полной. В реактор 1 типа пустотелой барботажной колонны, заполнен ной катализаторнкм раствором, подают кислород и этилен (свежий и рециркулирующий). Реактор работает с постоянным уровнем жидкости при 130 °С и « 0, 3 МПа. Избыточный этилен выдувает из раствора образовавшийся ацетальдегид, чем предотвращаются побочные реакции его конденсации. Вместе с ацетальдегидом испаряется часть воды, которую конденсируют в холодильнике 3 и возвращают в реактор. Газопаровую смесь направляют в абсорбер 4, где ацетальдегид поглощают водой, орошающей насадку абсорбера. Основное количество остаточного 42

газа, содержащего этилен, немного кислорода и инертные примеси, возвращают на окисление, дожимая его циркуляционным компрессором 2. Меньшую часть газа выводят с установки во избежание чрезмерного накопления в нем инертных примесей. Водный раствор ацетальдегида из куба абсорбера 4 поступает в отпарную колонну 5, где отгоняют растворенные газы и летучие примеси. Затем в колонне 6 в виде дистиллята получают ацетальдегид, а большую часть кубовой жидкости, содержащей менее летучие побочные продукты (кротоновый альдегид и др. ), возвращают после охлаждения на абсорбцию. Часть этой жидкости выводят в систему очистки сточных вод. По сравнению с двухстадийным процессом одностадийный синтез ацетальдегида дает экономию в капиталовложениях и расходе энергии, но связан с применением более дорогостоящего окислителя (кислород). Показатели этих методов в общем близки, и оба они успешно эксплуатируются в промышленности. 43

Получение ацетальдегида окислительным дегидрированием этилового спирта При окислительном дегидрировании этилового спирта протекают последовательно две реакции: CH 3 - CH 2 -OH→ CH 3 -CHO + H 2 + 0, 5 O 2 → H 2 O Для уменьшения теплового эффекта процесса вводят меньше воздуха. Например, спирт можно смешивать с воздухом в отношении 1 : 1, 1, что соответствует расходу кислорода 44% от теоретического. При пропускании такой смеси над серебряным катализатором при 450 550°С очень интенсивно протекает дегидрирование этилового спирта и выходящий из контактного аппарата газ содержит 10% водорода] 44

Каталитическое дегидрирование этилового спирта РЕАКЦИЯ CH 3 CH 2 OH→ CH 3 CHO + H 2 Медные или медно цинковые катализаторы. Медь для данного процесса является высокоактивным катализатором, но она быстро теряет активность. Хорошим стойким катализатором является медь с добавками 5% оксида кобальта и 2% оксида хрома, нанесенная на асбест. С). Температура 275 300°С. Степень превращения спирта 33 50% за один проход через катализатор. Достоинством процесса дегидрирования спирта по сравнению с процессом окислительного дегидрирования является относительно малое образование побочных продуктов и высокое содержание ацетальдегида в контактных газах. Контактные газы процесса дегидрирования в основном состоят из паров ацетальдегида и водорода (примерно 1 : 1), в то время как контактные газы окисления спирта разбавлены азотом, вводимым с воздухом. Поэтому выделение ацетальдегида из контактных газов дегидрирования спирта легче и сопряжено с меньшими потерями альдегида. Кроме того, при дегидрировании этилового спирта образуется ценный побочный продукт этилацетат (9 10% от количества 45 ацетальдегида).

Получение ацетальдегида из ацетилена через бутилвиниловый эфир Производство ацетальдегида из ацетилена этим методомпредставляет двухстадийный процесс винилирования н бутанола ацетиленом с образованием винилбутилового эфира (ВБЭ): С 2 Н 2 + С 4 Н 9 ОН → СН 2=СН О С 4 Н 9 и последующего гидролиза ВБЭ: СН 2=СН О С 4 Н 9 + Н 2 О → СН 3 СНО + С 4 Н 9 ОН Бутанол находится в рецикле и добавляется только для пополнения производственных потерь, а на получение ацетальдегида расходуется только ацетилен. Реакция винилирования протекает в присутствии гидроксида калия при температуре 400 440°С. Конверсия ацетилена составляет 0, 6 0, 8. Реакционная смесь, содержащая 75 80% ВБЭ, около 20% непрореагировавшего бутанола, воду и легкую фракцию, перед гидролизом разделяется методами ректификации или экстракции. На гидролиз направляется фракция, содержащая 99, 5% винилбутилового эфира. 46

Реакция гидролиза ВБЭ протекает в парожидкостной среде при температуре, близкой к температуре кипения смеси «ВБЭ вода» , в присутствии катионнообменного катализатора КУ 2 ФПП, который обеспечивает степень конверсии ВБЭ, близкую к единице. В результате гидролиза образуется система «ацетальдегид вода бутанол» , из которой ректификацией выделяется целевой продукт ацетальдегид, а бутанол возвращается в процесс 47

Новое в области синтеза ацетальдегида 1. Метод получения ацетальдегида взаимодействием водорода и кетена в присутствии катализатора, содержащего металл, выбранный из IX и X группы периодической системы при температуре 50 200°С. CH 2=C=O + H 2 → CH 3 CHO 2. Окисление н бутанола кислородсодержащим газом в присутствии гетерогенного катализатора(гранулированный ортофосфат железа): СН 3 СН 2 ОН + О 2 → 2 СН 3 СНО + Н 2 О температура 380 420°С, время контакта 0, 8 1 с. 3. Рассмотрен процесс превращения этиленгликоля в ацетальдегид 4. Предложен метод получения ацетальдегида селективным гидрированием уксусной кислоты на катализаторе Fe 2 O 3, нанесённом на основу 48 СН 3 СООН + Н 2 → СН 3 СНО + Н 2 О

Выводы. Из рассмотренных методов получения ацетальдегида наиболее удобен метод окисления этилена в водном растворе хлорида палладия. Процесс проходит с высоким выходом ацетальдегида (до 98%). Этилен является относительно дешёвым и доступным сырьём. В процессе производства не используются ядовитые вещества, такие как ртуть при гидратации ацетилена. Аппаратное оформление процесса достаточно простое и требует относительно небольших капитальных затрат. Себестоимость ацетальдегида, произведённого из этилена почти вдвое ниже себестоимости продукта, получаемого гидратацией ацетилена. Поэтому в качестве метода получения и выбран именно этот метод. 49

НЕПРЕДЕЛЬНЫЕ АЛЬДЕГИДЫ. АКРОЛЕИН Бесцветная легколетучая слезоточивая жидкость с резким запахом, сильный лакриматор, т. кипения. 52, 70 СH 2 C=CH CHO, Акролеин, будучи непредельным альдегидом, проявляет реакционную способность, свойственную как олефинам, так и альдегидам. Так, акролеин образует ацетали: его альдегидная группа легко окисляется до карбоксильной: и восстанавливается до гидроксильной: 50

Карбонильная группа акролеина находится в сопряжении с двойной связью, что обуславливает его высокую реакционную способность по отношению к нуклеофилам, при этом присоединение идёт по β атому углерода: Галогены присоединяются к акролеину по двойной связи с образованием дигалогенпроизводного, которое далее отщепляет галогеноводород с образованием α галогенакролеина: 51

ПУТИ ПОЛУЧЕНИЯ АКРОЛЕИНА 1. Альдольная конденсация формальдегида с ацетальдегидом о паровой фазе Смесь формальдегида и ацетальдегида в мольном соотношении 1 : 1 пропускают при 300 0 С вместе с водяным паром нал катализатором (силикат натрия на силикагеле). Промежуточной стадией процесса является образование оксипропионового альдегида, который далее подвергается дегидратации: Конверсия за один проход составляет 50%. Выход акролеина, считая на формальдегид примерно 65% от теоретического, а считая на ацетальдегид 75%. Метод устаревший 2. Пиролиз диаллилового эфира, побочного продукта производства аллилового спирта при Т=5200 С, Р=4 атм 52

3. Прямое каталитическое окисление пропилена. : побочные реакции, в результате которых получаются диоксид углерода, вода, формальдегид, ацетальдегид, органические кислоты и полимерные соединения Процесс окисления пропилена в акролеин проводят в различных условиях: 1. Процессы с использованием смеси пропилена с воздухом, содержащей около 20/о пропилена. Благодаря большому содержанию кислорода в исходной реакционной смеси достигается высокая конверсия пропилена и можно обойтись без рециркуляция олефина. Степень превращения пропилена в акролеин при 320° С и давлении 8 10 атм. С составляет 70%, а в двуокись углерода — 17%. Катализатор процесса окисления пропилена: закись меди на носителе — карборунде; доля закиси меди от количества всей контактной массы составляет 1, 4%. В случае применения других носителей (пемза, силикагель, окись алюмнния) количество закиси меди изменяется и соответственно составляет 0, 25; 2, 0; 5, 00/о. 53

ПРИМЕНЕНИЕ АКРОЛЕИНА 1. Синтезы глицеринового альдегида и аллилового спирта (совместно с ацетальдегидом), лежащие в основе весьма перспективных способов получения синтетического глицерина. Присоединение перекиси водорода по двойной связи акролеина в присутствии катализатора дает глицериновый альдегид который далее гидрируется в глицерин 2. При пропускании смеси паров акролеина и этилового спирта над окисью магния при 380— 400° С и атмосферном давлении образуются аллиловый спирт и ацетальдегид Аллиловый спирт акже может быть превращен в глицерин 54

3. Хлорированием акролеина в жидкой фазе при обычной температуре получается с высоким выходом 1, 2. дихлорпропионовый альдегид полупродукт для получения хлоракрилатных полимеров 4. Акролеин применяется для получения метионина аминокислоты, стимулирующей рост растений и применяемой также в качестве добавки к корму домашней птицы для усиления роста. 5. Акролеин способен полимеризоваться. Полиакролеины находят применение в технике Гомолог акролеина метакролеин. СН 2=С(СН 3)—СНО. Применяют для синтеза метакриловой кислоты Получают метакролеин окислением металлилового спирта кислородом при 5200 С в присутствии водяных паров: 55
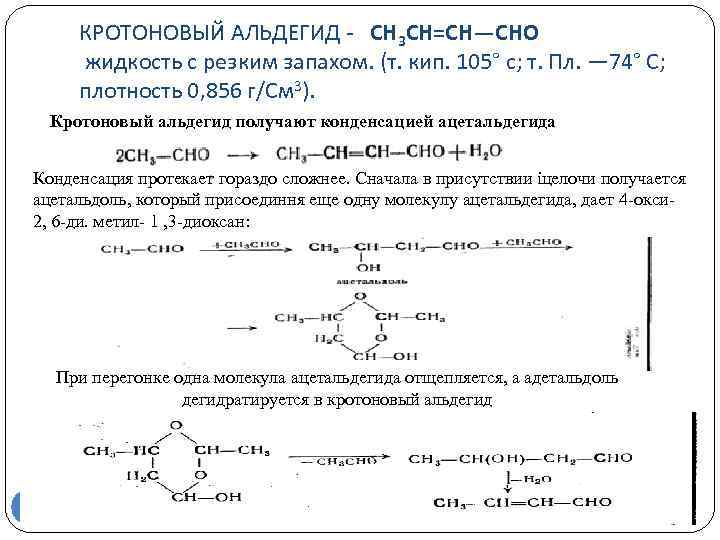
КРОТОНОВЫЙ АЛЬДЕГИД - СН 3 СН=СН—СНО жидкость с резким запахом. (т. кип. 105° с; т. Пл. — 74° С; плотность 0, 856 г/См 3). Кротоновый альдегид получают конденсацией ацетальдегида Конденсация протекает гораздо сложнее. Сначала в присутствии iцелочи получается ацетальдоль, который присоединня еще одну молекулу ацетальдегида, дает 4 окси 2, 6 ди. метил 1 , 3 диоксан: При перегонке одна молекула ацетальдегида отщепляется, а адетальдоль дегидратируется в кротоновый альдегид 56

Применение кротонового альдегида 1. Кротоновый альдегид применяют для получения н масляного альдегида 2. Окислением кротонового альдегида в жидкой фазе при 20° С в присутствии катализаторов (ацетаты меди и ганца) получают кротоновую кислоту Используется для получения синтетических смол, сложных эфиров и пр. 3. Парофазное окисления кротонового альдегида при 380° С над смешанным катализаторами (Тi 02+ Мо. О 3 + V 205 или Мо 03+V 205 на пемзе) можно получить малеиновый ангидрид. – применяемый для получения полимеров, моющих средств. 57

4. Гидрированием кротонового альдегида получают н бутиловый спирт: . Гидрирование проводят на медном катализа торе при 160° С при большом (12 крастном) избытке водорода Гидрирование кротонового альдегида в паровой фазе осуществлят в одну стадию, если вести процесс в псевдоожиженом слое катализатора. Можно проводить гидрирование и в жидкой фазе при 100—I 30°С и 300 ат. Катализатором в этом случае служит смесь активированных меди и никеля. . 58
ацетальдегид.ppt