Слайды альдегиды и кетоны.ppt
- Количество слайдов: 42
 Альдегиды и кетоны алифатического и ароматического рядов Альдегиды и кетоны представляют собой производные алканов, в молекулах которых два геминальных атома водорода замещены на кислород (или оксо-группу). Общие формулы альдегидов и кетонов
Альдегиды и кетоны алифатического и ароматического рядов Альдегиды и кетоны представляют собой производные алканов, в молекулах которых два геминальных атома водорода замещены на кислород (или оксо-группу). Общие формулы альдегидов и кетонов
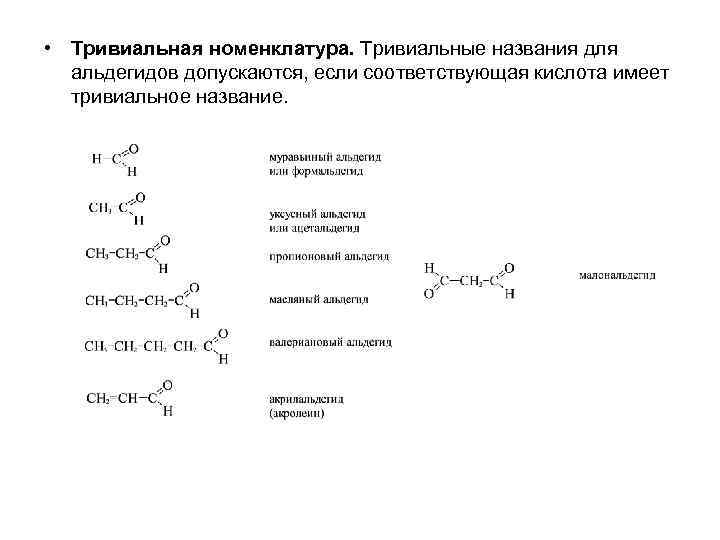 • Тривиальная номенклатура. Тривиальные названия для альдегидов допускаются, если соответствующая кислота имеет тривиальное название.
• Тривиальная номенклатура. Тривиальные названия для альдегидов допускаются, если соответствующая кислота имеет тривиальное название.
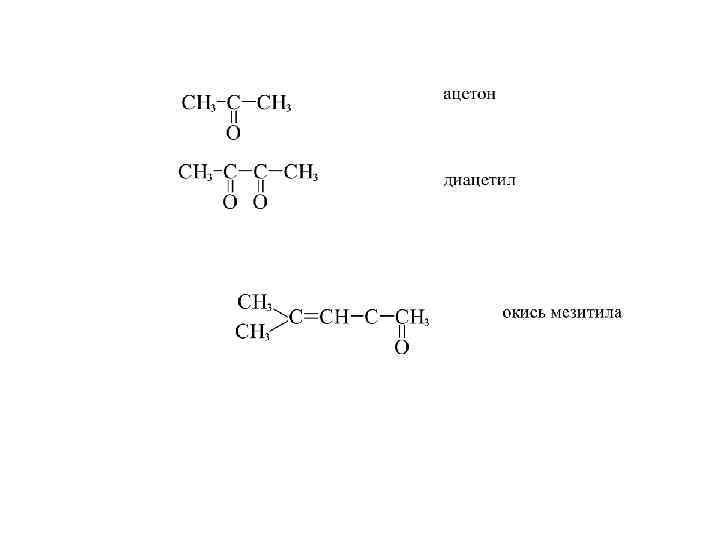
 • Рациональные названия альдегидов строятся с использованием в качестве основы уксусного альдегида . Рациональные названия кетонов образуются путем перечисления радикалов, связанных с карбонильной группой, добавляя в конце слово КЕТОН. Причем, радикалы называют в порядке возрастания сложности.
• Рациональные названия альдегидов строятся с использованием в качестве основы уксусного альдегида . Рациональные названия кетонов образуются путем перечисления радикалов, связанных с карбонильной группой, добавляя в конце слово КЕТОН. Причем, радикалы называют в порядке возрастания сложности.
 • Номенклатура ЮПАК. По номенклатуре ЮПАК название ациклических альдегидов образуют путем добавления окончания АЛЬ или ДИАЛЬ (для диальдегидов) к названию углеводорода, соответствующего главной цепи. Нумерацию начинают от углеродного атома, принадлежащего альдегидной группе. В названии номер при альдегидной группе не ставится.
• Номенклатура ЮПАК. По номенклатуре ЮПАК название ациклических альдегидов образуют путем добавления окончания АЛЬ или ДИАЛЬ (для диальдегидов) к названию углеводорода, соответствующего главной цепи. Нумерацию начинают от углеродного атома, принадлежащего альдегидной группе. В названии номер при альдегидной группе не ставится.
 • Если в соединении имеется другая группа, имеющая преимущество по старшинству, то альдегидную группу называют ФОРМИЛ- или ОКСО-.
• Если в соединении имеется другая группа, имеющая преимущество по старшинству, то альдегидную группу называют ФОРМИЛ- или ОКСО-.
 • Названия ациклических кетонов по ЮПАК образуют из названия соответствующих углеводородов, прибавляя окончание –ОН или –ДИОН (для дикетонов); цифрой указывают номер атома карбонильной группы. Нумерацию начинают от ближайшего к кетонной группе конца цепи. Например :
• Названия ациклических кетонов по ЮПАК образуют из названия соответствующих углеводородов, прибавляя окончание –ОН или –ДИОН (для дикетонов); цифрой указывают номер атома карбонильной группы. Нумерацию начинают от ближайшего к кетонной группе конца цепи. Например :
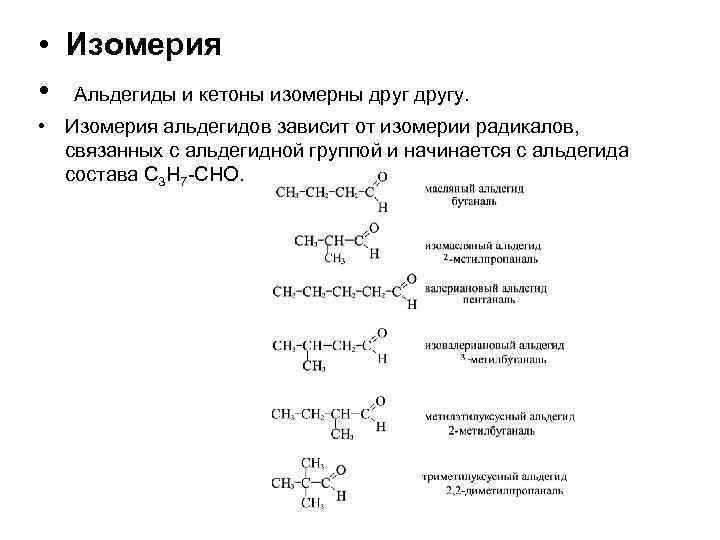 • Изомерия • Альдегиды и кетоны изомерны другу. • Изомерия альдегидов зависит от изомерии радикалов, связанных с альдегидной группой и начинается с альдегида состава C 3 H 7 -CHO.
• Изомерия • Альдегиды и кетоны изомерны другу. • Изомерия альдегидов зависит от изомерии радикалов, связанных с альдегидной группой и начинается с альдегида состава C 3 H 7 -CHO.
 • Способы получения карбоновых кислот Взаимодействие реактива Гриньяра R-Mg. Hal с производными (нитрилами):
• Способы получения карбоновых кислот Взаимодействие реактива Гриньяра R-Mg. Hal с производными (нитрилами):
 Сухая перегонка кальциевых солей (и Ва) одноосновных карбоновых кислот :
Сухая перегонка кальциевых солей (и Ва) одноосновных карбоновых кислот :
 • Изомерия кетонов обусловлена изомерией радикалов и изомерией положения карбонильной группы и начинается с кетонов состава C 5 H 10 O
• Изомерия кетонов обусловлена изомерией радикалов и изомерией положения карбонильной группы и начинается с кетонов состава C 5 H 10 O
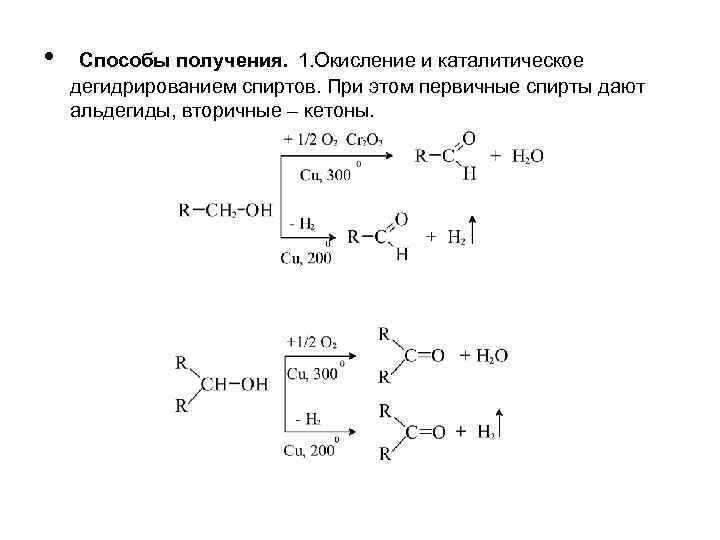 • Способы получения. 1. Окисление и каталитическое дегидрированием спиртов. При этом первичные спирты дают альдегиды, вторичные – кетоны.
• Способы получения. 1. Окисление и каталитическое дегидрированием спиртов. При этом первичные спирты дают альдегиды, вторичные – кетоны.
 2. Гидролиз геминальных дигалогенопроизводных. Из дигалогенопроизводных с галогеном при первичном углероде образуются альдегиды, при вторичном – кетоны.
2. Гидролиз геминальных дигалогенопроизводных. Из дигалогенопроизводных с галогеном при первичном углероде образуются альдегиды, при вторичном – кетоны.
 3. Гидратация ацетилена и его гомологов (реакция Кучерова). Из ацетилена получается уксусный альдегид, а из его гомологов – кетоны. Кето-енольная таутомерия это один из видов динамической изомерии.
3. Гидратация ацетилена и его гомологов (реакция Кучерова). Из ацетилена получается уксусный альдегид, а из его гомологов – кетоны. Кето-енольная таутомерия это один из видов динамической изомерии.
 • 4. Восстановление карбоновых кислот до альдегидов. Превращение карбоновой кислоты в альдегид путем прямого восстановления осуществляется с трудом. Наиболее широко используемые методы основаны на превращении кислот либо в производные, которые восстанавливаются легче, либо в соединения, из которых был получен альдегид.
• 4. Восстановление карбоновых кислот до альдегидов. Превращение карбоновой кислоты в альдегид путем прямого восстановления осуществляется с трудом. Наиболее широко используемые методы основаны на превращении кислот либо в производные, которые восстанавливаются легче, либо в соединения, из которых был получен альдегид.
 • 5. Оксосинтезом называется метод получения кислородсодержащих соединений из этиленовых углеводородов, окиси углерода и водорода. Исходную смесь газов под высоким давлением пропускают над нагретым катализатором, содержащим кобальт.
• 5. Оксосинтезом называется метод получения кислородсодержащих соединений из этиленовых углеводородов, окиси углерода и водорода. Исходную смесь газов под высоким давлением пропускают над нагретым катализатором, содержащим кобальт.
 • Реакционная способность карбонильных соединений определяется наличием карбонильной группы ( С=О ). Двойная связь С=О, подобно связи С=С представляет собой комбинацию σ- и π-связей. Существенным отличием ее от двойной углеродной связи является высокая полярность. Наибольший вклад в поляризацию связи С=О вносят более поляризуемые ρэлектроны. Энергия связи С=О (708 к. Дж/моль) больше, чем связи С=С (620 к. Дж/моль), а ее длина (0, 120 нм) меньше, чем длина связи С=С (0, 134 нм). Атом углерода карбонильной группы имеет тригональную конфигурацию, и его валентные углы близки к 120 0.
• Реакционная способность карбонильных соединений определяется наличием карбонильной группы ( С=О ). Двойная связь С=О, подобно связи С=С представляет собой комбинацию σ- и π-связей. Существенным отличием ее от двойной углеродной связи является высокая полярность. Наибольший вклад в поляризацию связи С=О вносят более поляризуемые ρэлектроны. Энергия связи С=О (708 к. Дж/моль) больше, чем связи С=С (620 к. Дж/моль), а ее длина (0, 120 нм) меньше, чем длина связи С=С (0, 134 нм). Атом углерода карбонильной группы имеет тригональную конфигурацию, и его валентные углы близки к 120 0.
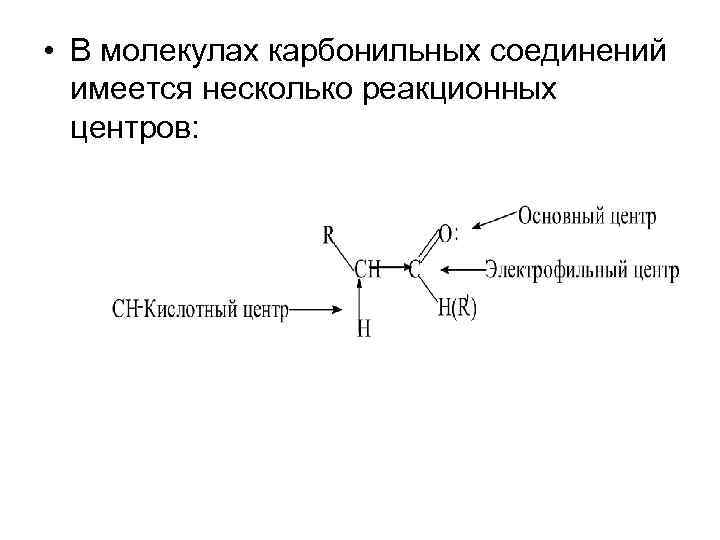 • В молекулах карбонильных соединений имеется несколько реакционных центров:
• В молекулах карбонильных соединений имеется несколько реакционных центров:
 • Электрофильный центр – карбонильный атом углерода, возникновение частичного положительного заряда на котором обусловлено полярностью связи С=О. Электрофильный центр участвует в реакциях нуклеофильного присоединения. • Основный центр – атом кислорода с неподеленными парами электронов. С участием основного центра осуществляется кислотный катализ в реакциях присоединения, а также в процессе енолизации. • α-СН-Кислотный центр, возникновение которого обусловлено индуктивным эффектом карбонильной группы. При участии СН-кислотного центра протекают многие реакции карбонильных соединений, в частности реакции конденсации. • Связь С-Н в альдегидной группе, разрывающаяся в реакциях окисления. • Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами.
• Электрофильный центр – карбонильный атом углерода, возникновение частичного положительного заряда на котором обусловлено полярностью связи С=О. Электрофильный центр участвует в реакциях нуклеофильного присоединения. • Основный центр – атом кислорода с неподеленными парами электронов. С участием основного центра осуществляется кислотный катализ в реакциях присоединения, а также в процессе енолизации. • α-СН-Кислотный центр, возникновение которого обусловлено индуктивным эффектом карбонильной группы. При участии СН-кислотного центра протекают многие реакции карбонильных соединений, в частности реакции конденсации. • Связь С-Н в альдегидной группе, разрывающаяся в реакциях окисления. • Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами.
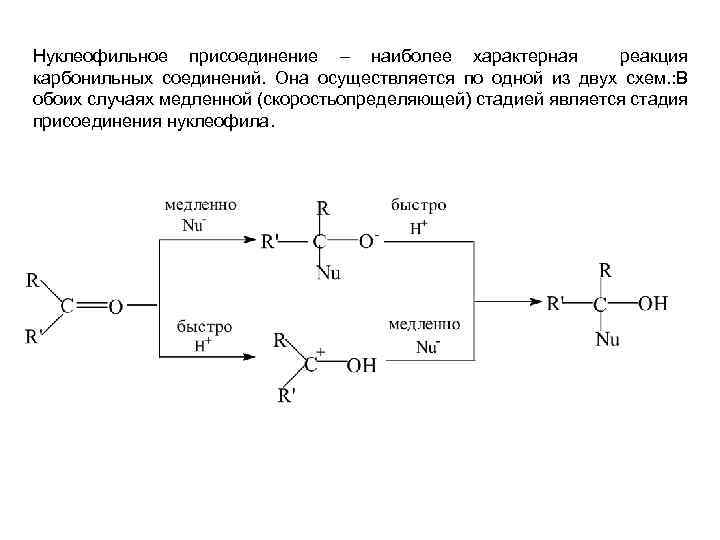 Нуклеофильное присоединение – наиболее характерная реакция карбонильных соединений. Она осуществляется по одной из двух схем. : В обоих случаях медленной (скоростьопределяющей) стадией является стадия присоединения нуклеофила.
Нуклеофильное присоединение – наиболее характерная реакция карбонильных соединений. Она осуществляется по одной из двух схем. : В обоих случаях медленной (скоростьопределяющей) стадией является стадия присоединения нуклеофила.
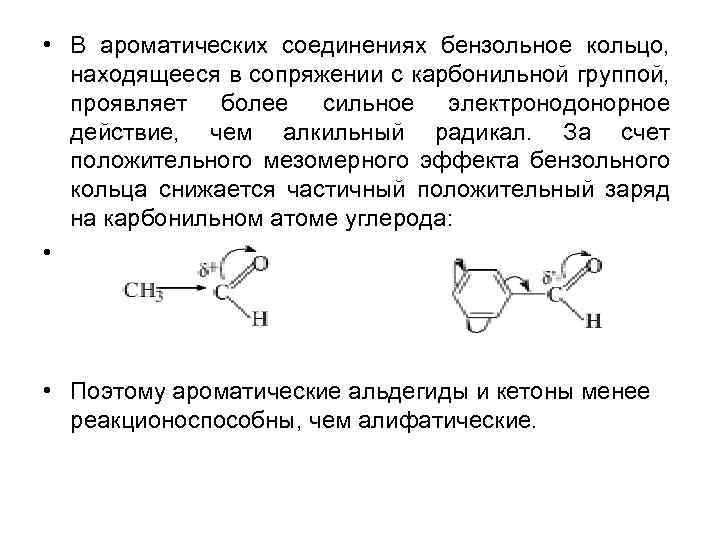 • В ароматических соединениях бензольное кольцо, находящееся в сопряжении с карбонильной группой, проявляет более сильное электронодонорное действие, чем алкильный радикал. За счет положительного мезомерного эффекта бензольного кольца снижается частичный положительный заряд на карбонильном атоме углерода: • • Поэтому ароматические альдегиды и кетоны менее реакционоспособны, чем алифатические.
• В ароматических соединениях бензольное кольцо, находящееся в сопряжении с карбонильной группой, проявляет более сильное электронодонорное действие, чем алкильный радикал. За счет положительного мезомерного эффекта бензольного кольца снижается частичный положительный заряд на карбонильном атоме углерода: • • Поэтому ароматические альдегиды и кетоны менее реакционоспособны, чем алифатические.
 • Для непредельных альдегидов и кетонов присущи реакции, характерные как для этиленовых углеводородов, так и для карбонильных соединений. Наличие π–связи, сопряженной с карбонильной группой, накладывает некоторые особенности в поведении этих соединений. Так, например, присоединение НВг к акролеину идет против правила Марковникова,
• Для непредельных альдегидов и кетонов присущи реакции, характерные как для этиленовых углеводородов, так и для карбонильных соединений. Наличие π–связи, сопряженной с карбонильной группой, накладывает некоторые особенности в поведении этих соединений. Так, например, присоединение НВг к акролеину идет против правила Марковникова,
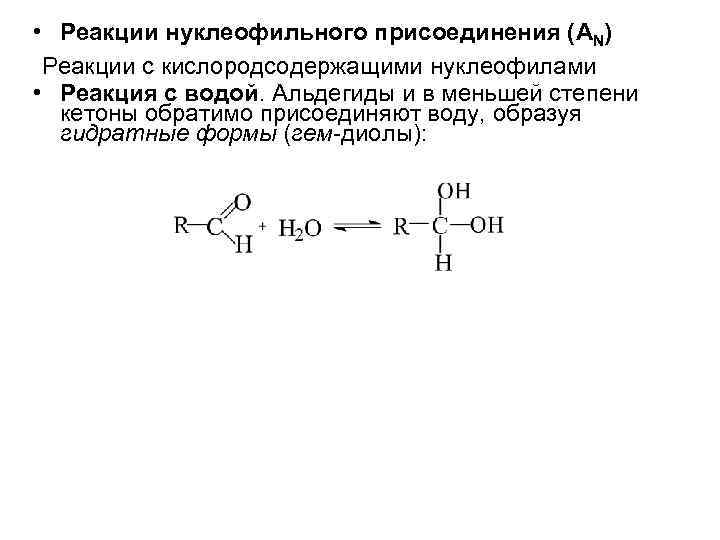 • Реакции нуклеофильного присоединения (AN) Реакции с кислородсодержащими нуклеофилами • Реакция с водой. Альдегиды и в меньшей степени кетоны обратимо присоединяют воду, образуя гидратные формы (гем-диолы):
• Реакции нуклеофильного присоединения (AN) Реакции с кислородсодержащими нуклеофилами • Реакция с водой. Альдегиды и в меньшей степени кетоны обратимо присоединяют воду, образуя гидратные формы (гем-диолы):
 • Реакция со спиртами. Спирты присоединяются к альдегидам с образованием полуацеталей. В спиртовых растворах альдегидов полуацетали находятся в равновесии с карбонильными соединениями. Полуацетали обычно не выделяют из реакционной смеси из-за их неустойчивости.
• Реакция со спиртами. Спирты присоединяются к альдегидам с образованием полуацеталей. В спиртовых растворах альдегидов полуацетали находятся в равновесии с карбонильными соединениями. Полуацетали обычно не выделяют из реакционной смеси из-за их неустойчивости.
 • Полуацетали при взаимодействии со второй молекулой спирта превращаются в ацетали: Ацетали получают из альдегидов или кетонов в присутствии кислоты.
• Полуацетали при взаимодействии со второй молекулой спирта превращаются в ацетали: Ацетали получают из альдегидов или кетонов в присутствии кислоты.
 • Реакции с азотсодержащими нуклеофилами • Альдегиды и кетоны взаимодействуют с различными соединениями, содержащими аминогруппу, при этом нуклеофильное присоединение чаще всего сопровождается отщеплением воды:
• Реакции с азотсодержащими нуклеофилами • Альдегиды и кетоны взаимодействуют с различными соединениями, содержащими аминогруппу, при этом нуклеофильное присоединение чаще всего сопровождается отщеплением воды:
 • Реакция с аминами. При взаимодействии альдегидов и кетонов с первичными аминами образуются N-замещенные имины (основания Шиффа): Имины, полученные из алифатических аминов и алифатических карбонильных соединений, обычно малоустойчивы, быстро разлагаются или полимеризуются. Производные ароматических аминов и ароматических альдегидов более стабильны. Образование иминов происходит в ряде биохимических реакций,
• Реакция с аминами. При взаимодействии альдегидов и кетонов с первичными аминами образуются N-замещенные имины (основания Шиффа): Имины, полученные из алифатических аминов и алифатических карбонильных соединений, обычно малоустойчивы, быстро разлагаются или полимеризуются. Производные ароматических аминов и ароматических альдегидов более стабильны. Образование иминов происходит в ряде биохимических реакций,
 • Реакция с гидразинами. При взаимодействии альде-гидов и кетонов с гидразином и замещенными гидразинами получают гидразоны. Свободная аминогруппа гидразона способна вступать в реакцию со второй молекулой карбонильного соединения с образованием азина, поэтому гидразоны в большинстве случаев бывает трудно выделить. Замещенные гидразины, особенно арилгидразины, образуют в реакциях с карбонильными соединениями устойчивые гидразоны.
• Реакция с гидразинами. При взаимодействии альде-гидов и кетонов с гидразином и замещенными гидразинами получают гидразоны. Свободная аминогруппа гидразона способна вступать в реакцию со второй молекулой карбонильного соединения с образованием азина, поэтому гидразоны в большинстве случаев бывает трудно выделить. Замещенные гидразины, особенно арилгидразины, образуют в реакциях с карбонильными соединениями устойчивые гидразоны.
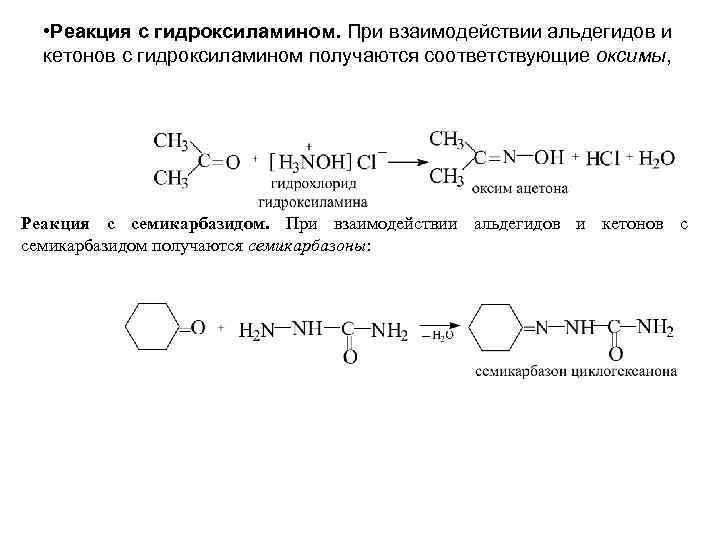 • Реакция с гидроксиламином. При взаимодействии альдегидов и кетонов с гидроксиламином получаются соответствующие оксимы, Реакция с семикарбазидом. При взаимодействии альдегидов и кетонов с семикарбазидом получаются семикарбазоны:
• Реакция с гидроксиламином. При взаимодействии альдегидов и кетонов с гидроксиламином получаются соответствующие оксимы, Реакция с семикарбазидом. При взаимодействии альдегидов и кетонов с семикарбазидом получаются семикарбазоны:
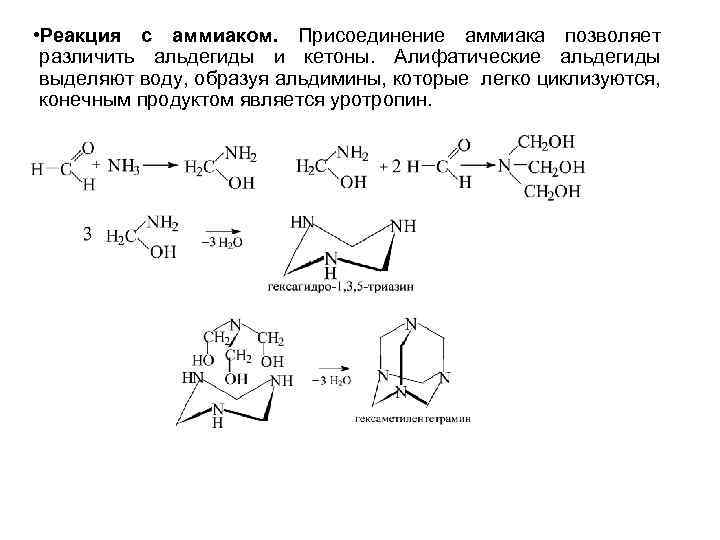 • Реакция с аммиаком. Присоединение аммиака позволяет различить альдегиды и кетоны. Алифатические альдегиды выделяют воду, образуя альдимины, которые легко циклизуются, конечным продуктом является уротропин.
• Реакция с аммиаком. Присоединение аммиака позволяет различить альдегиды и кетоны. Алифатические альдегиды выделяют воду, образуя альдимины, которые легко циклизуются, конечным продуктом является уротропин.
 • Кетоны с аммиаком подобных соединений не дают, они реагируют медленно и более сложно образуя кристаллические вещества (имины), которые служат для качественного и количественного определения карбонильных соединений, а также для их выделения и очистки. • альдегиды ароматического ряда взаимодействуют с аммиаком в соотношении 3: 2. Так, из бензальдегида образуется гидробензамид, превращающийся при нагревании в присутствии кислот в амарин:
• Кетоны с аммиаком подобных соединений не дают, они реагируют медленно и более сложно образуя кристаллические вещества (имины), которые служат для качественного и количественного определения карбонильных соединений, а также для их выделения и очистки. • альдегиды ароматического ряда взаимодействуют с аммиаком в соотношении 3: 2. Так, из бензальдегида образуется гидробензамид, превращающийся при нагревании в присутствии кислот в амарин:
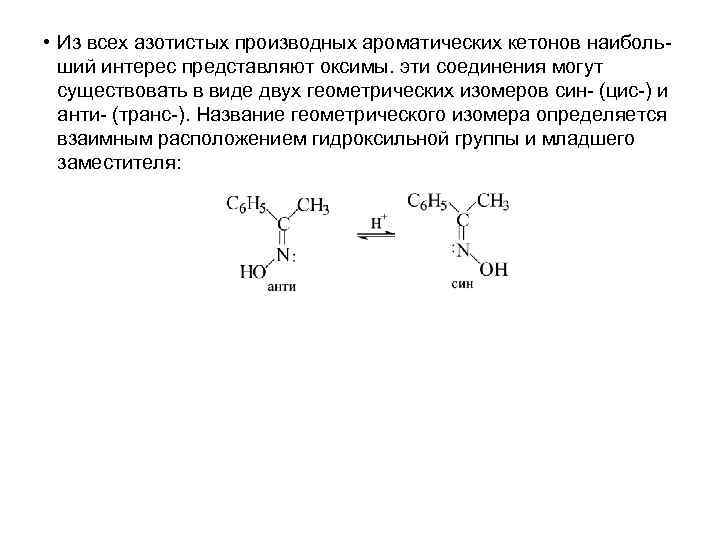 • Из всех азотистых производных ароматических кетонов наибольший интерес представляют оксимы. эти соединения могут существовать в виде двух геометрических изомеров син- (цис-) и анти- (транс-). Название геометрического изомера определяется взаимным расположением гидроксильной группы и младшего заместителя:
• Из всех азотистых производных ароматических кетонов наибольший интерес представляют оксимы. эти соединения могут существовать в виде двух геометрических изомеров син- (цис-) и анти- (транс-). Название геометрического изомера определяется взаимным расположением гидроксильной группы и младшего заместителя:
 • Присоединение циановодородной кислоты (цианогидринный синтез). Реакция приводит к образованию гидроксинитрилов и позволяет удлинить углеродную цепь на один атом углерода: Гидроксинитрилы гидролизуются в кислой среде в α-гидроксикарбоновые кислоты:
• Присоединение циановодородной кислоты (цианогидринный синтез). Реакция приводит к образованию гидроксинитрилов и позволяет удлинить углеродную цепь на один атом углерода: Гидроксинитрилы гидролизуются в кислой среде в α-гидроксикарбоновые кислоты:
 • С соединениями, обладающими СН- кислотными свойствами, альдегиды и кетоны способны вступать в различные реакции конденсации. Соединение, содержащее подвижный водород, в этих реакциях выступает в качестве нуклеофильного реагента и называется метиленовой компонентой, а альдегид или кетон – карбонильной компонентой. Реакции присоединения часто сопровождаются отщеплением воды. Альдольная конденсация. Реакция протекает при действии на альдегиды или кетоны разбавленных щелочей. При этом одна молекула альдегида представляет собой карбонильную компоненту, а другая – метиленовую.
• С соединениями, обладающими СН- кислотными свойствами, альдегиды и кетоны способны вступать в различные реакции конденсации. Соединение, содержащее подвижный водород, в этих реакциях выступает в качестве нуклеофильного реагента и называется метиленовой компонентой, а альдегид или кетон – карбонильной компонентой. Реакции присоединения часто сопровождаются отщеплением воды. Альдольная конденсация. Реакция протекает при действии на альдегиды или кетоны разбавленных щелочей. При этом одна молекула альдегида представляет собой карбонильную компоненту, а другая – метиленовую.
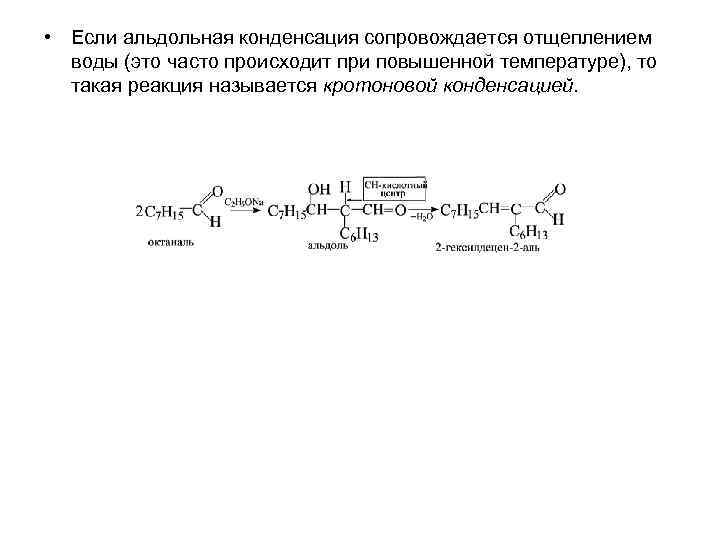 • Если альдольная конденсация сопровождается отщеплением воды (это часто происходит при повышенной температуре), то такая реакция называется кротоновой конденсацией.
• Если альдольная конденсация сопровождается отщеплением воды (это часто происходит при повышенной температуре), то такая реакция называется кротоновой конденсацией.
 • Реакции с галогенсодержащими нуклеофилами • Прямое взаимодействие карбонильных соединений с галогенидионами не наблюдается. При взаимодействии с сильными электрофилами - галогенидами фосфора или серы вначале происходит активация карбонильного соединения и затем реакция с галогенид-ионом:
• Реакции с галогенсодержащими нуклеофилами • Прямое взаимодействие карбонильных соединений с галогенидионами не наблюдается. При взаимодействии с сильными электрофилами - галогенидами фосфора или серы вначале происходит активация карбонильного соединения и затем реакция с галогенид-ионом:
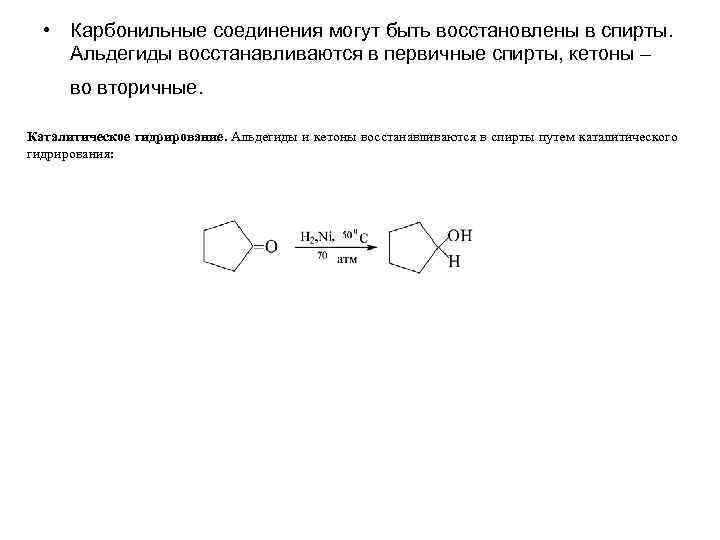 • Карбонильные соединения могут быть восстановлены в спирты. Альдегиды восстанавливаются в первичные спирты, кетоны – во вторичные. Каталитическое гидрирование. Альдегиды и кетоны восстанавливаются в спирты путем каталитического гидрирования:
• Карбонильные соединения могут быть восстановлены в спирты. Альдегиды восстанавливаются в первичные спирты, кетоны – во вторичные. Каталитическое гидрирование. Альдегиды и кетоны восстанавливаются в спирты путем каталитического гидрирования:
 • Окисление • Альдегиды окисляются значительно легче кетонов. Альдегиды практически любыми способами окисляются в карбоновые кислоты. Кетоны в зависимости от окислителя дают соединения разных классов, их окисление в основном сопровождается разрывом углеродного скелета. Альдегиды окисляются в кислоты также перманганатом калия в нейтральной и щелочной средах, дихроматом калия в кислой среде, оксидом хрома (VI).
• Окисление • Альдегиды окисляются значительно легче кетонов. Альдегиды практически любыми способами окисляются в карбоновые кислоты. Кетоны в зависимости от окислителя дают соединения разных классов, их окисление в основном сопровождается разрывом углеродного скелета. Альдегиды окисляются в кислоты также перманганатом калия в нейтральной и щелочной средах, дихроматом калия в кислой среде, оксидом хрома (VI).
 • Сильными окислителями кетоны окисляются с разрывом С-С связи по правилам, установленным Поповым. Если кетонная группа связана с двумя одинаковыми первичными радикалами, то разрыв углеродной цепи возможен с двух сторон от карбонильной группы : Однако, если радикалы разной длины, то группа СО останется с наиболее коротким радикалом.
• Сильными окислителями кетоны окисляются с разрывом С-С связи по правилам, установленным Поповым. Если кетонная группа связана с двумя одинаковыми первичными радикалами, то разрыв углеродной цепи возможен с двух сторон от карбонильной группы : Однако, если радикалы разной длины, то группа СО останется с наиболее коротким радикалом.
 • Енолизация и кето-енольная таутомерия. Карбонильная группа альдегидов и кетонов оказывает сильное электроноакцепторное влияние на соседний α-углеродный атом и делает водород при этом атоме очень подвижным, способным мигрировать к атому кислорода карбонильной группы. Образующиеся при этом непредельные спирты называются енолами, а сам процесс – енолизацией. Енолизация карбонильных соединений обратима.
• Енолизация и кето-енольная таутомерия. Карбонильная группа альдегидов и кетонов оказывает сильное электроноакцепторное влияние на соседний α-углеродный атом и делает водород при этом атоме очень подвижным, способным мигрировать к атому кислорода карбонильной группы. Образующиеся при этом непредельные спирты называются енолами, а сам процесс – енолизацией. Енолизация карбонильных соединений обратима.
 • Галоформная реакция. Метилкетоны, а также ацетальдегид при взаимодействии с хлором, бромом или иодом в щелочной среде галогенируются по метильной группе, превращаясь в тригалогенопроизводные. Образовавшийся тригалогенокетон или тригалогеноацетальдегид в щелочной среде расщепляется на карбоновую кислоту (в виде соли) и галоформ (хлороформ, бромоформ, иодоформ). Галоформную реакцию используют как способ получения карбоновых кислот, а также для обнаружения метилкетонов и ацетальдегида. Этим целям служит иодоформная проба, проведение которой сопровождается-образованием иодоформа CHI 3 – кристаллического вещества бледно-желтого цвета с характерным запахом.
• Галоформная реакция. Метилкетоны, а также ацетальдегид при взаимодействии с хлором, бромом или иодом в щелочной среде галогенируются по метильной группе, превращаясь в тригалогенопроизводные. Образовавшийся тригалогенокетон или тригалогеноацетальдегид в щелочной среде расщепляется на карбоновую кислоту (в виде соли) и галоформ (хлороформ, бромоформ, иодоформ). Галоформную реакцию используют как способ получения карбоновых кислот, а также для обнаружения метилкетонов и ацетальдегида. Этим целям служит иодоформная проба, проведение которой сопровождается-образованием иодоформа CHI 3 – кристаллического вещества бледно-желтого цвета с характерным запахом.
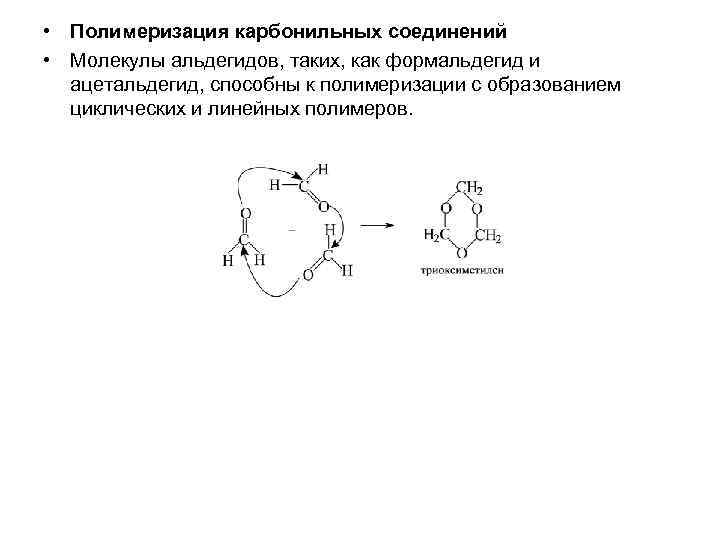 • Полимеризация карбонильных соединений • Молекулы альдегидов, таких, как формальдегид и ацетальдегид, способны к полимеризации с образованием циклических и линейных полимеров.
• Полимеризация карбонильных соединений • Молекулы альдегидов, таких, как формальдегид и ацетальдегид, способны к полимеризации с образованием циклических и линейных полимеров.


