e32b697c2af6a94adc3df1c64196f580.ppt
- Количество слайдов: 57
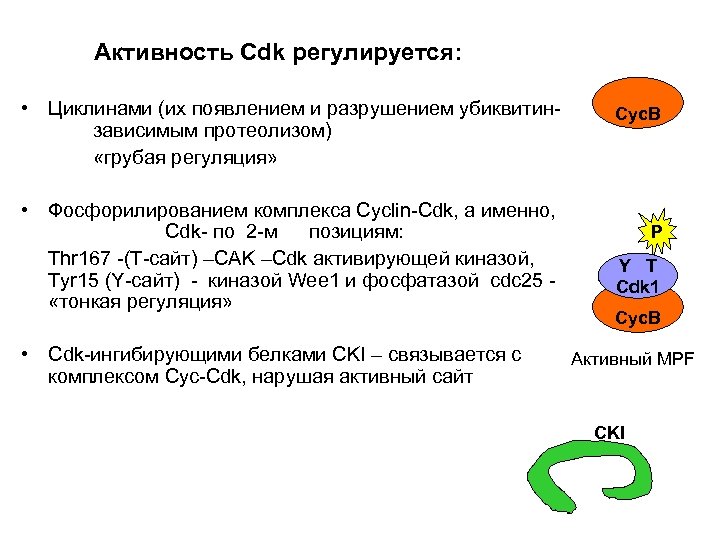 Активность Cdk регулируется: • Циклинами (их появлением и разрушением убиквитинзависимым протеолизом) «грубая регуляция» • Фосфорилированием комплекса Cyclin-Cdk, а именно, Cdk- по 2 -м позициям: Thr 167 -(T-сайт) –CAK –Cdk активирующей киназой, Tyr 15 (Y-сайт) - киназой Wee 1 и фосфатазой cdc 25 «тонкая регуляция» • Cdk-ингибирующими белками CKI – связывается с комплексом Cyc-Cdk, нарушая активный сайт Cyc. B P Y T Cdk 1 Cyc. B Активный MPF CKI
Активность Cdk регулируется: • Циклинами (их появлением и разрушением убиквитинзависимым протеолизом) «грубая регуляция» • Фосфорилированием комплекса Cyclin-Cdk, а именно, Cdk- по 2 -м позициям: Thr 167 -(T-сайт) –CAK –Cdk активирующей киназой, Tyr 15 (Y-сайт) - киназой Wee 1 и фосфатазой cdc 25 «тонкая регуляция» • Cdk-ингибирующими белками CKI – связывается с комплексом Cyc-Cdk, нарушая активный сайт Cyc. B P Y T Cdk 1 Cyc. B Активный MPF CKI
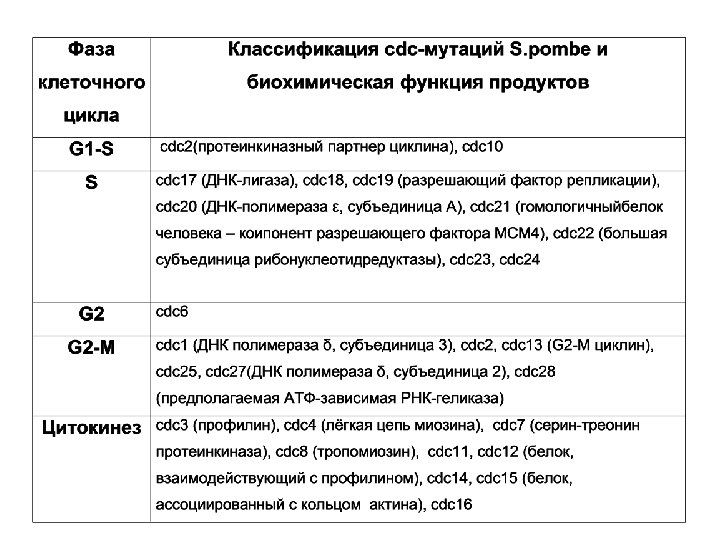
 Генетика клеточного цикла
Генетика клеточного цикла
 Ген cdc 25 - фосфатаза Температурочувствительные аллели блокируют в клетке переход G 2 -M, оставляя белок Cdc 2 фосфорилированным по Y-сайту и неактивным. Через 10 мин после возвращения к пермиссивной температуре происходит активация этого белка. Фосфатаза Cdc 25 дефосфорилирует Y –сайт Cdc 2, стимулирует переход MPF в активную форму Активируется киназой Polo и M/Cdk (MPF) Ген wee 1 - протеинкиназа Делеционные варианты аллелей вызывают преждевременное вхождение в митоз (почка меньше, чем обычно). При сверхпродукции этого белка происходит увеличение критического размера почкующейся клетки. Продукт гена wee 1 - 877 ак, имеющий гомологию с С-концом протеинкиназ. Действует противоположно cdc 25. Протеинкиназа фосфорилирует Y –сайт Cdc 2 и ингибирует активность
Ген cdc 25 - фосфатаза Температурочувствительные аллели блокируют в клетке переход G 2 -M, оставляя белок Cdc 2 фосфорилированным по Y-сайту и неактивным. Через 10 мин после возвращения к пермиссивной температуре происходит активация этого белка. Фосфатаза Cdc 25 дефосфорилирует Y –сайт Cdc 2, стимулирует переход MPF в активную форму Активируется киназой Polo и M/Cdk (MPF) Ген wee 1 - протеинкиназа Делеционные варианты аллелей вызывают преждевременное вхождение в митоз (почка меньше, чем обычно). При сверхпродукции этого белка происходит увеличение критического размера почкующейся клетки. Продукт гена wee 1 - 877 ак, имеющий гомологию с С-концом протеинкиназ. Действует противоположно cdc 25. Протеинкиназа фосфорилирует Y –сайт Cdc 2 и ингибирует активность
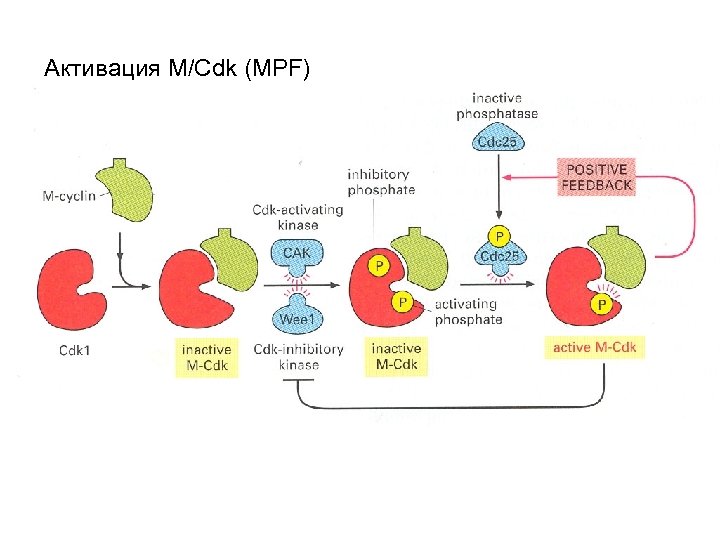 Активация M/Cdk (MPF)
Активация M/Cdk (MPF)
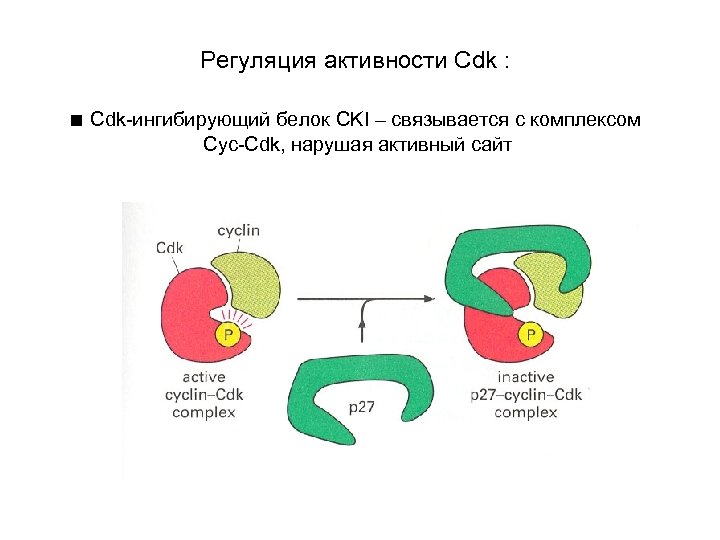 Регуляция активности Cdk : ■ Cdk-ингибирующий белок CKI – связывается с комплексом Cyc-Cdk, нарушая активный сайт
Регуляция активности Cdk : ■ Cdk-ингибирующий белок CKI – связывается с комплексом Cyc-Cdk, нарушая активный сайт
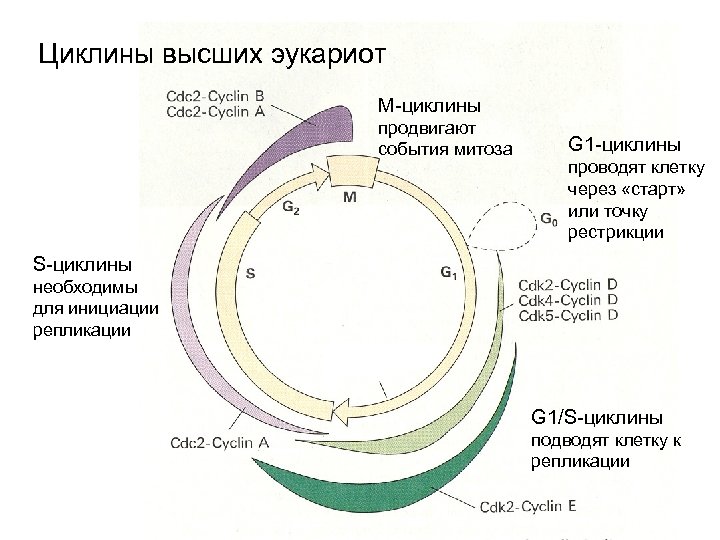 Циклины высших эукариот М-циклины продвигают события митоза G 1 -циклины проводят клетку через «старт» или точку рестрикции S-циклины необходимы для инициации репликации G 1/S-циклины подводят клетку к репликации
Циклины высших эукариот М-циклины продвигают события митоза G 1 -циклины проводят клетку через «старт» или точку рестрикции S-циклины необходимы для инициации репликации G 1/S-циклины подводят клетку к репликации
 Предотвращение повторной репликации S-Cdk: -запускает репликацию ДНК -фосфорилирует Сdc 6, он отделяется от ОRС- предотвращение репликации с этого ori. Фосфорилированный Сdc 6 узнается комплексом SCF, убиквитинизируется, деградирует в протеосоме -фосфорилирует некоторые Mcm-белки , это вызывает их экспорт из ядра – гарантия того, что комплекс Mcm больше не соберется Активность S-Cdk остается высокой до конца цикла: в G 2 и раннем митозе, предотвращая репликацию после завершения S-фазы M-Cdk предотвращает ререпликацию в митозе: продолжает фосфорилировать Сdc 6 и Mcm-белки, стимулируя их экспорт из ядра RESET: в конце митоза активность всех Cdk падает до нуля. Сdc 6 и Mcm-белки дефосфорилируются, pre-ORC может собираться снова.
Предотвращение повторной репликации S-Cdk: -запускает репликацию ДНК -фосфорилирует Сdc 6, он отделяется от ОRС- предотвращение репликации с этого ori. Фосфорилированный Сdc 6 узнается комплексом SCF, убиквитинизируется, деградирует в протеосоме -фосфорилирует некоторые Mcm-белки , это вызывает их экспорт из ядра – гарантия того, что комплекс Mcm больше не соберется Активность S-Cdk остается высокой до конца цикла: в G 2 и раннем митозе, предотвращая репликацию после завершения S-фазы M-Cdk предотвращает ререпликацию в митозе: продолжает фосфорилировать Сdc 6 и Mcm-белки, стимулируя их экспорт из ядра RESET: в конце митоза активность всех Cdk падает до нуля. Сdc 6 и Mcm-белки дефосфорилируются, pre-ORC может собираться снова.
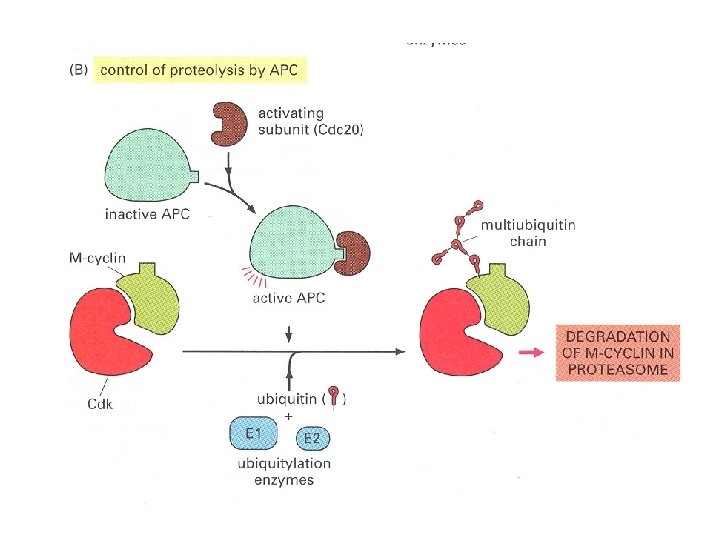
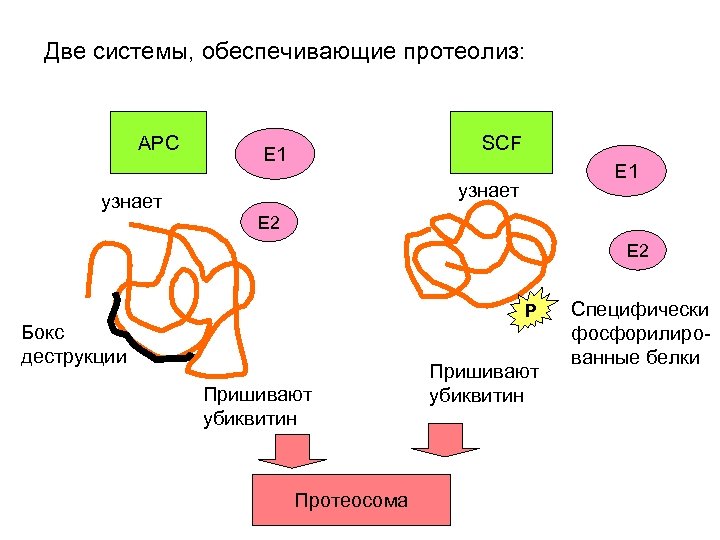 Две системы, обеспечивающие протеолиз: APC узнает SCF E 1 узнает E 2 P Бокс деструкции Пришивают убиквитин Протеосома Пришивают убиквитин Специфически фосфорилированные белки
Две системы, обеспечивающие протеолиз: APC узнает SCF E 1 узнает E 2 P Бокс деструкции Пришивают убиквитин Протеосома Пришивают убиквитин Специфически фосфорилированные белки
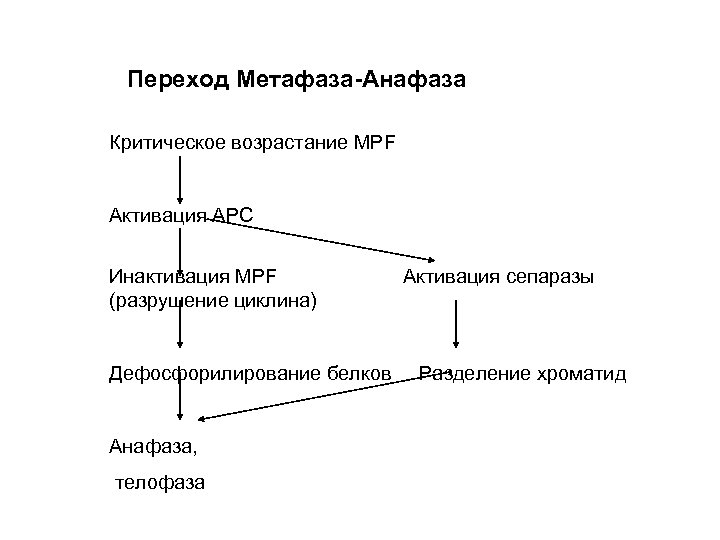 Переход Метафаза-Анафаза Критическое возрастание MPF Активация APC Инактивация MPF (разрушение циклина) Дефосфорилирование белков Анафаза, телофаза Активация сепаразы Разделение хроматид
Переход Метафаза-Анафаза Критическое возрастание MPF Активация APC Инактивация MPF (разрушение циклина) Дефосфорилирование белков Анафаза, телофаза Активация сепаразы Разделение хроматид
 Переход метафаза- анафаза Основные участники: APC - anaphase promotion complex – при добавлении субъединиц Е 1 и Е 2 служит убиквитин лигазой Cdc 20 - белок, активирующий APC Сепараза – протеаза, разрезающая один из когезинов Секурин- белок, инактивирующий протеазу
Переход метафаза- анафаза Основные участники: APC - anaphase promotion complex – при добавлении субъединиц Е 1 и Е 2 служит убиквитин лигазой Cdc 20 - белок, активирующий APC Сепараза – протеаза, разрезающая один из когезинов Секурин- белок, инактивирующий протеазу
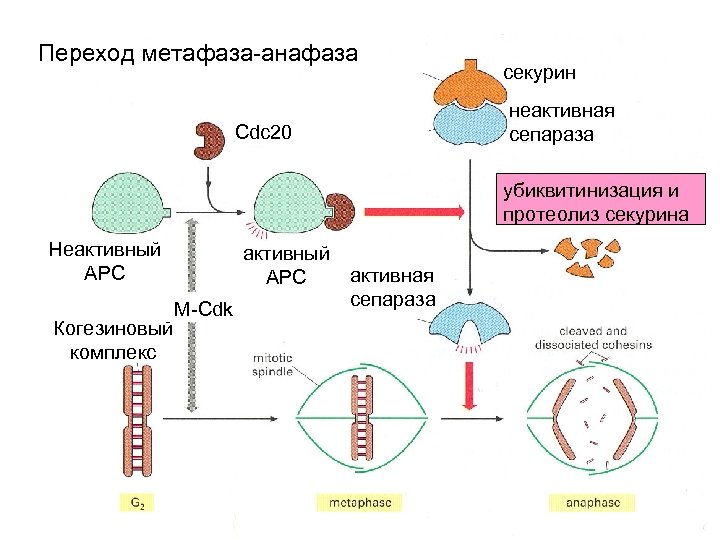 Переход метафаза-анафаза секурин неактивная сепараза Cdc 20 убиквитинизация и протеолиз секурина Неактивный АРС Когезиновый комплекс активный АРС M-Cdk активная сепараза
Переход метафаза-анафаза секурин неактивная сепараза Cdc 20 убиквитинизация и протеолиз секурина Неактивный АРС Когезиновый комплекс активный АРС M-Cdk активная сепараза
 Цитокинез должен происходить в нужное время в нужном месте Сократительное кольцо образуется под мембраной, его плоскость перпендикулярна веретену Активированные , но неоплодотворенные яйца лягушки: нет центросомы – нет веретена – нет цитокинеза Сдвиг веретена сдвигает сократительное кольцо. Сокращение началось – веретено можно удалить – цитокинез продолжится. Активная форма MPF фосфорилирует легкую цепь миозина АТФ-азная активность миозин ингибируется, кольцо сокращаться не может Интерфаза Метафаза Цитокинез P
Цитокинез должен происходить в нужное время в нужном месте Сократительное кольцо образуется под мембраной, его плоскость перпендикулярна веретену Активированные , но неоплодотворенные яйца лягушки: нет центросомы – нет веретена – нет цитокинеза Сдвиг веретена сдвигает сократительное кольцо. Сокращение началось – веретено можно удалить – цитокинез продолжится. Активная форма MPF фосфорилирует легкую цепь миозина АТФ-азная активность миозин ингибируется, кольцо сокращаться не может Интерфаза Метафаза Цитокинез P
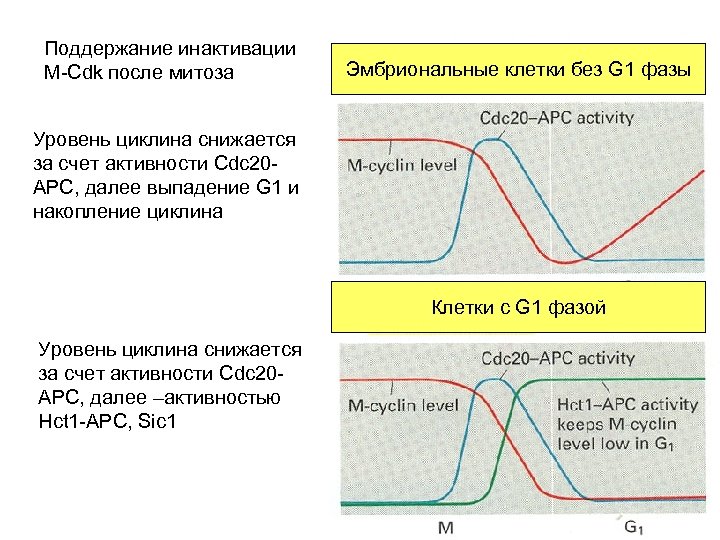 Поддержание инактивации M-Cdk после митоза Эмбриональные клетки без G 1 фазы Уровень циклина снижается за счет активности Cdc 20 APC, далее выпадение G 1 и накопление циклина Клетки с G 1 фазой Уровень циклина снижается за счет активности Cdc 20 APC, далее –активностью Hct 1 -APC, Sic 1
Поддержание инактивации M-Cdk после митоза Эмбриональные клетки без G 1 фазы Уровень циклина снижается за счет активности Cdc 20 APC, далее выпадение G 1 и накопление циклина Клетки с G 1 фазой Уровень циклина снижается за счет активности Cdc 20 APC, далее –активностью Hct 1 -APC, Sic 1
 Активность Cdk регулируется: • Циклинами (их появлением и разрушением убиквитин. Cyc. B • Cdc 20 -APC и аналог Hct 1 -APC – деградация циклина. зависимым протеолизом) M-Cdk активирует Cdc 20 -APC «грубая регуляция» M-Cdk инактивирует Hct 1 -APC • Фосфорилированием комплекса Cyclin-Cdk, а именно, Hct 1 -APC активируется в конце митоза, когда P Cdk- по 2 -м позициям: снижается к-во M-Cdk Thr 167 -(T-сайт) –CAK –Cdk активирующей киназой, Y T Tyr 15 (Y-сайт) - киназой Wee 1 и фосфотазой «тонкая Cdk 1 регуляция» • Sic 1 – белок из группы CKI Cyc. B M-Cdk инактивирует Sic 1 • Cdk-ингибирующими белками CKI – связывается с Sic 1 активируется в конце митоза, когда Активный MPF комплексом Cyc-Cdk, нарушая активный сайт снижается к-во M-Cdk CKI • В конце митоза снижается транскрипция М-циклина, до этого работала положительная обратная связь
Активность Cdk регулируется: • Циклинами (их появлением и разрушением убиквитин. Cyc. B • Cdc 20 -APC и аналог Hct 1 -APC – деградация циклина. зависимым протеолизом) M-Cdk активирует Cdc 20 -APC «грубая регуляция» M-Cdk инактивирует Hct 1 -APC • Фосфорилированием комплекса Cyclin-Cdk, а именно, Hct 1 -APC активируется в конце митоза, когда P Cdk- по 2 -м позициям: снижается к-во M-Cdk Thr 167 -(T-сайт) –CAK –Cdk активирующей киназой, Y T Tyr 15 (Y-сайт) - киназой Wee 1 и фосфотазой «тонкая Cdk 1 регуляция» • Sic 1 – белок из группы CKI Cyc. B M-Cdk инактивирует Sic 1 • Cdk-ингибирующими белками CKI – связывается с Sic 1 активируется в конце митоза, когда Активный MPF комплексом Cyc-Cdk, нарушая активный сайт снижается к-во M-Cdk CKI • В конце митоза снижается транскрипция М-циклина, до этого работала положительная обратная связь
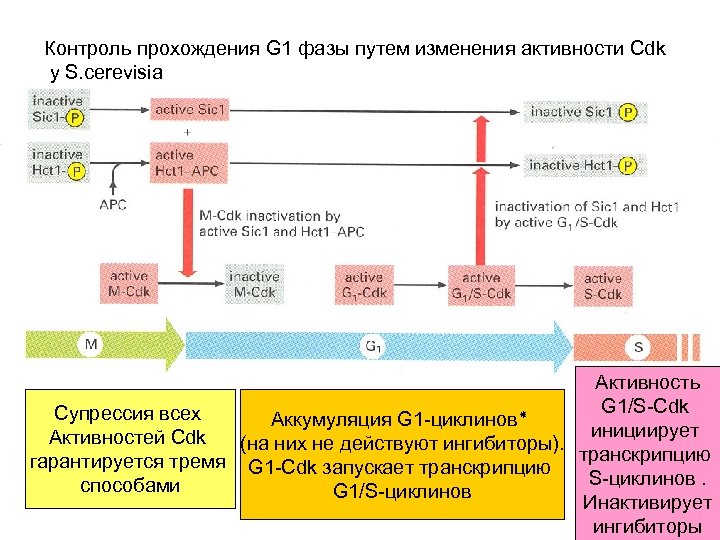 Контроль прохождения G 1 фазы путем изменения активности Cdk у S. cerevisia Активность G 1/S-Cdk Супрессия всех Аккумуляция G 1 -циклинов ٭ инициирует Активностей Cdk (на них не действуют ингибиторы). гарантируется тремя G 1 -Cdk запускает транскрипцию S-циклинов. способами G 1/S-циклинов Инактивирует ингибиторы
Контроль прохождения G 1 фазы путем изменения активности Cdk у S. cerevisia Активность G 1/S-Cdk Супрессия всех Аккумуляция G 1 -циклинов ٭ инициирует Активностей Cdk (на них не действуют ингибиторы). гарантируется тремя G 1 -Cdk запускает транскрипцию S-циклинов. способами G 1/S-циклинов Инактивирует ингибиторы
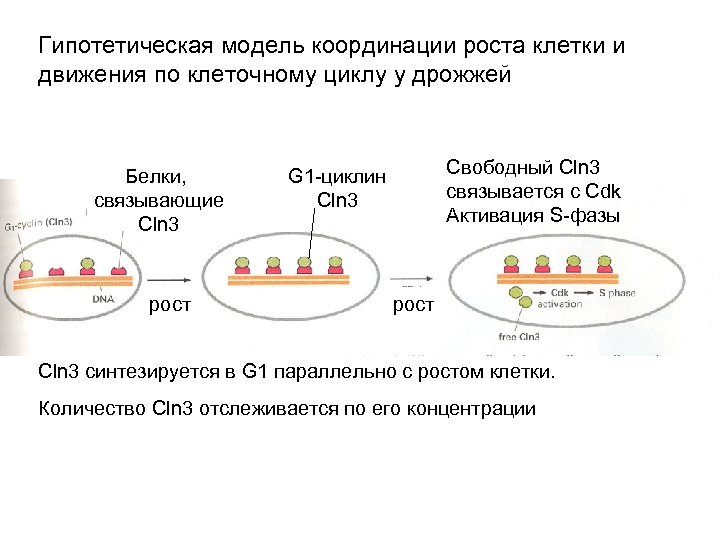 Гипотетическая модель координации роста клетки и движения по клеточному циклу у дрожжей Белки, cвязывающие Cln 3 рост Свободный Cln 3 cвязывается с Cdk Активация S-фазы G 1 -циклин Cln 3 рост Cln 3 синтезируется в G 1 параллельно с ростом клетки. Количество Cln 3 отслеживается по его концентрации
Гипотетическая модель координации роста клетки и движения по клеточному циклу у дрожжей Белки, cвязывающие Cln 3 рост Свободный Cln 3 cвязывается с Cdk Активация S-фазы G 1 -циклин Cln 3 рост Cln 3 синтезируется в G 1 параллельно с ростом клетки. Количество Cln 3 отслеживается по его концентрации
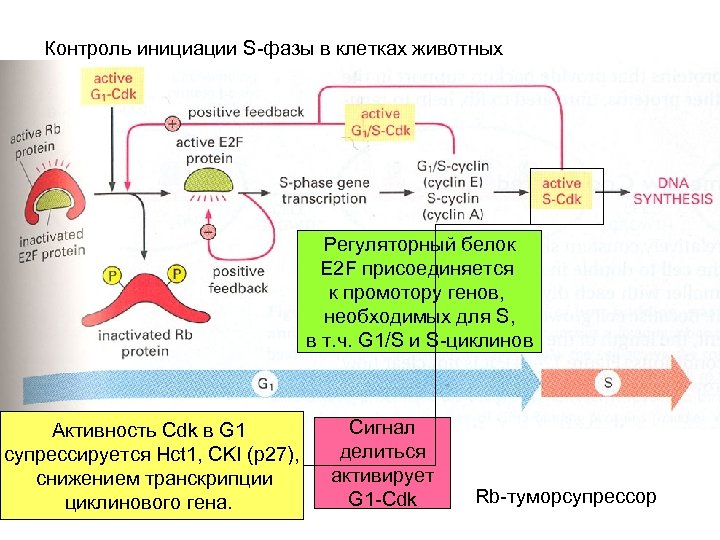 Контроль инициации S-фазы в клетках животных Регуляторный белок E 2 F присоединяется к промотору генов, необходимых для S, в т. ч. G 1/S и S-циклинов Активность Cdk в G 1 супрессируется Hct 1, CKI (p 27), снижением транскрипции циклинового гена. Сигнал делиться активирует G 1 -Cdk Rb-туморсупрессор
Контроль инициации S-фазы в клетках животных Регуляторный белок E 2 F присоединяется к промотору генов, необходимых для S, в т. ч. G 1/S и S-циклинов Активность Cdk в G 1 супрессируется Hct 1, CKI (p 27), снижением транскрипции циклинового гена. Сигнал делиться активирует G 1 -Cdk Rb-туморсупрессор
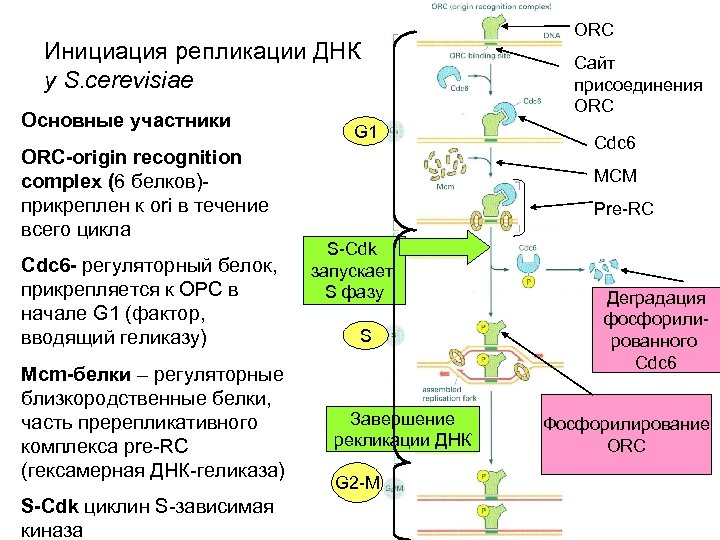 Инициация репликации ДНК у S. cerevisiae Основные участники ОRС-origin recognition complex (6 белков)прикреплен к ori в течение всего цикла Сdc 6 - регуляторный белок, прикрепляется к ОРС в начале G 1 (фактор, вводящий геликазу) Mcm-белки – регуляторные близкородственные белки, часть пререпликативного комплекса pre-RC (гексамерная ДНК-геликаза) S-Cdk циклин S-зависимая киназа G 1 ORC Сайт присоединения ORC Cdc 6 MCM Pre-RC S-Cdk запускает S фазу S Завершение рекликации ДНК G 2 -M Деградация фосфорилированного Cdc 6 Фосфорилирование ORC
Инициация репликации ДНК у S. cerevisiae Основные участники ОRС-origin recognition complex (6 белков)прикреплен к ori в течение всего цикла Сdc 6 - регуляторный белок, прикрепляется к ОРС в начале G 1 (фактор, вводящий геликазу) Mcm-белки – регуляторные близкородственные белки, часть пререпликативного комплекса pre-RC (гексамерная ДНК-геликаза) S-Cdk циклин S-зависимая киназа G 1 ORC Сайт присоединения ORC Cdc 6 MCM Pre-RC S-Cdk запускает S фазу S Завершение рекликации ДНК G 2 -M Деградация фосфорилированного Cdc 6 Фосфорилирование ORC
 Предотвращение повторной репликации S-Cdk: -запускает репликацию ДНК -фосфорилирует Сdc 6, он отделяется от ОRС- предотвращение репликации с этого ori. Фосфорилированный Сdc 6 узнается комплексом SCF, убиквитинизируется, деградирует в протеосоме -фосфорилирует некоторые Mcm-белки , это вызывает их экспорт из ядра – гарантия того, что комплекс Mcm больше не соберется Активность S-Cdk остается высокой до конца цикла: в G 2 и раннем митозе, предотвращая репликацию после завершения S-фазы M-Cdk предотвращает ререпликацию в митозе: продолжает фосфорилировать Сdc 6 и Mcm-белки, стимулируя их экспорт из ядра RESET: в конце митоза активность всех Cdk падает до нуля. Сdc 6 и Mcm-белки дефосфорилируются, pre-ORC может собираться снова.
Предотвращение повторной репликации S-Cdk: -запускает репликацию ДНК -фосфорилирует Сdc 6, он отделяется от ОRС- предотвращение репликации с этого ori. Фосфорилированный Сdc 6 узнается комплексом SCF, убиквитинизируется, деградирует в протеосоме -фосфорилирует некоторые Mcm-белки , это вызывает их экспорт из ядра – гарантия того, что комплекс Mcm больше не соберется Активность S-Cdk остается высокой до конца цикла: в G 2 и раннем митозе, предотвращая репликацию после завершения S-фазы M-Cdk предотвращает ререпликацию в митозе: продолжает фосфорилировать Сdc 6 и Mcm-белки, стимулируя их экспорт из ядра RESET: в конце митоза активность всех Cdk падает до нуля. Сdc 6 и Mcm-белки дефосфорилируются, pre-ORC может собираться снова.
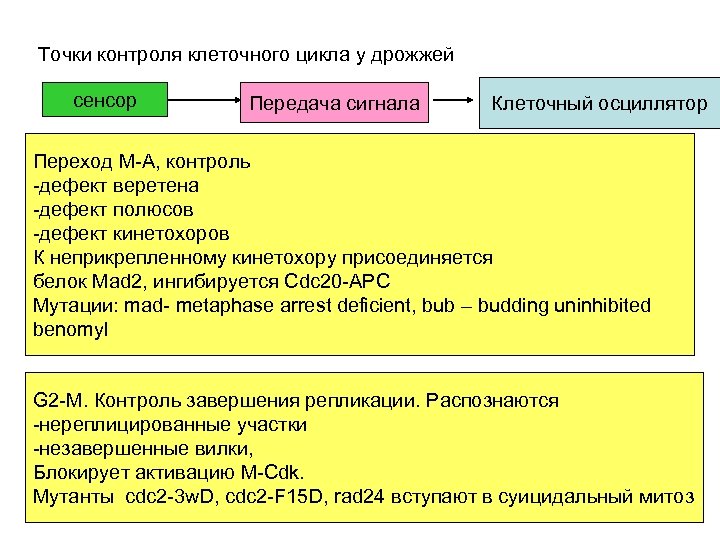 Точки контроля клеточного цикла у дрожжей сенсор Передача сигнала Клеточный осциллятор Переход М-А, контроль -дефект веретена Метафаза-дефект полюсов анафаза -дефект кинетохоров К неприкрепленному кинетохору присоединяется белок Mad 2, ингибируется Cdc 20 -APC G 1 -S Мутации: mad- metaphase arrest deficient, bub – budding uninhibited benomyl G 2 -M. Контроль завершения репликации. Распознаются -нереплицированные участки -незавершенные вилки, Блокирует активацию M-Cdk. Мутанты cdc 2 -3 w. D, cdc 2 -F 15 D, rad 24 вступают в суицидальный митоз
Точки контроля клеточного цикла у дрожжей сенсор Передача сигнала Клеточный осциллятор Переход М-А, контроль -дефект веретена Метафаза-дефект полюсов анафаза -дефект кинетохоров К неприкрепленному кинетохору присоединяется белок Mad 2, ингибируется Cdc 20 -APC G 1 -S Мутации: mad- metaphase arrest deficient, bub – budding uninhibited benomyl G 2 -M. Контроль завершения репликации. Распознаются -нереплицированные участки -незавершенные вилки, Блокирует активацию M-Cdk. Мутанты cdc 2 -3 w. D, cdc 2 -F 15 D, rad 24 вступают в суицидальный митоз
 Точки контроля клеточного цикла: G 2 Контроль повреждения ДНК. Поврежденная ДНК – киназы – инактивируют Cdc 25 Блок активации M-Cdk Мутации rad 1, rad 3, rad 24, rad 9 (регулятор репликации), rad 17(экзонуклеаза), hus 1, hus 2 G 1 контроль повреждения ДНК. Поврежденная ДНК – киназы – инактивируют Cdc 25 Блок активации G 1/S-Cdk, S-Cdk G 1 контроль роста клетки перед Стартом cln 3 D Передача сигналапротеинкиназы : Mec 3, Rad 53
Точки контроля клеточного цикла: G 2 Контроль повреждения ДНК. Поврежденная ДНК – киназы – инактивируют Cdc 25 Блок активации M-Cdk Мутации rad 1, rad 3, rad 24, rad 9 (регулятор репликации), rad 17(экзонуклеаза), hus 1, hus 2 G 1 контроль повреждения ДНК. Поврежденная ДНК – киназы – инактивируют Cdc 25 Блок активации G 1/S-Cdk, S-Cdk G 1 контроль роста клетки перед Стартом cln 3 D Передача сигналапротеинкиназы : Mec 3, Rad 53
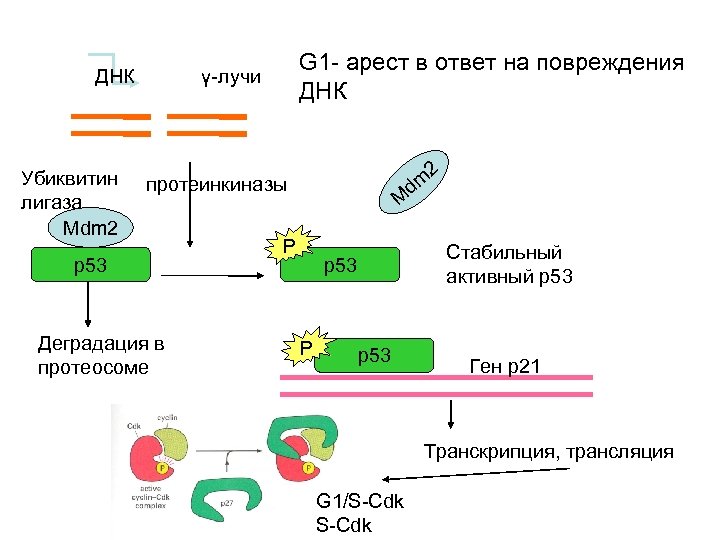 ДНК Убиквитин лигаза Mdm 2 G 1 - арест в ответ на повреждения ДНК γ-лучи 2 dm протеинкиназы p 53 Деградация в протеосоме M P Стабильный активный р53 p 53 P p 53 Ген р21 Транскрипция, трансляция G 1/S-Cdk
ДНК Убиквитин лигаза Mdm 2 G 1 - арест в ответ на повреждения ДНК γ-лучи 2 dm протеинкиназы p 53 Деградация в протеосоме M P Стабильный активный р53 p 53 P p 53 Ген р21 Транскрипция, трансляция G 1/S-Cdk
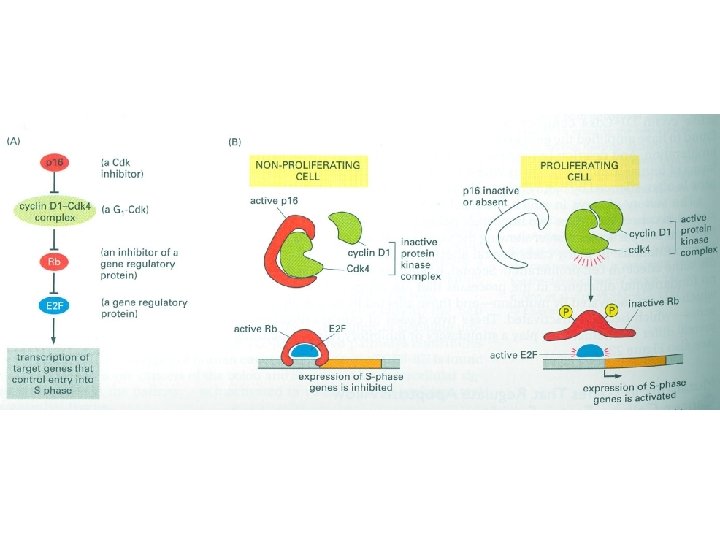
 Апоптоз: • Клетка сморщивается, • цитоскелет сжимается • Ядерная оболочка распадается • ДНК режется на фрагменты • Клеточная поверхность меняется, вызывая быстрый фагоцитоз клетки макрофагами или соседями Каспазы - протеазы, имеющие цистеин в активном сайте и разрезающие белки-мишени по аспарагиновой кислоте – caspases Синтезируются в виде прокаспаз, хранятся в клетке долгое время. Активируются другими каспазами разрезанием по аспарагиновой кислоте. Амплификация протеолитического каскада. Разрушение ламины. Разрезание белка, инактивирующего ДНКазу – разрезание ДНК.
Апоптоз: • Клетка сморщивается, • цитоскелет сжимается • Ядерная оболочка распадается • ДНК режется на фрагменты • Клеточная поверхность меняется, вызывая быстрый фагоцитоз клетки макрофагами или соседями Каспазы - протеазы, имеющие цистеин в активном сайте и разрезающие белки-мишени по аспарагиновой кислоте – caspases Синтезируются в виде прокаспаз, хранятся в клетке долгое время. Активируются другими каспазами разрезанием по аспарагиновой кислоте. Амплификация протеолитического каскада. Разрушение ламины. Разрезание белка, инактивирующего ДНКазу – разрезание ДНК.
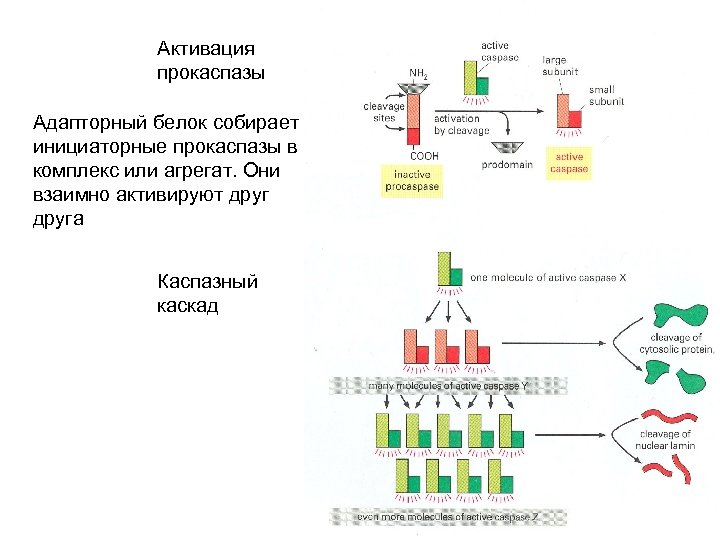 Активация прокаспазы Адапторный белок собирает инициаторные прокаспазы в комплекс или агрегат. Они взаимно активируют друга Каспазный каскад
Активация прокаспазы Адапторный белок собирает инициаторные прокаспазы в комплекс или агрегат. Они взаимно активируют друга Каспазный каскад
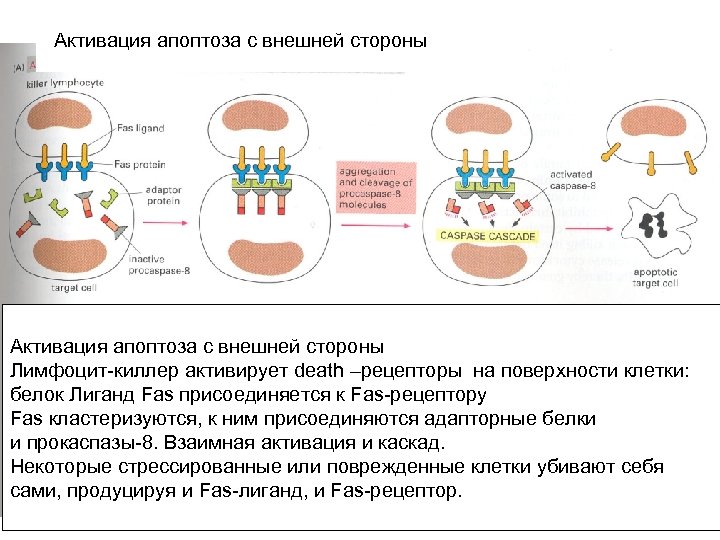 Активация апоптоза с внешней стороны Лимфоцит-киллер активирует death –рецепторы на поверхности клетки: белок Лиганд Fas присоединяется к Fas-рецептору Fas кластеризуются, к ним присоединяются адапторные белки и прокаспазы-8. Взаимная активация и каскад. Некоторые стрессированные или поврежденные клетки убивают себя сами, продуцируя и Fas-лиганд, и Fas-рецептор.
Активация апоптоза с внешней стороны Лимфоцит-киллер активирует death –рецепторы на поверхности клетки: белок Лиганд Fas присоединяется к Fas-рецептору Fas кластеризуются, к ним присоединяются адапторные белки и прокаспазы-8. Взаимная активация и каскад. Некоторые стрессированные или поврежденные клетки убивают себя сами, продуцируя и Fas-лиганд, и Fas-рецептор.
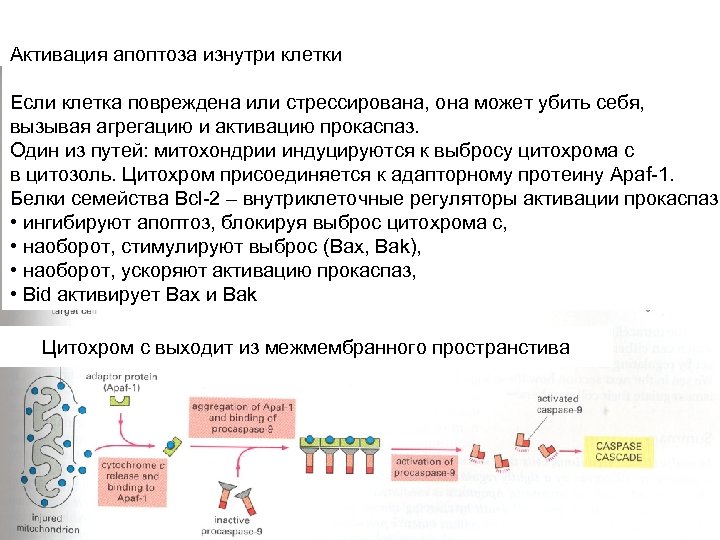 Активация апоптоза изнутри клетки Если клетка повреждена или стрессирована, она может убить себя, вызывая агрегацию и активацию прокаспаз. Один из путей: митохондрии индуцируются к выбросу цитохрома с в цитозоль. Цитохром присоединяется к адапторному протеину Apaf-1. Белки семейства Bcl-2 – внутриклеточные регуляторы активации прокаспаз: • ингибируют апоптоз, блокируя выброс цитохрома с, • наоборот, стимулируют выброс (Bax, Bak), • наоборот, ускоряют активацию прокаспаз, • Bid активирует Bax и Bak Цитохром с выходит из межмембранного пространстива
Активация апоптоза изнутри клетки Если клетка повреждена или стрессирована, она может убить себя, вызывая агрегацию и активацию прокаспаз. Один из путей: митохондрии индуцируются к выбросу цитохрома с в цитозоль. Цитохром присоединяется к адапторному протеину Apaf-1. Белки семейства Bcl-2 – внутриклеточные регуляторы активации прокаспаз: • ингибируют апоптоз, блокируя выброс цитохрома с, • наоборот, стимулируют выброс (Bax, Bak), • наоборот, ускоряют активацию прокаспаз, • Bid активирует Bax и Bak Цитохром с выходит из межмембранного пространстива
 Надклеточный контроль клеточного деления, роста и апоптоза Размер организма и органа зависит от числа клеток и их массы. Число клеток определяется их рождением и гибелью Экстраклеточные сигналы, регулирующие эти процессы, часто называют «факторы роста» в широком смысле. Для точного выражения следует различать: 1. Митогены – стимулируют клеточные деления, снимая внутриклеточный блок с продвижения по циклу. 2. Ростовые факторы – стимулируют увеличение массы клетки, вызывая синтез макромолекул и ингибируя их деградацию 3. Факторы выживания – супрессируют апоптоз
Надклеточный контроль клеточного деления, роста и апоптоза Размер организма и органа зависит от числа клеток и их массы. Число клеток определяется их рождением и гибелью Экстраклеточные сигналы, регулирующие эти процессы, часто называют «факторы роста» в широком смысле. Для точного выражения следует различать: 1. Митогены – стимулируют клеточные деления, снимая внутриклеточный блок с продвижения по циклу. 2. Ростовые факторы – стимулируют увеличение массы клетки, вызывая синтез макромолекул и ингибируя их деградацию 3. Факторы выживания – супрессируют апоптоз
 Митогены (более 50 белков) Фактор роста тромбоцитов PDGF –platelet-derived grows factor Клетки фибробластов в культуре делились с добавлением сывортки крови и не делились в плазме. Плазма – забирают жидкую часть крови без образования сгустка. Сыворотка – то же после образования сгустка. Клетки делились при добавлении экстракта фибробластов В организме фибробласты стимулируют деление клеток при заживлении ран. EGF –epidermal growth factor PDGF (фибробласты, гладкие мышечные, нейроглиальные) и EGF – широкого спектра дейстия Эритропоэтин – только для эритроцитов TGF-β – трансформирующийся фактор роста – одни клетки стимулирует, другие ингибирует
Митогены (более 50 белков) Фактор роста тромбоцитов PDGF –platelet-derived grows factor Клетки фибробластов в культуре делились с добавлением сывортки крови и не делились в плазме. Плазма – забирают жидкую часть крови без образования сгустка. Сыворотка – то же после образования сгустка. Клетки делились при добавлении экстракта фибробластов В организме фибробласты стимулируют деление клеток при заживлении ран. EGF –epidermal growth factor PDGF (фибробласты, гладкие мышечные, нейроглиальные) и EGF – широкого спектра дейстия Эритропоэтин – только для эритроцитов TGF-β – трансформирующийся фактор роста – одни клетки стимулирует, другие ингибирует
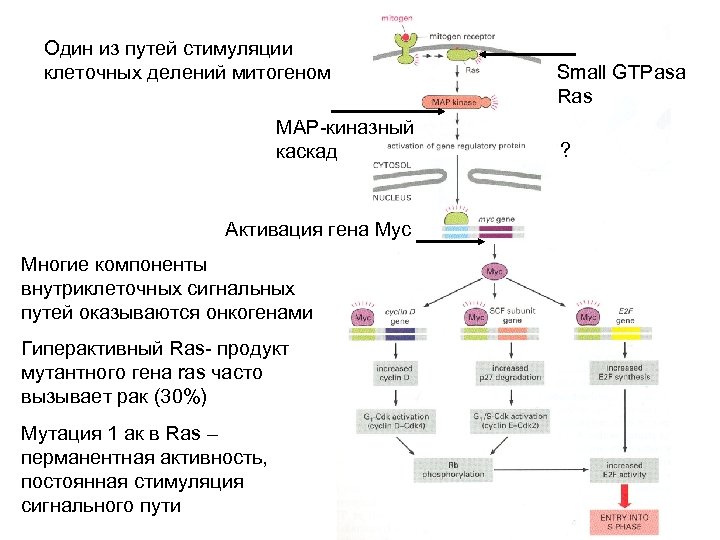 Один из путей стимуляции клеточных делений митогеном MAP-киназный каскад Активация гена Myc Многие компоненты внутриклеточных сигнальных путей оказываются онкогенами Гиперактивный Ras- продукт мутантного гена ras часто вызывает рак (30%) Мутация 1 ак в Ras – перманентная активность, постоянная стимуляция сигнального пути Small GTPasa Ras ?
Один из путей стимуляции клеточных делений митогеном MAP-киназный каскад Активация гена Myc Многие компоненты внутриклеточных сигнальных путей оказываются онкогенами Гиперактивный Ras- продукт мутантного гена ras часто вызывает рак (30%) Мутация 1 ак в Ras – перманентная активность, постоянная стимуляция сигнального пути Small GTPasa Ras ?
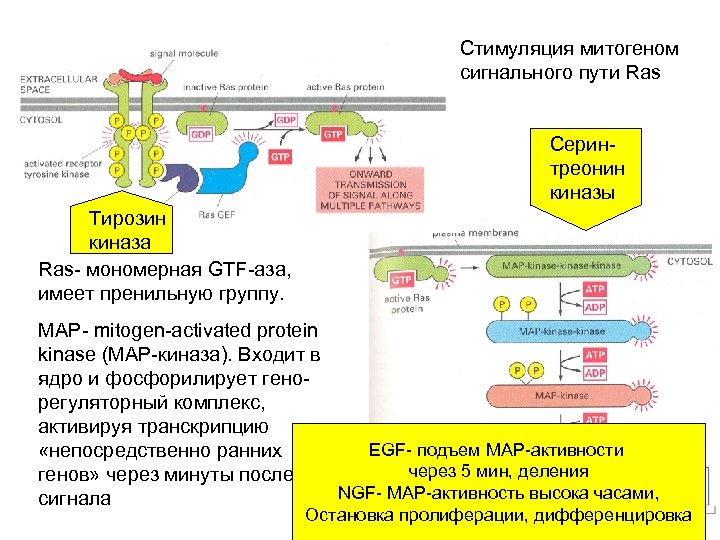 Стимуляция митогеном сигнального пути Ras Серинтреонин киназы Тирозин киназа Ras- мономерная GTF-аза, имеет пренильную группу. MAP- mitogen-activated protein kinase (MAP-киназа). Входит в ядро и фосфорилирует генорегуляторный комплекс, активируя транскрипцию EGF- подъем МАР-активности «непосредственно ранних через 5 мин, деления генов» через минуты после NGF- MAP-активность высока часами, сигнала Остановка пролиферации, дифференцировка
Стимуляция митогеном сигнального пути Ras Серинтреонин киназы Тирозин киназа Ras- мономерная GTF-аза, имеет пренильную группу. MAP- mitogen-activated protein kinase (MAP-киназа). Входит в ядро и фосфорилирует генорегуляторный комплекс, активируя транскрипцию EGF- подъем МАР-активности «непосредственно ранних через 5 мин, деления генов» через минуты после NGF- MAP-активность высока часами, сигнала Остановка пролиферации, дифференцировка
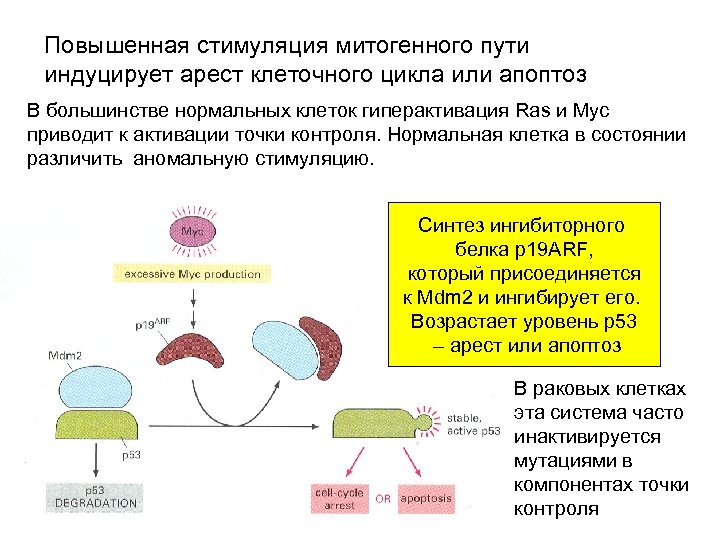 Повышенная стимуляция митогенного пути индуцирует арест клеточного цикла или апоптоз В большинстве нормальных клеток гиперактивация Ras и Myc приводит к активации точки контроля. Нормальная клетка в состоянии различить аномальную стимуляцию. Синтез ингибиторного белка р19 ARF, который присоединяется к Mdm 2 и ингибирует его. Возрастает уровень р53 – арест или апоптоз В раковых клетках эта система часто инактивируется мутациями в компонентах точки контроля
Повышенная стимуляция митогенного пути индуцирует арест клеточного цикла или апоптоз В большинстве нормальных клеток гиперактивация Ras и Myc приводит к активации точки контроля. Нормальная клетка в состоянии различить аномальную стимуляцию. Синтез ингибиторного белка р19 ARF, который присоединяется к Mdm 2 и ингибирует его. Возрастает уровень р53 – арест или апоптоз В раковых клетках эта система часто инактивируется мутациями в компонентах точки контроля
 Другие способы регуляции митогенной активности • Белок CKI p 27 в клетках, которые делятся определенное число раз, прежде чем войдут в перманентный арест при терминальной дифференцировке. У мышей, дефицитных по р27, общее число клеток увеличино • Репликативное старение клеток, связанное с теломерами. У фибробластов через 25 -50 делений с митогенами в среде наступает арест. Активация пути р53 в ответ на повреждения теломер. • У грызунов теломераза активна. Контроль над делениями осуществляется механизмом p 19 ARF. Мутации в нем могут приводить к «бессмертию» культуры клеток
Другие способы регуляции митогенной активности • Белок CKI p 27 в клетках, которые делятся определенное число раз, прежде чем войдут в перманентный арест при терминальной дифференцировке. У мышей, дефицитных по р27, общее число клеток увеличино • Репликативное старение клеток, связанное с теломерами. У фибробластов через 25 -50 делений с митогенами в среде наступает арест. Активация пути р53 в ответ на повреждения теломер. • У грызунов теломераза активна. Контроль над делениями осуществляется механизмом p 19 ARF. Мутации в нем могут приводить к «бессмертию» культуры клеток
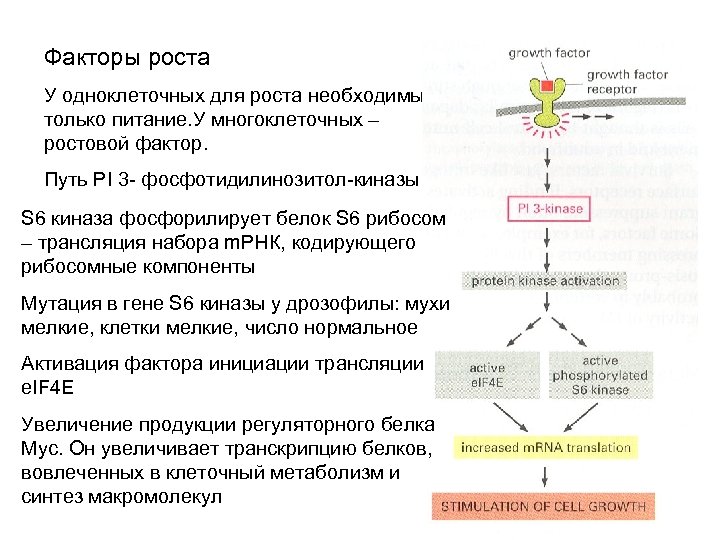 Факторы роста У одноклеточных для роста необходимы только питание. У многоклеточных – ростовой фактор. Путь PI 3 - фосфотидилинозитол-киназы S 6 киназа фосфорилирует белок S 6 рибосом – трансляция набора m. РНК, кодирующего рибосомные компоненты Мутация в гене S 6 киназы у дрозофилы: мухи мелкие, клетки мелкие, число нормальное Активация фактора инициации трансляции e. IF 4 E Увеличение продукции регуляторного белка Myc. Он увеличивает транскрипцию белков, вовлеченных в клеточный метаболизм и синтез макромолекул
Факторы роста У одноклеточных для роста необходимы только питание. У многоклеточных – ростовой фактор. Путь PI 3 - фосфотидилинозитол-киназы S 6 киназа фосфорилирует белок S 6 рибосом – трансляция набора m. РНК, кодирующего рибосомные компоненты Мутация в гене S 6 киназы у дрозофилы: мухи мелкие, клетки мелкие, число нормальное Активация фактора инициации трансляции e. IF 4 E Увеличение продукции регуляторного белка Myc. Он увеличивает транскрипцию белков, вовлеченных в клеточный метаболизм и синтез макромолекул
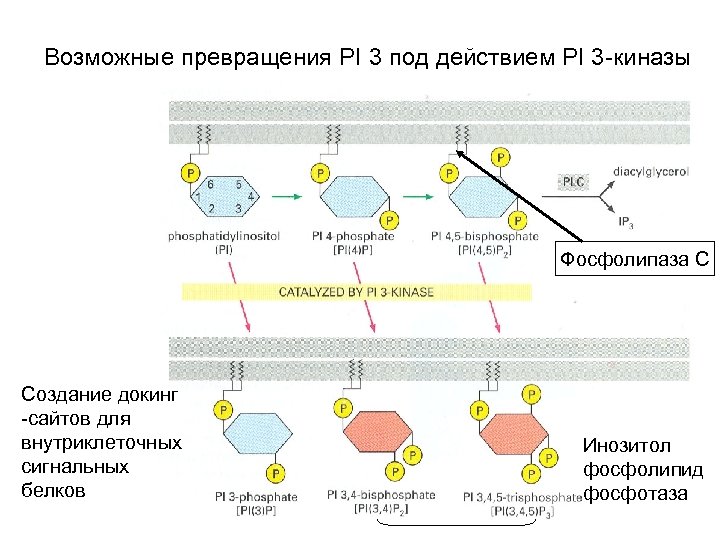 Возможные превращения PI 3 под действием PI 3 -киназы Фосфолипаза С Создание докинг -сайтов для внутриклеточных сигнальных белков Инозитол фосфолипид фосфотаза
Возможные превращения PI 3 под действием PI 3 -киназы Фосфолипаза С Создание докинг -сайтов для внутриклеточных сигнальных белков Инозитол фосфолипид фосфотаза
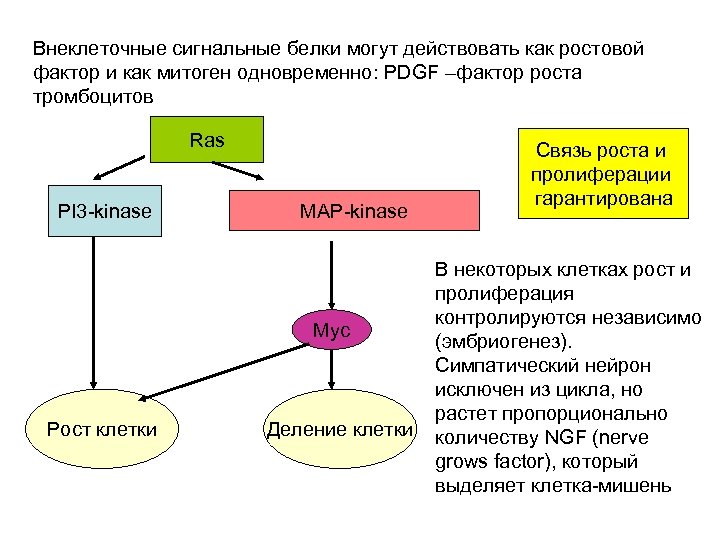 Внеклеточные сигнальные белки могут действовать как ростовой фактор и как митоген одновременно: PDGF –фактор роста тромбоцитов Ras PI 3 -kinase MAP-kinase Myc Рост клетки Деление клетки Связь роста и пролиферации гарантирована В некоторых клетках рост и пролиферация контролируются независимо (эмбриогенез). Симпатический нейрон исключен из цикла, но растет пропорционально количеству NGF (nerve grows factor), который выделяет клетка-мишень
Внеклеточные сигнальные белки могут действовать как ростовой фактор и как митоген одновременно: PDGF –фактор роста тромбоцитов Ras PI 3 -kinase MAP-kinase Myc Рост клетки Деление клетки Связь роста и пролиферации гарантирована В некоторых клетках рост и пролиферация контролируются независимо (эмбриогенез). Симпатический нейрон исключен из цикла, но растет пропорционально количеству NGF (nerve grows factor), который выделяет клетка-мишень
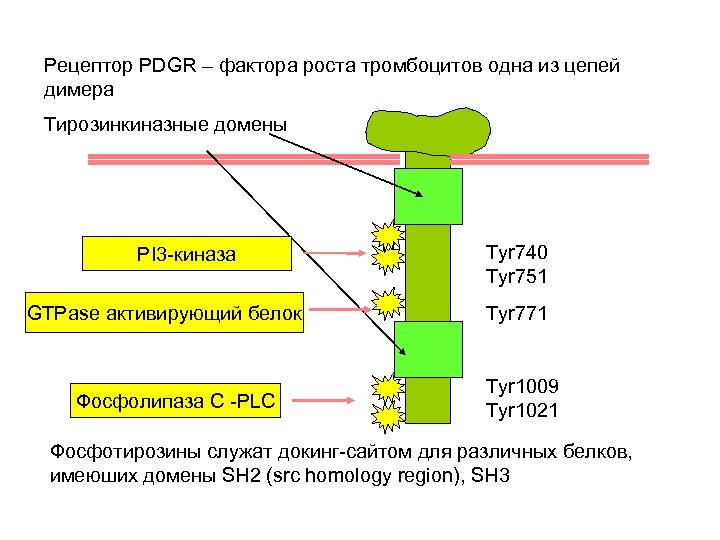 Рецептор PDGR – фактора роста тромбоцитов одна из цепей димера Тирозинкиназные домены PI 3 -киназа GTPase активирующий белок Фосфолипаза С -PLC Tyr 740 Tyr 751 Tyr 771 Tyr 1009 Tyr 1021 Фосфотирозины служат докинг-сайтом для различных белков, имеюших домены SH 2 (src homology region), SH 3
Рецептор PDGR – фактора роста тромбоцитов одна из цепей димера Тирозинкиназные домены PI 3 -киназа GTPase активирующий белок Фосфолипаза С -PLC Tyr 740 Tyr 751 Tyr 771 Tyr 1009 Tyr 1021 Фосфотирозины служат докинг-сайтом для различных белков, имеюших домены SH 2 (src homology region), SH 3
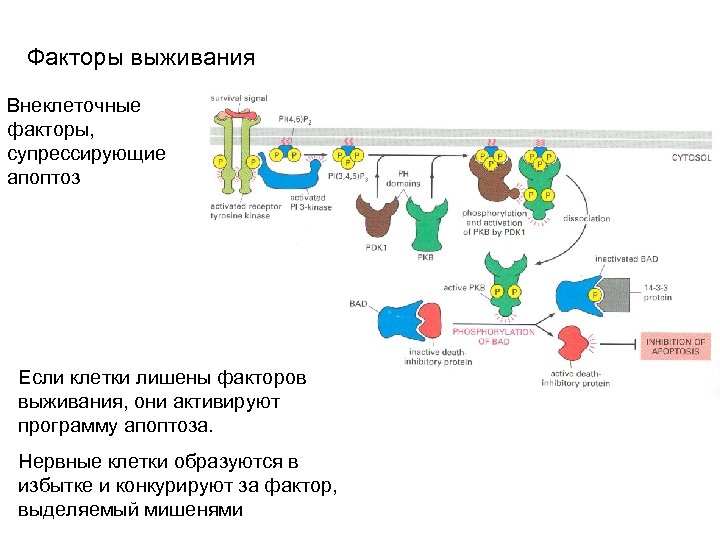 Факторы выживания Внеклеточные факторы, супрессирующие апоптоз Если клетки лишены факторов выживания, они активируют программу апоптоза. Нервные клетки образуются в избытке и конкурируют за фактор, выделяемый мишенями
Факторы выживания Внеклеточные факторы, супрессирующие апоптоз Если клетки лишены факторов выживания, они активируют программу апоптоза. Нервные клетки образуются в избытке и конкурируют за фактор, выделяемый мишенями
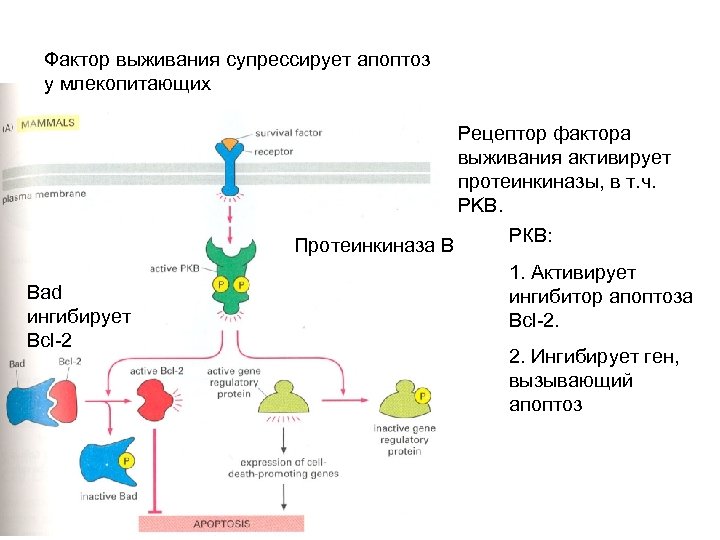 Фактор выживания супрессирует апоптоз у млекопитающих Рецептор фактора выживания активирует протеинкиназы, в т. ч. PKB. Протеинкиназа В Bad ингибирует Bcl-2 РКВ: 1. Активирует ингибитор апоптоза Bcl-2. 2. Ингибирует ген, вызывающий апоптоз
Фактор выживания супрессирует апоптоз у млекопитающих Рецептор фактора выживания активирует протеинкиназы, в т. ч. PKB. Протеинкиназа В Bad ингибирует Bcl-2 РКВ: 1. Активирует ингибитор апоптоза Bcl-2. 2. Ингибирует ген, вызывающий апоптоз
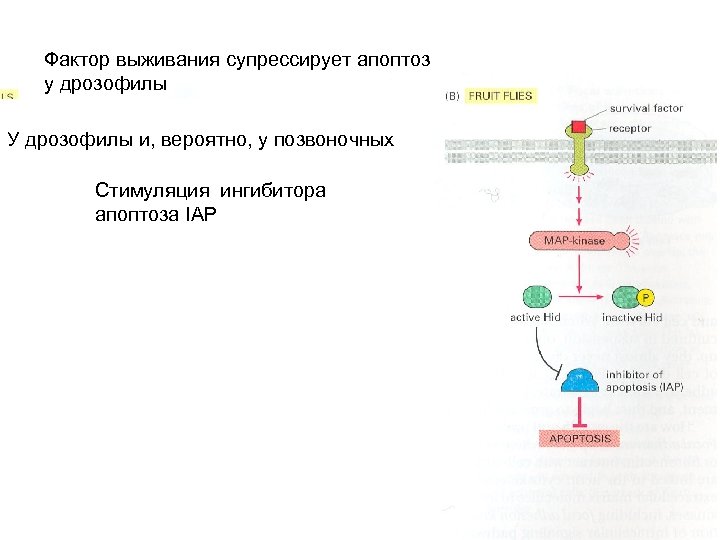 Фактор выживания супрессирует апоптоз у дрозофилы У дрозофилы и, вероятно, у позвоночных Стимуляция ингибитора апоптоза IAP
Фактор выживания супрессирует апоптоз у дрозофилы У дрозофилы и, вероятно, у позвоночных Стимуляция ингибитора апоптоза IAP
 Внеклеточные сигналы, ингибирующие рост TGF-β –большое семейство родственных белков. Растворимые димеры, действуют как гормоны или локальные медиаторы. Суперсемейство: TGF-β, активины и BMP TGF-β ингибирует пролиферацию нескольких типов клеток, блокируя клеточный цикл в G 1 или стимулируя апоптоз. Градуирующие морфогены Активирует путь Smads. Изменения в транскрипции генов, регулирующих клеточные деления, дифференцировку, образование внеклеточного матрикса и смерть. BMP- bone morphogenetic protein из семейства TGF-β. Помогает включить апоптоз в тканях между развивающимися пальцами. Myostatin (то же семейство) – ингибирует пролиферацию миобластов.
Внеклеточные сигналы, ингибирующие рост TGF-β –большое семейство родственных белков. Растворимые димеры, действуют как гормоны или локальные медиаторы. Суперсемейство: TGF-β, активины и BMP TGF-β ингибирует пролиферацию нескольких типов клеток, блокируя клеточный цикл в G 1 или стимулируя апоптоз. Градуирующие морфогены Активирует путь Smads. Изменения в транскрипции генов, регулирующих клеточные деления, дифференцировку, образование внеклеточного матрикса и смерть. BMP- bone morphogenetic protein из семейства TGF-β. Помогает включить апоптоз в тканях между развивающимися пальцами. Myostatin (то же семейство) – ингибирует пролиферацию миобластов.
 Внеклеточные сигналы, ингибирующие рост Стратегия наиболее быстрой передачи сигнала в ядро
Внеклеточные сигналы, ингибирующие рост Стратегия наиболее быстрой передачи сигнала в ядро
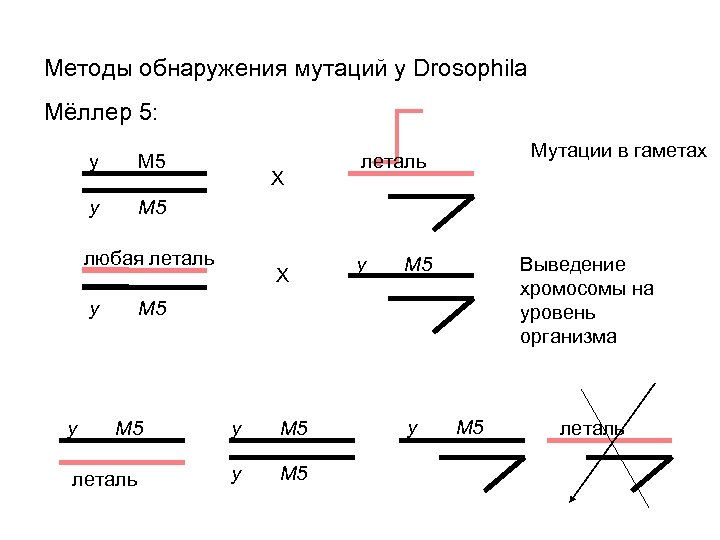 Методы обнаружения мутаций у Drosophila Мёллер 5: y M 5 X любая леталь y y Мутации в гаметах X леталь y M 5 Выведение хромосомы на уровень организма M 5 y M 5 леталь
Методы обнаружения мутаций у Drosophila Мёллер 5: y M 5 X любая леталь y y Мутации в гаметах X леталь y M 5 Выведение хромосомы на уровень организма M 5 y M 5 леталь
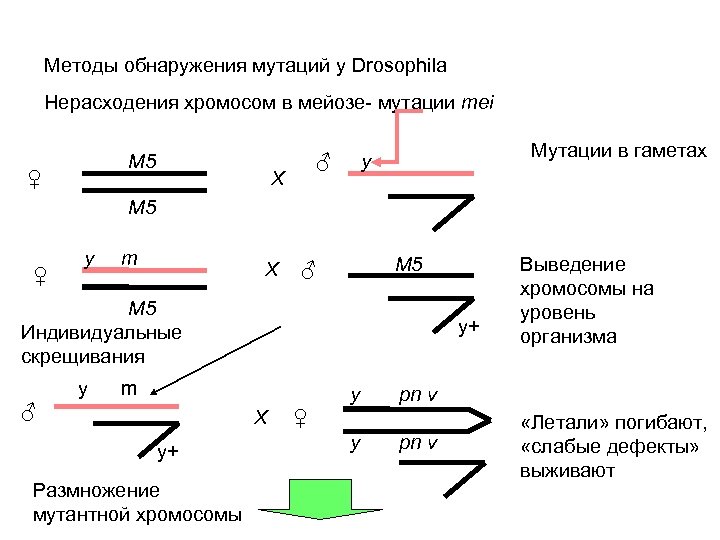 Методы обнаружения мутаций у Drosophila Нерасходения хромосом в мейозе- мутации mei M 5 ♀ ♀ ♂ X Мутации в гаметах y M 5 y m X M 5 ♂ M 5 Индивидуальные скрещивания y y+ m y ♂ X y+ Размножение мутантной хромосомы pn v ♀ y Выведение хромосомы на уровень организма pn v «Летали» погибают, «слабые дефекты» выживают
Методы обнаружения мутаций у Drosophila Нерасходения хромосом в мейозе- мутации mei M 5 ♀ ♀ ♂ X Мутации в гаметах y M 5 y m X M 5 ♂ M 5 Индивидуальные скрещивания y y+ m y ♂ X y+ Размножение мутантной хромосомы pn v ♀ y Выведение хромосомы на уровень организма pn v «Летали» погибают, «слабые дефекты» выживают
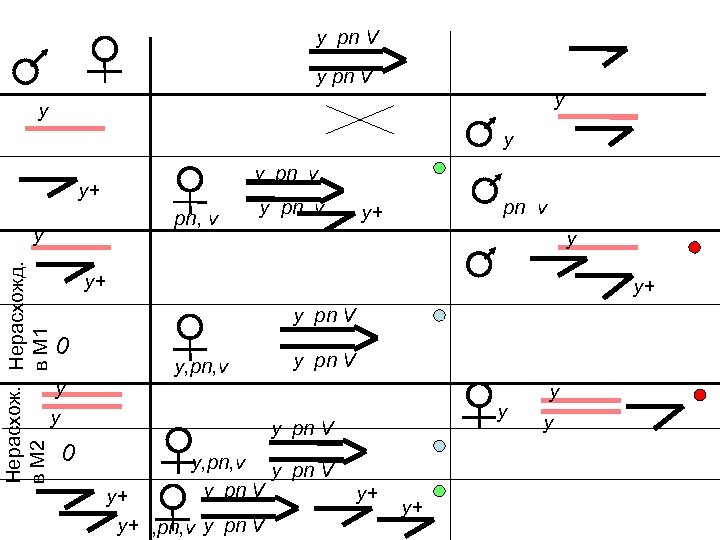 y pn V y y pn v y+ pn, v Нерасхожд. в М 2 в М 1 y y pn v y+ y+ y pn V 0 y, pn, v y y 0 y pn V y, pn, v y pn V y+ y+ y y
y pn V y y pn v y+ pn, v Нерасхожд. в М 2 в М 1 y y pn v y+ y+ y pn V 0 y, pn, v y y 0 y pn V y, pn, v y pn V y+ y+ y y
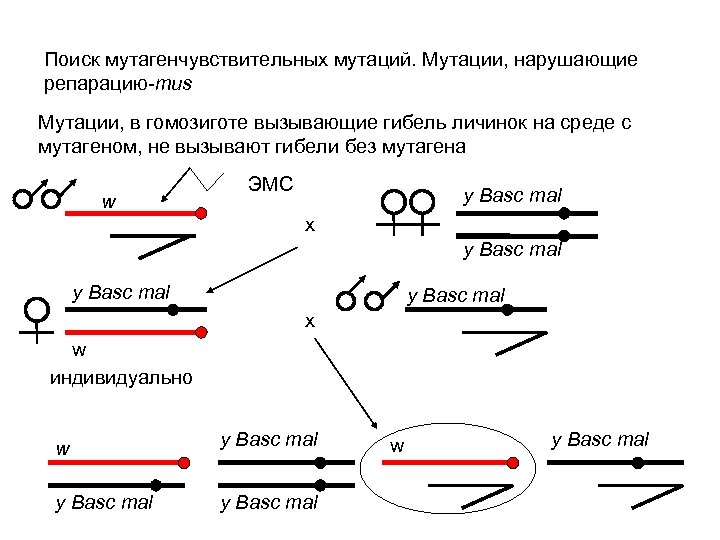 Поиск мутагенчувствительных мутаций. Мутации, нарушающие репарацию-mus Мутации, в гомозиготе вызывающие гибель личинок на среде с мутагеном, не вызывают гибели без мутагена w ЭМС y Basc mal х y Basc mal х w индивидуально w y Basc mal w y Basc mal
Поиск мутагенчувствительных мутаций. Мутации, нарушающие репарацию-mus Мутации, в гомозиготе вызывающие гибель личинок на среде с мутагеном, не вызывают гибели без мутагена w ЭМС y Basc mal х y Basc mal х w индивидуально w y Basc mal w y Basc mal
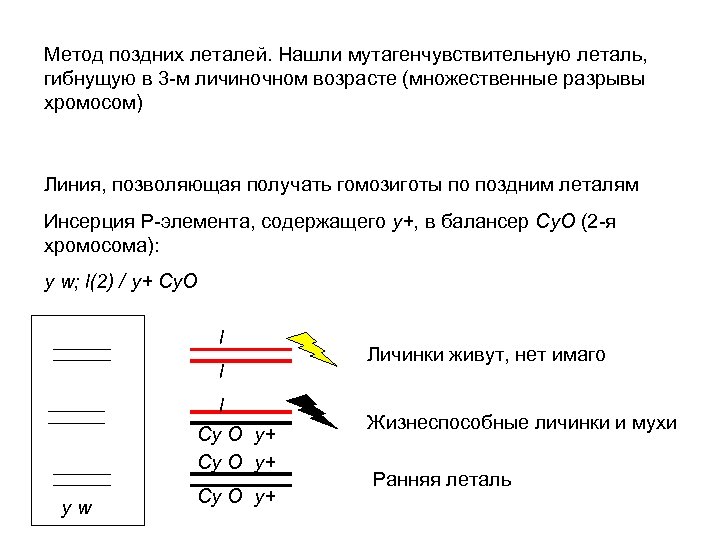 Метод поздних леталей. Нашли мутагенчувствительную леталь, гибнущую в 3 -м личиночном возрасте (множественные разрывы хромосом) Линия, позволяющая получать гомозиготы по поздним леталям Инсерция Р-элемента, содержащего у+, в балансер Cy. O (2 -я хромосома): y w; l(2) / y+ Cy. O l l l Cy O y+ yw Cy O y+ Личинки живут, нет имаго Жизнеспособные личинки и мухи Ранняя леталь
Метод поздних леталей. Нашли мутагенчувствительную леталь, гибнущую в 3 -м личиночном возрасте (множественные разрывы хромосом) Линия, позволяющая получать гомозиготы по поздним леталям Инсерция Р-элемента, содержащего у+, в балансер Cy. O (2 -я хромосома): y w; l(2) / y+ Cy. O l l l Cy O y+ yw Cy O y+ Личинки живут, нет имаго Жизнеспособные личинки и мухи Ранняя леталь
 Поиск мутаций по взаимодействию с определенными генами 3 -я хромосома маркирована генами клеточного деления: gnu, polo, mgr, asp, stg Хромосома, обработанные мутагеном Тест на летальность gnu- Giant nuclei Обнаружены : • аллели всех мутаций, • новые мутации, проявляющие летальное взаимодействие с этими генами asp- abnormal spindle mgr- merry go round stg- string- протеинфосфатаза, гомолог cdc 25 S. pombe polp- серин-треонин-протеинкиназа, белок метафазных хромосом. Монополярное веретено
Поиск мутаций по взаимодействию с определенными генами 3 -я хромосома маркирована генами клеточного деления: gnu, polo, mgr, asp, stg Хромосома, обработанные мутагеном Тест на летальность gnu- Giant nuclei Обнаружены : • аллели всех мутаций, • новые мутации, проявляющие летальное взаимодействие с этими генами asp- abnormal spindle mgr- merry go round stg- string- протеинфосфатаза, гомолог cdc 25 S. pombe polp- серин-треонин-протеинкиназа, белок метафазных хромосом. Монополярное веретено
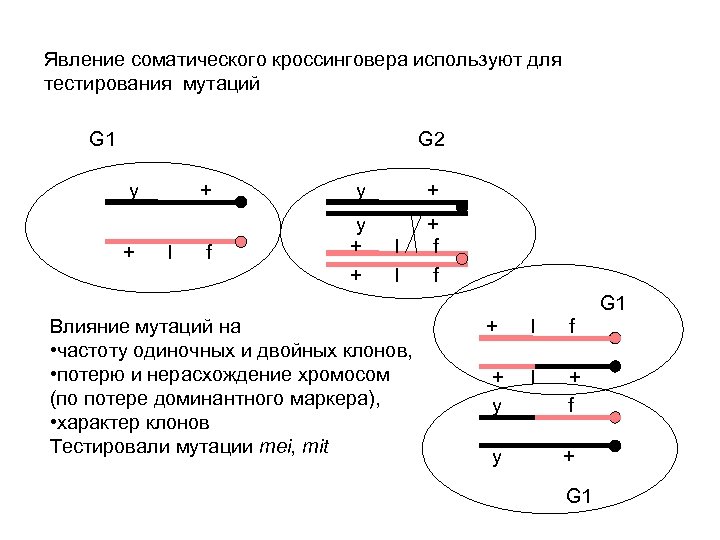 Явление соматического кроссинговера используют для тестирования мутаций G 1 G 2 y + + l y + f y + + + f f l l G 1 Влияние мутаций на • частоту одиночных и двойных клонов, • потерю и нерасхождение хромосом (по потере доминантного маркера), • характер клонов Тестировали мутации mei, mit + l f + y l + f y + G 1
Явление соматического кроссинговера используют для тестирования мутаций G 1 G 2 y + + l y + f y + + + f f l l G 1 Влияние мутаций на • частоту одиночных и двойных клонов, • потерю и нерасхождение хромосом (по потере доминантного маркера), • характер клонов Тестировали мутации mei, mit + l f + y l + f y + G 1
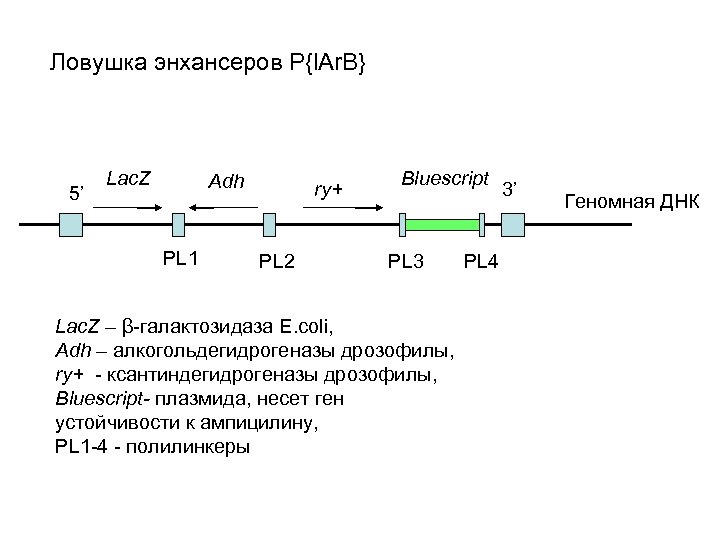 Ловушка энхансеров P{l. Ar. B} 5’ Lac. Z Adh PL 1 ry+ PL 2 Bluescript PL 3 Lac. Z – β-галактозидаза E. coli, Adh – алкогольдегидрогеназы дрозофилы, ry+ - ксантиндегидрогеназы дрозофилы, Bluescript- плазмида, несет ген устойчивости к ампицилину, PL 1 -4 - полилинкеры PL 4 3’ Геномная ДНК
Ловушка энхансеров P{l. Ar. B} 5’ Lac. Z Adh PL 1 ry+ PL 2 Bluescript PL 3 Lac. Z – β-галактозидаза E. coli, Adh – алкогольдегидрогеназы дрозофилы, ry+ - ксантиндегидрогеназы дрозофилы, Bluescript- плазмида, несет ген устойчивости к ампицилину, PL 1 -4 - полилинкеры PL 4 3’ Геномная ДНК
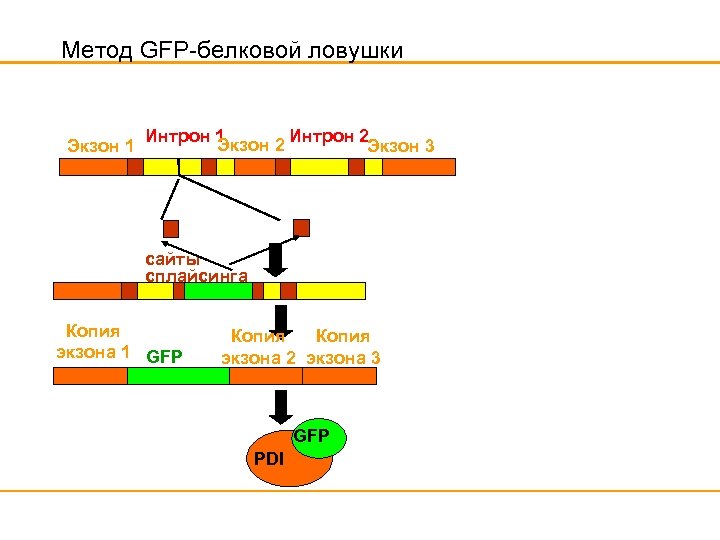 Метод GFP-белковой ловушки Экзон 1 Интрон 2 Экзон 3 сайты сплайсинга Копия экзона 1 GFP Копия экзона 2 экзона 3 GFP PDI
Метод GFP-белковой ловушки Экзон 1 Интрон 2 Экзон 3 сайты сплайсинга Копия экзона 1 GFP Копия экзона 2 экзона 3 GFP PDI
 FLP-FRT система для искусственной митотической рекомбинации FRT hs-FLP ry+ 1. линии, содержащие FLPрекомбиназу, работающую под промотором теплового шока 2. линии, содержащие встройки Рэлемента с геном white+ и FRTсайтами При индукции FLP рекомбиназы происходит митотический обмен между двумя одинаково ориентированными FRT сайтами на стадии 4 -х хроматид. Вариант: UAS-FLP ; GAL 4 ; FRT + + FRT вводят мутацию Применение системы для маркирования мозаичного клона в ткани: GFP- белок промотор FRT GFP белок появится, если спейсер удален.
FLP-FRT система для искусственной митотической рекомбинации FRT hs-FLP ry+ 1. линии, содержащие FLPрекомбиназу, работающую под промотором теплового шока 2. линии, содержащие встройки Рэлемента с геном white+ и FRTсайтами При индукции FLP рекомбиназы происходит митотический обмен между двумя одинаково ориентированными FRT сайтами на стадии 4 -х хроматид. Вариант: UAS-FLP ; GAL 4 ; FRT + + FRT вводят мутацию Применение системы для маркирования мозаичного клона в ткани: GFP- белок промотор FRT GFP белок появится, если спейсер удален.
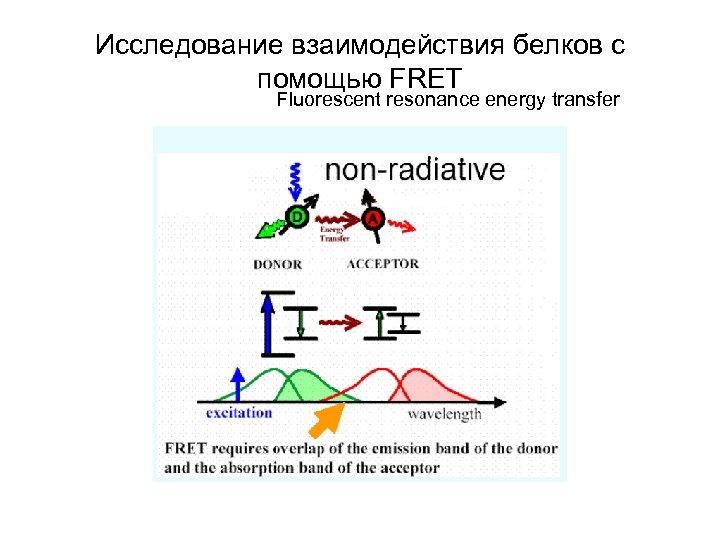 Исследование взаимодействия белков с помощью FRET Fluorescent resonance energy transfer
Исследование взаимодействия белков с помощью FRET Fluorescent resonance energy transfer
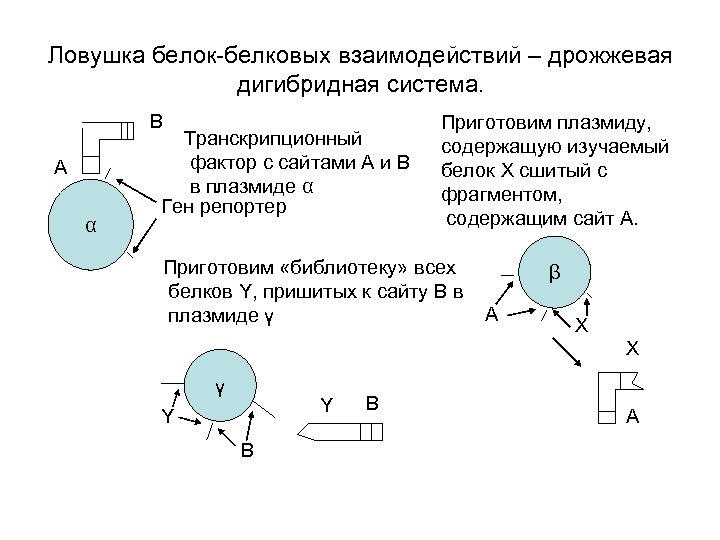 Ловушка белок-белковых взаимодействий – дрожжевая дигибридная система. B A α Транскрипционный фактор с сайтами A и B в плазмиде α Ген репортер Приготовим плазмиду, cодержащую изучаемый белок X сшитый с фрагментом, содержащим сайт A. Приготовим «библиотеку» всех белков Y, пришитых к сайту B в плазмиде γ β A X X γ Y Y B B A
Ловушка белок-белковых взаимодействий – дрожжевая дигибридная система. B A α Транскрипционный фактор с сайтами A и B в плазмиде α Ген репортер Приготовим плазмиду, cодержащую изучаемый белок X сшитый с фрагментом, содержащим сайт A. Приготовим «библиотеку» всех белков Y, пришитых к сайту B в плазмиде γ β A X X γ Y Y B B A
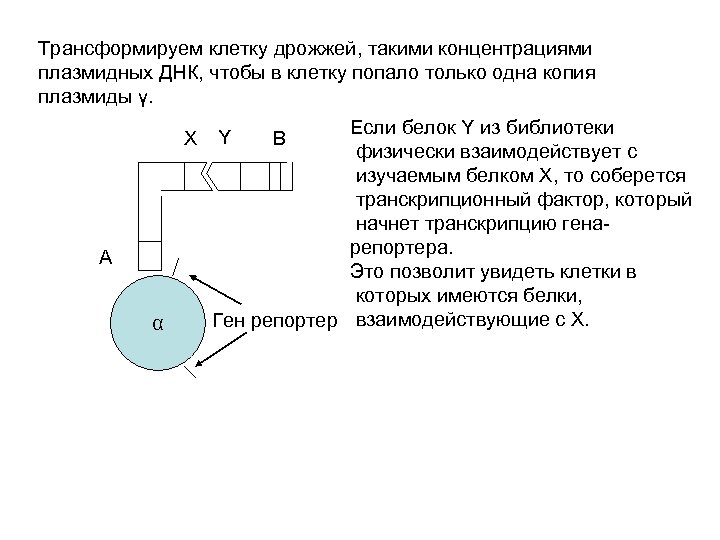 Трансформируем клетку дрожжей, такими концентрациями плазмидных ДНК, чтобы в клетку попало только одна копия плазмиды γ. X A α Если белок Y из библиотеки физически взаимодействует с изучаемым белком X, то соберется транскрипционный фактор, который начнет транскрипцию генарепортера. Это позволит увидеть клетки в которых имеются белки, Ген репортер взаимодействующие с X. Y B
Трансформируем клетку дрожжей, такими концентрациями плазмидных ДНК, чтобы в клетку попало только одна копия плазмиды γ. X A α Если белок Y из библиотеки физически взаимодействует с изучаемым белком X, то соберется транскрипционный фактор, который начнет транскрипцию генарепортера. Это позволит увидеть клетки в которых имеются белки, Ген репортер взаимодействующие с X. Y B


