Химия.Кинетика.ppt
- Количество слайдов: 24
 АКАДЕМИЯ ГРАЖДАНСКОЙ ЗАЩИТЫ МЧС РОССИИ Кафедра химии и материаловедения ЛЕКЦИЯ по дисциплине «Химия» Раздел III. Основы химической термодинамики и кинетики Тема 3/2. Основы химической кинетики Байдакова Н. В. , кандидат технических наук, доцент
АКАДЕМИЯ ГРАЖДАНСКОЙ ЗАЩИТЫ МЧС РОССИИ Кафедра химии и материаловедения ЛЕКЦИЯ по дисциплине «Химия» Раздел III. Основы химической термодинамики и кинетики Тема 3/2. Основы химической кинетики Байдакова Н. В. , кандидат технических наук, доцент
 Учебные вопросы 1. Скорость химической реакции и законы химической кинетики. 2. Зависимость скорости химической реакции от концентрации и температуры. 3. Анализ кинетических зависимостей химических реакций. Литература для самостоятельной работы: 1. Незговоров Л. Ф. , Чижов В. М. Основы химии. Ч. I. Книга 1. Общая химия. Под ред. Пушкина. Новогорск, Изд. АГЗ, 1999, - 99 с. 2. Незговоров Л. Ф. , Чижов В. М. Основы химии. Ч. I. Книга 2. Общая химия. Под ред. Пушкина. Новогорск, Изд. АГЗ, 1999, - 250 с. 3. Незговоров Л. Ф. , Чижов В. М. Основы химии. Ч. II. Общая химия. Под ред. Пушкина. Новогорск, Изд. АГЗ, 1998, - 185 с. 4. Незговоров Л. Ф. , Чижов В. М. Основы химии. Ч. III. Книга 1. Книга 2. Под ред. Пушкина. Новогорск, Изд. АГЗ, 1998, - 375 с. 5. Степин Б. Д. , Цветков А. А. . Неорганическая химия. М. , «Химия» , 1994. – 608 с. 6. Козловская Э. Б. Лабораторные работы по общей и неорганической химии. Новогорск, Изд. АГЗ, 2002 г. , - 175 с.
Учебные вопросы 1. Скорость химической реакции и законы химической кинетики. 2. Зависимость скорости химической реакции от концентрации и температуры. 3. Анализ кинетических зависимостей химических реакций. Литература для самостоятельной работы: 1. Незговоров Л. Ф. , Чижов В. М. Основы химии. Ч. I. Книга 1. Общая химия. Под ред. Пушкина. Новогорск, Изд. АГЗ, 1999, - 99 с. 2. Незговоров Л. Ф. , Чижов В. М. Основы химии. Ч. I. Книга 2. Общая химия. Под ред. Пушкина. Новогорск, Изд. АГЗ, 1999, - 250 с. 3. Незговоров Л. Ф. , Чижов В. М. Основы химии. Ч. II. Общая химия. Под ред. Пушкина. Новогорск, Изд. АГЗ, 1998, - 185 с. 4. Незговоров Л. Ф. , Чижов В. М. Основы химии. Ч. III. Книга 1. Книга 2. Под ред. Пушкина. Новогорск, Изд. АГЗ, 1998, - 375 с. 5. Степин Б. Д. , Цветков А. А. . Неорганическая химия. М. , «Химия» , 1994. – 608 с. 6. Козловская Э. Б. Лабораторные работы по общей и неорганической химии. Новогорск, Изд. АГЗ, 2002 г. , - 175 с.
 1. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ И ЗАКОНЫ ХИМИЧЕСКОЙ КИНЕТИКИ. Скорость химической реакции Wгi – это количество ni (моль) одного из реагентов (или продуктов), прореагировавшее (или образовавшееся) в единицу времени в единице реакционного пространства. Для гомогенной химической реакции где V - реакционный объем.
1. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ И ЗАКОНЫ ХИМИЧЕСКОЙ КИНЕТИКИ. Скорость химической реакции Wгi – это количество ni (моль) одного из реагентов (или продуктов), прореагировавшее (или образовавшееся) в единицу времени в единице реакционного пространства. Для гомогенной химической реакции где V - реакционный объем.
 В том случае, если реакция происходит при постоянном объеме, скорость определяют как изменение молярной концентрации Сi в единицу времени Если химическая реакция описывается стехиометрическим уравнением a. A + b. B r. R + s. S , то изменения количеств реагентов и продуктов ni в результате ее протекания связаны между собой соотношением где ni – изменения количеств участников реакции. Тогда скорости реакции, определенные по изменению количества различных реагентов ( ni), будут иметь различные численные значения, за исключением случая, когда стехиометрические коэффициенты у этих реагентов в уравнении реакции равны. В то же время очевидно, что будет справедливо равенство:
В том случае, если реакция происходит при постоянном объеме, скорость определяют как изменение молярной концентрации Сi в единицу времени Если химическая реакция описывается стехиометрическим уравнением a. A + b. B r. R + s. S , то изменения количеств реагентов и продуктов ni в результате ее протекания связаны между собой соотношением где ni – изменения количеств участников реакции. Тогда скорости реакции, определенные по изменению количества различных реагентов ( ni), будут иметь различные численные значения, за исключением случая, когда стехиометрические коэффициенты у этих реагентов в уравнении реакции равны. В то же время очевидно, что будет справедливо равенство:
 Чтобы значения скоростей по различным компонентам реакции не различались, скорость химической реакции выражают как: где i – стехиометрический коэффициент у компонента I, по которому рассчитывают скорость реакции. (6) Скорость химической реакции может быть измерена по любому компоненту, участвующему в реакции. Она всегда положительна, поэтому: dni/d – отрицательна, если i – реагент, или dni/d – положительна, если i – продукт. Скорость химической реакции выражают в единицах концентрации в единицу времени, например, [кмоль/(м 3 ч)] или [моль/(л с)] и т. д.
Чтобы значения скоростей по различным компонентам реакции не различались, скорость химической реакции выражают как: где i – стехиометрический коэффициент у компонента I, по которому рассчитывают скорость реакции. (6) Скорость химической реакции может быть измерена по любому компоненту, участвующему в реакции. Она всегда положительна, поэтому: dni/d – отрицательна, если i – реагент, или dni/d – положительна, если i – продукт. Скорость химической реакции выражают в единицах концентрации в единицу времени, например, [кмоль/(м 3 ч)] или [моль/(л с)] и т. д.
 Установлены два постулата химической кинетики: – скорость химической реакции пропорциональна концентрации реагентов; – суммарная скорость нескольких последовательных превращений определяется скоростью наиболее медленной реакции. Скорость химической реакции зависит от целого ряда факторов. Зависимость скорости химической реакции от концентрации компонентов реакционной смеси W = f (CA , CB, …. CI) называют кинетическим уравнением реакции.
Установлены два постулата химической кинетики: – скорость химической реакции пропорциональна концентрации реагентов; – суммарная скорость нескольких последовательных превращений определяется скоростью наиболее медленной реакции. Скорость химической реакции зависит от целого ряда факторов. Зависимость скорости химической реакции от концентрации компонентов реакционной смеси W = f (CA , CB, …. CI) называют кинетическим уравнением реакции.
 В химической кинетике различают элементарные и неэлементарные (сложные) химические реакции. Элементарные (одностадийные) химические реакции – это реакции, связанные с преодолением одного энергетического барьера. Для реакции: a. A + b. B –– r. R + s. S, кинетическое уравнение будет иметь вид: Wr = k. CAa. CBb, где k – коэффициент пропорциональности; а и b – стехиометрические коэффициенты. Коэффициент пропорциональности k, входящий в кинетическое уравнение, называют константой скорости химической реакции. Целочисленные показатели степени а и b у концентраций реагентов А и В в кинетическом уравнении для элементарной реакции называют частными порядками реакции по компонентам А и В соответственно, (a + b) = n – общим порядком реакции. Для элементарных реакций общий порядок реакции равен ее молекулярности – числу молекул, участвующих в единичном акте реакции. Обычно он не превышает 3, так как вероятность одновременного столкновения большего числа молекул чрезвычайно мала. Для сложных реакций, которые удобно рассматривать как формально простые, частные порядки могут иметь дробные значения.
В химической кинетике различают элементарные и неэлементарные (сложные) химические реакции. Элементарные (одностадийные) химические реакции – это реакции, связанные с преодолением одного энергетического барьера. Для реакции: a. A + b. B –– r. R + s. S, кинетическое уравнение будет иметь вид: Wr = k. CAa. CBb, где k – коэффициент пропорциональности; а и b – стехиометрические коэффициенты. Коэффициент пропорциональности k, входящий в кинетическое уравнение, называют константой скорости химической реакции. Целочисленные показатели степени а и b у концентраций реагентов А и В в кинетическом уравнении для элементарной реакции называют частными порядками реакции по компонентам А и В соответственно, (a + b) = n – общим порядком реакции. Для элементарных реакций общий порядок реакции равен ее молекулярности – числу молекул, участвующих в единичном акте реакции. Обычно он не превышает 3, так как вероятность одновременного столкновения большего числа молекул чрезвычайно мала. Для сложных реакций, которые удобно рассматривать как формально простые, частные порядки могут иметь дробные значения.
 Большинство химических реакций не является элементарными и протекает через ряд промежуточных стадий. Стехиометрическое уравнение сложной реакции отражает лишь конечное и начальное состояние системы и не описывает механизма реакции. Простейшими примерами сложных реакций являются параллельные и последовательные реакции. Если механизм сложной реакции (элементарные стадии) известен, то скорость реакции по одному из веществ равна алгебраической сумме скоростей тех элементарных стадий, в которых это вещество участвует. Для определения их знаков пользуются формальным правилом: производная концентрации данного компонента по времени d. Ci/d всегда имеет знак «минус» ; скорости элементарных стадий, в которых компонент расходуется (является реагентом), записывают со знаком «плюс» , скорости стадий, в которых компонент образуется (является продуктом), – со знаком «минус» . n
Большинство химических реакций не является элементарными и протекает через ряд промежуточных стадий. Стехиометрическое уравнение сложной реакции отражает лишь конечное и начальное состояние системы и не описывает механизма реакции. Простейшими примерами сложных реакций являются параллельные и последовательные реакции. Если механизм сложной реакции (элементарные стадии) известен, то скорость реакции по одному из веществ равна алгебраической сумме скоростей тех элементарных стадий, в которых это вещество участвует. Для определения их знаков пользуются формальным правилом: производная концентрации данного компонента по времени d. Ci/d всегда имеет знак «минус» ; скорости элементарных стадий, в которых компонент расходуется (является реагентом), записывают со знаком «плюс» , скорости стадий, в которых компонент образуется (является продуктом), – со знаком «минус» . n
 Для сложной реакции, механизм которой установлен и включает три элементарные стадии k 1 А + B ––– R k 2 R ––– S + T k 3 R ––– M + N, скорость по компоненту R, участвующему во всех трех стадиях, выражается уравнением Wг. А = – d. CR/d = k 1·CA·CB – k 2·CR + k 3·CR, скорость по исходному реагенту А, участвующему лишь в первой элементарной стадии, выражается уравнением Wг. А = – d. CA/d = k 1·CA·CB ,
Для сложной реакции, механизм которой установлен и включает три элементарные стадии k 1 А + B ––– R k 2 R ––– S + T k 3 R ––– M + N, скорость по компоненту R, участвующему во всех трех стадиях, выражается уравнением Wг. А = – d. CR/d = k 1·CA·CB – k 2·CR + k 3·CR, скорость по исходному реагенту А, участвующему лишь в первой элементарной стадии, выражается уравнением Wг. А = – d. CA/d = k 1·CA·CB ,
 Обратимую реакцию k 1 А + В == R + S k 2 с точки зрения химической кинетики можно рассматривать как сложную, включающую две стадии: k 1 А + В ––– R + S k 2 R + S ––– А + В Поэтому скорость этой сложной реакции по компонентам А и R может быть записана с помощью следующих уравнений: Wг, A = – d. CA/d = k 1·CA·CB – k 2·CR·CS, Wг, R = – d. CR/d = k 1·CA·CB + k 2·CR·CS,
Обратимую реакцию k 1 А + В == R + S k 2 с точки зрения химической кинетики можно рассматривать как сложную, включающую две стадии: k 1 А + В ––– R + S k 2 R + S ––– А + В Поэтому скорость этой сложной реакции по компонентам А и R может быть записана с помощью следующих уравнений: Wг, A = – d. CA/d = k 1·CA·CB – k 2·CR·CS, Wг, R = – d. CR/d = k 1·CA·CB + k 2·CR·CS,
 2. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ И ТЕМПЕРАТУРЫ Из кинетических уравнений следует, что скорость зависит от концентрации веществ. W = k C A а C Bb При этом наибольшее влияние на скорость реакции оказывает концентрация компонента, имеющего больший частный порядок. Например, для сложной реакции, кинетическое уравнение которой W = k CA 2 CB 0, 25, увеличение концентрации реагента А приводит к увеличению скорости в 4 раза, а реагента В – лишь в 1, 19 раза. Для реакций, протекающих в газовой фазе, повышение скорости реакции может быть достигнуто повышением общего давления или парциального давления компонента, если речь идет о газовой смеси. В этом случае повышение давления равносильно повышению концентрации компонента. Повышение давления тем более эффективно, чем выше общий порядок реакции.
2. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ И ТЕМПЕРАТУРЫ Из кинетических уравнений следует, что скорость зависит от концентрации веществ. W = k C A а C Bb При этом наибольшее влияние на скорость реакции оказывает концентрация компонента, имеющего больший частный порядок. Например, для сложной реакции, кинетическое уравнение которой W = k CA 2 CB 0, 25, увеличение концентрации реагента А приводит к увеличению скорости в 4 раза, а реагента В – лишь в 1, 19 раза. Для реакций, протекающих в газовой фазе, повышение скорости реакции может быть достигнуто повышением общего давления или парциального давления компонента, если речь идет о газовой смеси. В этом случае повышение давления равносильно повышению концентрации компонента. Повышение давления тем более эффективно, чем выше общий порядок реакции.
 Наибольшее влияние на скорость химической реакции оказывает изменение температуры. Экспериментально установлено, что при повышении температуры на 10 градусов, скорость химической реакции возрастает примерно в 2 -4 раза. Эта зависимость выражается уравнением Аррениуса: k = k 0 exp – E / (RT) где k - константа скорости реакции; R - универсальная газовая постоянная; T - температура; k 0 - предэкспоненциальный множитель; E - энергия активации. Энергия активации элементарной реакции Е – это минимальный избыток энергии над средней внутренней энергией молекул, необходимый для того, чтобы произошло химическое взаимодействие (энергетический барьер, который должны преодолеть молекулы при переходе реакционной системы из одного состояния в другое). Из уравнения Аррениуса ясно, что сильное влияние температуры на скорость химической реакции обусловлено тем, температура находится в показателе степени уравнения экспоненты скорости химической реакции.
Наибольшее влияние на скорость химической реакции оказывает изменение температуры. Экспериментально установлено, что при повышении температуры на 10 градусов, скорость химической реакции возрастает примерно в 2 -4 раза. Эта зависимость выражается уравнением Аррениуса: k = k 0 exp – E / (RT) где k - константа скорости реакции; R - универсальная газовая постоянная; T - температура; k 0 - предэкспоненциальный множитель; E - энергия активации. Энергия активации элементарной реакции Е – это минимальный избыток энергии над средней внутренней энергией молекул, необходимый для того, чтобы произошло химическое взаимодействие (энергетический барьер, который должны преодолеть молекулы при переходе реакционной системы из одного состояния в другое). Из уравнения Аррениуса ясно, что сильное влияние температуры на скорость химической реакции обусловлено тем, температура находится в показателе степени уравнения экспоненты скорости химической реакции.
 Логарифмическая форма уравнения Аррениуса: ln K = ln K 0 – E/R. 1/T Так как k 0, Е и R – величины постоянные, то зависимость, выражаемая уравнением, в координатах ln k – 1/T является прямолинейной. Температурная зависимость логарифма константы скорости химической реакции от обратной температуры для реакций с различными энергиями активации Е 1 и Е 2 (Е 1 Е 2): I – изменение ln k при росте температуры с 300 до 400 К; II – то же при росте температуры с 500 до 600 К; III – изменения ln k для реакций с различной энергией активации при изменении температуры с 500 до 600 К.
Логарифмическая форма уравнения Аррениуса: ln K = ln K 0 – E/R. 1/T Так как k 0, Е и R – величины постоянные, то зависимость, выражаемая уравнением, в координатах ln k – 1/T является прямолинейной. Температурная зависимость логарифма константы скорости химической реакции от обратной температуры для реакций с различными энергиями активации Е 1 и Е 2 (Е 1 Е 2): I – изменение ln k при росте температуры с 300 до 400 К; II – то же при росте температуры с 500 до 600 К; III – изменения ln k для реакций с различной энергией активации при изменении температуры с 500 до 600 К.
 Из графической зависимости логарифма константы скорости реакции от обратной температуры можно определить: а) энергию активации Е: определив тангенс угла наклона прямой к оси абсцисс можно рассчитать энергию активации реакции, так как, исходя из уравнения Аррениуса, – E/R = tg , ==> Е; где – угол наклона. б) предэкспоненциальный множитель k 0: при очень высокой температуре можно принять, что E/RТ 0, тогда ln k 0 будет равняться отрезку, отсекаемому продолжением прямой на оси ординат; в) константу скорости при любой температуре по уравнению Аррениуса.
Из графической зависимости логарифма константы скорости реакции от обратной температуры можно определить: а) энергию активации Е: определив тангенс угла наклона прямой к оси абсцисс можно рассчитать энергию активации реакции, так как, исходя из уравнения Аррениуса, – E/R = tg , ==> Е; где – угол наклона. б) предэкспоненциальный множитель k 0: при очень высокой температуре можно принять, что E/RТ 0, тогда ln k 0 будет равняться отрезку, отсекаемому продолжением прямой на оси ординат; в) константу скорости при любой температуре по уравнению Аррениуса.
 Анализ логарифмической зависимости константы скорости реакции от обратной температуры показывает: из-за экспоненциальной зависимости константы от температуры (неравномерность температурной шкалы) химические реакции более чувствительны к повышению температуры при низких ее значениях; чем больше энергия активации, тем реакция более чувствительна к повышению температуры.
Анализ логарифмической зависимости константы скорости реакции от обратной температуры показывает: из-за экспоненциальной зависимости константы от температуры (неравномерность температурной шкалы) химические реакции более чувствительны к повышению температуры при низких ее значениях; чем больше энергия активации, тем реакция более чувствительна к повышению температуры.
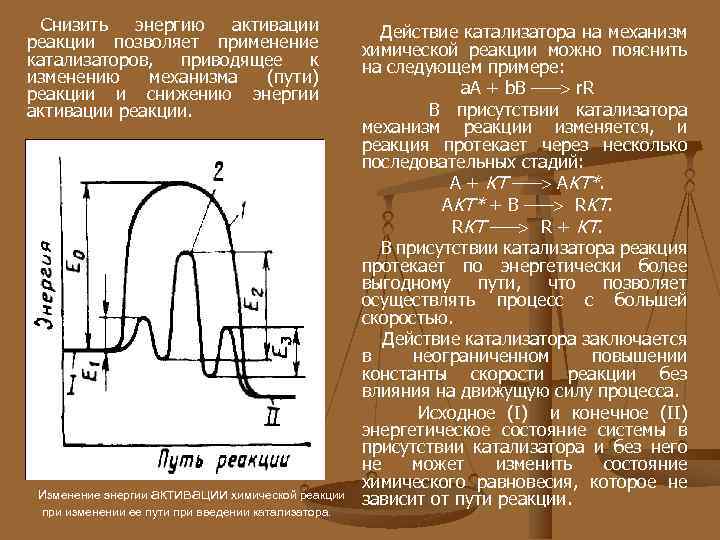 Снизить энергию активации реакции позволяет применение катализаторов, приводящее к изменению механизма (пути) реакции и снижению энергии активации реакции. Изменение энергии активации химической реакции при изменении ее пути при введении катализатора. Действие катализатора на механизм химической реакции можно пояснить на следующем примере: a. A + b. B ––– r. R В присутствии катализатора механизм реакции изменяется, и реакция протекает через несколько последовательных стадий: А + КТ ––– АКТ*. AKT* + B ––– RKT. RКТ ––– R + КТ. В присутствии катализатора реакция протекает по энергетически более выгодному пути, что позволяет осуществлять процесс с большей скоростью. Действие катализатора заключается в неограниченном повышении константы скорости реакции без влияния на движущую силу процесса. Исходное (I) и конечное (II) энергетическое состояние системы в присутствии катализатора и без него не может изменить состояние химического равновесия, которое не зависит от пути реакции.
Снизить энергию активации реакции позволяет применение катализаторов, приводящее к изменению механизма (пути) реакции и снижению энергии активации реакции. Изменение энергии активации химической реакции при изменении ее пути при введении катализатора. Действие катализатора на механизм химической реакции можно пояснить на следующем примере: a. A + b. B ––– r. R В присутствии катализатора механизм реакции изменяется, и реакция протекает через несколько последовательных стадий: А + КТ ––– АКТ*. AKT* + B ––– RKT. RКТ ––– R + КТ. В присутствии катализатора реакция протекает по энергетически более выгодному пути, что позволяет осуществлять процесс с большей скоростью. Действие катализатора заключается в неограниченном повышении константы скорости реакции без влияния на движущую силу процесса. Исходное (I) и конечное (II) энергетическое состояние системы в присутствии катализатора и без него не может изменить состояние химического равновесия, которое не зависит от пути реакции.
 Катализаторы – это вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции. При этом катализаторы восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий и не находятся в стехиометрических отношениях с реагентами и продуктами реакции. Катализаторы оказывают исключительно большое влияние на скорость химических реакций, снижая энергию активации, которая входит в показатель степени уравнения Аррениуса. В результате этого скорость реакции в присутствии катализатора иногда увеличивается в тысячи и даже миллионы раз. Этот способ увеличения скорости химических реакций является более мягким и энергетически более выгодным, чем широко распространенный в химической технологии способ интенсификации процессов увеличением температуры. Роль катализатора состоит в увеличении скорости достижения химического равновесия. Катализатор может увеличивать скорость только термодинамически разрешенных реакций.
Катализаторы – это вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции. При этом катализаторы восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий и не находятся в стехиометрических отношениях с реагентами и продуктами реакции. Катализаторы оказывают исключительно большое влияние на скорость химических реакций, снижая энергию активации, которая входит в показатель степени уравнения Аррениуса. В результате этого скорость реакции в присутствии катализатора иногда увеличивается в тысячи и даже миллионы раз. Этот способ увеличения скорости химических реакций является более мягким и энергетически более выгодным, чем широко распространенный в химической технологии способ интенсификации процессов увеличением температуры. Роль катализатора состоит в увеличении скорости достижения химического равновесия. Катализатор может увеличивать скорость только термодинамически разрешенных реакций.
 3. АНАЛИЗ КИНЕТИЧЕСКИХ ЗАВИСИМОСТЕЙ ХИМИЧЕСКИХ РЕАКЦИЙ. Для оценки эффективности химической реакции необходимо использовать критерии, которые отражали бы химическую и физико-химическую сущность происходящих в реакторе процессов. Таким критерием является степень превращения – Х. Степень превращения X – это отношение количества реагента, вступившего в реакцию, к его исходному количеству. Для простой необратимой реакции a. A + b. B –– r. R + s. S где n. Ao - начальное количество вещества А, моль; n. A – текущее количествo вещества А, моль; n. A = n. A, o (1 -XА) n. A – изменение количества реагента А в ходе химической реакции. Х – выражается в долях (1 X 0) или %% (100 X 0) и является одним из основных показателей, определяющих эффективность химического производства.
3. АНАЛИЗ КИНЕТИЧЕСКИХ ЗАВИСИМОСТЕЙ ХИМИЧЕСКИХ РЕАКЦИЙ. Для оценки эффективности химической реакции необходимо использовать критерии, которые отражали бы химическую и физико-химическую сущность происходящих в реакторе процессов. Таким критерием является степень превращения – Х. Степень превращения X – это отношение количества реагента, вступившего в реакцию, к его исходному количеству. Для простой необратимой реакции a. A + b. B –– r. R + s. S где n. Ao - начальное количество вещества А, моль; n. A – текущее количествo вещества А, моль; n. A = n. A, o (1 -XА) n. A – изменение количества реагента А в ходе химической реакции. Х – выражается в долях (1 X 0) или %% (100 X 0) и является одним из основных показателей, определяющих эффективность химического производства.
 В химической реакции могут участвовать несколько химических веществ и степень их превращения может быть рассчитана по каждому реагенту, причем в общем случае эти степени превращения могут быть разными. Цель всякой химической реакции состоит в том, чтобы степень превращения XA = (n. А, о – n. А) /n. А, о и выход целевого продукта были возможно более высокими и достигались в возможно более короткое время, т. е. скорость процесса должна быть возможно более высокой. Для реакции a. А + b. B ––– r. R + s. S скорость выражается уравнением W = k Ca. ACb. B, где a и b – частные порядки реакции. Константа скорости реакции k выражается уравнением Аррениуса k = k 0 · e– E/RT , подставив значение k из уравнения в уравнение, находим W = k 0 e –E/RT ·Ca. A · Cb. B или W = f (С, Т, Р, Кат).
В химической реакции могут участвовать несколько химических веществ и степень их превращения может быть рассчитана по каждому реагенту, причем в общем случае эти степени превращения могут быть разными. Цель всякой химической реакции состоит в том, чтобы степень превращения XA = (n. А, о – n. А) /n. А, о и выход целевого продукта были возможно более высокими и достигались в возможно более короткое время, т. е. скорость процесса должна быть возможно более высокой. Для реакции a. А + b. B ––– r. R + s. S скорость выражается уравнением W = k Ca. ACb. B, где a и b – частные порядки реакции. Константа скорости реакции k выражается уравнением Аррениуса k = k 0 · e– E/RT , подставив значение k из уравнения в уравнение, находим W = k 0 e –E/RT ·Ca. A · Cb. B или W = f (С, Т, Р, Кат).
 Для простой необратимой реакции: А ––– R Q W = k 0 e –E/RT CА, из которого следует, что при CА = const и увеличении температуры Т скорость реакции возрастает по экспоненциальному закону. w Зависимость скорости реакции W от температуры
Для простой необратимой реакции: А ––– R Q W = k 0 e –E/RT CА, из которого следует, что при CА = const и увеличении температуры Т скорость реакции возрастает по экспоненциальному закону. w Зависимость скорости реакции W от температуры
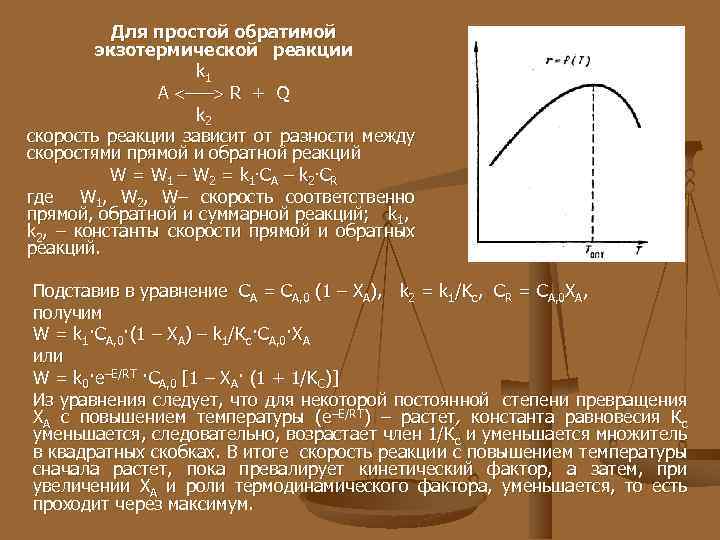 Для простой обратимой экзотермической реакции k 1 А ––– R + Q k 2 скорость реакции зависит от разности между скоростями прямой и обратной реакций W = W 1 – W 2 = k 1 · C A – k 2 · C R где W 1, W 2, W– скорость соответственно прямой, обратной и суммарной реакций; k 1, k 2, – константы скорости прямой и обратных реакций. Подставив в уравнение СА = СА, 0 (1 – ХА), k 2 = k 1/Kс, СR = СА, 0 ХА, получим W = k 1·CA, 0·(1 – XA) – k 1/Кc·CA, 0·XA или W = k 0·e–E/RT ·CA, 0 [1 – XA· (1 + 1/KC)] Из уравнения следует, что для некоторой постоянной степени превращения ХА с повышением температуры (e–E/RT) – растет, константа равновесия Кс уменьшается, следовательно, возрастает член 1/Кс и уменьшается множитель в квадратных скобках. В итоге скорость реакции с повышением температуры сначала растет, пока превалирует кинетический фактор, а затем, при увеличении ХA и роли термодинамического фактора, уменьшается, то есть проходит через максимум.
Для простой обратимой экзотермической реакции k 1 А ––– R + Q k 2 скорость реакции зависит от разности между скоростями прямой и обратной реакций W = W 1 – W 2 = k 1 · C A – k 2 · C R где W 1, W 2, W– скорость соответственно прямой, обратной и суммарной реакций; k 1, k 2, – константы скорости прямой и обратных реакций. Подставив в уравнение СА = СА, 0 (1 – ХА), k 2 = k 1/Kс, СR = СА, 0 ХА, получим W = k 1·CA, 0·(1 – XA) – k 1/Кc·CA, 0·XA или W = k 0·e–E/RT ·CA, 0 [1 – XA· (1 + 1/KC)] Из уравнения следует, что для некоторой постоянной степени превращения ХА с повышением температуры (e–E/RT) – растет, константа равновесия Кс уменьшается, следовательно, возрастает член 1/Кс и уменьшается множитель в квадратных скобках. В итоге скорость реакции с повышением температуры сначала растет, пока превалирует кинетический фактор, а затем, при увеличении ХA и роли термодинамического фактора, уменьшается, то есть проходит через максимум.
 Для простой обратимой эндотермической реакции А ––– R – Q характер зависимости W = f (T) также может быть выражен уравнением W = k 0·e–E/RT ·CA, 0 [1 – XA· (1 + 1/KC)] и в этом случае скорость реакции будет определяться соотношением скоростей прямой и обратной реакции. Из уравнения следует, что при повышении температуры скорость реакции возрастает за счет увеличения как члена е–Е/RT, так и значения Кс. То есть с повышением температуры растут и кинетическая и термодинамическая составляющие скорости реакции, в итоге скорость реакции растет с повышением температуры. Зависимость скорости W от температуры Т для простой обратимой эндотермической реакции А ––– R – Q для различных степеней превращения реагента (Х 3 > Х 2 > X 1).
Для простой обратимой эндотермической реакции А ––– R – Q характер зависимости W = f (T) также может быть выражен уравнением W = k 0·e–E/RT ·CA, 0 [1 – XA· (1 + 1/KC)] и в этом случае скорость реакции будет определяться соотношением скоростей прямой и обратной реакции. Из уравнения следует, что при повышении температуры скорость реакции возрастает за счет увеличения как члена е–Е/RT, так и значения Кс. То есть с повышением температуры растут и кинетическая и термодинамическая составляющие скорости реакции, в итоге скорость реакции растет с повышением температуры. Зависимость скорости W от температуры Т для простой обратимой эндотермической реакции А ––– R – Q для различных степеней превращения реагента (Х 3 > Х 2 > X 1).
 Концентрация реагирующих веществ оказывает влияние на скорость реакции всех типов (кроме реакций нулевого порядка): с увеличением концентрации исходных реагентов скорость реакции возрастает. Для химической реакции k 1 a. A + b. B == r. R + s. S k 2 суммарная скорость равна разности между скоростями прямой и обратной реакций W = k 1·CAa·CBb – k 2·CRr + CSs Из уравнения следует, что, чем больше значения СА и СВ, тем выше W. С течением времени суммарная скорость реакции W снижается, так концентрации исходных реагентов СА и СВ уменьшаются, а концентрации продуктов реакции СR и СS увеличиваются. Для того, чтобы судить об изменении скорости реакции, строят кривые зависимости концентраций реагентов, участвующих в реакции, от времени, т. е. устанавливают зависимость C = f (T).
Концентрация реагирующих веществ оказывает влияние на скорость реакции всех типов (кроме реакций нулевого порядка): с увеличением концентрации исходных реагентов скорость реакции возрастает. Для химической реакции k 1 a. A + b. B == r. R + s. S k 2 суммарная скорость равна разности между скоростями прямой и обратной реакций W = k 1·CAa·CBb – k 2·CRr + CSs Из уравнения следует, что, чем больше значения СА и СВ, тем выше W. С течением времени суммарная скорость реакции W снижается, так концентрации исходных реагентов СА и СВ уменьшаются, а концентрации продуктов реакции СR и СS увеличиваются. Для того, чтобы судить об изменении скорости реакции, строят кривые зависимости концентраций реагентов, участвующих в реакции, от времени, т. е. устанавливают зависимость C = f (T).
 Давление оказывает влияние на скорость химических процессов, когда процессы происходят в газовой фазе или когда хотя бы один компонент реакции находится в газовой фазе. При повышении давления уменьшается объем газовой фазы и соответственно увеличивается концентрация реагирующих веществ, то есть повышение давления равноценно повышению концентрации реагентов. Общую скорость реакции а. А + b. B ––– r. R + s. S, если она необратима или обратима, но происходит вдали от равновесия, можно выразить в виде уравнения Wr = k. PAa. PBb где p. A и p. B – парциальные давления исходных реагентов. . Парциальное давление каждого реагента пропорционально общему давления Р: p. A = NA Р и p. B = NB Р. Подставив эти значения в уравнение, находим Wr = k·NAa · Pa · NBb · Pb = k* · Pn где k* = k · NAa. NBb n – общий порядок реакции (n = a + b). Скорость реакции пропорциональна давлению в степени, равной порядку реакции, следовательно, изменение давления наиболее сильно влияет на реакции высокого порядка. Зависимость скорости реакции от давления для реакций различного порядка.
Давление оказывает влияние на скорость химических процессов, когда процессы происходят в газовой фазе или когда хотя бы один компонент реакции находится в газовой фазе. При повышении давления уменьшается объем газовой фазы и соответственно увеличивается концентрация реагирующих веществ, то есть повышение давления равноценно повышению концентрации реагентов. Общую скорость реакции а. А + b. B ––– r. R + s. S, если она необратима или обратима, но происходит вдали от равновесия, можно выразить в виде уравнения Wr = k. PAa. PBb где p. A и p. B – парциальные давления исходных реагентов. . Парциальное давление каждого реагента пропорционально общему давления Р: p. A = NA Р и p. B = NB Р. Подставив эти значения в уравнение, находим Wr = k·NAa · Pa · NBb · Pb = k* · Pn где k* = k · NAa. NBb n – общий порядок реакции (n = a + b). Скорость реакции пропорциональна давлению в степени, равной порядку реакции, следовательно, изменение давления наиболее сильно влияет на реакции высокого порядка. Зависимость скорости реакции от давления для реакций различного порядка.


