Презентация лекции Адсорбция.ppt
- Количество слайдов: 39

АДСОРБЦИЯ НА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ 1

Адсорбцией называют процесс самопроизвольного перераспределения (концентрирования) вещества на границе раздела двух фаз. Протекание адсорбции приводит к значительному увеличению концентрации этого вещества на поверхности жидкости или твердого тела. 2
![[моль/м 2] где Ni-общее число молей i-го компонента в системе; Ni’ и Ni” - [моль/м 2] где Ni-общее число молей i-го компонента в системе; Ni’ и Ni” -](https://present5.com/presentation/34131125_231003590/image-3.jpg)
[моль/м 2] где Ni-общее число молей i-го компонента в системе; Ni’ и Ni” - число молей того же компонента в каждой из двух соприкасающихся фаз; S - площадь поверхности. Гиббсовская адсорбция – избыток вещества в межфазном слое, приходящееся на единицу площади поверхности по сравнению с количеством вещества в таком же объеме фазы. 3
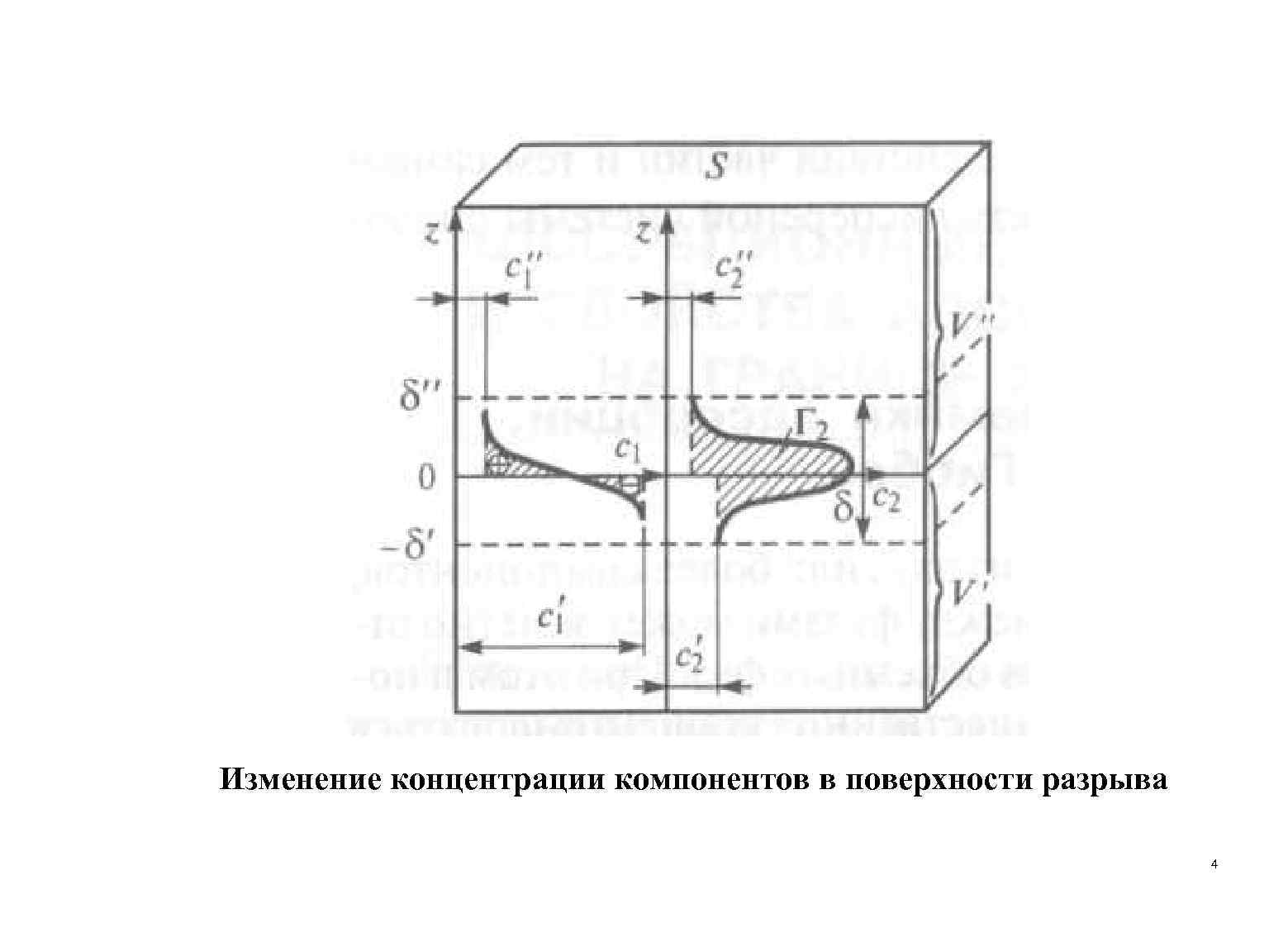
Изменение концентрации компонентов в поверхности разрыва 4
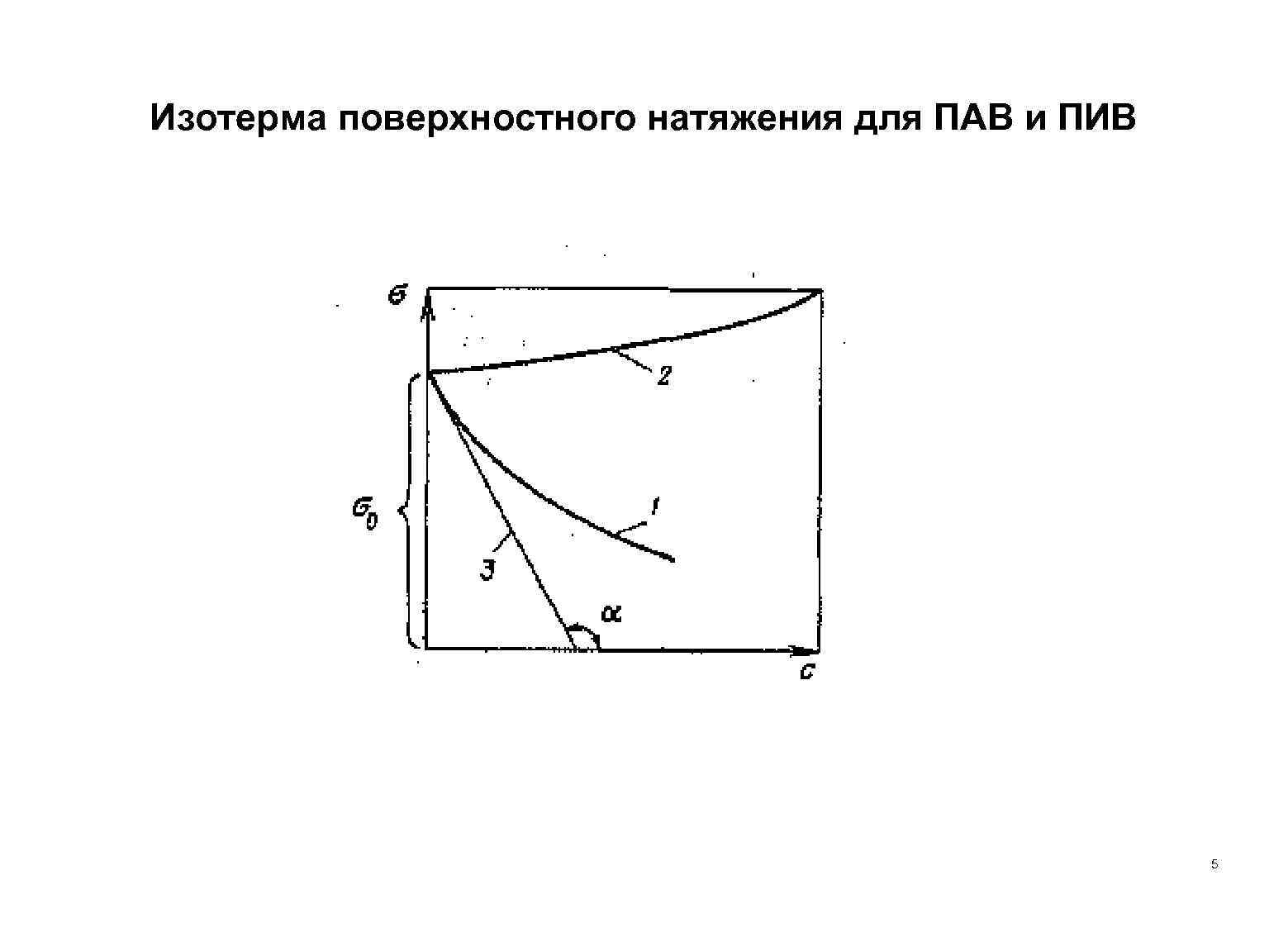
Изотерма поверхностного натяжения для ПАВ и ПИВ 5

Уравнение адсорбции Гиббса Josiah Willard Gibbs (1839 — 1903) 6
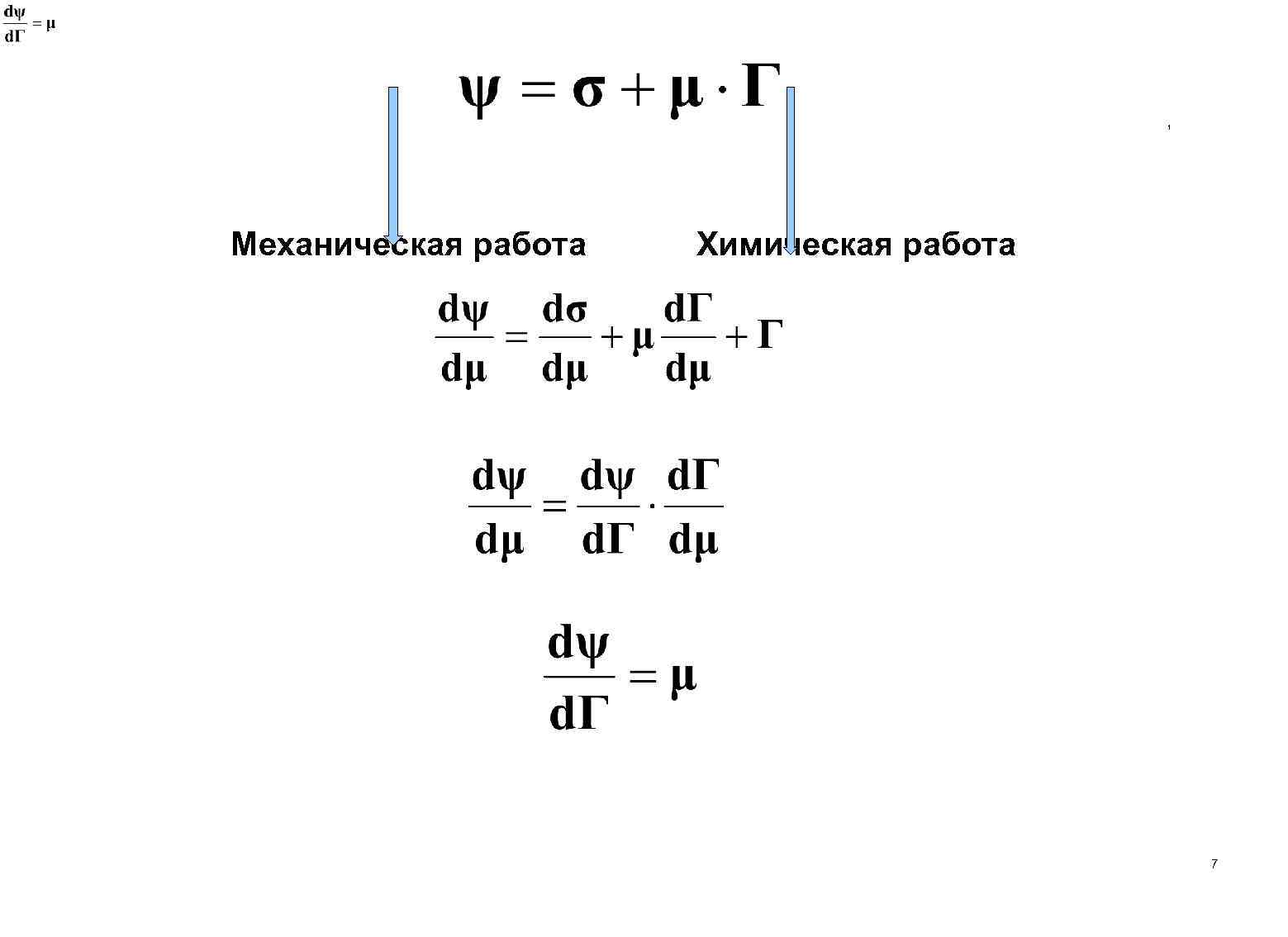
1 Механическая работа Химическая работа 7

Термодинамическое уравнение Гиббса

Для разбавленных растворов μ 0 – cтандартный химичееский потенциал 9

Изотермы адсорбции водных растворов органических кислот: 1 - пропионовая (C 2 -COOH); 2 – масляная (C 3 COOH); 3 –изовалериановая (C 4 -COOH); 4 капроновая (C 5 -COOH) (Гmах - максимальная адсорбция)/ 10
![Поверхностная активность [м. Дж·м-2/кмоль·м-2] tgα=g 11 Поверхностная активность [м. Дж·м-2/кмоль·м-2] tgα=g 11](https://present5.com/presentation/34131125_231003590/image-11.jpg)
Поверхностная активность [м. Дж·м-2/кмоль·м-2] tgα=g 11
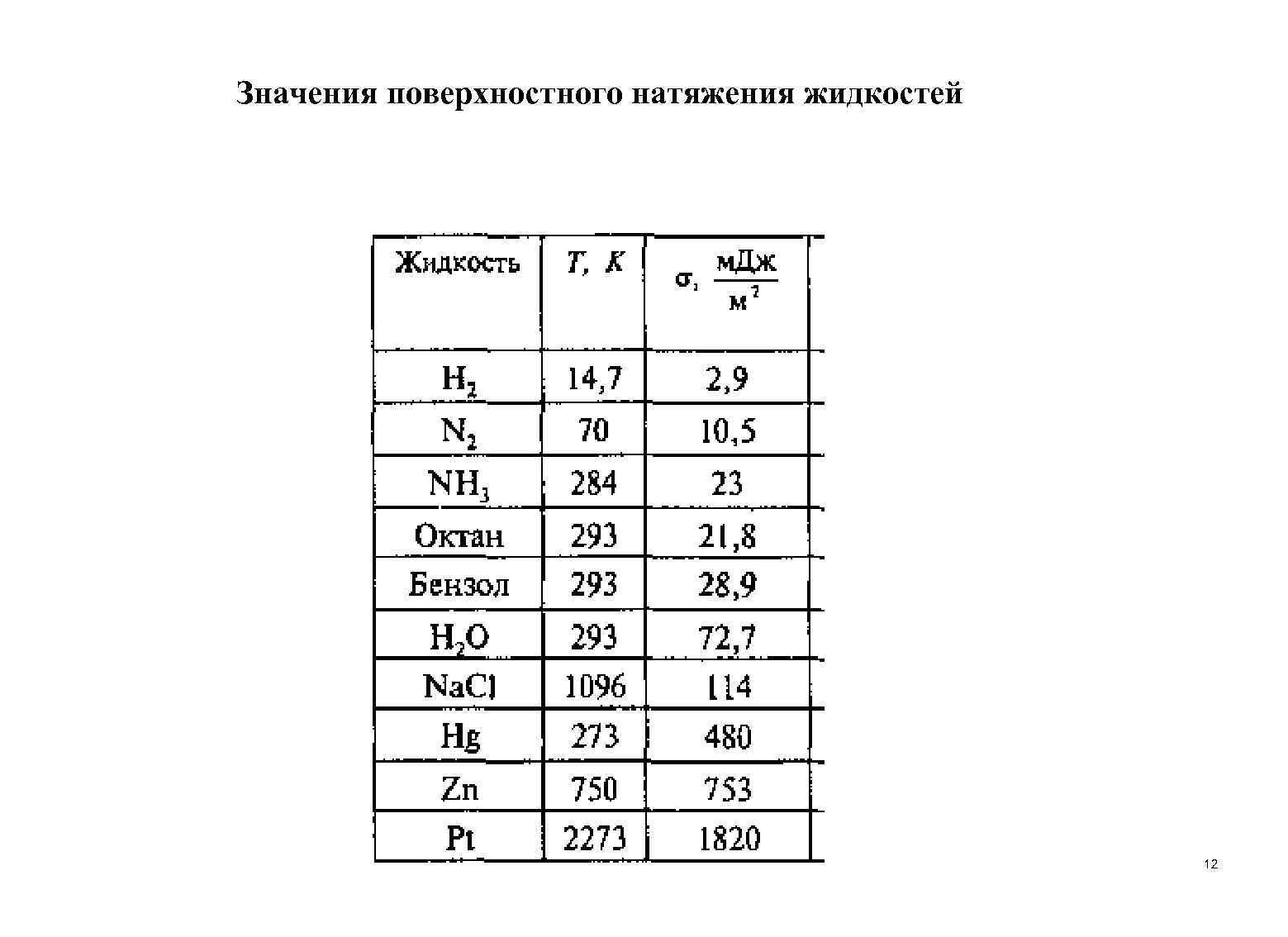
Значения поверхностного натяжения жидкостей 12

Уравнение Шишковского σ0 - σ =b·ln(1+Aс) b - постоянный для данного класса ПАВ параметр, м. Дж/м 2; значения параметра одинаковы для одного гомологического ряда; А - параметр, характеризующий адсорбционную активность индивидуального ПАВ, моль-1 Для разбавленных растворов ПАВ σ0 - σ ≈ Abс . 13

Правило Дюкло-Траубе Пьер Эмиль Дюкло (1840 -1904) Исидор Траубе (1860 -1943) В одном гомологическом ряду при удлинении углеводородной цепи в молекуле ПАВ на одну группу -СН 2 поверхностная активность возрастает в 3 -3, 5 раза. Правило соблюдается: 1. При температурах близких к комнатной; 2. В водных растворах ПАВ, в противном случае правило обращается. 14

Работа адсорбции (Wадс), равна работе совершаемой системой при переносе 1 моля ПАВ из внутреннего объема раствора на его поверхность, граничащую с соседней фазой, при постоянной температуре. μ= 0+ μ RTlnс μ = μs 0+ RTlnсs Условие термодинамического равновесия μ = μs При μ 0 ≠ μs 0 сs /с = Wадс = μ 0 - μs 0 Г = сs·δ 0 ехр[(μ μs 0)/RT] Wадс =RTln (сs /с) Wадс =RTln (Г / δс) 15

Уравнение Ленгмюра Irving Langmuir (1881 -1957) 16

Адсорбция ПАВ - конкуренция двух процессов 1) движение молекул ПАВ из объема на поверхность раствора (адсорбционный поток iа) 2) движение молекул ПАВ с поверхности в объем раствора (десорбционный поток id) Адсорбционное равновесие на поверхности раздела фаз носит динамический характер 17

Допущения: 1. Молекулы ПАВ могут адсорбироваться из раствора только на свободных от ПАВ участках поверхности раствора. 2. Адсорбционный слой ПАВ состоит только из одного слоя молекул ПАВ (монослой). В таком случае удельная адсорбция имеет предельное значение (Г mах), которое достигается при образовании насыщенного монослоя ПАВ. При монослойном строении доля поверхности φ, занятая молекулами ПАВ, будет равна φ = Г/Гmах. Доля «свободной» поверхности, которая доступна для адсорбции дополнительных молекул ПАВ, равна 1 - φ = 1 - Г/Гmах. В рамках этой модели можно рассчитать скорость адсорбции ( a , моль/(м 2 с)) — количество ПАВ, которое выносит адсорбционный поток на единицу площади поверхности раствора в единицу времени. 18

Скорость адсорбции пропорциональна концентрации ПАВ (С) в растворе и доле (1 - φ) доступной поверхности: a = ka. C(1 - Г/Г max), где ka - константа скорости адсорбции, л/(м 2 с). Скорость десорбции ( d) пропорциональна только доле поверхности φ, занятой адсорбированными молекулами, так как в объеме раствора всегда есть свободные места для размещения десорбированных молекул: d =k d φ, где k d — константа скорости десорбции, 2· моль/(м с). 19

Условие динамического равновесия: a = d. Уравнение адсорбции Ленгмюра А = ka/ k d А — коэффициент, равный отношению констант скоростей адсорбции и десорбции 20
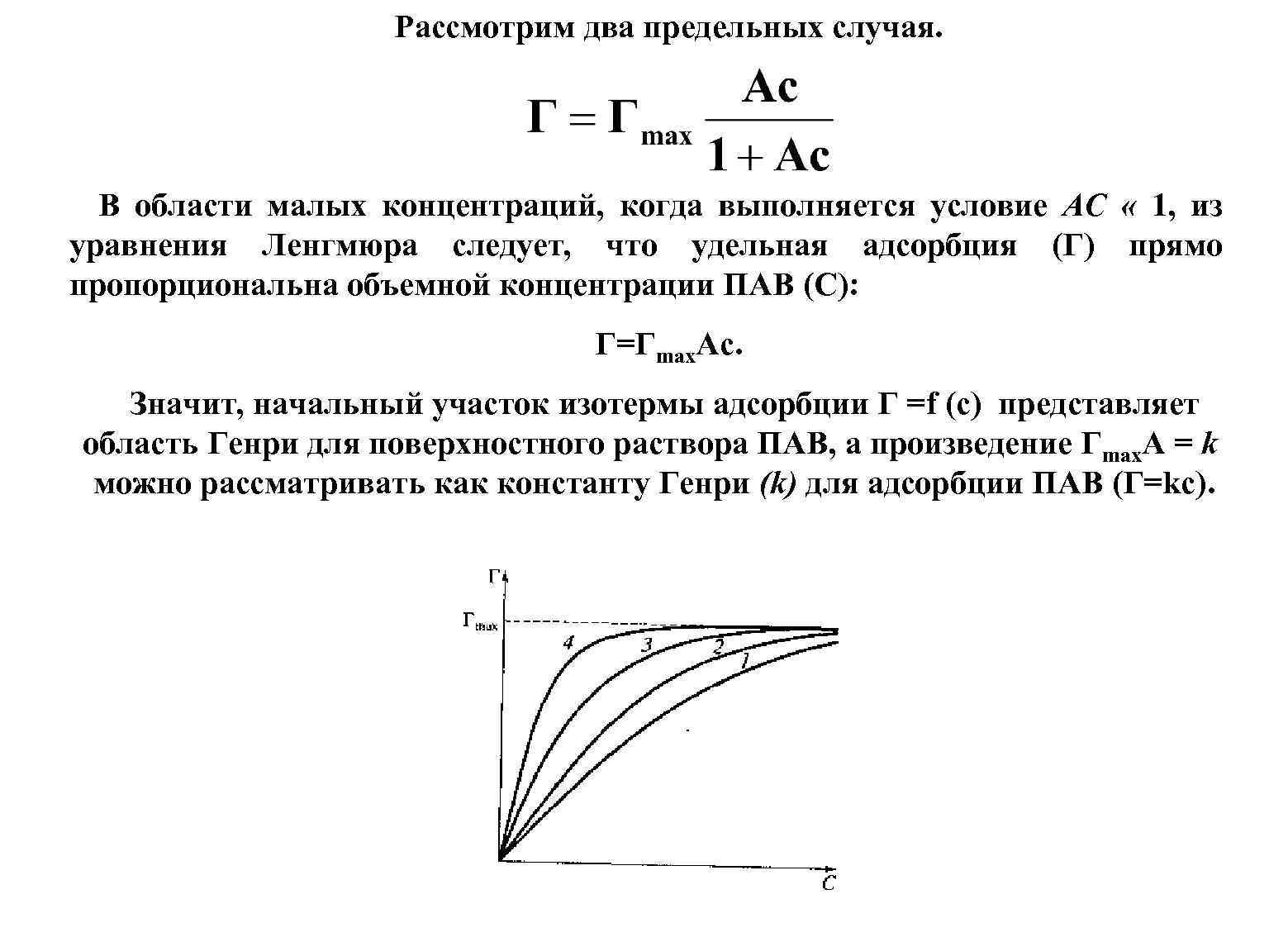
Рассмотрим два предельных случая. В области малых концентраций, когда выполняется условие АС « 1, из уравнения Ленгмюра следует, что удельная адсорбция (Г) прямо пропорциональна объемной концентрации ПАВ (С): Г=Гmах. Aс. Значит, начальный участок изотермы адсорбции Г =f (с) представляет область Генри для поверхностного раствора ПАВ, а произведение Гmах. A = k можно рассматривать как константу Генри (k) для адсорбции ПАВ (Г=kc).

В области больших концентраций, когда выполняется условие Ас> 1, из уравнения Ленгмюра получаем Г = Гmах, т. е. при больших концентрациях достигается предельная, или максимальная, адсорбция (Гmах). Причина существования такого предела заключается в образовании насыщенного монослоя молекул ПАВ, который занимает всю поверхность раствора
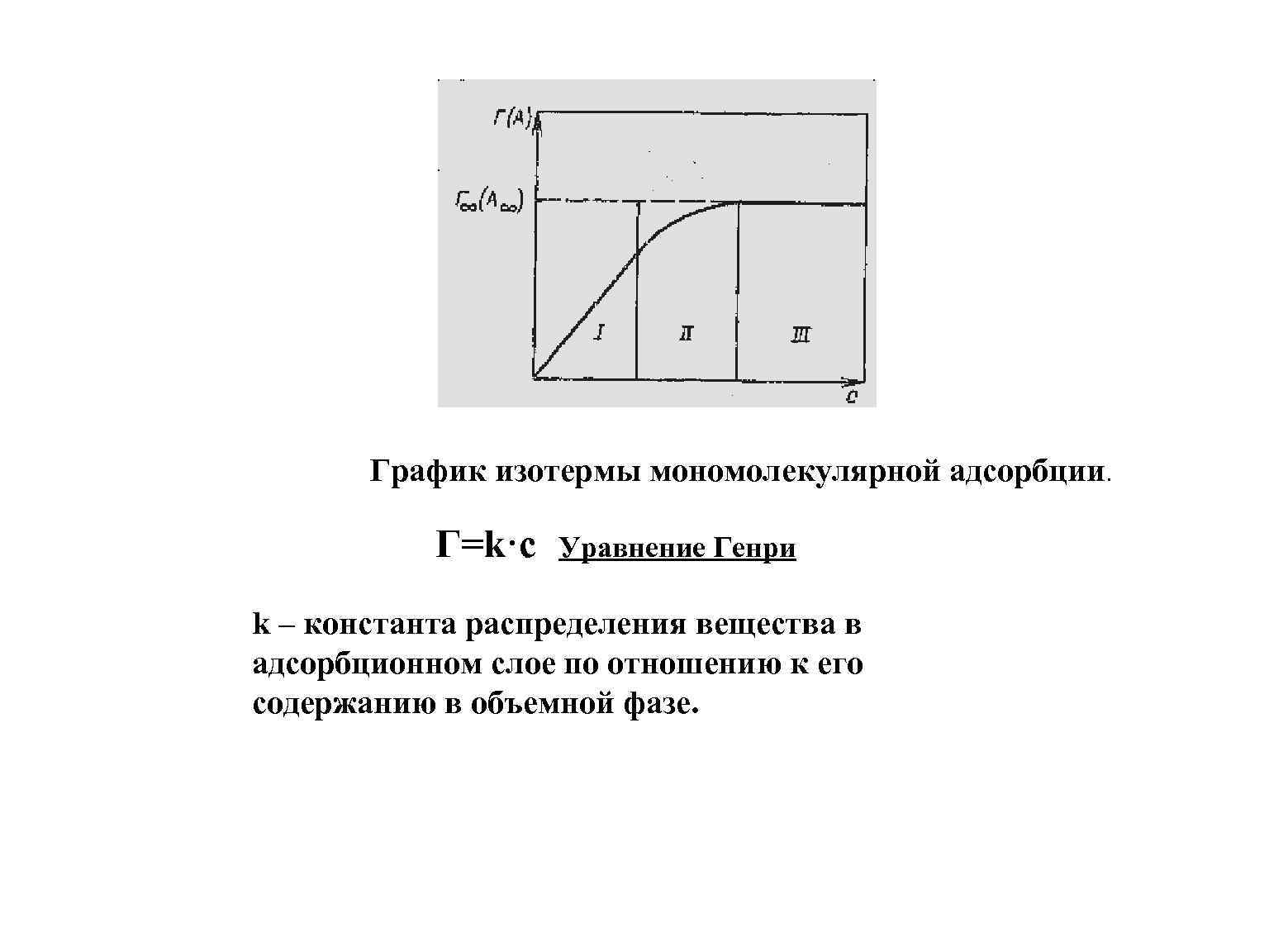
График изотермы мономолекулярной адсорбции. Г=k·c Уравнение Генри k – константа распределения вещества в адсорбционном слое по отношению к его содержанию в объемной фазе.

Г= k·c 1/n Уравнение Фрейндлиха k и n - коэффициенты lg. Г = lgk + 1/n lgc Графическое определение коэффициентов k и n в уравнении Фрейндлиха.

Связь уравнения Ленгмюра с уравнениями Гиббса и Шишковского -dσ/dс = Гmax. RTAс/(1+ Aс) σ0 - σ =b·ln(1+Aс) b=Гmax. RТ Гmax=1/ s 1 NA b=RТ/ (s 1 NA) 25
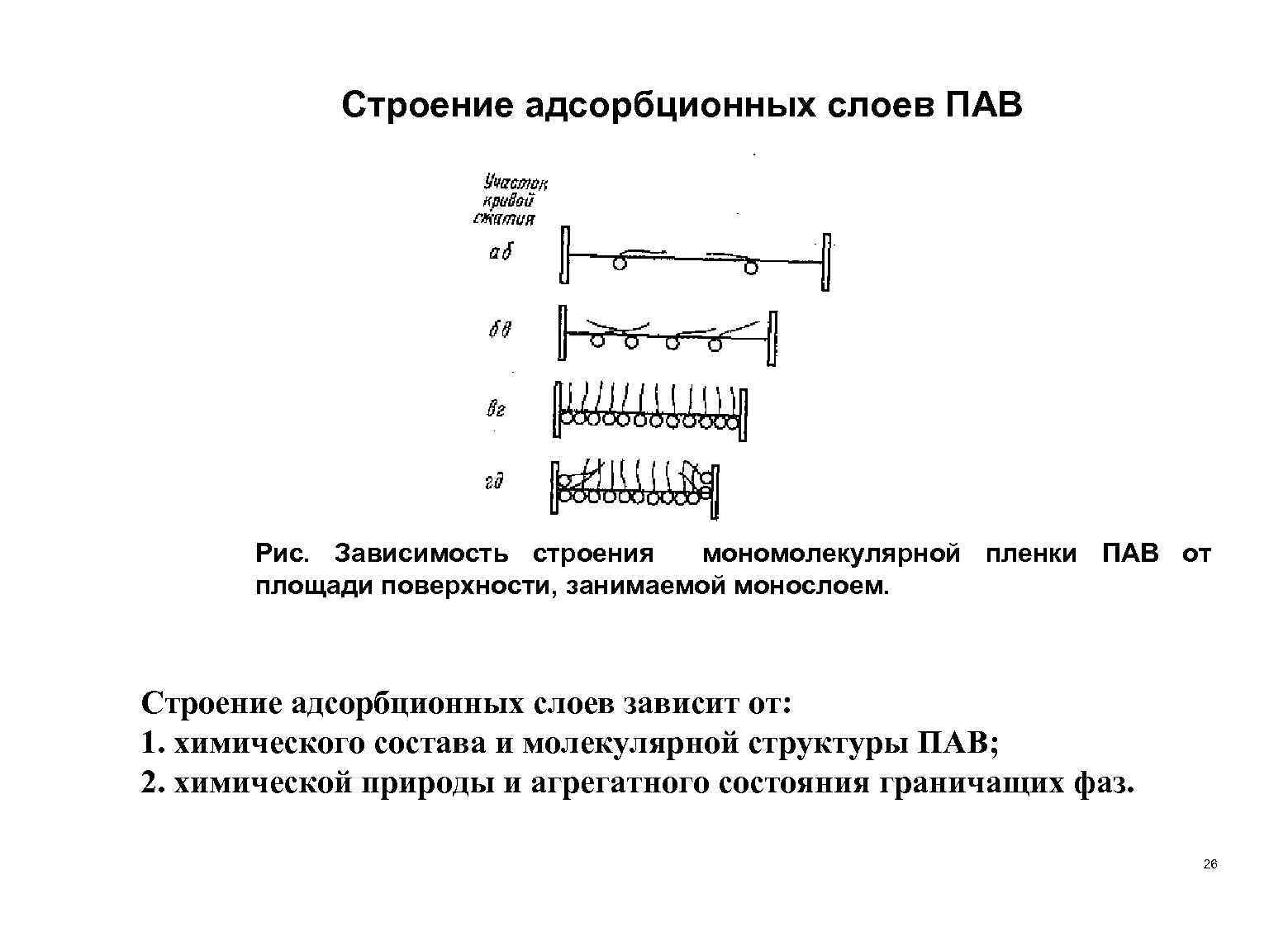
Строение адсорбционных слоев ПАВ Рис. Зависимость строения мономолекулярной пленки ПАВ от площади поверхности, занимаемой монослоем. Строение адсорбционных слоев зависит от: 1. химического состава и молекулярной структуры ПАВ; 2. химической природы и агрегатного состояния граничащих фаз. 26

Правило уравнивания полярностей Ребиндера Количественной мерой полярности вещества может служит его диэлектрическая проницаемость (ε). Ребиндер Петр Александрович (1882 -1972) Диэлектрическая проницаемость ПАВ (εпав) должна занимать промежуточное место между диэлектрическими проницаемостями граничащих фаз А и В: εА > εПАВ > εв

1. Разреженный монослой. В области Генри поверхностная активность равна g = -dσ/dc = Δσ/c где Δσ = σ0 -σ Тогда из уравнения Гиббса получаем Г = Δσ /(RТ) Обозначим Sm = 1/Г — площадь, которую занимает на поверхности 1 моль данного ПАВ. Разность поверхностных натяжений (σ0 - σ) = π представляет двухмерное давление (π), которое создают адсорбированные молекулы. После подстановки выражений для Sm и π в уравнение адсорбции получаем уравнение состояния разреженного монослоя: π Sm= RТ или π SМ= k. Т SМ – площадь, приходящаяся на одну молекулу в адсорбционном слое Уравнения Менделеева-Клапейрона для идеальных газов p. V= RT 28
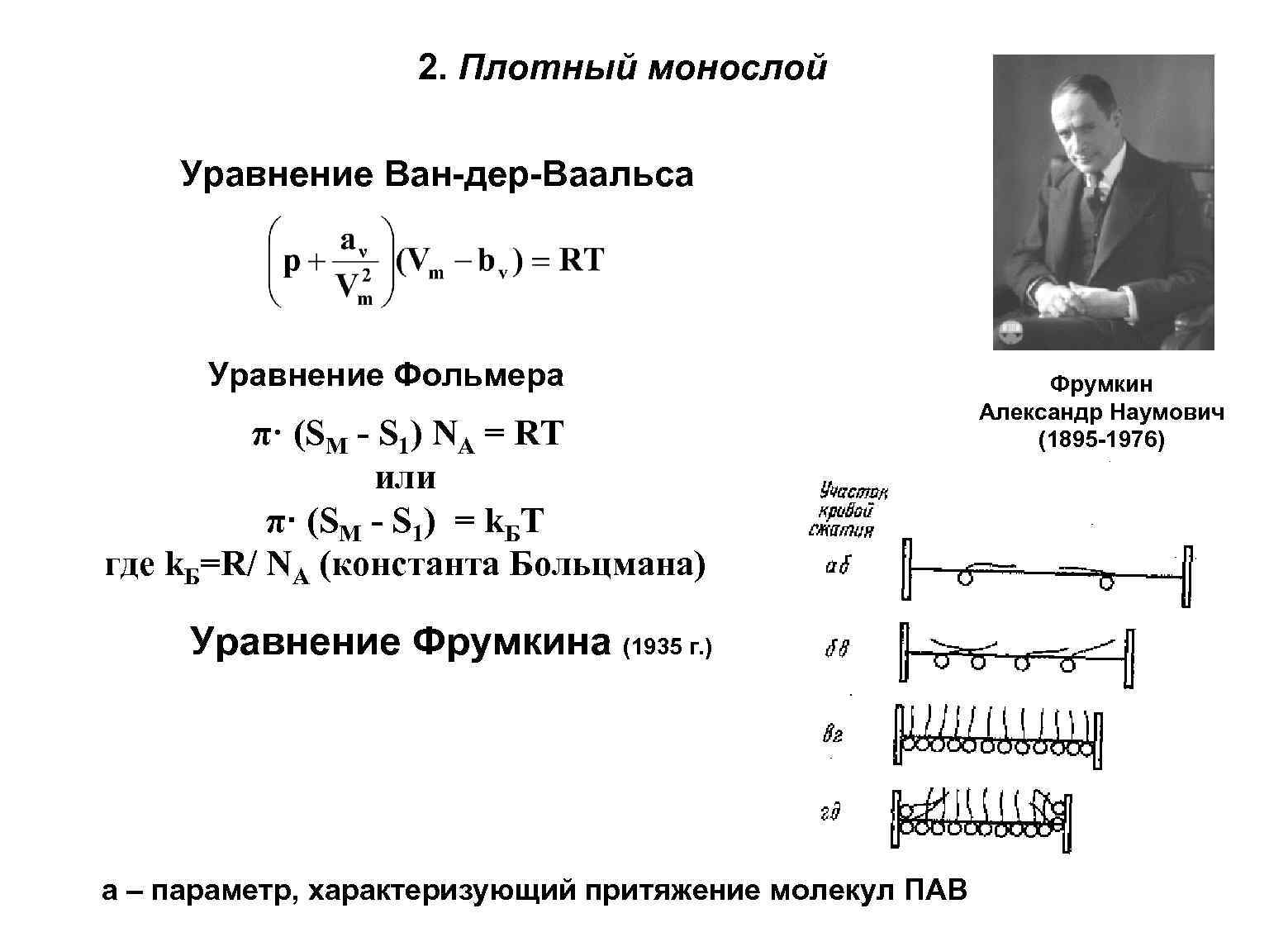
2. Плотный монослой Уравнение Ван-дер-Ваальса Уравнение Фольмера π· (SМ - S 1) NA = RТ или π· (SМ - S 1) = k. БТ где k. Б=R/ NA (константа Больцмана) Уравнение Фрумкина (1935 г. ) а – параметр, характеризующий притяжение молекул ПАВ Фрумкин Александр Наумович (1895 -1976)
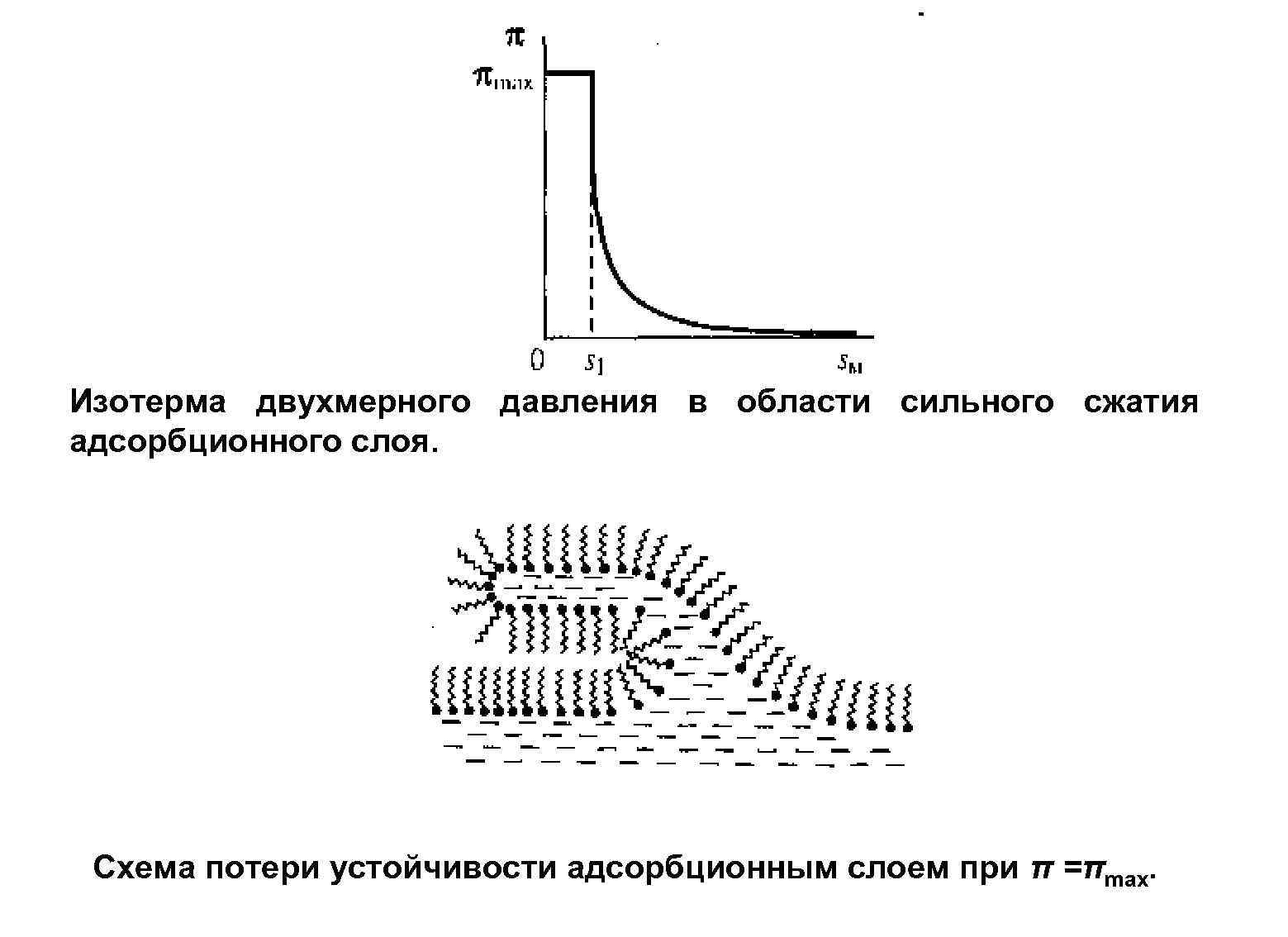
Изотерма двухмерного давления в области сильного сжатия адсорбционного слоя. Схема потери устойчивости адсорбционным слоем при π =πmах.

3. Предельно упакованный монослой. Гmax=1/ s 1 NA b= Гmах RТ Для карбоновых кислот s 1= 0, 216 2, нм спиртов — 0, 205 нм 2 Плотно упакованный адсорбционный монослой полиэлектролитов и высокомолекулярных соединений приобретает механические свойства, характерные для твердых тел и структурированных жидкостей высокую вязкость и предельное напряжение сдвига. Создается тем самым структурно-механический барьер, обеспечивающий стабилизацию (устойчивость) дисперсных систем (пен, эмульсий).
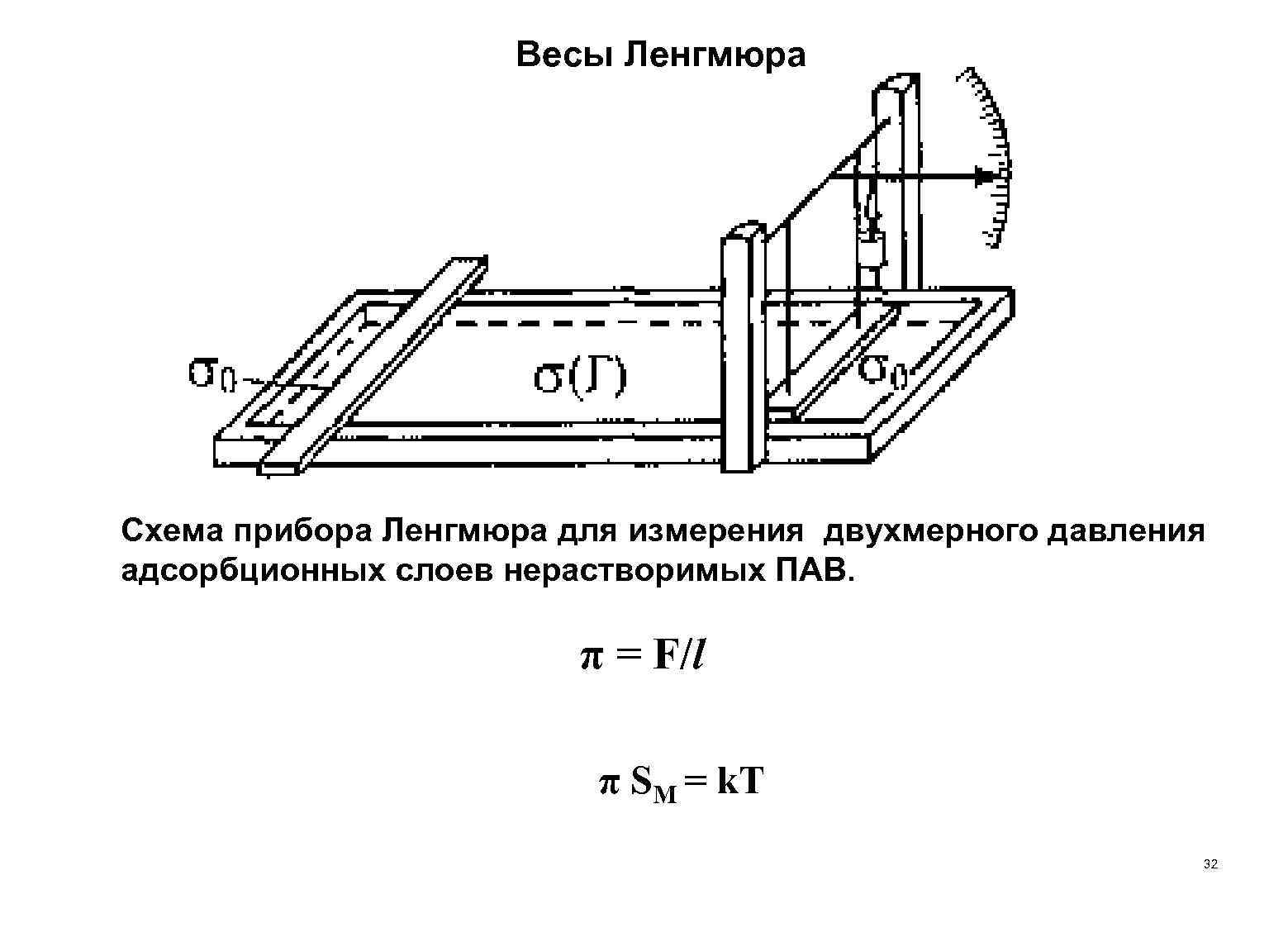
Весы Ленгмюра Схема прибора Ленгмюра для измерения двухмерного давления адсорбционных слоев нерастворимых ПАВ. π = F/l π SМ = k. Т 32
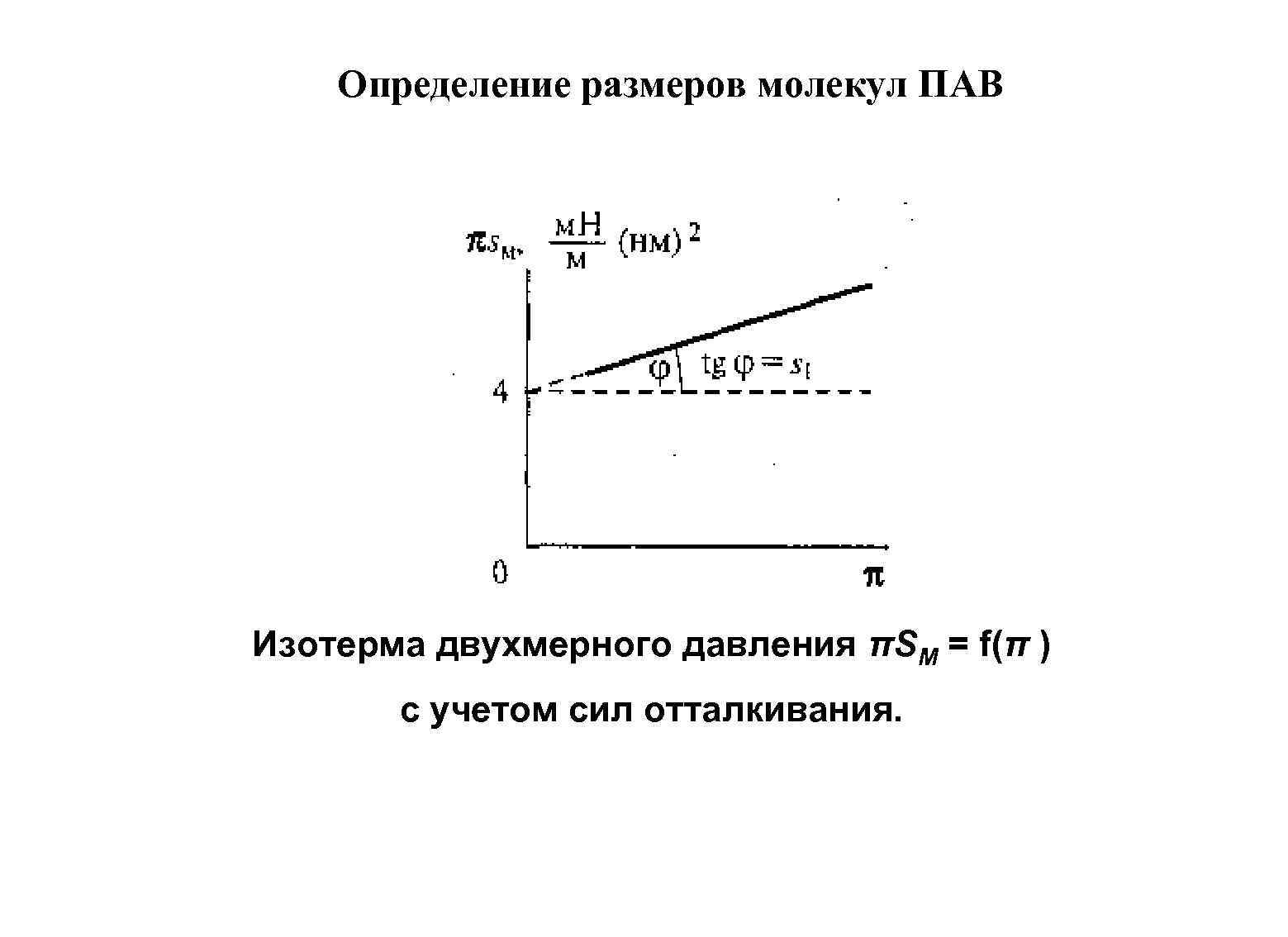
Определение размеров молекул ПАВ Изотерма двухмерного давления πSM = f(π ) с учетом сил отталкивания.
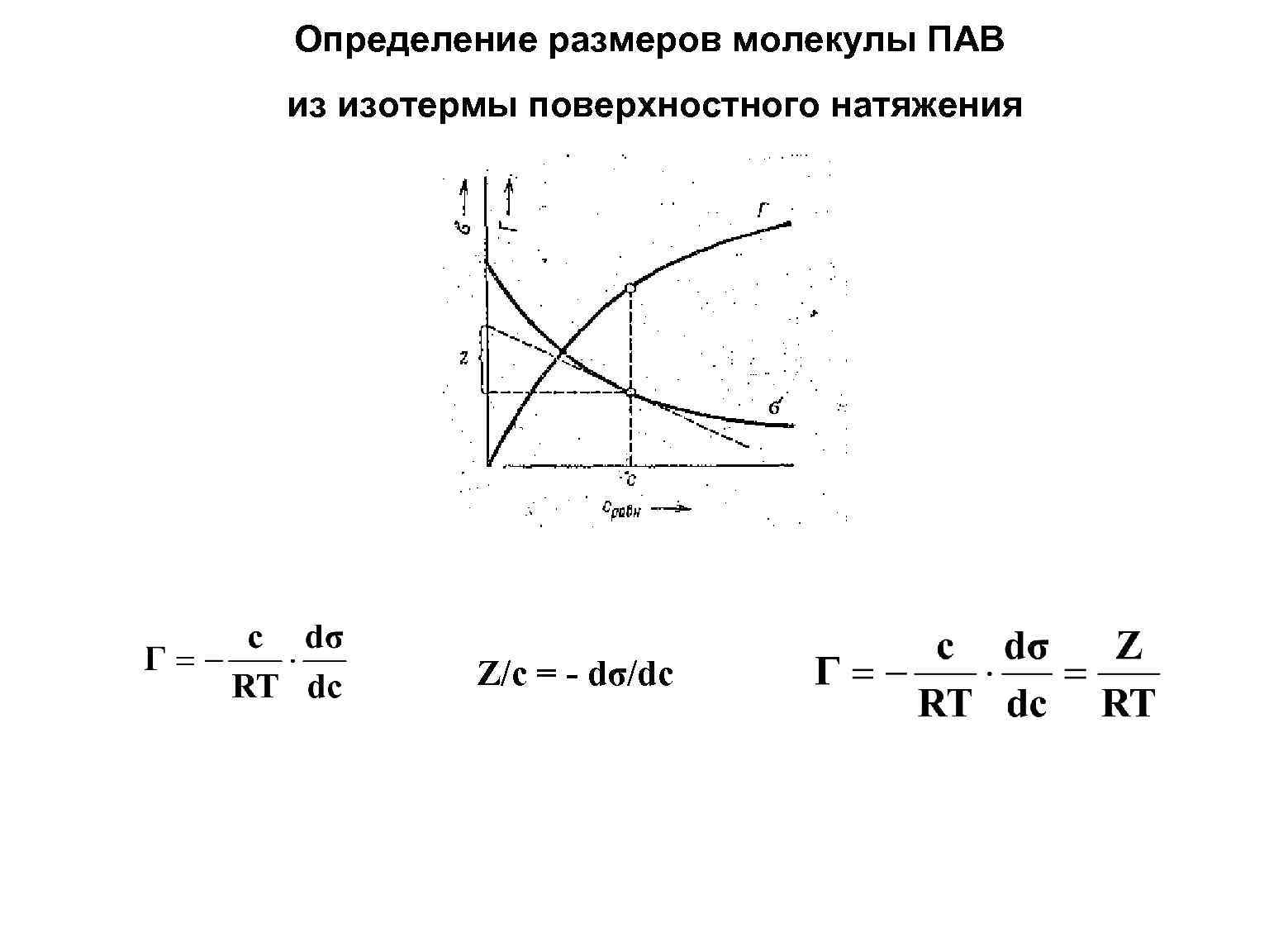
Определение размеров молекулы ПАВ из изотермы поверхностного натяжения Z/c = - dσ/dc

Уравнение Ленгмюра приводят к линейной форме, путем деления концентрации (С) на обе части уравнения.
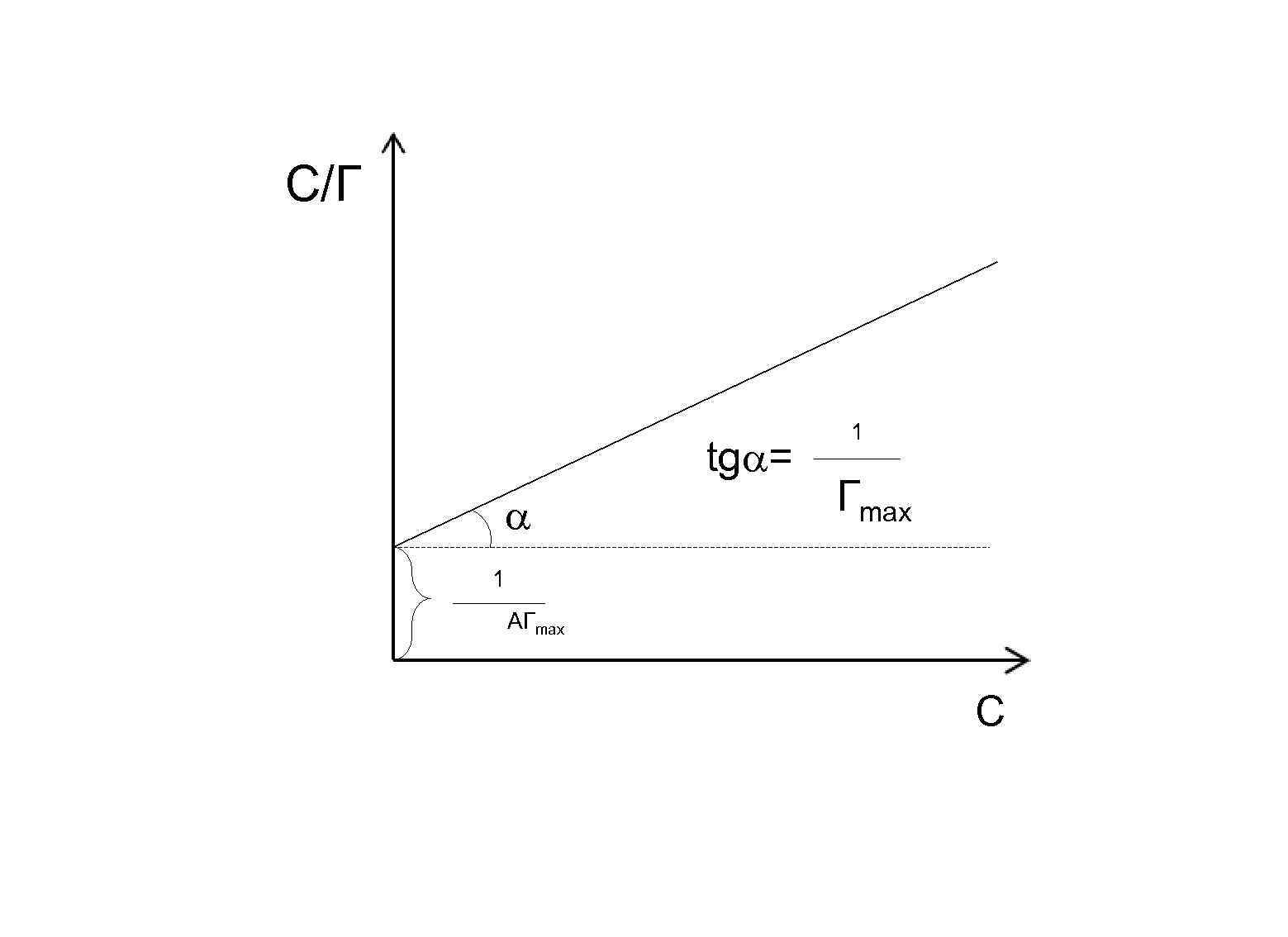
С/Г tg = 1 Гmax 1 АГmax С

Площадь, занимаемая молекулой в поверхностном слое SМ = 1/ Гmax NА Длина молекулы ПАВ δ = Гmax. М/ρ. М - молекулярная масса ПАВ ρ- плотность ПАВ в жидком состоянии

Основные типы нерастворимых пленок ПАВ А. Адамсон различает следующие типы поверхностных пленок. 1. G-пленки газообразные (gaseous) 2. LЕ-пленки (Liquid-expended жидко-растянутые или L 2–пленки). SM» S 1 SM = от 0, 4 - 0, 5 до 0, 22 нм 2 3. LC-пленки (Liquid-condensed – жидкие) или L 1 -пленки S 1 ~ 0, 22 нм 2 4. S-пленки (solid - твердые) S 1 ~ 0, 206 2 нм

Условия перехода одного типа пленки в другой Влияние условий и природы ПАВ. Низкие давления, высокие температуры и ослабление притяжения м/у молекулами (уменьшение длины цепи ПАВ и разветвленности) способствуют образованию менее конденсированной пленки. Влияние среды. Ионизация полярных групп адсорбированных молекул, например кислот при щелочной реакции воды, на которой образована пленка, усиливает отталкивание полярные групп и вызывает расширение области газообразного состояния. 39
Презентация лекции Адсорбция.ppt