9. Адсорбция из растворов.ppt
- Количество слайдов: 8

Адсорбция на границе твердое тело - раствор

Особенности адсорбции из растворов 1. Одновременно могут протекать два параллельных процесса: v адсорбция молекул растворенного вещества; v адсорбция молекул растворителя. 2. Адсорбироваться будет то вещество, которое в большей степени будет снижать поверхностное натяжение адсорбента. Различают: v молекулярную адсорбцию; v ионообменную адсорбцию. 2
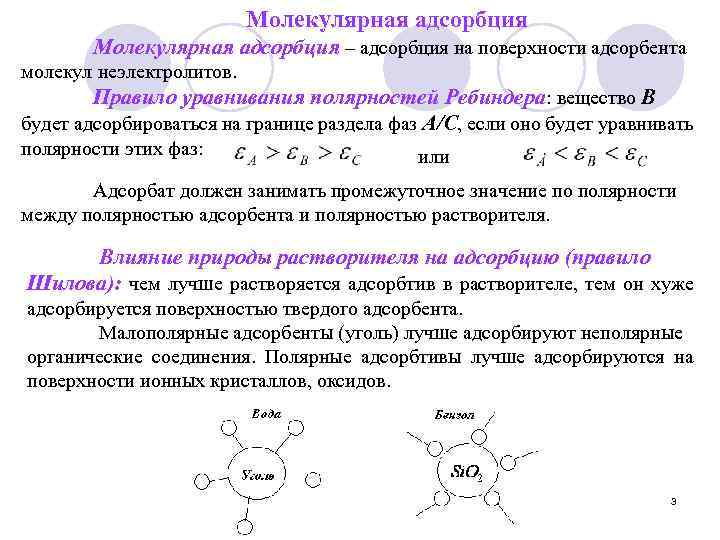
Молекулярная адсорбция – адсорбция на поверхности адсорбента молекул неэлектролитов. Правило уравнивания полярностей Ребиндера: вещество В будет адсорбироваться на границе раздела фаз А/С, если оно будет уравнивать полярности этих фаз: или Адсорбат должен занимать промежуточное значение по полярности между полярностью адсорбента и полярностью растворителя. Влияние природы растворителя на адсорбцию (правило Шилова): чем лучше растворяется адсорбтив в растворителе, тем он хуже адсорбируется поверхностью твердого адсорбента. Малополярные адсорбенты (уголь) лучше адсорбируют неполярные органические соединения. Полярные адсорбтивы лучше адсорбируются на поверхности ионных кристаллов, оксидов. 3
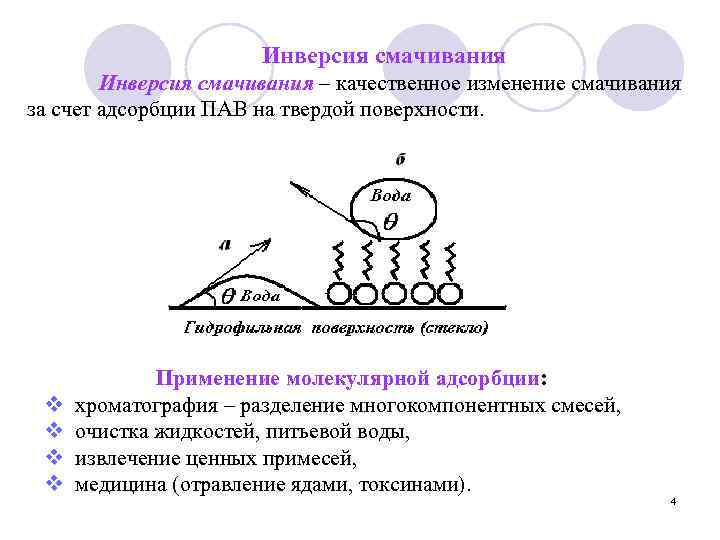
Инверсия смачивания – качественное изменение смачивания за счет адсорбции ПАВ на твердой поверхности. v v Применение молекулярной адсорбции: хроматография – разделение многокомпонентных смесей, очистка жидкостей, питьевой воды, извлечение ценных примесей, медицина (отравление ядами, токсинами). 4

Ионная адсорбция – адсорбция сильных электролитов из водных растворов, обусловленная химическими и электростатическими силами. Ионы избирательно адсорбируются на поверхностях, состоящих из ионов или полярных молекул. Правило избирательной адсорбции Пескова – Фаянса На твердой поверхности адсорбента в первую очередь адсорбируются ионы, которые: vвходят в состав кристаллической решетки адсорбента; vспособны достраивать кристаллическую решетку адсорбента; vизоморфны с ионами адсорбента. Влияние природы ионов на их адсорбционную способность Ионы адсорбируются тем лучше: vчем больше заряд иона; vчем больше радиус иона; vчем больше поляризуемость иона. 5
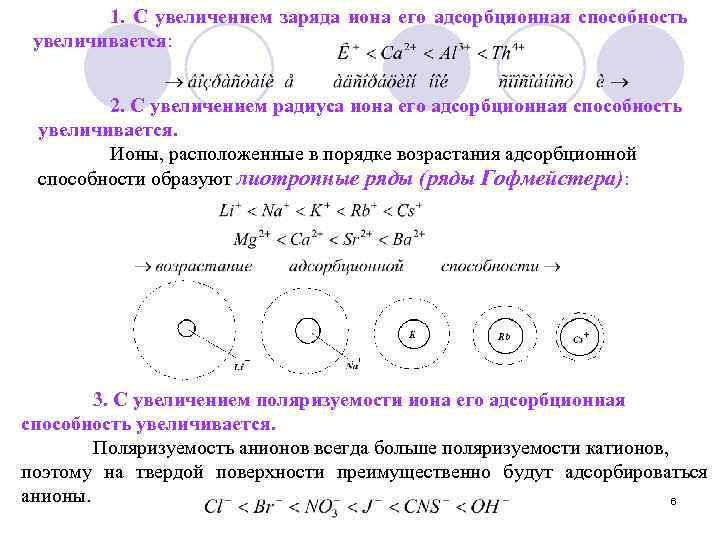
1. С увеличением заряда иона его адсорбционная способность увеличивается: 2. С увеличением радиуса иона его адсорбционная способность увеличивается. Ионы, расположенные в порядке возрастания адсорбционной способности образуют лиотропные ряды (ряды Гофмейстера): 3. С увеличением поляризуемости иона его адсорбционная способность увеличивается. Поляризуемость анионов всегда больше поляризуемости катионов, поэтому на твердой поверхности преимущественно будут адсорбироваться анионы. 6

Ионообменная адсорбция. Ионный обмен Ионообменная адсорбция - процесс обмена ионов между раствором и ионообменником (сорбентом). Ионообменники (иониты) – высокомолекулярные полиэлектролиты, состоящие из синтетического нерастворимого каркаса с привитыми функциональными группами кислотного (-SO 3 Н, -COOН, и др. ) и основного ( =NH, -NH 2 и др. ) характера. Особенности ионообменная адсорбции v специфична, каждый адсорбент (ионит) обменивается определенными типами ионов; v не всегда обратима; v протекает более медленно, чем молекулярная адсорбция; v часто меняется р. Н среды. 7
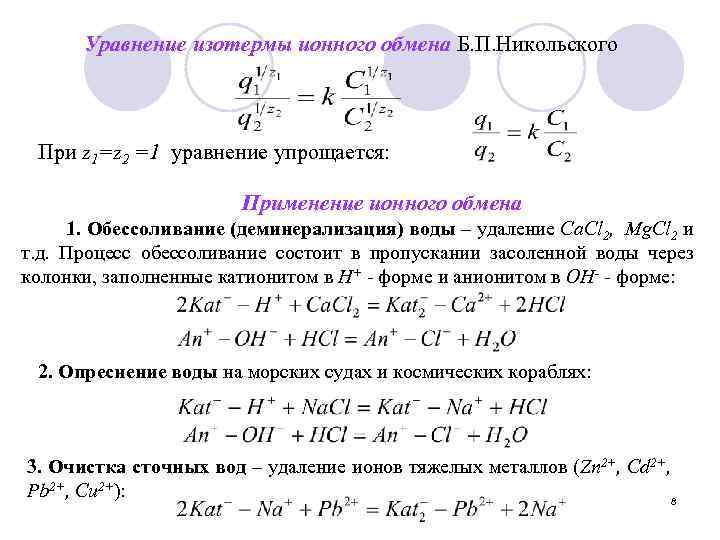
Уравнение изотермы ионного обмена Б. П. Никольского При z 1=z 2 =1 уравнение упрощается: Применение ионного обмена 1. Обессоливание (деминерализация) воды – удаление Са. Cl 2, Мg. Cl 2 и т. д. Процесс обессоливание состоит в пропускании засоленной воды через колонки, заполненные катионитом в Н+ - форме и анионитом в ОН- - форме: 2. Опреснение воды на морских судах и космических кораблях: 3. Очистка сточных вод – удаление ионов тяжелых металлов (Zn 2+, Cd 2+, Pb 2+, Cu 2+): 8
9. Адсорбция из растворов.ppt