Адсорбция. 2014.pptx
- Количество слайдов: 21

Адсорбция

1. Адсорбция 2. Мономолекулалы адсорбция теориясы 3. Гиббс теңдеуі 4. Капиллярлық конденсация 5. Адсорбцияның газдың қасиетіне тәуелділігі, газдардың адсорбциясының практикада қолданылуы 6. Адсорбенттер типтері

Бөлім беттері шегінде заттардың концентрацияларының өздігінен көбеюі адсорбция деп аталады. Абсорбция дегеніміз қатты заттың немесе сұйықтың бүкіл көлемімен газ немесе буды сіңіруі. Адсорбция мен абсорбция процестері қатар жүргенде қатты материалдардың еріген заттарды, газдарды жұтуы сорбция деп аталады. Сіңіруші заттар сорбенттер және адсорбенттер деп аталады. Газда сіңірілген еріген заттарды сорбаттар және адсорбтивтер деп атайды.
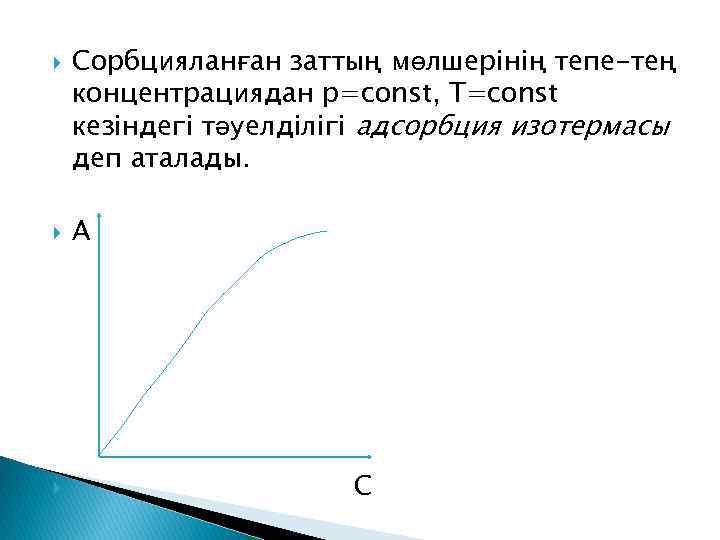
Сорбцияланған заттың мөлшерінің тепе-тең концентрациядан р=const, T=const кезіндегі тәуелділігі адсорбция изотермасы деп аталады. А С

Адсорцияны физикалық және химиялық (хемосорбция) деп бөледі. Физикалық адсорбция – беттік процесс адсорбенттің бетімен сутектік байланыс, электростатикалық күш есебінен жүзеге асады. Физикалық адсорбцияның ерекшеліктері: үлкен жылдамдық, қайтымдылығы, жұтылған заттың Т жоғарылаған сайын мөлшерінің азаюы, адсорбцияның аз мөлшердегі жылуы 8 -20 к. Дж/моль

Химиялық адсорбция – химиялық өзара әсер күші есебінен жүзеге асатын адсорбция. Химиялық адсорбцияның ерекшеліктері: қайтымсыздығы, адсорбенттің табиғатына тәуелді, температураның жоғарылауы хемосорбцияның көбеюіне әкеледі, адсорбция жылуы 800 -1000 к. Дж/моль.

Мономолекулалы адсорбция теориясы Газдың қатты адсорбенттегі мономолекулалы адсорция теориясын жасағанда И. Ленгмюр келесі ерекшеліктерді ескереді: газдың бір молекуласы ғана әрекеттесетін жеке адсорбциялық орталықтарда адсорбция жинақталған(молекулалар бетіне ауыспайды); адсорбциялық орталықтар энергетикалық эквивалентті – адсорбент беті эквипотенциалды; әрбір адсорбциялық орталық бір ғана молекуланы ұстап тұрады; адсорбцияланған молекулалар адсорбциялық орталықтарда белгілі бір уақыт аралығында ғана бола алады; адсорбциялық молекулалар бір-бірімен өзара әрекеттеспейді.

Адсорбциялық тепе-теңдік константасы: К = CАВ/СА∙СВ CАВ – беттегі түзілген комплекстің концентрациясы; СА – белсенді орталықтардың концентрациясы; СВ–газдың концентрациясы. Ленгмюрдің мономолекулалы адсорбция изотермасының теңдеуі. α = α∞∙K∙p/(1+K∙p) α∞ - адсорбциялық қабаттың сыйымдылығы, яғни 1 массалық бірліктегі адсорбциялық орталықтар саны.

Ленгмюр теңдеуін заттың адсорбциясы мономолекулалы қабат түзілумен қоса жүретін жағыдайда пайдалануға болады. Ленгмюр теңдеуі: А= A∞ A – адсорбция моль/л; A∞ - шекті адсорбцияның өлшемі; в – адсорбциялық қабілетті сипаттайтын константа; с – тепе-теңдік концентрациясы.
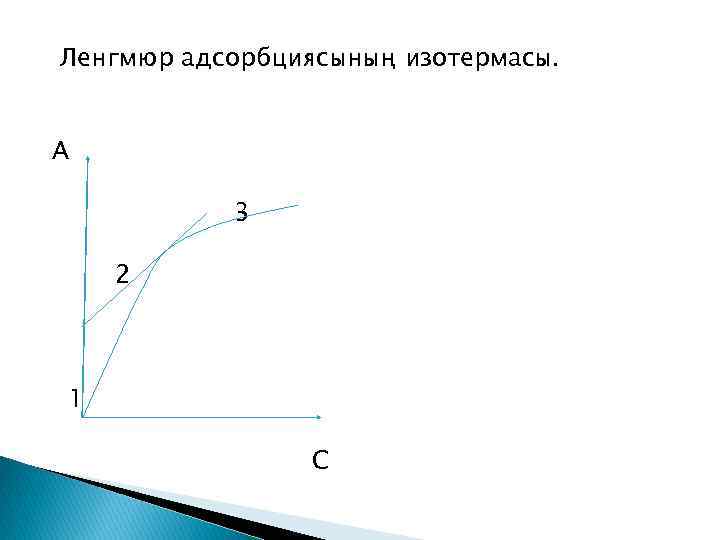
Ленгмюр адсорбциясының изотермасы. А 3 2 1 С

Адсорбциялық қабаттың қанығуы болатын ең үлкен тұрақты мәні, концентрацияға тәуелсіз адсорбция шекті адсорбция A∞ деп аталады. Адсорбцияға әсер ететін факторлар: еріген заттың теңдік концентрациясы; еріткіштің табиғаты; сорбент табиғаты; адсорбция температурасы, уақыты.

Гиббс теңдеуі адсорбция өлшемі мен ерітінді концентрациясы бар беттік керілудің өзгерісі арасындағы қатынасты анықтайды: Г=А=- A˃0, ˃0 A˂0, ˂0 A=0, =0

Капиллярлық конденсация Капиллярлық конденсация дегеніміз қатты дене (сорбент) қуысында бу сияқты заттардың (сорбтивтердің) конденсациялануы. Конденсация құбылысы температураға, бу серпімділігіне, капиляр диаметріне, қатты сорбенттің беткі қабатының өзіне сұйық күйдегі сорбтивті жұқтыру қабілетіне байланысты. Ондағы капилляр түтігі жіңішке болған сайын және олардың қабырғасы сұйық күйдегі сорбтивті өзіне жақсы жұқтырғанда да конденсациялану тезірек жүреді. Капиллярлы конденсация тез жүреді және бірнеше минутта тоқтайды. Бұл кездегі сорбция изотермасы S – пішінді болып келеді. Капиллярлы конденсацияны поралы сорбенттермен буларды ұстау үшін пайдаланады. Құрғату, топырақта, құрылыс және басқа материалдарда ылғалды ұстап тұру процестерінде үлкен роль атқарады.

Адсорбцияның газдың қасиетіне тәуелділігі Газ: тез сығылған сайын; критикалық температурасы жоғары болған сайын; конденсация температурасы жоғары болған сайын жақсы адсорбцияланады.

Газдардың адсорбциясының практикада қолданылуы Қатты адсорбенттердегі газдардың адсорбциясы: газ қоспаларынан жеке компоненттерді бөліп алу үшін және қоспаларды толық бөліп алуда; уландыратын газдарды жұту үшін; еріткіштерді тотықсыздандыру; өндірістік қалдық газдарды ұстау үшін, агрессивті газдардан ауаны тазарту үшін; әр түрлі мақсаттағы газдарды құрғату үшін пайдаланылады.

Адсорбенттер типтері Барлық адсорбенттер екі топқа бөлінеді: порасыз адсорбенттер (тегіс беті бар адсорбенттер ); поралы адсорбенттер. Порасыз адсорбенттердегі адсорбция келесі түрде жүреді: адсорбенттің адсорбтивке тартылуы; (бұл тартқыштық күшті болған сайын, белгілі бір байланыстар түзілуге бейімділік сирек білінеді). адсорбенттің дисперстілігі; (бөлшектің өлшемі аз болған сайын, оның меншікті беті Sмен. үлкен болады). Порасыз кең тараған адсорбенттерге: оксидтер (Si. O 2), тұздар (Zn. SO 4, Ba. SO 4), графитті күйе.

Поралы адсорбенттер Поралы денелер – ішкі фаза аралық беттерімен шектелетін, ішінде поралары бар қатты заттар. Поралы заттардың адсорбциясы поралардың өлшеміне, поралылығына тәуелді. Адсорбенттердің пораларының өлшеміне байланысты: Макропоралы - rпора>100 -200 нм, Sмен. = 0, 5 – 2 м 2/г; өтпелі поралы (капиллярлы-поралы) - rпора>1, 5 - 100 нм, Sмен. = 10 – 500 м 2/г; микропоралы (пораларының өлшемі адсорбцияланған молекулалардың өлшеміне сәйкес) - rпора>0, 5 -1, 5 нм, Sмен. = 500 – 1000 м 2/г.

Поралылық дене көлемінің бірлігіне келетін поралардың көлемі, яғни оның құрылымындағы бос жердің үлесі. П=Vn/Vжалпы Поралылық адсорбенттің меншікті бетін анықтайды – ол үлкен болған сайын адсорбенттің сыйымдылығы да үлкен болады. Поралы адсорбенттер қатарына белсенді көмір, силикагельдер, алюмогельдер, цеолиттер жатады.

Сорбенттерді табиғи және синтетикалық деп бөледі. Табиғи адсорбенттерге: ағаш көмірі, саз, силикагель, поралы шынылар, тұнбалы тау жыныстары – кизельгур жатады. Табиғи иониттер практикада кең қолданылмайды, өйткені кейбір кемшіліктеріне байланысты: химиялық тұрақсыз, механикалық беріктігі төмен. Синтетикалық сорбенттерге: әр түрлі функционалды топтары бар ионалмастырғыш шайырлар жатады. Артықтықшылығы: жоғары механикалық беріктігі; жоғары химиялық беріктігі; үлкен сорбциялық сыйымдылығы.

Аниониттер, катиониттер, полиамфолиттер болып бөлінеді. Аниониттер – ерімейтін негіздер, аниондарды алмастырады (-NH 2); Катиониттер – катиондарды алмастыратын Полиамфолиттер – қышқылдық және катиондар. негіздік топтары бар ерімейтін қосылыстар. Гидрофильдік адсорбенттер – сумен жақсы араласатын және гидрофобты адсорбенттер – белсенді көмір, графит, тальк болады.

Адсорбцияның практикада қолданылуы Гетерогенді катализ; хроматография, бояу, жуу, сұйықтарды тазалауда және қоспалардан бөліп алуда, азық-түлік өнімдері өндірісінде, тоқыма технологиясында, таулы жыныстарда мұнай скважиналарын бұрғылауда, мұнда арнайы бұрғылау ерітінділері пайдаланылады.
Адсорбция. 2014.pptx