4-5 л Общая характеристика адсорбции. ПАВ.ppt
- Количество слайдов: 50


Адсорбционные явления
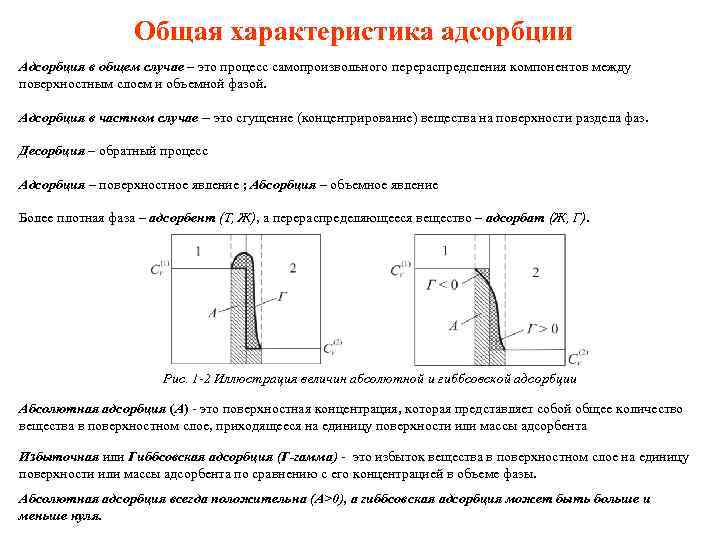
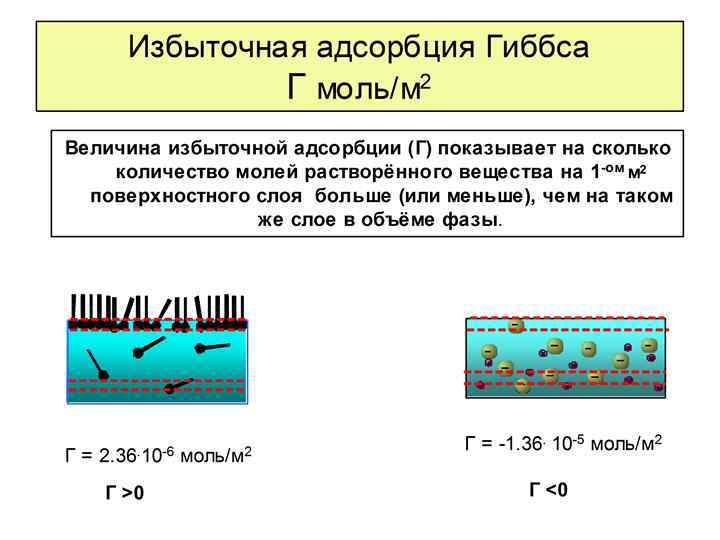
Общая характеристика адсорбции Адсорбция в общем случае – это процесс самопроизвольного перераспределения компонентов между поверхностным слоем и объемной фазой. Адсорбция в частном случае – это сгущение (концентрирование) вещества на поверхности раздела фаз. Десорбция – обратный процесс Адсорбция – поверхностное явление ; Абсорбция – объемное явление Более плотная фаза – адсорбент (Т, Ж), а перераспределяющееся вещество – адсорбат (Ж, Г). Рис. 1 -2 Иллюстрация величин абсолютной и гиббсовской адсорбции Абсолютная адсорбция (А) - это поверхностная концентрация, которая представляет собой общее количество вещества в поверхностном слое, приходящееся на единицу поверхности или массы адсорбента Избыточная или Гиббсовская адсорбция (Г-гамма) - это избыток вещества в поверхностном слое на единицу поверхности или массы адсорбента по сравнению с его концентрацией в объеме фазы. Абсолютная адсорбция всегда положительна (А>0), а гиббсовская адсорбция может быть больше и меньше нуля.

Для А и Г можно записать: (1) где CS – средняя концентрация вещества в поверхностном слое; VS – объем поверхностного слоя; S – площадь поверхности; h. S – толщина поверхностного слоя. (2) где СV – концентрация в объеме. (3) (4) где С 0 и Ср – концентрации вещества в объеме раствора до и после адсорбции; V – объем раствора; S(m) – площадь поверхности (или масса) адсорбента.

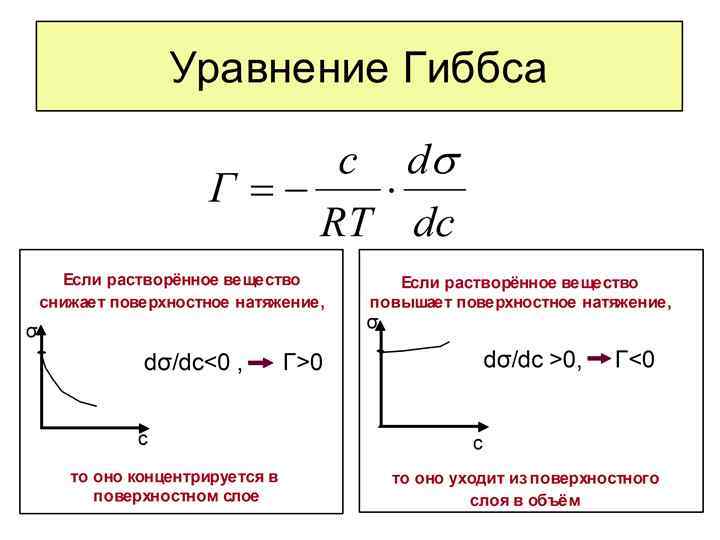
A = f(C) (T = const) – изотерма; A = f(T) (С = const) – изопикна; C = f(T) (A = const) – изостера. Рис. 3 Адсорбционное уравнение Гиббса ( σ, μ, Г ) Воспользуемся методом избытков Гиббса (Vп. с. =0) (5) => (6) Для поверхностного слоя при q=const (7) Из уравнения (5) и (7) при V=0: (8)

При постоянной температуре после преобразований соотношение (8) примет вид: (9) (10) (11) где Г – гиббсовская адсорбция или плотность избытка массы i-го компонента в поверхностном по сравнению с его концентрацией в объеме С учетом (11), будем иметь (12) Фундаментальное или общее уравнение Гиббса (12) Запишем уравнение (12) для системы из двух компонентов – растворителя 1 и растворенного вещества 2: (13) В разбавленном растворе будем иметь: (14)
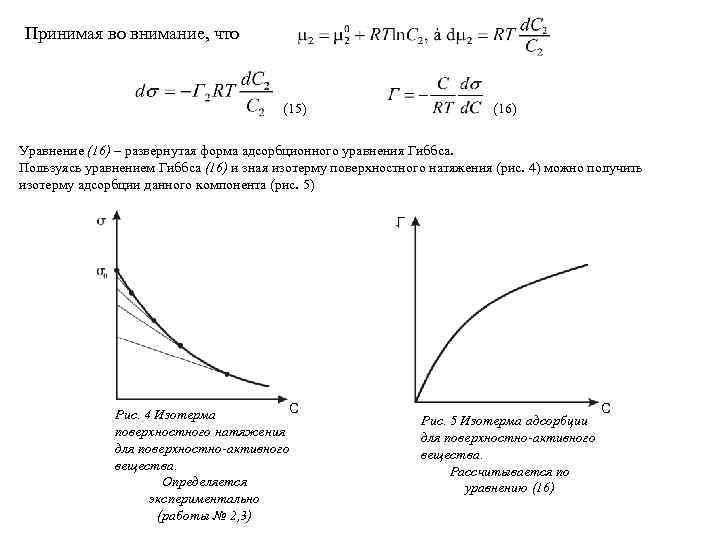
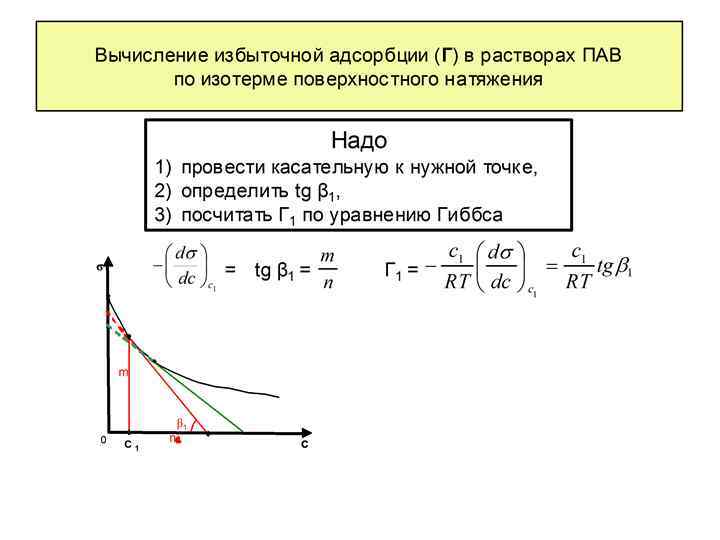
Принимая во внимание, что (15) (16) Уравнение (16) – развернутая форма адсорбционного уравнения Гиббса. Пользуясь уравнением Гиббса (16) и зная изотерму поверхностного натяжения (рис. 4) можно получить изотерму адсорбции данного компонента (рис. 5) Г С Рис. 4 Изотерма поверхностного натяжения для поверхностно-активного вещества. Определяется экспериментально (работы № 2, 3) Рис. 5 Изотерма адсорбции для поверхностно-активного вещества. Рассчитывается по уравнению (16) С
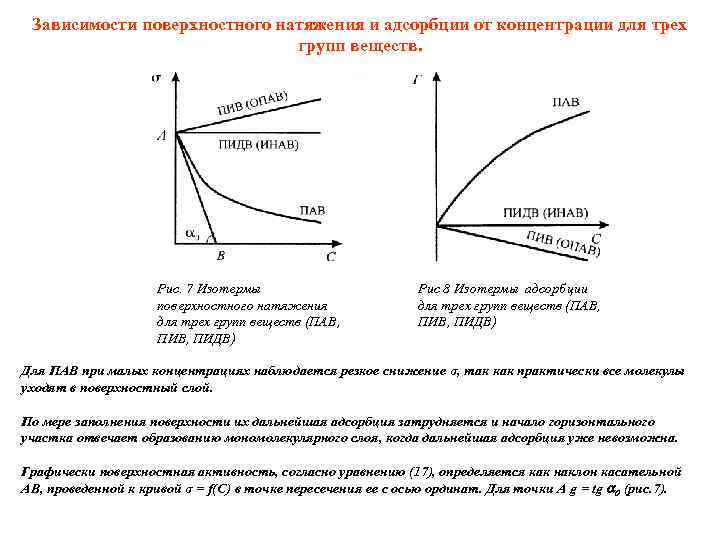
Зависимости поверхностного натяжения и адсорбции от концентрации для трех групп веществ. Рис. 7 Изотермы поверхностного натяжения для трех групп веществ (ПАВ, ПИДВ) Рис 8 Изотермы адсорбции для трех групп веществ (ПАВ, ПИДВ) Для ПАВ при малых концентрациях наблюдается резкое снижение σ, так как практически все молекулы уходят в поверхностный слой. По мере заполнения поверхности их дальнейшая адсорбция затрудняется и начало горизонтального участка отвечает образованию мономолекулярного слоя, когда дальнейшая адсорбция уже невозможна. Графически поверхностная активность, согласно уравнению (17), определяется как наклон касательной АВ, проведенной к кривой σ = f(C) в точке пересечения ее с осью ординат. Для точки А g = tg 0 (рис. 7).

Поверхностная активность. Классификация веществ по поверхностной активности. Из адсорбционного уравнения Гиббса (16) видно, что влияние природы вещества на адсорбцию заключено в величине и знаке производной dσ/d. C. Если она положительна, то адсорбция отрицательна, а если dσ/d. C отрицательна, то адсорбция положительна. Предельное значение этой производной при C 0, взятой со знаком минус, называют поверхностной активностью: (17) чем сильнее уменьшается поверхностное натяжение с ростом концентрации, тем больше поверхностная активность. Все вещества по способности адсорбироваться на границе раздела фаз делятся на три группы. Поверхностно-активные вещества (ПАВ) Поверхностно-инактивные вещества (ПИВ) или ОПАВ – отрицательные поверхностноактивные вещества. Поверхностноиндифферентные вещества (ПИДВ) или ИНАВ – инактивные вещества.


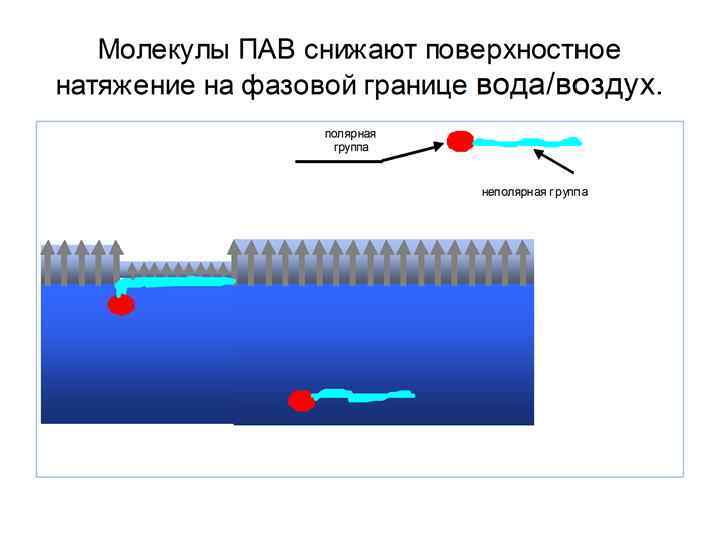
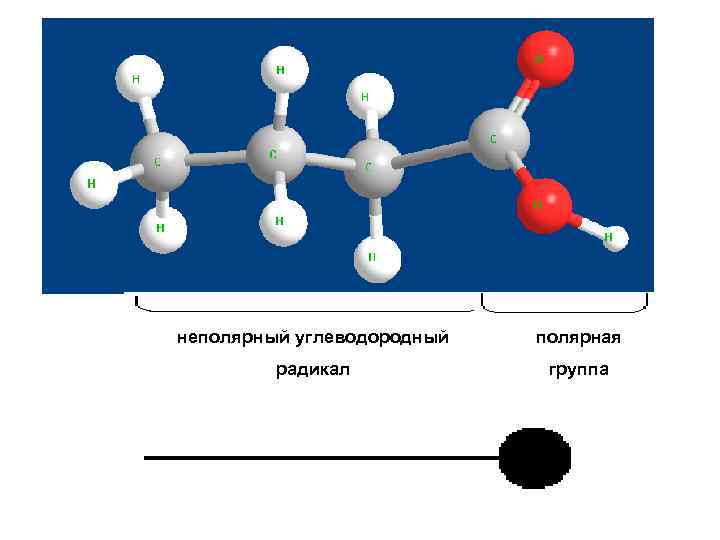
1 группа Поверхностно-активные вещества (ПАВ) Для таких веществ g > 0, dσ/d. C < 0, Г >0 Поверхностно-активные вещества способны накапливаться в поверхностном слое и снижать при этом поверхностное натяжение. Характерные особенности ПАВ: 1) Дифильность молекулы, то есть она состоит из двух разных частей – неполярной (углеводородного радикала) и полярной, представленной функциональными группами -СООН, -NH 2, -OH, -NO 2, -SH, -CNS. Это – органические кислоты, амины, спирты, белки, мыла и т. д. На границе водный раствор–воздух полярная группа ПАВ втягивается в воду, а неполярный радикал выталкивается в неполярную фазу (воздух). В результате молекулы ПАВ концентрируются (адсорбируются) на поверхности. 2) σпав < σ0 (растворителя) Замена молекул растворителя в поверхностном слое на молекулы ПАВ является энергетически выгодной. 3) Малая растворимость Схематичное изображение молекулы ПАВ Полярная Неполярная часть Рис. 6 Примеры: 1. Основа мыла – стеараты и олеаты натрия и калия 2. ПАВ (в пищевой промышлености) лимонная кислота, белки, эфиры сахарозы, жирные кислоты, фосфолипиды (↓σ до 30 -50 м. Дж/м²)


2 группа Поверхностно-инактивные вещества (ПИВ) или ОПАВ – отрицательные поверхностно-активные вещества. 3 группа Поверхностно-индифферентные вещества (ПИДВ) или инактивные вещества (ИНАВ) g < 0; dσ/d. C > 0; Г < 0 Для ПИВ характерно стремление уйти с поверхности в объем раствора, Отрицательная гиббсовская адсорбция (Г< 0) для ПИВ означает, что концентрация вещества в объеме больше, чем на поверхности. Характерные особенности: 1) Имеют 2 одинаковые части (полярные), не имеют гидрофобной части. Характеризуются сильным взаимодействием с молекулами растворителя. 2) σ > σ0 3) Хорошая растворимость - беспечивает переход молекул в глубь раствора, а большое значение поверхностного натяжения способствует замене молекул ПИВ в поверхностном слое на молекулы растворителя. Таким условиям отвечают неорганические основания, кислоты, соли в водных растворах. g = 0; dσ/d. C = 0; Г = 0 Они равномерно распределяются между объемом фазы и поверхностным слоем. У них создается баланс полярной и неполярной частей, и поверхностное натяжение оказывается близким к поверхностному натяжению растворителя. Примером таких веществ являются глицерин, все сахара.
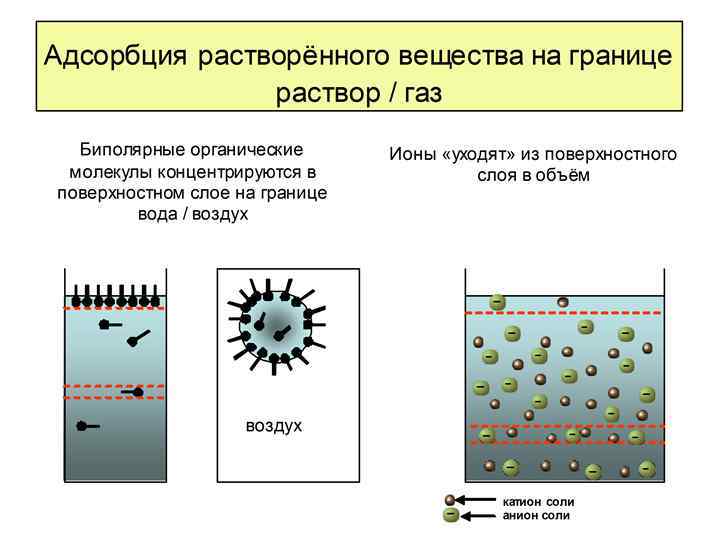
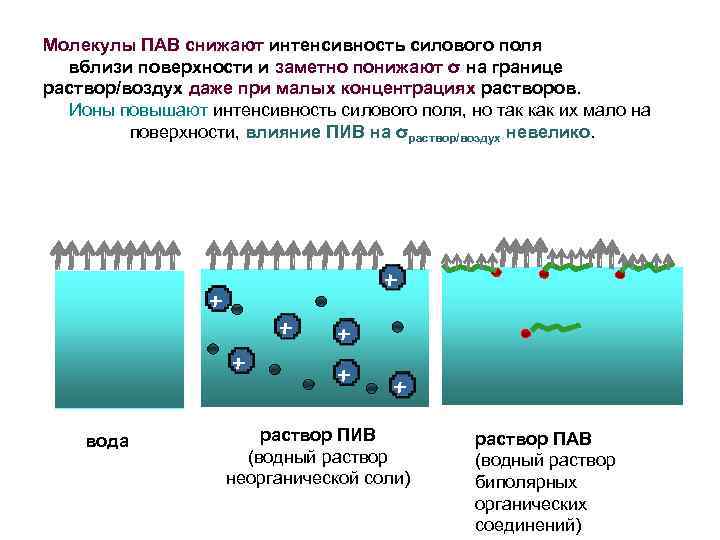
Молекулы ПАВ снижают интенсивность силового поля вблизи поверхности и заметно понижают σ на границе раствор/воздух даже при малых концентрациях растворов. Ионы повышают интенсивность силового поля, но так как их мало на поверхности, влияние ПИВ на σраствор/воздух невелико. вода раствор ПИВ (водный раствор неорганической соли) раствор ПАВ (водный раствор биполярных органических соединений)

Правило Дюкло – Траубе (эмпирическое) Поверхностная активность в гомологическом ряду жирных кислот, аминов, спиртов возрастает в 3, 2 раза при переходе к каждому следующему гомологу: (18) Существует иная формулировка правила Дюкло–Траубе: возрастание длины цепи молекулы ПАВ в арифметической прогрессии приводит к увеличению её поверхностной активности в геометрической прогрессии. Правило Дюкло–Траубе выполняется при следующих условиях: 1. При комнатной температуре. 2. При малых концентрациях ПАВ. 3. Только для полярных растворителей. В случае неполярных растворителей, правило становится обратным: с увеличением углеводородной цепи поверхностная активность падает в 3, 2 раза при переходе к каждому последующему гомологу. 4. Правило соблюдается только для ПАВ с небольшой длиной углеводородного радикала R. (до nc ≤ 10) Рис. 9 Изотермы адсорбции для двух соседних членов гомологического ряда: кривая 1 – (n); 2 – (n+1)
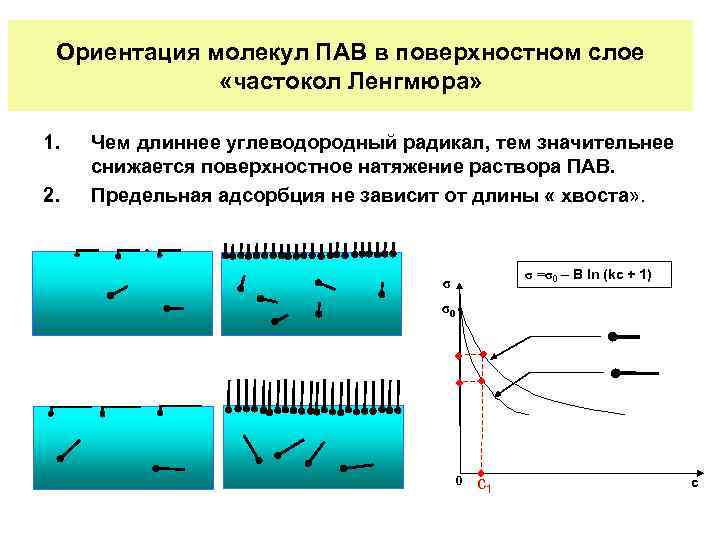
Ориентация молекул ПАВ в поверхностном слое «частокол Ленгмюра» 1. 2. Чем длиннее углеводородный радикал, тем значительнее снижается поверхностное натяжение раствора ПАВ. Предельная адсорбция не зависит от длины « хвоста» . σ =σ0 – В ln (kc + 1) σ σ0 ∙ 0 с1 с
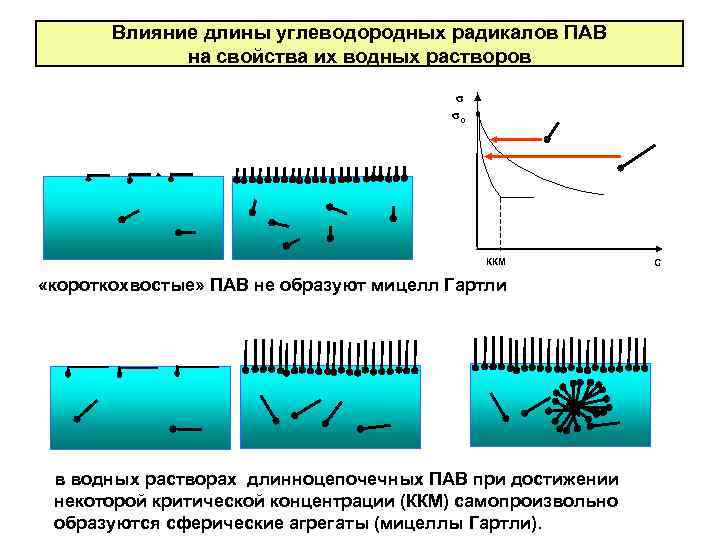
Влияние длины углеводородных радикалов ПАВ на свойства их водных растворов σ σо ККМ «короткохвостые» ПАВ не образуют мицелл Гартли в водных растворах длинноцепочечных ПАВ при достижении некоторой критической концентрации (ККМ) самопроизвольно образуются сферические агрегаты (мицеллы Гартли). С
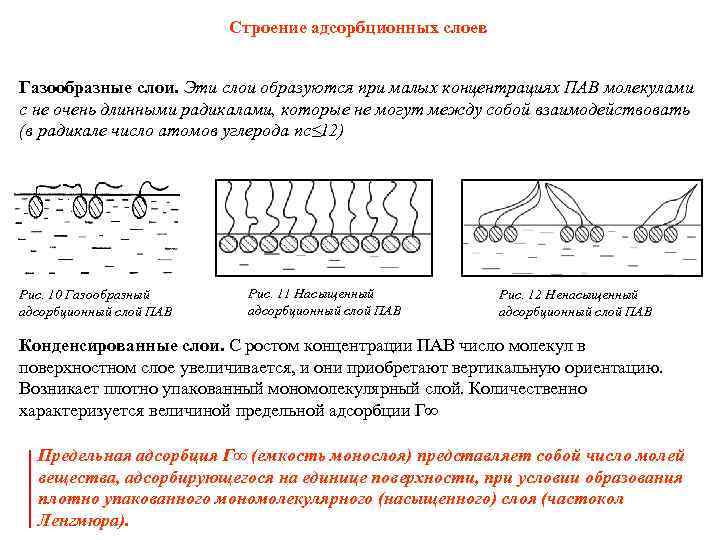
Строение адсорбционных слоев Газообразные слои. Эти слои образуются при малых концентрациях ПАВ молекулами с не очень длинными радикалами, которые не могут между собой взаимодействовать (в радикале число атомов углерода nс≤ 12) Рис. 10 Газообразный адсорбционный слой ПАВ Рис. 11 Насыщенный адсорбционный слой ПАВ Рис. 12 Ненасыщенный адсорбционный слой ПАВ Конденсированные слои. С ростом концентрации ПАВ число молекул в поверхностном слое увеличивается, и они приобретают вертикальную ориентацию. Возникает плотно упакованный мономолекулярный слой. Количественно характеризуется величиной предельной адсорбции Г∞ Предельная адсорбция Г∞ (емкость монослоя) представляет собой число молей вещества, адсорбирующегося на единице поверхности, при условии образования плотно упакованного мономолекулярного (насыщенного) слоя (частокол Ленгмюра).

Определение размеров молекул ПАВ В насыщенном адсорбционном слое молекулы плотно упакованы и имеют вертикальную ориентацию, параметры такого адсорбционного слоя можно отождествить с размерами молекулы ПАВ, то есть считать площадь, занимаемую каждой молекулой, равной площади самой молекулы S 0, а толщину адсорбционного слоя – длине молекулы δ (рис. 10) Площадь молекулы S 0 (посадочную площадку молекулы) рассчитывают, зная величину Г∞, по формуле: Рис. 10 Размеры молекулы ПАВ Длина молекулы (толщина адсорбционного слоя) (19) (20) где NA – число Авогадро. (21) где М – молекулярная масса поверхностно-активного вещества; ρ – плотность поверхностно-активного вещества.
неполярный углеводородный полярная радикал группа

Практическое значение поверхностно-активных веществ – наиболее распространенный синтетический продукт химической промышленности. 2. Ассортимент ПАВ – тысячи наименований. Цена до 300$ за 1 кг 1. Производство ПАВ 3. Они обладают особыми свойствами – производство и использование ПАВ определяется их биоразлагаемость. Они находят широкое применение в народном хозяйстве. Поверхностно-активные вещества при адсорбции на поверхности могут радикально изменять ее свойства и тем самым менять течение процессов, происходящих на границе раздела фаз. 1) Уменьшение поверхностного натяжения на межфазных границах способствует понижению прочности материалов при дроблении и резании, добыче нефти, бурении. 2) Возможность тонкого регулирования условий смачивания поверхностей. 3) Модифицирование поверхности, то есть нанесение на нее прочно закрепленного адсорбционного слоя, применяется для изменения свойств наполнителей резин, синтетических полимеров. 4) Придание гидрофобности поверхности путем введения ПАВ используется для предотвращения слеживания удобрений, защиты металлов от коррозии. При обработке растений ядохимикатами необходима гидрофилизация листьев поверхностно-активными веществами. 5) ПАВ широко применяются как моющие средства (детергенты). К основным потребителям ПАВ относятся: 1) горнодобывающая, металлообрабатывающая и перерабатывающая промышленности (добыча нефти, ) 2) флотационное обогащение руд и транспорт (смазки, смазочно-охлаждающие жидкости – СОЖ) промышленность полимерных материалов (пластификаторы, активаторы, наполнители), строительная, пищевая, парфюмерия, фармацевтическая, полиграфическая и др. 3)

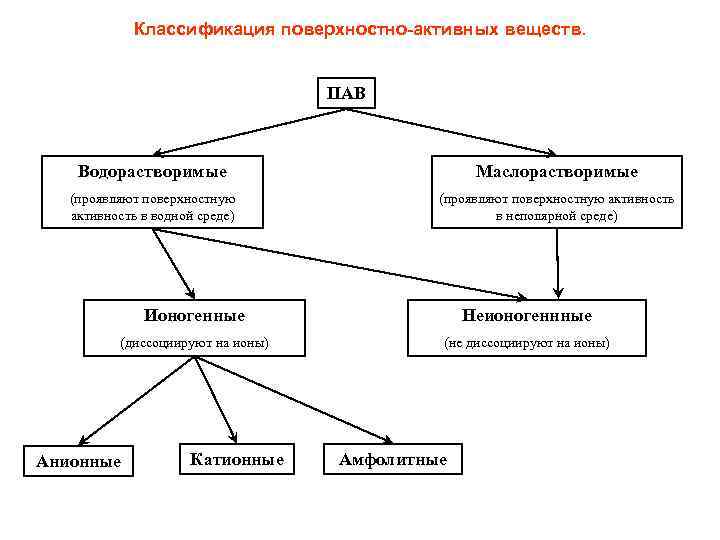
Классификация поверхностно-активных веществ. ПАВ Водорастворимые Маслорастворимые (проявляют поверхностную активность в водной среде) (проявляют поверхностную активность в неполярной среде) Ионогенные Неионогеннные (диссоциируют на ионы) (не диссоциируют на ионы) Анионные Катионные Амфолитные
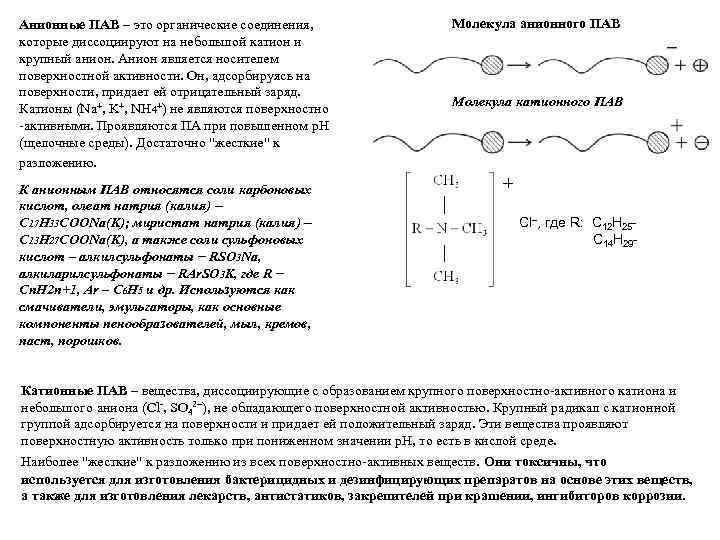
Анионные ПАВ – это органические соединения, которые диссоциируют на небольшой катион и крупный анион. Анион является носителем поверхностной активности. Он, адсорбируясь на поверхности, придает ей отрицательный заряд. Катионы (Na+, K+, NH 4+) не являются поверхностно -активными. Проявляются ПА при повышенном p. H (щелочные среды). Достаточно "жесткие" к разложению. К анионным ПАВ относятся соли карбоновых кислот, олеат натрия (калия) C 17 H 33 COONa(K); миристат натрия (калия) C 13 H 27 COONa(K), а также соли сульфоновых кислот – алкилсульфонаты RSO 3 Na, алкиларилсульфонаты RAr. SO 3 K, где R Cn. H 2 n+1, Ar – C 6 H 5 и др. Используются как смачиватели, эмульгаторы, как основные компоненты пенообразователей, мыл, кремов, паст, порошков. Молекула анионного ПАВ Молекула катионного ПАВ + Сl–, где R: С 12 Н 25 С 14 Н 29 - Катионные ПАВ – вещества, диссоциирующие с образованием крупного поверхностно-активного катиона и небольшого аниона (Cl-, SO 42 ), не обладающего поверхностной активностью. Крупный радикал с катионной группой адсорбируется на поверхности и придает ей положительный заряд. Эти вещества проявляют поверхностную активность только при пониженном значении p. H, то есть в кислой среде. Наиболее "жесткие" к разложению из всех поверхностно-активных веществ. Они токсичны, что используется для изготовления бактерицидных и дезинфицирующих препаратов на основе этих веществ, а также для изготовления лекарств, антистатиков, закрепителей при крашении, ингибиторов коррозии.
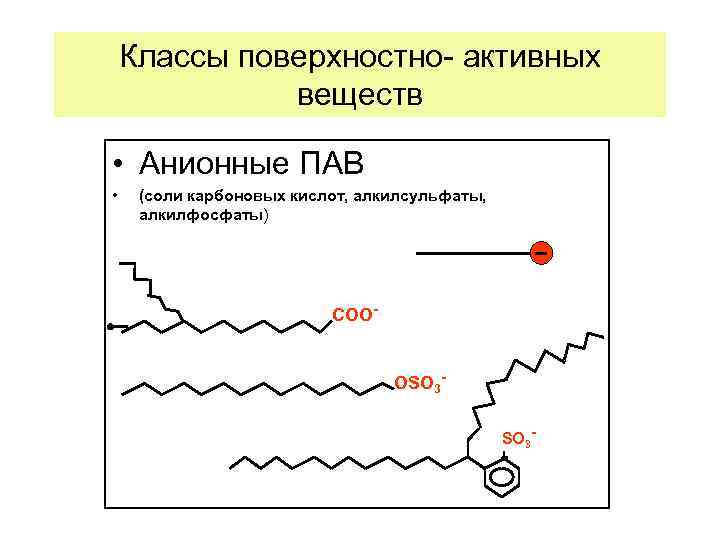
Классы поверхностно- активных веществ • Анионные ПАВ • (соли карбоновых кислот, алкилсульфаты, алкилфосфаты) COOОSO 3 -
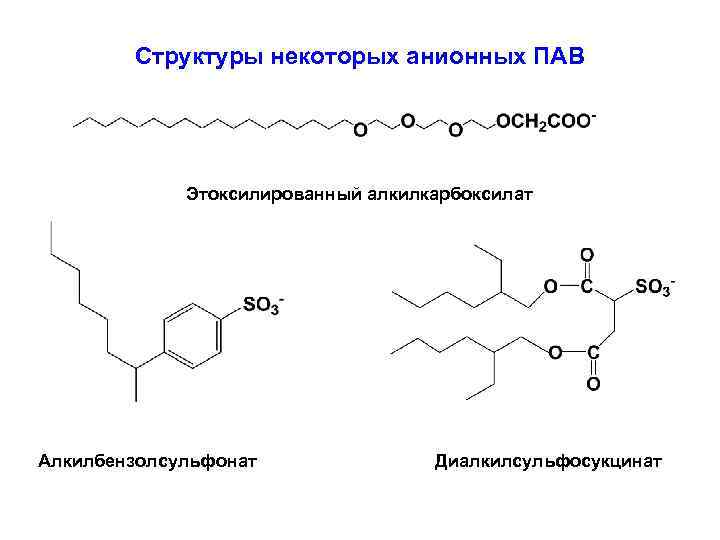
Структуры некоторых анионных ПАВ Этоксилированный алкилкарбоксилат Алкилбензолсульфонат Диалкилсульфосукцинат
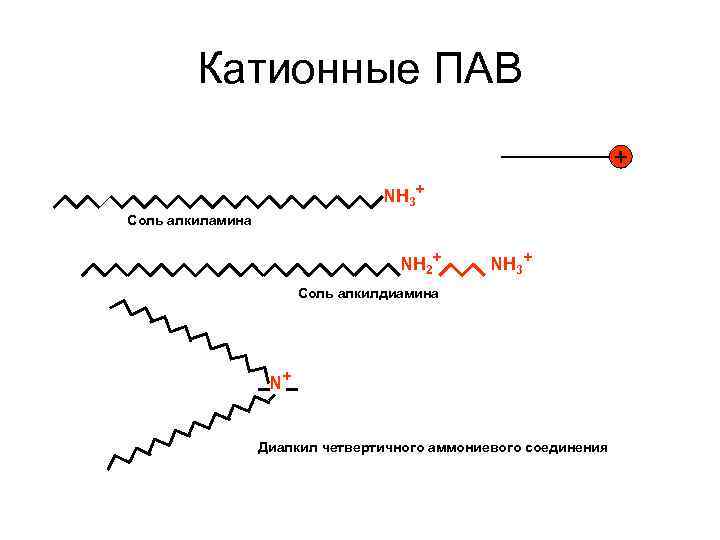
Катионные ПАВ NH 3+ Соль алкиламина NH 2+ NH 3+ Соль алкилдиамина N+ Диалкил четвертичного аммониевого соединения
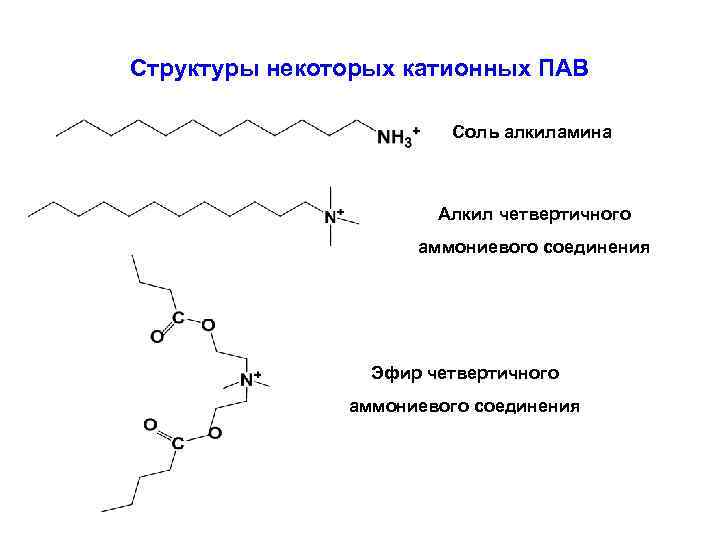
Структуры некоторых катионных ПАВ Соль алкиламина Алкил четвертичного аммониевого соединения Эфир четвертичного аммониевого соединения
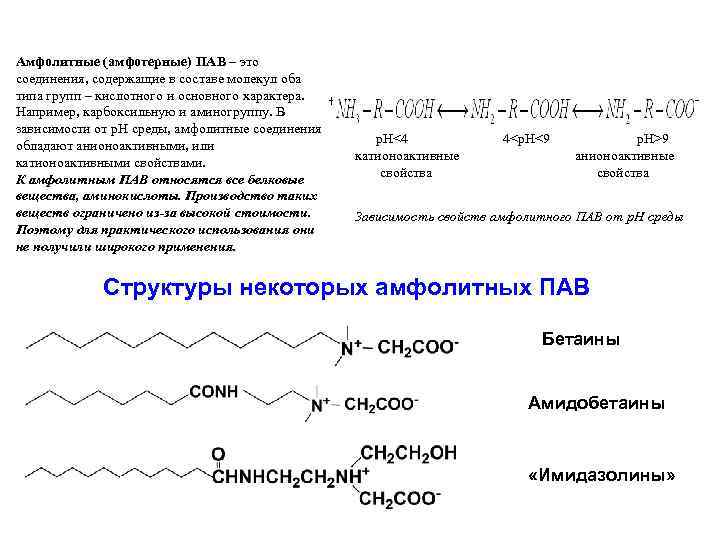
Амфолитные (амфотерные) ПАВ – это соединения, содержащие в составе молекул оба типа групп – кислотного и основного характера. Например, карбоксильную и аминогруппу. В зависимости от р. Н среды, амфолитные соединения обладают анионоактивными, или катионоактивными свойствами. К амфолитным ПАВ относятся все белковые вещества, аминокислоты. Производство таких веществ ограничено из-за высокой стоимости. Поэтому для практического использования они не получили широкого применения. p. H<4 катионоактивные cвойства 4<p. H<9 p. H>9 анионоактивные cвойства Зависимость свойств амфолитного ПАВ от p. H среды Структуры некоторых амфолитных ПАВ Бетаины Амидобетаины «Имидазолины»
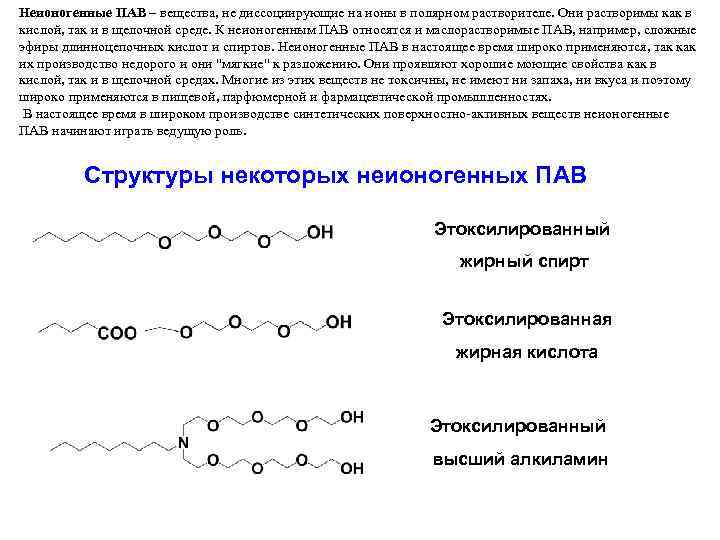
Неионогенные ПАВ – вещества, не диссоциирующие на ионы в полярном растворителе. Они растворимы как в кислой, так и в щелочной среде. К неионогенным ПАВ относятся и маслорастворимые ПАВ, например, сложные эфиры длинноцепочных кислот и спиртов. Неионогенные ПАВ в настоящее время широко применяются, так как их производство недорого и они "мягкие" к разложению. Они проявляют хорошие моющие свойства как в кислой, так и в щелочной средах. Многие из этих веществ не токсичны, не имеют ни запаха, ни вкуса и поэтому широко применяются в пищевой, парфюмерной и фармацевтической промышленностях. В настоящее время в широком производстве синтетических поверхностно-активных веществ неионогенные ПАВ начинают играть ведущую роль. Структуры некоторых неионогенных ПАВ Этоксилированный жирный спирт Этоксилированная жирная кислота Этоксилированный высший алкиламин
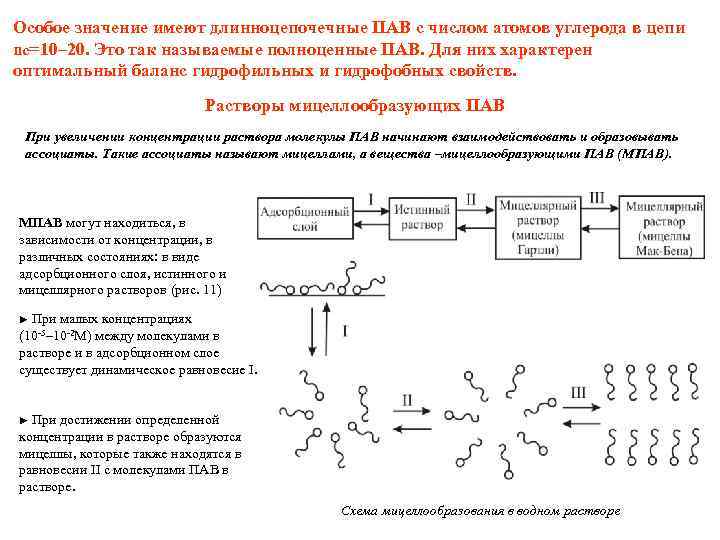
Особое значение имеют длинноцепочечные ПАВ с числом атомов углерода в цепи nc=10– 20. Это так называемые полноценные ПАВ. Для них характерен оптимальный баланс гидрофильных и гидрофобных свойств. Растворы мицеллообразующих ПАВ При увеличении концентрации раствора молекулы ПАВ начинают взаимодействовать и образовывать ассоциаты. Такие ассоциаты называют мицеллами, а вещества –мицеллообразующими ПАВ (МПАВ). МПАВ могут находиться, в зависимости от концентрации, в различных состояниях: в виде адсорбционного слоя, истинного и мицеллярного растворов (рис. 11) ► При малых концентрациях между молекулами в растворе и в адсорбционном слое существует динамическое равновесие I. (10 -5– 10 -2 М) ► При достижении определенной концентрации в растворе образуются мицеллы, которые также находятся в равновесии II с молекулами ПАВ в растворе. Схема мицеллообразования в водном растворе
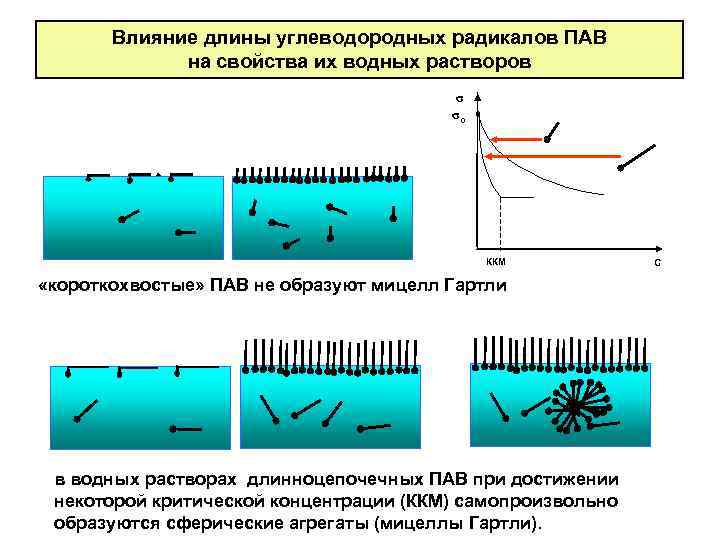
Влияние длины углеводородных радикалов ПАВ на свойства их водных растворов σ σо ККМ «короткохвостые» ПАВ не образуют мицелл Гартли в водных растворах длинноцепочечных ПАВ при достижении некоторой критической концентрации (ККМ) самопроизвольно образуются сферические агрегаты (мицеллы Гартли). С
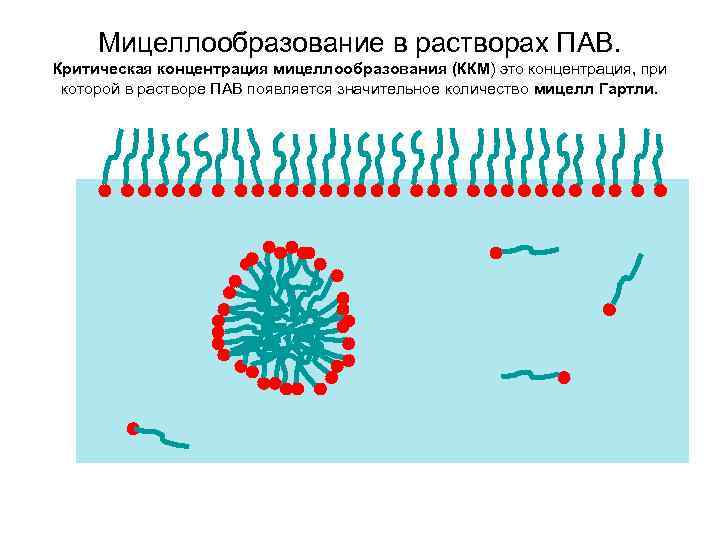
Мицеллообразование в растворах ПАВ. Критическая концентрация мицеллообразования (ККМ) это концентрация, при которой в растворе ПАВ появляется значительное количество мицелл Гартли.
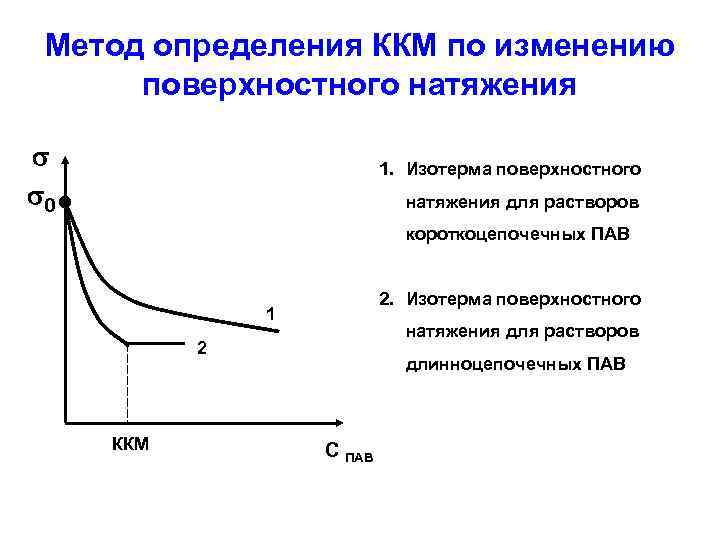
Метод определения ККМ по изменению поверхностного натяжения 0 1. Изотерма поверхностного натяжения для растворов короткоцепочечных ПАВ 2. Изотерма поверхностного 1 натяжения для растворов 2 ККМ длинноцепочечных ПАВ С ПАВ
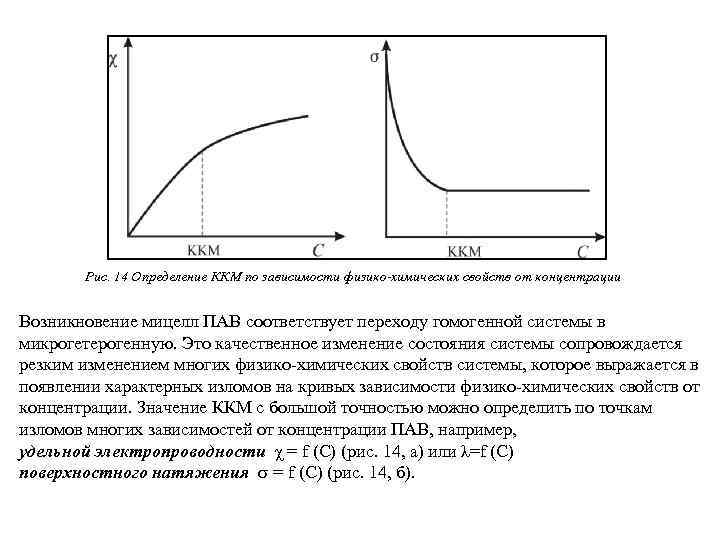
Рис. 14 Определение ККМ по зависимости физико-химических свойств от концентрации Возникновение мицелл ПАВ соответствует переходу гомогенной системы в микрогетерогенную. Это качественное изменение состояния системы сопровождается резким изменением многих физико-химических свойств системы, которое выражается в появлении характерных изломов на кривых зависимости физико-химических свойств от концентрации. Значение ККМ с большой точностью можно определить по точкам изломов многих зависимостей от концентрации ПАВ, например, удельной электропроводности χ = f (С) (рис. 14, а) или λ=f (C) поверхностного натяжения = f (С) (рис. 14, б).
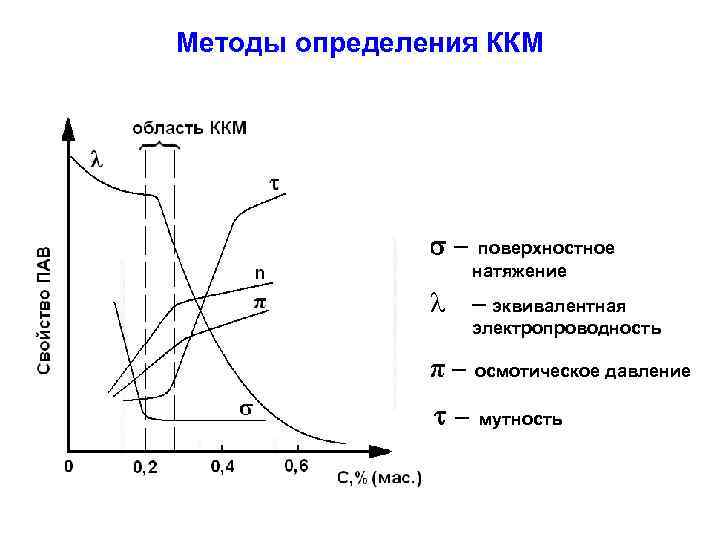
Методы определения ККМ – поверхностное натяжение l – эквивалентная электропроводность π– осмотическое давление – мутность

Способностью к мицеллообразованию обладают не все длинноцепочечные ПАВ, а только те, которые имеют определенные соотношения между гидрофобной (углеводородный радикал) и гидрофильной (полярная группа) частями. Это соотношение количественно определяется величиной гидрофильно-липофильного баланса (ГЛБ). Числа ГЛБ характеризуют соотношение действия воды и масла на молекулы ПАВ и определяют способность молекул к мицеллообразованию. Числа ГЛБ можно рассчитать по методу групповых чисел. Он основан на вкладе различных групп в общий гидрофильно-липофильный баланс молекулы: ГЛБПАВ = 7 + Σ (ГЛБ)г – Σ (ГЛБ)л или ГЛБ = 7 + ΣNi (21) где Σ (ГЛБ)г – сумма ГЛБ всех гидрофильных групп; Σ (ГЛБ)л – сумма ГЛБ всех липофильных (гидрофобных) групп. Суммирование ведется с учетом знака группового числа Ni. Он положителен для гидрофильных групп и отрицателен – для липофильных. Чем выше число ГЛБ, тем больше баланс сдвинут в сторону гидрофильных (полярных) свойств ПАВ. Для мицеллообразующих ПАВ необходимо, чтобы обе части были достаточно ярко выражены. Существует понятие критической концентрации мицеллообразования (ККМ). Это тот концентрационный предел, выше которого в растворе уже присутствует экспериментально фиксируемое количество мицелл. Если концентрация ПАВ превышает ККМ в 40– 50 раз, то мицеллы вместе с молекулами растворителя образуют жидкокристаллическую структуру, которая постепенно через гелеобразную переходит в твердокристаллическую.
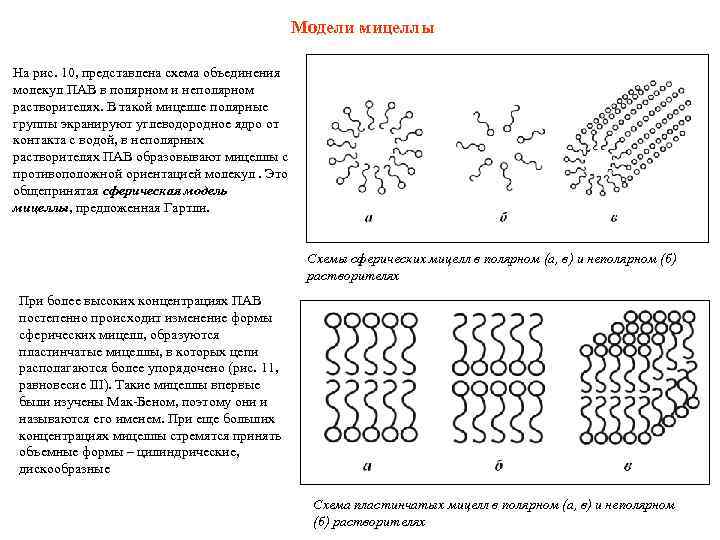
Модели мицеллы На рис. 10, представлена схема объединения молекул ПАВ в полярном и неполярном растворителях. В такой мицелле полярные группы экранируют углеводородное ядро от контакта с водой, в неполярных растворителях ПАВ образовывают мицеллы с противоположной ориентацией молекул. Это общепринятая сферическая модель мицеллы, предложенная Гартли. Схемы сферических мицелл в полярном (а, в) и неполярном (б) растворителях При более высоких концентрациях ПАВ постепенно происходит изменение формы сферических мицелл, образуются пластинчатые мицеллы, в которых цепи располагаются более упорядочено (рис. 11, равновесие III). Такие мицеллы впервые были изучены Мак-Беном, поэтому они и называются его именем. При еще больших концентрациях мицеллы стремятся принять объемные формы – цилиндрические, дискообразные Схема пластинчатых мицелл в полярном (а, в) и неполярном (б) растворителях
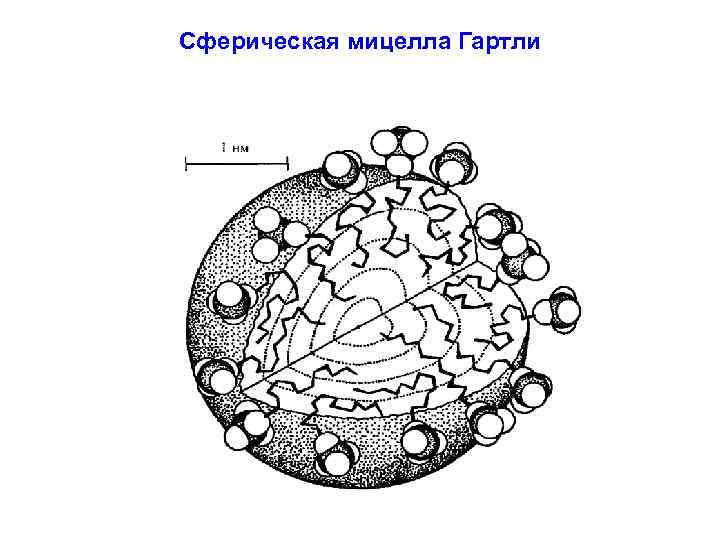
Сферическая мицелла Гартли

Вид ламелярных жидкокристаллических фаз
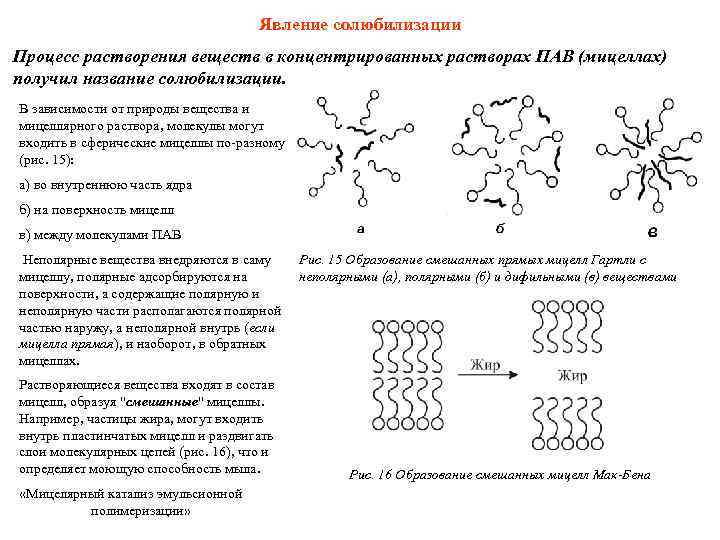
Явление солюбилизации Процесс растворения веществ в концентрированных растворах ПАВ (мицеллах) получил название солюбилизации. В зависимости от природы вещества и мицеллярного раствора, молекулы могут входить в сферические мицеллы по-разному (рис. 15): a) во внутреннюю часть ядра б) на поверхность мицелл в) между молекулами ПАВ Неполярные вещества внедряются в саму мицеллу, полярные адсорбируются на поверхности, а содержащие полярную и неполярную части располагаются полярной частью наружу, а неполярной внутрь (если мицелла прямая), и наоборот, в обратных мицеллах. Растворяющиеся вещества входят в состав мицелл, образуя "смешанные" мицеллы. Например, частицы жира, могут входить внутрь пластинчатых мицелл и раздвигать слои молекулярных цепей (рис. 16), что и определяет моющую способность мыла. «Мицелярный катализ эмульсионной полимеризации» Рис. 15 Образование смешанных прямых мицелл Гартли с неполярными (а), полярными (б) и дифильными (в) веществами Рис. 16 Образование смешанных мицелл Мак-Бена

Мицеллообразование в растворах ПАВ

Биконтинуальная структура ПАВ
4-5 л Общая характеристика адсорбции. ПАВ.ppt