L_5-6_PZ_i_Stroenie_atoma_ch1.ppt
- Количество слайдов: 179
 Адрес в интернет Vanyo. ru/margo
Адрес в интернет Vanyo. ru/margo
 Лекции 3 -4 Периодический закон Строение атома
Лекции 3 -4 Периодический закон Строение атома
 • В середине 19 века было известно около 60 химических элементов. • К этому времени были описаны свойства некоторых из них, а также их соединений. • Однако не существовало четкой классификации элементов, не было установлено от чего зависят свойства элементов.
• В середине 19 века было известно около 60 химических элементов. • К этому времени были описаны свойства некоторых из них, а также их соединений. • Однако не существовало четкой классификации элементов, не было установлено от чего зависят свойства элементов.
 Попытки систематизации элементов
Попытки систематизации элементов
 Закон триад Начало 19 века Дж. Дальтон (основатель атомистики) ввел важнейшую характеристику элементов – атомный вес (позже атомная масса). Это понятие позволило изучать и определять важнейшую характеристику – количественный состав простых и сложных тел. Первым, кто применил количественные характеристики элементов был немецкий ученый Иоганн Вольфганг Деберейнер (1780 – 1849).
Закон триад Начало 19 века Дж. Дальтон (основатель атомистики) ввел важнейшую характеристику элементов – атомный вес (позже атомная масса). Это понятие позволило изучать и определять важнейшую характеристику – количественный состав простых и сложных тел. Первым, кто применил количественные характеристики элементов был немецкий ученый Иоганн Вольфганг Деберейнер (1780 – 1849).
 В 1829 г он опубликовал таблицу, в которой в группы по 3 элемента объединялись элементы со сходными свойствами. Помимо химического сходства наблюдается и закономерность в отношении масс атомов. пример: 7 Li, 23 Na, 39 K; 40 Ca, 88 Sr, 137 Ba Закон триад: атомная масса среднего элемента равна среднему арифметическому атомных масс двух крайних элементов Ar(Na)= (Ar(Li)+ Ar(K))/2=(7+39)/2=23
В 1829 г он опубликовал таблицу, в которой в группы по 3 элемента объединялись элементы со сходными свойствами. Помимо химического сходства наблюдается и закономерность в отношении масс атомов. пример: 7 Li, 23 Na, 39 K; 40 Ca, 88 Sr, 137 Ba Закон триад: атомная масса среднего элемента равна среднему арифметическому атомных масс двух крайних элементов Ar(Na)= (Ar(Li)+ Ar(K))/2=(7+39)/2=23
 Позднее ученые Макс Петтенкофер (1850) и Жан Батист Дюма (1857) объединили большее число элементов в триады.
Позднее ученые Макс Петтенкофер (1850) и Жан Батист Дюма (1857) объединили большее число элементов в триады.
 Винтовая линия Шанкартуа 1862 г. французский ученый Александр Эмиль Бетье де Шанкуртуа предложил систему элементов в виде графика. Он разместил все известные элементы в порядке увеличения массы атомов по винтовой линии, описанной вокруг цилиндра. Сходные элементы располагались друг под другом. Однако эта схема не получила конкретного анализа и развития, не указывала точное место элемента в системе.
Винтовая линия Шанкартуа 1862 г. французский ученый Александр Эмиль Бетье де Шанкуртуа предложил систему элементов в виде графика. Он разместил все известные элементы в порядке увеличения массы атомов по винтовой линии, описанной вокруг цилиндра. Сходные элементы располагались друг под другом. Однако эта схема не получила конкретного анализа и развития, не указывала точное место элемента в системе.
 Спиральное расположение элементов Шанкуртуа
Спиральное расположение элементов Шанкуртуа
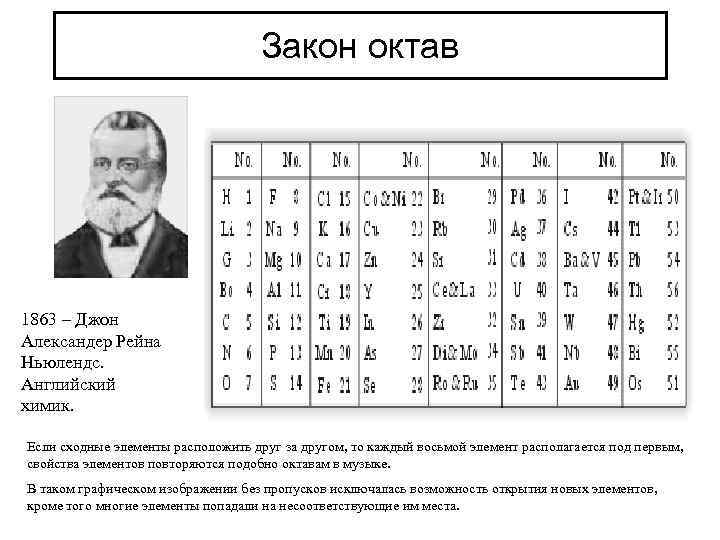 Закон октав 1863 – Джон Александер Рейна Ньюлендс. Английский химик. Если сходные элементы расположить друг за другом, то каждый восьмой элемент располагается под первым, свойства элементов повторяются подобно октавам в музыке. В таком графическом изображении без пропусков исключалась возможность открытия новых элементов, кроме того многие элементы попадали на несоответствующие им места.
Закон октав 1863 – Джон Александер Рейна Ньюлендс. Английский химик. Если сходные элементы расположить друг за другом, то каждый восьмой элемент располагается под первым, свойства элементов повторяются подобно октавам в музыке. В таком графическом изображении без пропусков исключалась возможность открытия новых элементов, кроме того многие элементы попадали на несоответствующие им места.
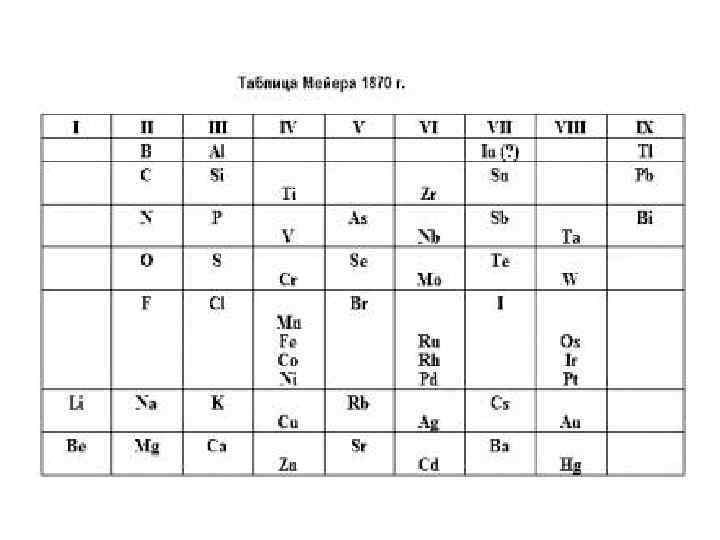
 Таблица Мейера 1864 – немецкий ученый Юлиус Лотар Мейер Расположил 44 элемента из известных 62 -х в шести столбцах в соответствии с их валентностью по водороду. Однако эта таблица не отражала периодичности свойств. В 1870 г. статья «Природа химических элементов как функция их атомных весов» , приведена графическая зависимость атомных объемов от атомных масс (кривая Мейера).
Таблица Мейера 1864 – немецкий ученый Юлиус Лотар Мейер Расположил 44 элемента из известных 62 -х в шести столбцах в соответствии с их валентностью по водороду. Однако эта таблица не отражала периодичности свойств. В 1870 г. статья «Природа химических элементов как функция их атомных весов» , приведена графическая зависимость атомных объемов от атомных масс (кривая Мейера).
 1893 -1898 – английский ученый Уильям Рамзай открыл сначала инертный газ аргон, а позже и остальные.
1893 -1898 – английский ученый Уильям Рамзай открыл сначала инертный газ аргон, а позже и остальные.
 Закон Мозли Однако несмотря на огромное естественнонаучное значение открытия периодического закона физический смысл обобщенных Д. И. Менделеевым фактов долгое время оставался непонятным (из-за отсутствия в 19 веке какихлибо представлений о сложности строения атома). Например, почему элемент калий(А=39, 1) в таблице находится после аргона (А=39, 9); никель (58, 7) после кобальта (58, 9); йод(126, 9) после теллура (127, 6). Менделеев отступил от принятого им порядка, исходя из свойств данных элементов, требовавших именно такого расположения. Таким образом он не придавал исключительного значения атомной массе, а руководствовался совокупностью свойств. Развитие теории строения атома доказало верность размещения этих элементов.
Закон Мозли Однако несмотря на огромное естественнонаучное значение открытия периодического закона физический смысл обобщенных Д. И. Менделеевым фактов долгое время оставался непонятным (из-за отсутствия в 19 веке какихлибо представлений о сложности строения атома). Например, почему элемент калий(А=39, 1) в таблице находится после аргона (А=39, 9); никель (58, 7) после кобальта (58, 9); йод(126, 9) после теллура (127, 6). Менделеев отступил от принятого им порядка, исходя из свойств данных элементов, требовавших именно такого расположения. Таким образом он не придавал исключительного значения атомной массе, а руководствовался совокупностью свойств. Развитие теории строения атома доказало верность размещения этих элементов.
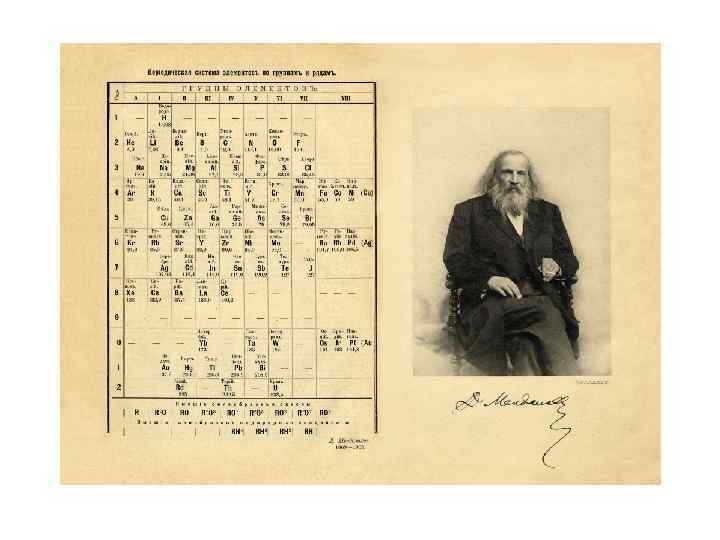
 Периодический закон и его графическое отображение 1869 – русский ученый Д. И. Менделеев открыл периодический закон и опубликовал свой первый вариант периодической системы химических элементов «Опыт системы элементов основанный на их атомном весе и химическом сходстве» . В этом первоначальном варианте таблицы многое было неясно, требовало уточнений и изменений. На протяжении 37 лет Менделеев продолжает творческую разработку таблицы. Д. И. Менделеев неоднократно подчеркивал значение тех трудов, которые побуждали его к исканиям: «…Я пользовался прежними исследованиями Дюма, Гладстона, еттенкофера, Кремерса и Ленссена» «Я считаю, что обязан преимущественно двум: Ленссену и Дюма. Я изучил их исследования и они побудили меня искать действительный закон» Д. И. Менделеев. Собр. со. ч. , т. 2, 1934, стр. 288 и 321
Периодический закон и его графическое отображение 1869 – русский ученый Д. И. Менделеев открыл периодический закон и опубликовал свой первый вариант периодической системы химических элементов «Опыт системы элементов основанный на их атомном весе и химическом сходстве» . В этом первоначальном варианте таблицы многое было неясно, требовало уточнений и изменений. На протяжении 37 лет Менделеев продолжает творческую разработку таблицы. Д. И. Менделеев неоднократно подчеркивал значение тех трудов, которые побуждали его к исканиям: «…Я пользовался прежними исследованиями Дюма, Гладстона, еттенкофера, Кремерса и Ленссена» «Я считаю, что обязан преимущественно двум: Ленссену и Дюма. Я изучил их исследования и они побудили меня искать действительный закон» Д. И. Менделеев. Собр. со. ч. , т. 2, 1934, стр. 288 и 321

 Формулировка периодического закона Д. И Менделеева 1869 г Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Формулировка периодического закона Д. И Менделеева 1869 г Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
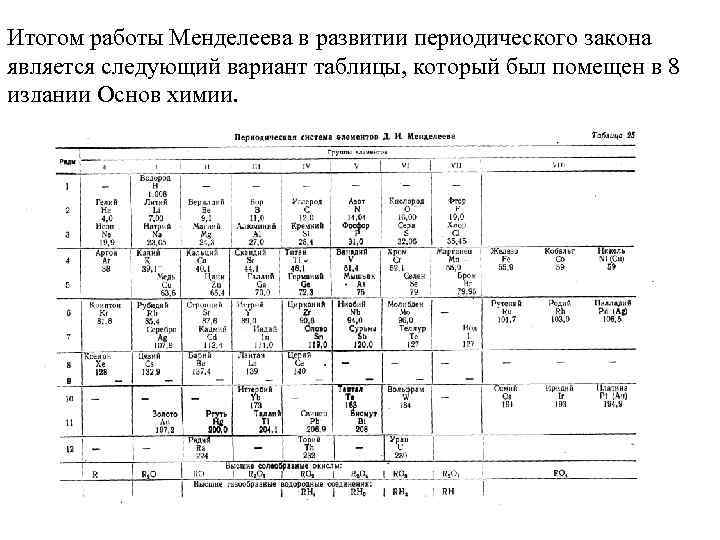 Итогом работы Менделеева в развитии периодического закона является следующий вариант таблицы, который был помещен в 8 издании Основ химии.
Итогом работы Менделеева в развитии периодического закона является следующий вариант таблицы, который был помещен в 8 издании Основ химии.
 Значение периодического закона Периодическая система элементов явилась одним из наиболее ценных обобщений в химии. Она представляет собой как бы конспект химии всех элементов, график по которому можно читать свойства элементов и их соединений. Система позволила уточнить положение, величины атомных масс, значение валентности некоторых элементов. На основе таблицы можно было предсказать существование и свойства еще не открытых элементов. Менделеев предсказал и описал свойства не открытых в то время элементов, которые он назвал экабор (скандий), экаалюминий (галий), экасилиций (германий).
Значение периодического закона Периодическая система элементов явилась одним из наиболее ценных обобщений в химии. Она представляет собой как бы конспект химии всех элементов, график по которому можно читать свойства элементов и их соединений. Система позволила уточнить положение, величины атомных масс, значение валентности некоторых элементов. На основе таблицы можно было предсказать существование и свойства еще не открытых элементов. Менделеев предсказал и описал свойства не открытых в то время элементов, которые он назвал экабор (скандий), экаалюминий (галий), экасилиций (германий).
 Открытия, позволившие развить периодический закон 1875 – французкий ученый П. Э. Лекок де Буабодран открыл новый элемент галий.
Открытия, позволившие развить периодический закон 1875 – французкий ученый П. Э. Лекок де Буабодран открыл новый элемент галий.
 1879 – шведский ученый Ларс Фредерик Нильсон окрыл новый элемент скандий. 1886 – немецкий ученый Клеменс Александр Винклер –открыл элемент германий. германиевый диод
1879 – шведский ученый Ларс Фредерик Нильсон окрыл новый элемент скандий. 1886 – немецкий ученый Клеменс Александр Винклер –открыл элемент германий. германиевый диод
 Менделеев сформулировал периодический закон и предложил его графическое отображение, однако в то время нельзя было определить природу периодичности. Не была вскрыта причина периодичности изменения свойств и их соединений. Смысл периодического закона был выявлен позднее, в связи с открытиями по строению атома.
Менделеев сформулировал периодический закон и предложил его графическое отображение, однако в то время нельзя было определить природу периодичности. Не была вскрыта причина периодичности изменения свойств и их соединений. Смысл периодического закона был выявлен позднее, в связи с открытиями по строению атома.
 Современная формулировка П. З. • Свойства атомов химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядер их атомов.
Современная формулировка П. З. • Свойства атомов химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядер их атомов.
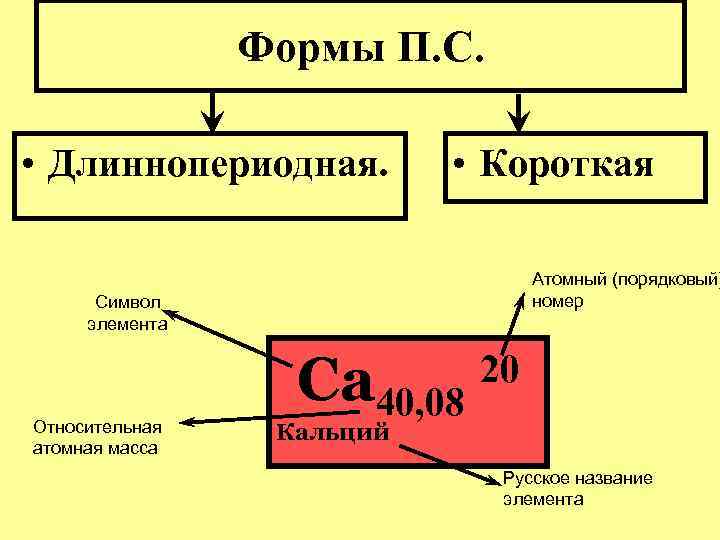 Формы П. С. • Длиннопериодная. • Короткая Атомный (порядковый) номер Символ элемента Относительная атомная масса Са 40, 08 20 Кальций Русское название элемента
Формы П. С. • Длиннопериодная. • Короткая Атомный (порядковый) номер Символ элемента Относительная атомная масса Са 40, 08 20 Кальций Русское название элемента
 Период • Период –горизонтальный ряд, элементов, расположенных в порядке возрастания порядкового номера. • Любой период (кроме 1) начинается типичным щелочным металлом и заканчивается инертным (благородным) газом.
Период • Период –горизонтальный ряд, элементов, расположенных в порядке возрастания порядкового номера. • Любой период (кроме 1) начинается типичным щелочным металлом и заканчивается инертным (благородным) газом.
 Малые периоды • Содержат • 1 -ый 2 элемента • 2 - и 3 - 8 элементов • Состоят из одного ряда
Малые периоды • Содержат • 1 -ый 2 элемента • 2 - и 3 - 8 элементов • Состоят из одного ряда
 Большие (длинные) периоды • Состоят из 2 -х рядов четного и нечетного • • Содержат 4 -5 по 18 элементов 6 -ой 32 элемента 7 -ой незавершен
Большие (длинные) периоды • Состоят из 2 -х рядов четного и нечетного • • Содержат 4 -5 по 18 элементов 6 -ой 32 элемента 7 -ой незавершен
 Группы • Группа – вертикальный ряд, объединяющий элементы, которые имеют одинаковую высшую валентность в оксидах и других соединениях. • Эта валентность равна номеру группы.
Группы • Группа – вертикальный ряд, объединяющий элементы, которые имеют одинаковую высшую валентность в оксидах и других соединениях. • Эта валентность равна номеру группы.
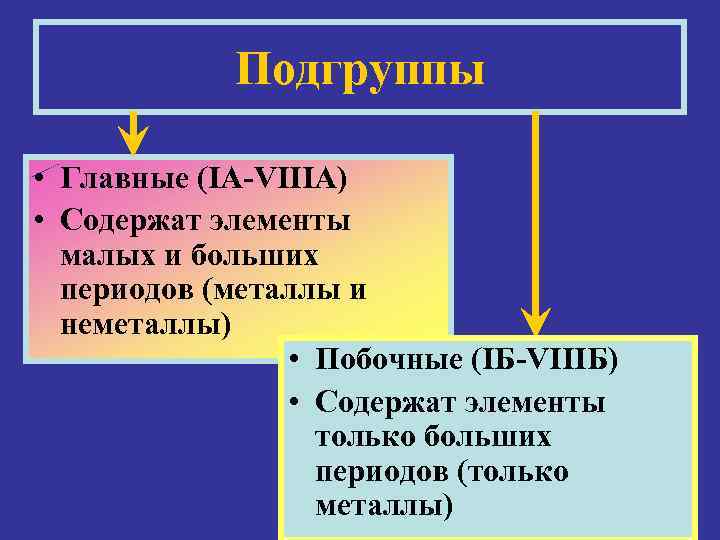 Подгруппы • Главные (IA-VIIIA) • Содержат элементы малых и больших периодов (металлы и неметаллы) • Побочные (IБ-VIIIБ) • Содержат элементы только больших периодов (только металлы)
Подгруппы • Главные (IA-VIIIA) • Содержат элементы малых и больших периодов (металлы и неметаллы) • Побочные (IБ-VIIIБ) • Содержат элементы только больших периодов (только металлы)
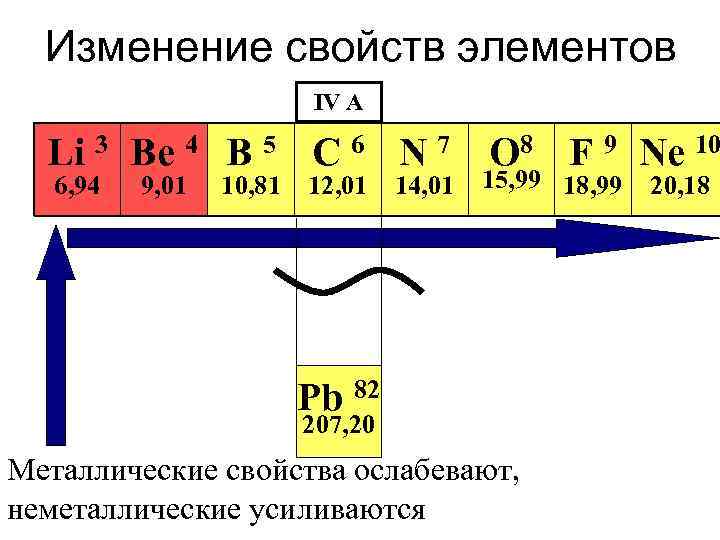 Изменение свойств элементов IV A Li 3 Be 4 B 5 C 6 N 7 O 8 F 9 Ne 10 6, 94 9, 01 10, 81 12, 01 14, 01 15, 99 18, 99 Pb 82 207, 20 Металлические свойства ослабевают, неметаллические усиливаются 20, 18
Изменение свойств элементов IV A Li 3 Be 4 B 5 C 6 N 7 O 8 F 9 Ne 10 6, 94 9, 01 10, 81 12, 01 14, 01 15, 99 18, 99 Pb 82 207, 20 Металлические свойства ослабевают, неметаллические усиливаются 20, 18
 Рентгеновские лучи (1895 г. , Вильгельм Рентген) Радиоактивность (1896 г. , Антуан Анри Беккерель) Выделение радиоактивных элементов Ra и Po (1896 г. , М. Склодовская-Кюри, П. Кюри) Открытие радиоактивного излучения (1899 г. , Э. Резерфорд- α-, ß-, П. Виллар – γ-излучение)
Рентгеновские лучи (1895 г. , Вильгельм Рентген) Радиоактивность (1896 г. , Антуан Анри Беккерель) Выделение радиоактивных элементов Ra и Po (1896 г. , М. Склодовская-Кюри, П. Кюри) Открытие радиоактивного излучения (1899 г. , Э. Резерфорд- α-, ß-, П. Виллар – γ-излучение)
 Электрон В 1874 г. Джозеф Джон Стоней предположил, что электрический ток представляет собой поток отрицательно заряженных частиц, названных им в 1891 г. электронами. Однако приоритет открытия электронов почти повсеместно признается за Джозефом Джоном Томсоном (изучение катодных лучей), так как именно он определил удельный заряд и массу электрона.
Электрон В 1874 г. Джозеф Джон Стоней предположил, что электрический ток представляет собой поток отрицательно заряженных частиц, названных им в 1891 г. электронами. Однако приоритет открытия электронов почти повсеместно признается за Джозефом Джоном Томсоном (изучение катодных лучей), так как именно он определил удельный заряд и массу электрона.
 Электрон в 1897 г. , определил удельный заряд и относительную массу электрона. На основании экспериментальных данных установил, что атомы всех элементов содержат электроны. Дж. Томсон (1856 -1940)
Электрон в 1897 г. , определил удельный заряд и относительную массу электрона. На основании экспериментальных данных установил, что атомы всех элементов содержат электроны. Дж. Томсон (1856 -1940)
 Роберт Эндрус Милликен в 1909 г. измерил заряд электрона, а также вычислил массу электрона с использованием отношения Томсона (е/m) е= -19 -1, 6· 10 mе = Kл -28 9, 1· 10 г
Роберт Эндрус Милликен в 1909 г. измерил заряд электрона, а также вычислил массу электрона с использованием отношения Томсона (е/m) е= -19 -1, 6· 10 mе = Kл -28 9, 1· 10 г
 Протон (р) В 1886 г. Гольдштейн обнаружил существование в атомах положительно заряженных частиц – протонов. Протон представляет собой атом водорода, от которого отнят один электрон: Н+ mр = 1836 · mе = -27 1, 67· 10 кг
Протон (р) В 1886 г. Гольдштейн обнаружил существование в атомах положительно заряженных частиц – протонов. Протон представляет собой атом водорода, от которого отнят один электрон: Н+ mр = 1836 · mе = -27 1, 67· 10 кг
 Подтверждение существования протона • 1899 г. Эрнст Резерфорд открыл радиоактивное альфа и бета-излучение. • Примерно в тоже время Томсон предложил модель атома, позволяющую объяснить наличие у атома «-» и «+» заряженных частей атома (модель сливового пудинга). • В 1909 Резерфорд показал, что альфаизлучение обусловлено «+» заряженными атомами гелия.
Подтверждение существования протона • 1899 г. Эрнст Резерфорд открыл радиоактивное альфа и бета-излучение. • Примерно в тоже время Томсон предложил модель атома, позволяющую объяснить наличие у атома «-» и «+» заряженных частей атома (модель сливового пудинга). • В 1909 Резерфорд показал, что альфаизлучение обусловлено «+» заряженными атомами гелия.
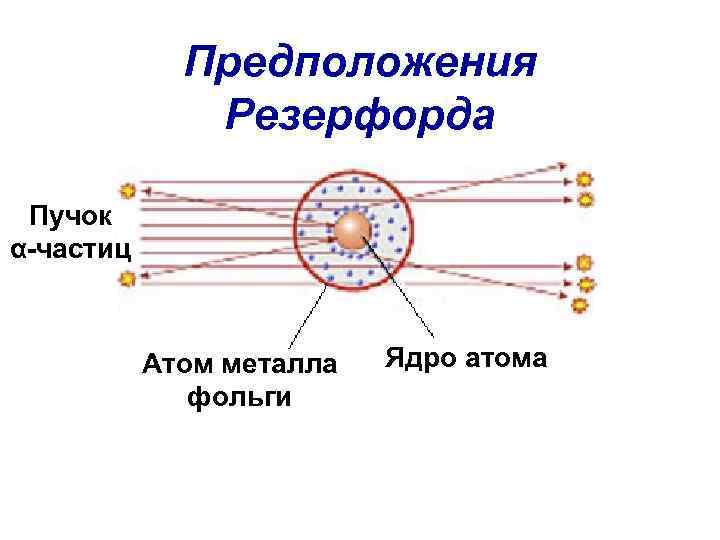 Предположения Резерфорда Пучок α-частиц Атом металла фольги Ядро атома
Предположения Резерфорда Пучок α-частиц Атом металла фольги Ядро атома
 Эрнст Резерфорд британский физик новозеландского происхождения. Известен как «отец» ядерной физики, создал планетарную модель атома. Лауреат Нобелевской премии по химии 1908 г.
Эрнст Резерфорд британский физик новозеландского происхождения. Известен как «отец» ядерной физики, создал планетарную модель атома. Лауреат Нобелевской премии по химии 1908 г.
 Текст к рисунку • 1914 г. ученые Ханс Гейгер и Эрнест Марсден установили истинную природу этих частиц, проводя опыты по бомбардировке золотой фольги альфа излучением.
Текст к рисунку • 1914 г. ученые Ханс Гейгер и Эрнест Марсден установили истинную природу этих частиц, проводя опыты по бомбардировке золотой фольги альфа излучением.
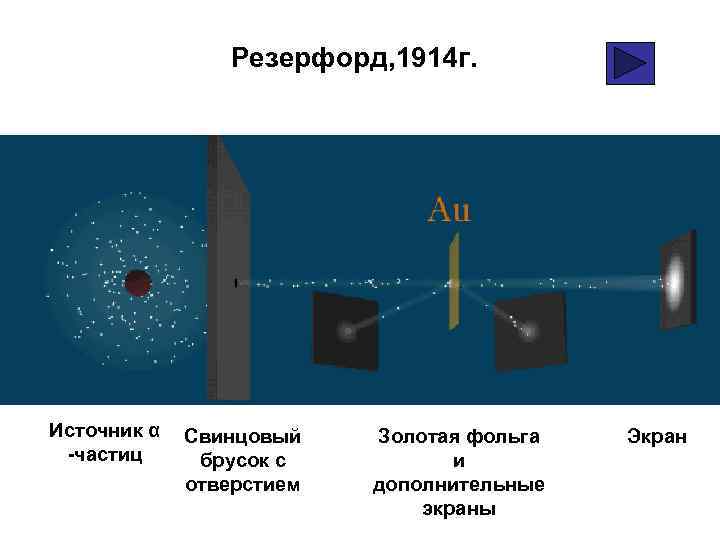 Резерфорд, 1914 г. Источник α -частиц Свинцовый брусок с отверстием Золотая фольга и дополнительные экраны Экран
Резерфорд, 1914 г. Источник α -частиц Свинцовый брусок с отверстием Золотая фольга и дополнительные экраны Экран
 Нейтрон (n). • Существование было предсказано Резерфордом в 1920 г, чтобы объяснить различие между атомной массой и атомным номером (порядковым номером). • Экспериментально обнаружен в 1932 г Дж. Чедвиком при изучении бомбардировки бериллия альфа - частицами. Бериллий испускал частицы с большой проникающей способностью, которые не отклонялись в электрическом и магнитном полях. Частица нейтральная отсюда ее название. • Позже были открыты и другие элементарные частицы мезоны, кварки, лептоны, фотоны, глюоны и т. д.
Нейтрон (n). • Существование было предсказано Резерфордом в 1920 г, чтобы объяснить различие между атомной массой и атомным номером (порядковым номером). • Экспериментально обнаружен в 1932 г Дж. Чедвиком при изучении бомбардировки бериллия альфа - частицами. Бериллий испускал частицы с большой проникающей способностью, которые не отклонялись в электрическом и магнитном полях. Частица нейтральная отсюда ее название. • Позже были открыты и другие элементарные частицы мезоны, кварки, лептоны, фотоны, глюоны и т. д.
 Характеристика элементарных частиц Наименование частицы Масса, а. е. м. * Заряд, у. е. Электрон (е) Протон (р11) 0 1 – 1 +1 Нейтрон (n 10) 1 0 *1 а. е. м. = 1, 66· 10– 27 кг
Характеристика элементарных частиц Наименование частицы Масса, а. е. м. * Заряд, у. е. Электрон (е) Протон (р11) 0 1 – 1 +1 Нейтрон (n 10) 1 0 *1 а. е. м. = 1, 66· 10– 27 кг
 Нуклоны. • Протоны и нейтроны – составляют ядро атома. • Нуклид - ядро конкретного атома (нуклид углерода – ядро атома углерода. )
Нуклоны. • Протоны и нейтроны – составляют ядро атома. • Нуклид - ядро конкретного атома (нуклид углерода – ядро атома углерода. )
 Пример • Запись нуклидов 12 С 6 14 С 6 • Т. к. все нуклиды углерода имеют атомный номер 6, то верна и другая запись 12 С - углерод 12.
Пример • Запись нуклидов 12 С 6 14 С 6 • Т. к. все нуклиды углерода имеют атомный номер 6, то верна и другая запись 12 С - углерод 12.
 продолжение • Верхний индекс – массовое число • Нижний индекс порядковый (атомный номер)
продолжение • Верхний индекс – массовое число • Нижний индекс порядковый (атомный номер)
 Выводы • Атом электронейтральная частица • Атом состоит из «+» заряженного ядра, в котором сосредоточена основная масса. • Вокруг ядра расположены «-» заряженные электроны. • Атомное ядро состоит из протонов и нейтронов.
Выводы • Атом электронейтральная частица • Атом состоит из «+» заряженного ядра, в котором сосредоточена основная масса. • Вокруг ядра расположены «-» заряженные электроны. • Атомное ядро состоит из протонов и нейтронов.
 1913 г. Закон Мозли • Установил закон, согласно которому возможно определять заряд ядра. • Положительный заряд ядра атома (в у. е. ) равен порядковому номеру элемента в п. с. • Подтвердил правильность расположения элементов в П. С.
1913 г. Закон Мозли • Установил закон, согласно которому возможно определять заряд ядра. • Положительный заряд ядра атома (в у. е. ) равен порядковому номеру элемента в п. с. • Подтвердил правильность расположения элементов в П. С.
 1913 – английский физик Генри Мозли на основании экспериментальных данных (исследование рентгеновских спектров химических элементов) установил, что порядковый номер элемента совпадает с зарядом ядра атома Периодическое изменение свойств элементов зависит от их порядкового номера.
1913 – английский физик Генри Мозли на основании экспериментальных данных (исследование рентгеновских спектров химических элементов) установил, что порядковый номер элемента совпадает с зарядом ядра атома Периодическое изменение свойств элементов зависит от их порядкового номера.
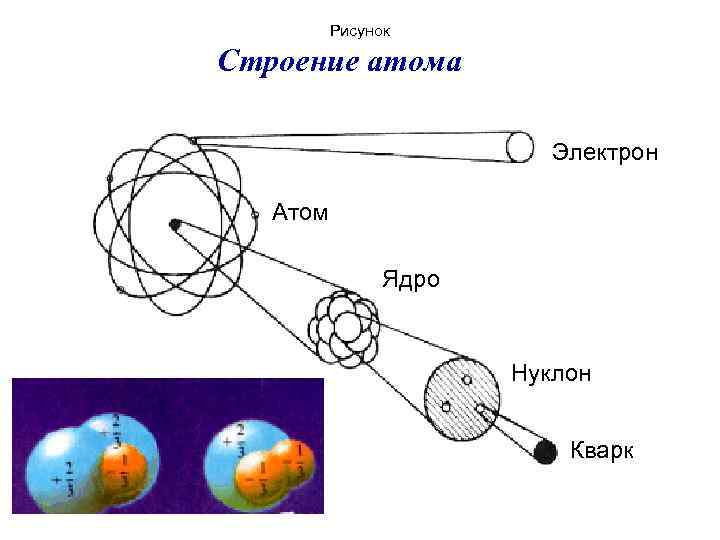 Рисунок Строение атома Электрон Атом Ядро Нуклон Кварк
Рисунок Строение атома Электрон Атом Ядро Нуклон Кварк
 Количество протонов электронов в атоме 1 • N( p)=N(e)=Z=Nпор 1 • N(11 p) –число протонов в ядре атома • N(e) – количество электронов • Z заряд ядра (атомный номер) • Nпор – порядковый номер
Количество протонов электронов в атоме 1 • N( p)=N(e)=Z=Nпор 1 • N(11 p) –число протонов в ядре атома • N(e) – количество электронов • Z заряд ядра (атомный номер) • Nпор – порядковый номер
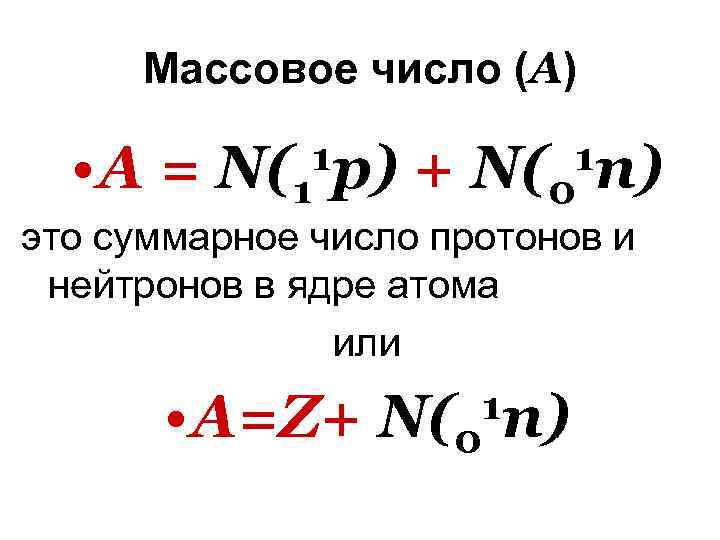 Массовое число (А) • А = N(1 1 p) + N(0 1 n) это суммарное число протонов и нейтронов в ядре атома или • А=Z+ N(0 1 n)
Массовое число (А) • А = N(1 1 p) + N(0 1 n) это суммарное число протонов и нейтронов в ядре атома или • А=Z+ N(0 1 n)
 Изотопы • Атомы одного химического элемента, которые имеют разные массовые числа (число протонов одинаково, число нейтронов различно)
Изотопы • Атомы одного химического элемента, которые имеют разные массовые числа (число протонов одинаково, число нейтронов различно)
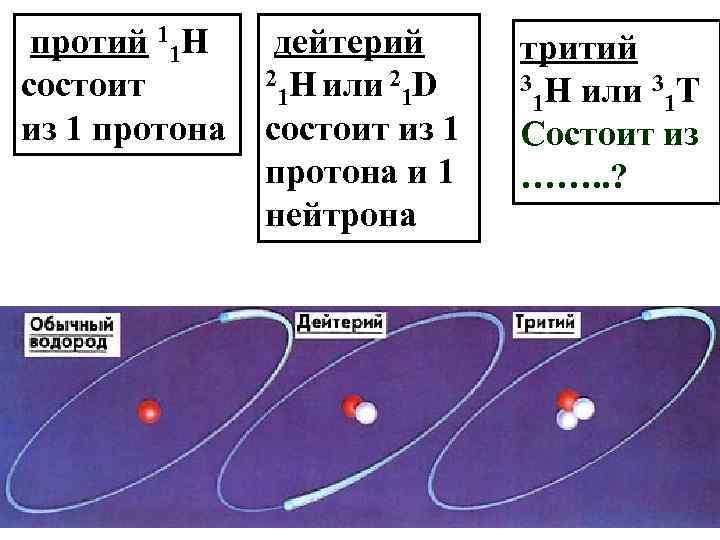 протий 11 Н состоит из 1 протона дейтерий 2 Н или 2 D 1 1 состоит из 1 протона и 1 нейтрона тритий 3 Н или 3 Т 1 1 Состоит из ……. . ?
протий 11 Н состоит из 1 протона дейтерий 2 Н или 2 D 1 1 состоит из 1 протона и 1 нейтрона тритий 3 Н или 3 Т 1 1 Состоит из ……. . ?
 Изотопы углерода • 12 C • 13 C • 14 C
Изотопы углерода • 12 C • 13 C • 14 C
 Изобары • Изобары- разновидность атомов имеющих одинаковое массовое число, но разное число протонов. • 40 Ar 18 40 K • 19 40 Ca. • 20
Изобары • Изобары- разновидность атомов имеющих одинаковое массовое число, но разное число протонов. • 40 Ar 18 40 K • 19 40 Ca. • 20
 Вывод • из вышесказанного - свойства химических элементов определяются не массой, а зарядом ядра.
Вывод • из вышесказанного - свойства химических элементов определяются не массой, а зарядом ядра.
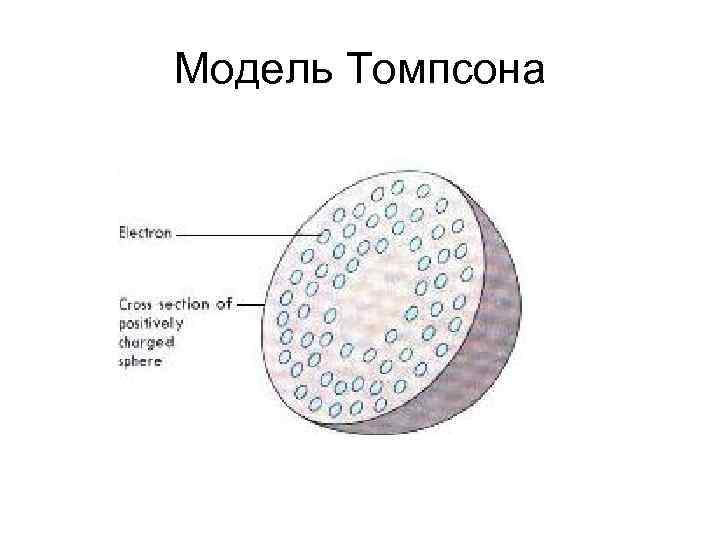 Модель Томпсона
Модель Томпсона
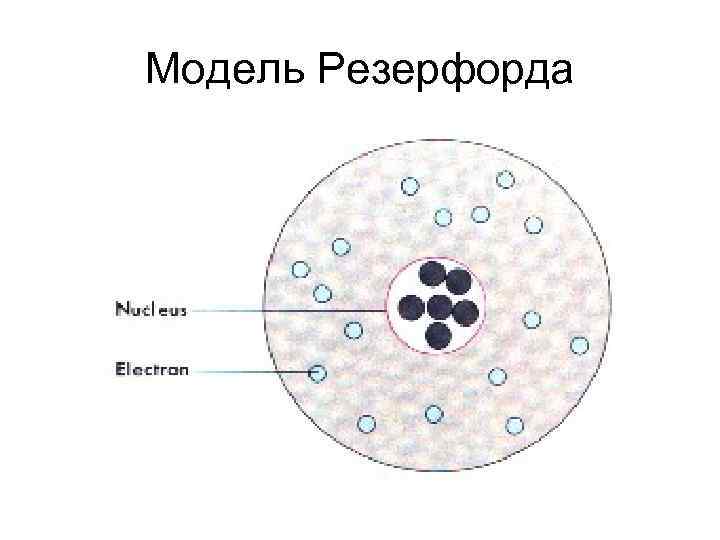 Модель Резерфорда
Модель Резерфорда
 Недостатки Согласно теории электромагнитного поля • электрон должен непрерывно излучать энергию, • двигаться не по окружности, а по спирали, • из-за потери энергии электрон должен упасть на ядро
Недостатки Согласно теории электромагнитного поля • электрон должен непрерывно излучать энергию, • двигаться не по окружности, а по спирали, • из-за потери энергии электрон должен упасть на ядро
 Продолжение • Итак классическая механика и теория электромагнитного поля не могли объяснить многие экспериментальные факты и охарактеризовать движение электрона в атоме.
Продолжение • Итак классическая механика и теория электромагнитного поля не могли объяснить многие экспериментальные факты и охарактеризовать движение электрона в атоме.
 • Открытия предшествовавшие развитию квантово-механической теории
• Открытия предшествовавшие развитию квантово-механической теории
 Альберт Эйнштейн 1905 г • Любое излучение состоит из дискретных частиц квантов излучения, называемых фотонами. • Следовательно свет имеет двойственную природу (корпускулярно-волновой дуализм). Волновые свойства - интерференция, дифракция Свойства пучка частиц (корпускул) – фотоэлектрический эффект Открытие явления фотоэффекта – Нобелевская премия
Альберт Эйнштейн 1905 г • Любое излучение состоит из дискретных частиц квантов излучения, называемых фотонами. • Следовательно свет имеет двойственную природу (корпускулярно-волновой дуализм). Волновые свойства - интерференция, дифракция Свойства пучка частиц (корпускул) – фотоэлектрический эффект Открытие явления фотоэффекта – Нобелевская премия
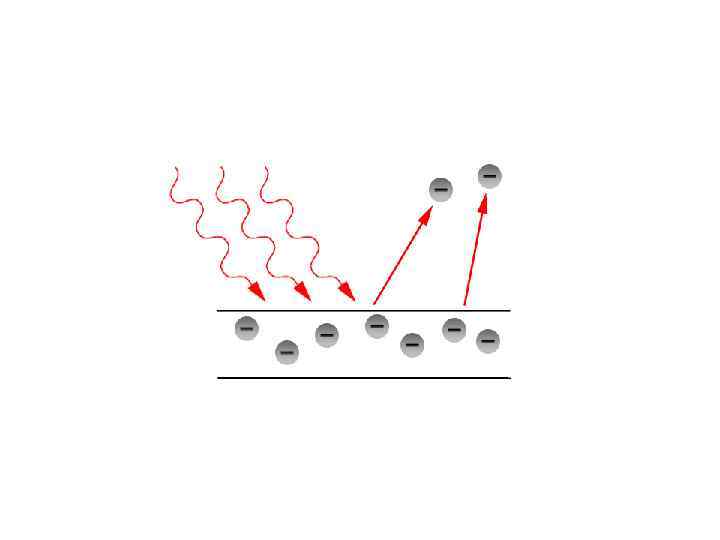
 Фотоэлектрический эффект • Высвобождение электронов с поверхности вещества (например кремния) под действием электромагнитного излучения, например света, УФ-излучения, рентгеновских или γлучей • Используется в фото-элементе, солнечных батареях (под действием света вырабатывется электричество – фотон излучения поглощается атомами вещества и передает энергию электронам, что позволяет последним покидать поверхность.
Фотоэлектрический эффект • Высвобождение электронов с поверхности вещества (например кремния) под действием электромагнитного излучения, например света, УФ-излучения, рентгеновских или γлучей • Используется в фото-элементе, солнечных батареях (под действием света вырабатывется электричество – фотон излучения поглощается атомами вещества и передает энергию электронам, что позволяет последним покидать поверхность.
 Солнечные батареи на МКС
Солнечные батареи на МКС
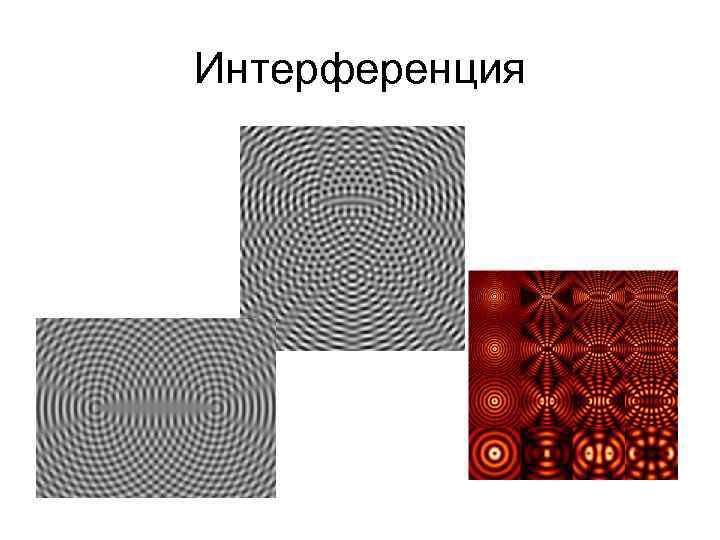
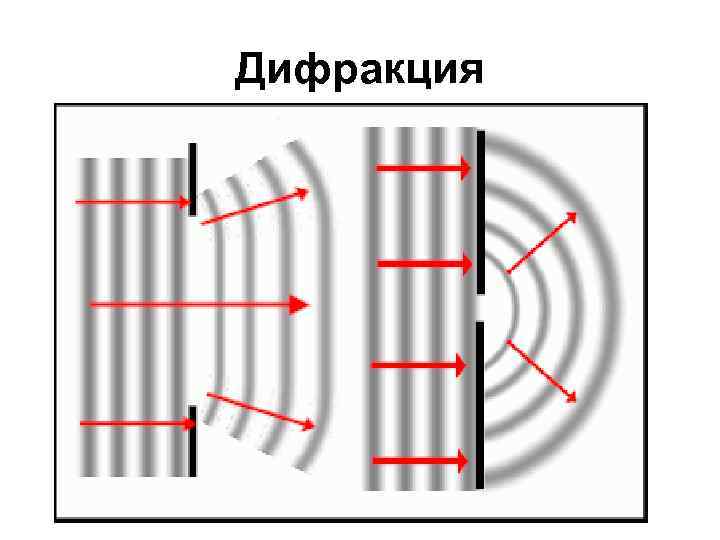
 Свойства света • Волновая теория 20 гг. 19 в. Томас Юнг Огюстен Жан Френель опыты по дифракции и интерференции • Интерференция – взаимодействие 2 и более волн • Дифракция –распространение волны при прохождение через узкое отверстие или при попадании на край препятствия
Свойства света • Волновая теория 20 гг. 19 в. Томас Юнг Огюстен Жан Френель опыты по дифракции и интерференции • Интерференция – взаимодействие 2 и более волн • Дифракция –распространение волны при прохождение через узкое отверстие или при попадании на край препятствия
 Интерференция
Интерференция
 Дифракция
Дифракция
 Макс Планк 1910 • Квантовая гипотеза энергия может излучаться или поглощаться строго определенными – дискретными – порциями, которые он назвал квантами. • Величина этих порций энергии Е связана с частотой излучения переносящего энергию (следующий слайд)
Макс Планк 1910 • Квантовая гипотеза энергия может излучаться или поглощаться строго определенными – дискретными – порциями, которые он назвал квантами. • Величина этих порций энергии Е связана с частотой излучения переносящего энергию (следующий слайд)
 Уравнение Планка Е=hn h=6, 625× 10 -34 Дж∙с n – частота излучения • n=с /l • c- скорость света, • l- длина волны
Уравнение Планка Е=hn h=6, 625× 10 -34 Дж∙с n – частота излучения • n=с /l • c- скорость света, • l- длина волны
 1913 г. Модель атома Бора Планетарная модель атома. Используя модель атома Резерфорда и теорию Планка обосновал модель атома водорода. Нильс Бор (1885 -1962) Обоснование этой и других более поздних моделей – атомные спектры и энергии ионизации атомов.
1913 г. Модель атома Бора Планетарная модель атома. Используя модель атома Резерфорда и теорию Планка обосновал модель атома водорода. Нильс Бор (1885 -1962) Обоснование этой и других более поздних моделей – атомные спектры и энергии ионизации атомов.
 Продолжение • Бор вычислил радиусы орбит. r 1=5, 29∙ 10 -29 м – радиус первой орбиты • r=n 2(5, 29*10 -13) • Теория Бора позволила точно вычислить энергию электронов, частоты в спектрах атома водорода и некоторых других одноэлектронных систем (Не+), что подтверждено экспериментально
Продолжение • Бор вычислил радиусы орбит. r 1=5, 29∙ 10 -29 м – радиус первой орбиты • r=n 2(5, 29*10 -13) • Теория Бора позволила точно вычислить энергию электронов, частоты в спектрах атома водорода и некоторых других одноэлектронных систем (Не+), что подтверждено экспериментально
 Согласно модели атома Бора 1)электроны вращаются в атоме по определенным устойчивым круговым орбитам. n Каждая орбита имеет номер (1, 2, 3…), который назвали главным квантовым числом.
Согласно модели атома Бора 1)электроны вращаются в атоме по определенным устойчивым круговым орбитам. n Каждая орбита имеет номер (1, 2, 3…), который назвали главным квантовым числом.
 2. Каждой орбите соответствует определенное значение энергии электрона (Е). Значение энергии зависит от главного квантового числа n. • E= -13, 6(1/n).
2. Каждой орбите соответствует определенное значение энергии электрона (Е). Значение энергии зависит от главного квантового числа n. • E= -13, 6(1/n).
 3. • Переход электрона на более высокую орбиту сопровождается затратой энергии (поглощение кванта) • Переход на более низкую орбиту сопровождается выделением энергии • hn=Едал-Ебл
3. • Переход электрона на более высокую орбиту сопровождается затратой энергии (поглощение кванта) • Переход на более низкую орбиту сопровождается выделением энергии • hn=Едал-Ебл
 Модель атома Бора(диск) • (2. 1)
Модель атома Бора(диск) • (2. 1)
 А. Зоммерфельд • 1915 -1916 гг. Развил теорию Бора. • Движение электронов происходит не только о круговым орбитам, но и эллиптическим. Поэтому для характеристики движения электрона недостаточно одного главного квантового числа. • l – орбитальное квантовое число
А. Зоммерфельд • 1915 -1916 гг. Развил теорию Бора. • Движение электронов происходит не только о круговым орбитам, но и эллиптическим. Поэтому для характеристики движения электрона недостаточно одного главного квантового числа. • l – орбитальное квантовое число
 Недостатки Согласно теории Бора-Зоммерфельда • Можно определить положение и скорость электрона • Проследить движение электрона по орбите • Оба предположения оказались неверными. • Не объяснялось поведение электрона в магнитном поле. • Нельзя объяснить строение многоэлектронных атомов
Недостатки Согласно теории Бора-Зоммерфельда • Можно определить положение и скорость электрона • Проследить движение электрона по орбите • Оба предположения оказались неверными. • Не объяснялось поведение электрона в магнитном поле. • Нельзя объяснить строение многоэлектронных атомов
 Возникла необходимсть в новой модели атома. • Основана на открытиях в микромире.
Возникла необходимсть в новой модели атома. • Основана на открытиях в микромире.

 Квантово-механичекая теория • Изучает движение и взаимодействие микрочастиц. (В основе работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, Шредингера) Содержит два основных положения
Квантово-механичекая теория • Изучает движение и взаимодействие микрочастиц. (В основе работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, Шредингера) Содержит два основных положения
 -1 • Электрон имеет двойственную природу. Обладает свойствами частицы и волны. • Как частица имеет массу и заряд • однако движение электрона волновой процесс (например дифракция электронов)
-1 • Электрон имеет двойственную природу. Обладает свойствами частицы и волны. • Как частица имеет массу и заряд • однако движение электрона волновой процесс (например дифракция электронов)
 Уравнение Де Бройля (1924) • l=h/(mv)
Уравнение Де Бройля (1924) • l=h/(mv)
 2. Принцип неопределенности Гейзенберга • Положение электрона в атоме неопределенно. Невозможно одновременно точно определить и скорость электрона и его координаты в пространстве. • Электрон может находиться на любом расстояние от ядра. • Вероятность его нахождения в разных местах атома различна. • Поэтому вводится понятия электронное облако, орбиталь уровень, подуровень
2. Принцип неопределенности Гейзенберга • Положение электрона в атоме неопределенно. Невозможно одновременно точно определить и скорость электрона и его координаты в пространстве. • Электрон может находиться на любом расстояние от ядра. • Вероятность его нахождения в разных местах атома различна. • Поэтому вводится понятия электронное облако, орбиталь уровень, подуровень
 Волновая функция Ψ • Т. к. электрон обладает свойствами частицы и волны одновременно, то его движение описывают с помощью волновой функции Ψ(x, y, z) • Физический смысл – квадрат этой функции пропорционален вероятности нахождения электрона в точке пространства с координатами x, y, z. • Входит в уравнение Шредингера, описывющее движение электрона.
Волновая функция Ψ • Т. к. электрон обладает свойствами частицы и волны одновременно, то его движение описывают с помощью волновой функции Ψ(x, y, z) • Физический смысл – квадрат этой функции пропорционален вероятности нахождения электрона в точке пространства с координатами x, y, z. • Входит в уравнение Шредингера, описывющее движение электрона.
 Эрвин Рудольф Йозеф Александр Шредингер Австрийский физик-теоретик, один из создателей квантовой механики Лауреат Нобелевской премии по физике (1933) Член ряда академий наук мира, в том числе иностранный член Академии наук СССР (1934)
Эрвин Рудольф Йозеф Александр Шредингер Австрийский физик-теоретик, один из создателей квантовой механики Лауреат Нобелевской премии по физике (1933) Член ряда академий наук мира, в том числе иностранный член Академии наук СССР (1934)
 Для объяснения строения атома вводятся понятия • электронное облако, • орбиталь • уровень, • подуровень
Для объяснения строения атома вводятся понятия • электронное облако, • орбиталь • уровень, • подуровень
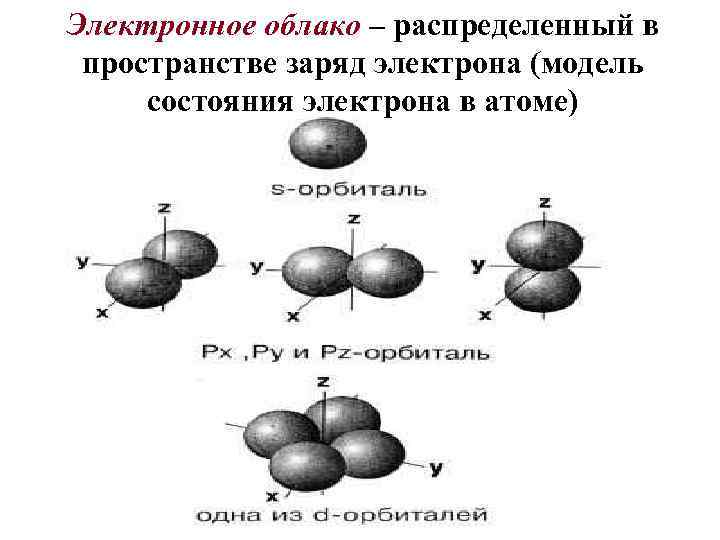 Электронное облако – распределенный в пространстве заряд электрона (модель состояния электрона в атоме)
Электронное облако – распределенный в пространстве заряд электрона (модель состояния электрона в атоме)
 Орбиталь – область пространства, в которой наиболее вероятно нахождение электрона.
Орбиталь – область пространства, в которой наиболее вероятно нахождение электрона.
 Энергетический уровень • Совокупность орбиталей, имеющих одинаковое значение энергии (главного квантового числа)
Энергетический уровень • Совокупность орбиталей, имеющих одинаковое значение энергии (главного квантового числа)
 Электронный слой • совокупность электронов, находящихся на одном энергетическом уровне.
Электронный слой • совокупность электронов, находящихся на одном энергетическом уровне.
 Энергетический подуровень – • совокупность орбиталей, находящихся на одном энергетическом уровне и имеющих одинаковую форму
Энергетический подуровень – • совокупность орбиталей, находящихся на одном энергетическом уровне и имеющих одинаковую форму
 Вывод • Уровень подуровень орбитали
Вывод • Уровень подуровень орбитали
 Квантовые числа Энергетическое состояние электронов характеризуют квантовые числа n – главное квантовое число l – орбитальное квантовое число m – магнитное квантовое число s – спиновое квантовое число
Квантовые числа Энергетическое состояние электронов характеризуют квантовые числа n – главное квантовое число l – орбитальное квантовое число m – магнитное квантовое число s – спиновое квантовое число
 Главное квантовое число • n– характеризует общий запас энергии электронов в атоме, размер орбитали и электронного облака. • n =1÷∞ • Численно равно номеру периода и определяет число энергетических уровней, номер энергетического уровня.
Главное квантовое число • n– характеризует общий запас энергии электронов в атоме, размер орбитали и электронного облака. • n =1÷∞ • Численно равно номеру периода и определяет число энергетических уровней, номер энергетического уровня.
 Пример • Что означает n=5. • Атом элемента содержит 5 энергетических уровней. • Рассматриваем строение 5 -го энергетического уровня
Пример • Что означает n=5. • Атом элемента содержит 5 энергетических уровней. • Рассматриваем строение 5 -го энергетического уровня
 Орбитальное квантовое число • l – характеризует энергию энергетического подуровня. Определяет форму электронного облака. • l=0÷(n-1)
Орбитальное квантовое число • l – характеризует энергию энергетического подуровня. Определяет форму электронного облака. • l=0÷(n-1)
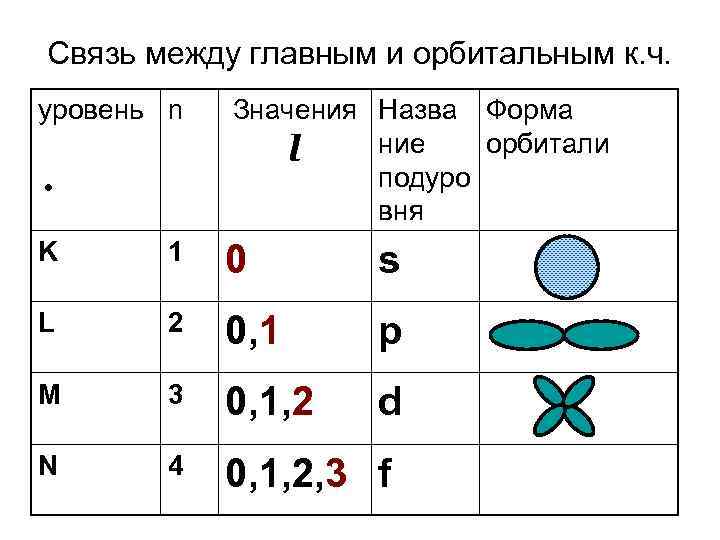 Связь между главным и орбитальным к. ч. уровень n • Значения Назва Форма ние орбитали l подуро вня K 1 0 s L 2 0, 1 p M 3 0, 1, 2 d N 4 0, 1, 2, 3 f
Связь между главным и орбитальным к. ч. уровень n • Значения Назва Форма ние орбитали l подуро вня K 1 0 s L 2 0, 1 p M 3 0, 1, 2 d N 4 0, 1, 2, 3 f
 Магнитное квантовое число • m – определяет • расположение электронного облако в пространстве относительно осей координат • также количество возможных ориентаций • Количество орбиталей на данном подуровне
Магнитное квантовое число • m – определяет • расположение электронного облако в пространстве относительно осей координат • также количество возможных ориентаций • Количество орбиталей на данном подуровне
 Значения m • m=-l ÷ +l • Число значений 2 l+1
Значения m • m=-l ÷ +l • Число значений 2 l+1
 Число орбиталей на подуровне. Графическое обозначение орбиталей (квантовые ячейки)_ Число орбиталей 2 l+1 n l m 1 0 (s) 1 1 2 1 (p) -1; 0; +1 3 3 2 (d) -2; -1; 0; +1; +2 5
Число орбиталей на подуровне. Графическое обозначение орбиталей (квантовые ячейки)_ Число орбиталей 2 l+1 n l m 1 0 (s) 1 1 2 1 (p) -1; 0; +1 3 3 2 (d) -2; -1; 0; +1; +2 5
 Спиновое квантовое число • ms – характеризует вращение электрона относительно своей оси.
Спиновое квантовое число • ms – характеризует вращение электрона относительно своей оси.
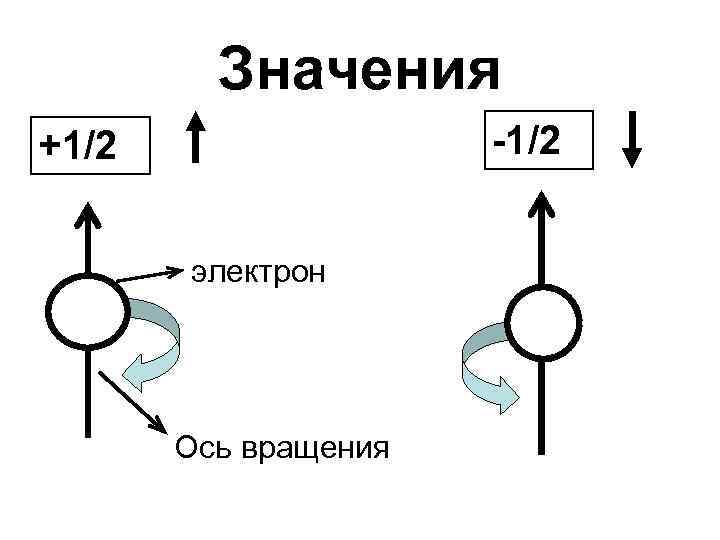 Значения -1/2 +1/2 электрон Ось вращения
Значения -1/2 +1/2 электрон Ось вращения
 Электронная конфигурация элемента (электронная формула) – запись распределения электронов по энергетическим подуровням H 1 s 1 1 уровень подуровень Число электронов
Электронная конфигурация элемента (электронная формула) – запись распределения электронов по энергетическим подуровням H 1 s 1 1 уровень подуровень Число электронов
 Электронно-графическая формула • Показывает распределение электронов по орбиталям и спины электронов) 1 s 1
Электронно-графическая формула • Показывает распределение электронов по орбиталям и спины электронов) 1 s 1
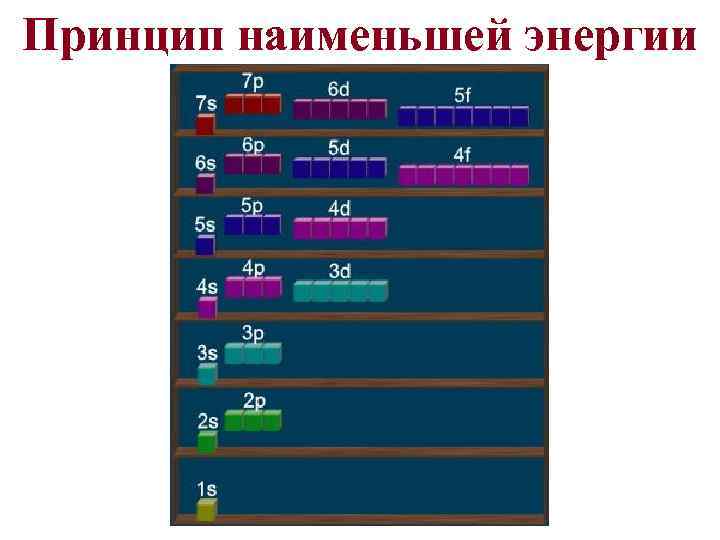
 Принцип наименьшей энергии Наиболее устойчивым состоянием атома считается то, при котором суммарная энергия всех его электронов минимальна.
Принцип наименьшей энергии Наиболее устойчивым состоянием атома считается то, при котором суммарная энергия всех его электронов минимальна.
 Принцип наименьшей энергии
Принцип наименьшей энергии
 Электронные формулы атомов I-III периодов • Последовательность заполнения подуровней 1 s<2 s<2 p<3 s<3 p
Электронные формулы атомов I-III периодов • Последовательность заполнения подуровней 1 s<2 s<2 p<3 s<3 p
 Энергия подуровня • Определяется суммой (n+l). Чем меньше эта сумма, тем меньше энергия подуровня
Энергия подуровня • Определяется суммой (n+l). Чем меньше эта сумма, тем меньше энергия подуровня
 Правила Клечковского 1 -ое правило • 1 –заполнение подуровней происходит в порядке возрастания суммы (n+l) IV период Свободные подуровни 3 d 4 s 4 p
Правила Клечковского 1 -ое правило • 1 –заполнение подуровней происходит в порядке возрастания суммы (n+l) IV период Свободные подуровни 3 d 4 s 4 p
 продолжение подуровень (n+l) 3 d 3+2=5 4 s 4+0=4 4 p 4+1=5
продолжение подуровень (n+l) 3 d 3+2=5 4 s 4+0=4 4 p 4+1=5
 2 -ое правило • Если сумма (n+l) для разных подуровней одинакова, то заполняется подуровень с меньшим значением n
2 -ое правило • Если сумма (n+l) для разных подуровней одинакова, то заполняется подуровень с меньшим значением n
 Последовательность заполнения подуровней в IV периоде • …. 4 s 3 d 4 p
Последовательность заполнения подуровней в IV периоде • …. 4 s 3 d 4 p
 Всеволод Маврикиевич Клечковский (28. 11. 1900– 02. 05. 1972) ДХН, академик ВАСНИЛ
Всеволод Маврикиевич Клечковский (28. 11. 1900– 02. 05. 1972) ДХН, академик ВАСНИЛ
 Принцип Паули В атоме не может быть двух электронов с одинаковым значением всех четырех квантовых чисел
Принцип Паули В атоме не может быть двух электронов с одинаковым значением всех четырех квантовых чисел

 Вольфганг Паули американский физик, родившийся в Австрии . 1900 -1958 • Занимался разработками квантовой теории под руководством Нильса БОРА. • В 1925 г. сформулировал ПРИНЦИП ЗАПРЕТА ПАУЛИ, который гласит, что два ФЕРМИОНА (например, ЭЛЕКТРОНЫ или КВАРКИ) не могут одновременно находится в одном и том же квантовом состоянии. • В 1931 г. верно предсказал существование нейтрино. • В 1945 г. получил Нобелевскую премию по физике за его достижения в квантовой физике.
Вольфганг Паули американский физик, родившийся в Австрии . 1900 -1958 • Занимался разработками квантовой теории под руководством Нильса БОРА. • В 1925 г. сформулировал ПРИНЦИП ЗАПРЕТА ПАУЛИ, который гласит, что два ФЕРМИОНА (например, ЭЛЕКТРОНЫ или КВАРКИ) не могут одновременно находится в одном и том же квантовом состоянии. • В 1931 г. верно предсказал существование нейтрино. • В 1945 г. получил Нобелевскую премию по физике за его достижения в квантовой физике.
 Правило Хунда Алгебраическое значение суммарного спина должно быть максимальным, т. е. внутри подуровней электроны заполняют все максимально возможные свободные орбитали.
Правило Хунда Алгебраическое значение суммарного спина должно быть максимальным, т. е. внутри подуровней электроны заполняют все максимально возможные свободные орбитали.

 Фридрих Хунд немецкий физик. 1894 -1997 Участник разработки метода молекулярных орбиталей
Фридрих Хунд немецкий физик. 1894 -1997 Участник разработки метода молекулярных орбиталей
 Валентность атомов. Валентные электроны. Валентность элемента определяется числом неспаренных электронов в атоме, поскольку они принимают участие в образовании химической связи между атомами в молекулах соединений.
Валентность атомов. Валентные электроны. Валентность элемента определяется числом неспаренных электронов в атоме, поскольку они принимают участие в образовании химической связи между атомами в молекулах соединений.
 Нормальное (основное) состояние атома. • Нормальное состояние атома – это такое состояние которое характеризуется минимальной энергией. • Характеризуется электронной конфигурацией атома, которая соответствует положению элемента в периодической системе
Нормальное (основное) состояние атома. • Нормальное состояние атома – это такое состояние которое характеризуется минимальной энергией. • Характеризуется электронной конфигурацией атома, которая соответствует положению элемента в периодической системе
 Возбужденное состояние атома • Новое энергетическое состояние с новым распределением электронов в пределах своего валентного уровня.
Возбужденное состояние атома • Новое энергетическое состояние с новым распределением электронов в пределах своего валентного уровня.
 Примеры 1. Записать электронные формулы для атомов элементов № 8, 16 в соответствии с принципом наименьшей энергии (в порядке заполнения). 2. Подчеркнуть валентные подуровни
Примеры 1. Записать электронные формулы для атомов элементов № 8, 16 в соответствии с принципом наименьшей энергии (в порядке заполнения). 2. Подчеркнуть валентные подуровни
 продолжение 3. Изобразить электроннографические формулы указанных атомов элементов для нормального и возможных возбужденных состояний. 4. Какие валентности могут проявлять атомы этих элементов.
продолжение 3. Изобразить электроннографические формулы указанных атомов элементов для нормального и возможных возбужденных состояний. 4. Какие валентности могут проявлять атомы этих элементов.
 Примеры • № 23 1 s 2 4 s 2 22 p 6 2 s 3 d 3 3 s 23 p 6 4 s 23 d 3
Примеры • № 23 1 s 2 4 s 2 22 p 6 2 s 3 d 3 3 s 23 p 6 4 s 23 d 3
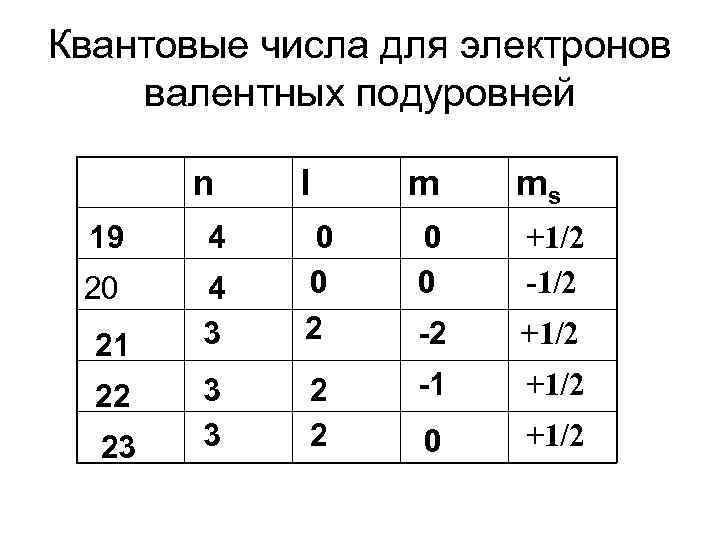 Квантовые числа для электронов валентных подуровней n 19 4 20 21 22 23 l m ms 4 3 0 0 2 0 0 +1/2 -2 +1/2 3 3 2 2 -1 +1/2 0 +1/2
Квантовые числа для электронов валентных подуровней n 19 4 20 21 22 23 l m ms 4 3 0 0 2 0 0 +1/2 -2 +1/2 3 3 2 2 -1 +1/2 0 +1/2
 Электронные формулы ионов +6 S Строение валентного уровня атома 0 серы S 2 … 3 s 4 3 p
Электронные формулы ионов +6 S Строение валентного уровня атома 0 серы S 2 … 3 s 4 3 p
 Продолжение 0 S 23 p 4 3 s - 6 е +6 S 03 p 0 3 s
Продолжение 0 S 23 p 4 3 s - 6 е +6 S 03 p 0 3 s
 -2 S 0 S 23 p 4 3 s +2 е -2 S 23 p 6 3 s
-2 S 0 S 23 p 4 3 s +2 е -2 S 23 p 6 3 s
 Периодическая система и строение атомов. В настоящее время периодическую систему элементов Менделеева можно рассматривать как классификацию атомов по строению их электронной оболочки.
Периодическая система и строение атомов. В настоящее время периодическую систему элементов Менделеева можно рассматривать как классификацию атомов по строению их электронной оболочки.
 2. • Таблица дает исчерпывающую информацию о разнообразии и подобии в строении электронной оболочки, а следовательно классификацию элементов по строению их атомов.
2. • Таблица дает исчерпывающую информацию о разнообразии и подобии в строении электронной оболочки, а следовательно классификацию элементов по строению их атомов.
 3. • Физико-химические свойства элементов тесно связаны со строением электронной оболочки атома, следовательно таблица представляет классификацию элементов и по физико-химическим свойствам.
3. • Физико-химические свойства элементов тесно связаны со строением электронной оболочки атома, следовательно таблица представляет классификацию элементов и по физико-химическим свойствам.
 Классификация атомов 1. По способу застраивания электронной оболочки s- элементы заполняется sподуровень наружного слоя. Внутренние электронные слои остаются неизменными. Это два первые элемента любого периода
Классификация атомов 1. По способу застраивания электронной оболочки s- элементы заполняется sподуровень наружного слоя. Внутренние электронные слои остаются неизменными. Это два первые элемента любого периода
 p-элементы заполняется р-подуровень наружного слоя. Внутренние электронные слои остаются неизменными. Это шесть последних элементов периода (кроме 7 -го)
p-элементы заполняется р-подуровень наружного слоя. Внутренние электронные слои остаются неизменными. Это шесть последних элементов периода (кроме 7 -го)
 d – элементы. Застраивается соседний с наружным уровень. В наружном слое этих элементов на sподуровне находится чаще 2 реже 1 электрон. Таких элементов по 10 в каждом большом периоде (кроме 7 -го)
d – элементы. Застраивается соседний с наружным уровень. В наружном слое этих элементов на sподуровне находится чаще 2 реже 1 электрон. Таких элементов по 10 в каждом большом периоде (кроме 7 -го)
 f – элементы. В атомах этих элементов заполняется f-подуровень третьего уровня, считая от внешнего. Сейчас известно 28 таких элементов. Они делятся на два семейства лантаноидов (заполняется 4 f-подуровень) и актиноиды (заполняется 5 fподуровень.
f – элементы. В атомах этих элементов заполняется f-подуровень третьего уровня, считая от внешнего. Сейчас известно 28 таких элементов. Они делятся на два семейства лантаноидов (заполняется 4 f-подуровень) и актиноиды (заполняется 5 fподуровень.
 2. По числу электронов в наружном квантовом слое электронной оболочки Металлы – все элементы в наружном квантовом слое которых 1 -3 электрона (кроме водорода, бора, гелия). Могут только отдавать электроны, поэтому не образуют отрицательно заряженных ионов.
2. По числу электронов в наружном квантовом слое электронной оболочки Металлы – все элементы в наружном квантовом слое которых 1 -3 электрона (кроме водорода, бора, гелия). Могут только отдавать электроны, поэтому не образуют отрицательно заряженных ионов.
 К ним относятся s-, некоторые p-, а также d-, f-элементы. • d-, f-металлы могут проявлять переменную степень окисления. Максимальная положительная степень окисления равна номеру группы в которой находится элемент.
К ним относятся s-, некоторые p-, а также d-, f-элементы. • d-, f-металлы могут проявлять переменную степень окисления. Максимальная положительная степень окисления равна номеру группы в которой находится элемент.
 Неметаллы – элементы наружный слой которых содержит 4 - 7 электронов, а также водород и бор. Неметаллы способны как принимать так и отдавать электроны. Поэтому могут проявлять как отрицательные, так и положительные степени окисления. Однако тенденция к приему электронов у них выражена сильнее. Все неметаллы кроме водорода относятся к р-элементам.
Неметаллы – элементы наружный слой которых содержит 4 - 7 электронов, а также водород и бор. Неметаллы способны как принимать так и отдавать электроны. Поэтому могут проявлять как отрицательные, так и положительные степени окисления. Однако тенденция к приему электронов у них выражена сильнее. Все неметаллы кроме водорода относятся к р-элементам.
 Инертные (благородные) газы элементы в наружном слое которых находится 8 (р-элементы : неон, аргон, криптон, ксенон, радон) или 2 электрона (гелий s-элемент)
Инертные (благородные) газы элементы в наружном слое которых находится 8 (р-элементы : неон, аргон, криптон, ксенон, радон) или 2 электрона (гелий s-элемент)
 Некоторые характеристики атома и свойства элементов Периодичность накопления электронов около ядра приводит к периодичности в изменении свойств атомов элементов. Периодически изменяются такие характеристики атомов, как валентность, объемы атомов, радиусы атомов и ионов, энергии ионизации, восстановительные свойства, энергии сродства к электрону, окислительные свойства, электроотрицательности, некоторые физические свойства (температуры плавления и кипения и др. ). Понятие валентность более подробно рассмотрим позже. Перейдем к рассмотрению других характеристик.
Некоторые характеристики атома и свойства элементов Периодичность накопления электронов около ядра приводит к периодичности в изменении свойств атомов элементов. Периодически изменяются такие характеристики атомов, как валентность, объемы атомов, радиусы атомов и ионов, энергии ионизации, восстановительные свойства, энергии сродства к электрону, окислительные свойства, электроотрицательности, некоторые физические свойства (температуры плавления и кипения и др. ). Понятие валентность более подробно рассмотрим позже. Перейдем к рассмотрению других характеристик.
 Атомные объемы Атомный объем – объем, занимаемый одним молем атомов простого вещества в твердом состоянии. Дает четкое представление о периодичности изменения физических свойств простых веществ. Впервые графическую зависимость между величинами атомных масс и атомных объемов предложил Мейер. Наибольший атомный объем имеют щелочные металлы.
Атомные объемы Атомный объем – объем, занимаемый одним молем атомов простого вещества в твердом состоянии. Дает четкое представление о периодичности изменения физических свойств простых веществ. Впервые графическую зависимость между величинами атомных масс и атомных объемов предложил Мейер. Наибольший атомный объем имеют щелочные металлы.
 Радиус атома (радиус Слейтера) – расстояние от ядра атома до максимума электронной плотности его валентных электронов
Радиус атома (радиус Слейтера) – расстояние от ядра атома до максимума электронной плотности его валентных электронов
 Обозначение r. Размерность пм (пикометр – 10 -12 м) или нм (нанометр – 10 -9 м) rан >rат> rкат
Обозначение r. Размерность пм (пикометр – 10 -12 м) или нм (нанометр – 10 -9 м) rан >rат> rкат
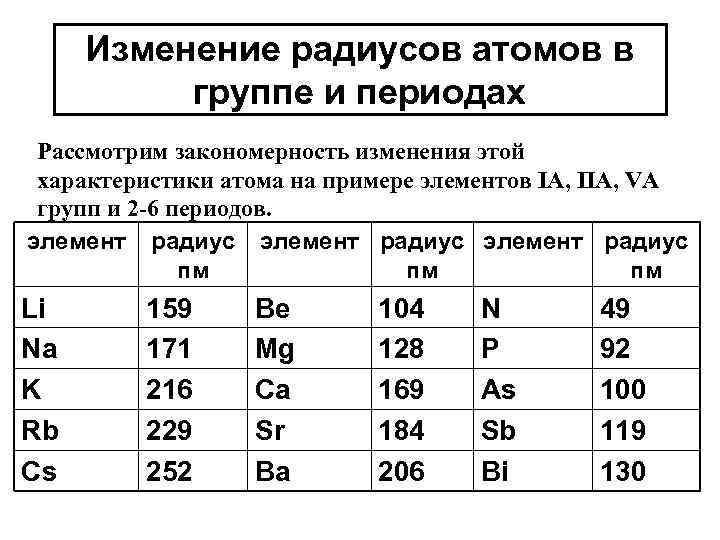 Изменение радиусов атомов в группе и периодах Рассмотрим закономерность изменения этой характеристики атома на примере элементов IA, IIA, VA групп и 2 -6 периодов. элемент радиус пм пм пм Li Na K Rb Cs 159 171 216 229 252 Be Mg Ca Sr Ba 104 128 169 184 206 N P As Sb Bi 49 92 100 119 130
Изменение радиусов атомов в группе и периодах Рассмотрим закономерность изменения этой характеристики атома на примере элементов IA, IIA, VA групп и 2 -6 периодов. элемент радиус пм пм пм Li Na K Rb Cs 159 171 216 229 252 Be Mg Ca Sr Ba 104 128 169 184 206 N P As Sb Bi 49 92 100 119 130
 Выводы из таблицы: 1) в группе сверху вниз радиус атома увеличивается. Число электронов остается постоянным равным номеру группы. Чем меньше электронов на внешнем уровне и чем дальше эти электроны находятся от ядра, тем слабее электростатические силы между «+» ядром и электронами легче атом элемента отдает эти электроны. Элементы легко отдающие электроны проявляют металлические свойства, восстановительные свойства. Их оксиды и гидроксиды проявляют основные свойства (реже амфотерные) 2) В периоде слева направо радиус атома уменьшается, т. к. число энергетических уровней в пределах одного периода постоянно, но увеличивается число электронов на внешнем уровне. Следовательно электростатическое взаимодействие между «+» ядром и электронами усиливается, а радиус уменьшается (эффект р-сжатия). В связи с этим элементы конца периода будут легче принимать электроны. Такие элементы проявляют неметаллические и окислительные свойства. Их оксиды носят кислотный характер
Выводы из таблицы: 1) в группе сверху вниз радиус атома увеличивается. Число электронов остается постоянным равным номеру группы. Чем меньше электронов на внешнем уровне и чем дальше эти электроны находятся от ядра, тем слабее электростатические силы между «+» ядром и электронами легче атом элемента отдает эти электроны. Элементы легко отдающие электроны проявляют металлические свойства, восстановительные свойства. Их оксиды и гидроксиды проявляют основные свойства (реже амфотерные) 2) В периоде слева направо радиус атома уменьшается, т. к. число энергетических уровней в пределах одного периода постоянно, но увеличивается число электронов на внешнем уровне. Следовательно электростатическое взаимодействие между «+» ядром и электронами усиливается, а радиус уменьшается (эффект р-сжатия). В связи с этим элементы конца периода будут легче принимать электроны. Такие элементы проявляют неметаллические и окислительные свойства. Их оксиды носят кислотный характер
 Энергия ионизации Определение: энергия ионизации – энергия, необходимая для превращения нейтрального атома в положительно заряженный ион. Обозначение – I. Размерность – э. В/атом или к. Дж/моль 1 э. В=1, 60*10 -22*6, 02*1023=96, 32 к. Дж/моль
Энергия ионизации Определение: энергия ионизации – энергия, необходимая для превращения нейтрального атома в положительно заряженный ион. Обозначение – I. Размерность – э. В/атом или к. Дж/моль 1 э. В=1, 60*10 -22*6, 02*1023=96, 32 к. Дж/моль
 энергия которую необходимо затратить для отрыва электрона от электронейтралього атома : 0 Э –е + Э . rкат.
энергия которую необходимо затратить для отрыва электрона от электронейтралього атома : 0 Э –е + Э . rкат.
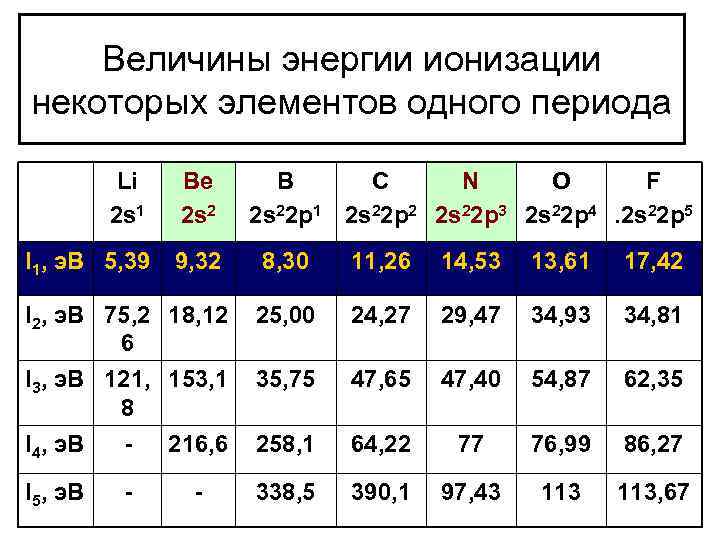 Величины энергии ионизации некоторых элементов одного периода Li 2 s 1 Ве 2 s 2 I 1, э. В 5, 39 9, 32 8, 30 11, 26 14, 53 13, 61 17, 42 I 2, э. В 75, 2 18, 12 6 25, 00 24, 27 29, 47 34, 93 34, 81 I 3, э. В 121, 153, 1 8 I 4, э. В 216, 6 35, 75 47, 65 47, 40 54, 87 62, 35 258, 1 64, 22 77 76, 99 86, 27 I 5, э. В 338, 5 390, 1 97, 43 113, 67 - - В С N O F 2 s 22 p 1 2 s 22 p 2 2 s 22 p 3 2 s 22 p 4. 2 s 22 p 5
Величины энергии ионизации некоторых элементов одного периода Li 2 s 1 Ве 2 s 2 I 1, э. В 5, 39 9, 32 8, 30 11, 26 14, 53 13, 61 17, 42 I 2, э. В 75, 2 18, 12 6 25, 00 24, 27 29, 47 34, 93 34, 81 I 3, э. В 121, 153, 1 8 I 4, э. В 216, 6 35, 75 47, 65 47, 40 54, 87 62, 35 258, 1 64, 22 77 76, 99 86, 27 I 5, э. В 338, 5 390, 1 97, 43 113, 67 - - В С N O F 2 s 22 p 1 2 s 22 p 2 2 s 22 p 3 2 s 22 p 4. 2 s 22 p 5
 Выводы из таблицы Общая тенденция: 1) в периоде с увеличением заряда ядра, уменьшается радиус, энергия ионизация увеличивается. Наименьшее значение энергии ионизация у элемента лития, наибольшее у фтора. Следовательно наибольшей восстановительной активностью характеризуются щелочные металлы. 2) Отрыв каждого следующего электрона требует большей затраты энергии. Особенно резко возрастает энергия ионизации при переходе к другому электронному слою.
Выводы из таблицы Общая тенденция: 1) в периоде с увеличением заряда ядра, уменьшается радиус, энергия ионизация увеличивается. Наименьшее значение энергии ионизация у элемента лития, наибольшее у фтора. Следовательно наибольшей восстановительной активностью характеризуются щелочные металлы. 2) Отрыв каждого следующего электрона требует большей затраты энергии. Особенно резко возрастает энергия ионизации при переходе к другому электронному слою.
 Исключения : элементы бериллий и азот. Энергии ионизации бериллия выше, чем у соседних бора и углерода. То же справедливо для азота. Это объясняется следующим правилом: наиболее устойчивы электронные конфигурации атомов элементов с полностью или наполовину заполненным подуровнем. Электронные конфигурации Бериллия 1 s 22 s 2 Азот 1 s 22 p 3
Исключения : элементы бериллий и азот. Энергии ионизации бериллия выше, чем у соседних бора и углерода. То же справедливо для азота. Это объясняется следующим правилом: наиболее устойчивы электронные конфигурации атомов элементов с полностью или наполовину заполненным подуровнем. Электронные конфигурации Бериллия 1 s 22 s 2 Азот 1 s 22 p 3
 Энергия сродства к электрону Определение: энергия, которая выделяется (реже поглощается) присоединении электрона к атому. Э 0+е Э- rат.
Энергия сродства к электрону Определение: энергия, которая выделяется (реже поглощается) присоединении электрона к атому. Э 0+е Э- rат.
 Выводы Характер изменения энергии сродства к электрону в группе: в группе сверху вниз увеличивается радиус атома, силы электростатического взаимодействия «+» заряженного ядра и внешних электронов ослабевают, поэтому энергия сродства к электрону уменьшается. В периоде слева направо уменьшается радиус атома, количество электронов на внешнем уровне увеличивается, поэтому энергия сродства к электрону тоже увеличивается.
Выводы Характер изменения энергии сродства к электрону в группе: в группе сверху вниз увеличивается радиус атома, силы электростатического взаимодействия «+» заряженного ядра и внешних электронов ослабевают, поэтому энергия сродства к электрону уменьшается. В периоде слева направо уменьшается радиус атома, количество электронов на внешнем уровне увеличивается, поэтому энергия сродства к электрону тоже увеличивается.
 Электроотрицательность Определение: электроотрицательность – способность атома притягивать к себе электроны в химическом соединении. ЭО= (I+E)/2 (шкала Р. Малликена). Недостаток – нет надежных методов определения Е.
Электроотрицательность Определение: электроотрицательность – способность атома притягивать к себе электроны в химическом соединении. ЭО= (I+E)/2 (шкала Р. Малликена). Недостаток – нет надежных методов определения Е.
 Относительная электроотрицательность • На практике пользуются относительными значениями электроотрицательности. Величины приводятся в таблицах. Существует несколько шкал ОЭО. Мы будем пользоваться значениями ОЭО по Полингу. • Характер изменения ОЭО аналогичен уже рассмотренным характеристикам. За единицу принята ОЭО лития. Самая высокая ОЭО у фтора. По величине ОЭО можно судить о свойствах элемента, его заряде в соединении, типах связи.
Относительная электроотрицательность • На практике пользуются относительными значениями электроотрицательности. Величины приводятся в таблицах. Существует несколько шкал ОЭО. Мы будем пользоваться значениями ОЭО по Полингу. • Характер изменения ОЭО аналогичен уже рассмотренным характеристикам. За единицу принята ОЭО лития. Самая высокая ОЭО у фтора. По величине ОЭО можно судить о свойствах элемента, его заряде в соединении, типах связи.
 Общие выводы по теме 1. На основании энергетических характеристик атомов элементов, энергетически устойчивы электронные конфигурации с полностью или наполовину заполненными подуровнями. В связи с этим для ряда элементов наблюдается провал электрона с текущего уровня на предыдущий.
Общие выводы по теме 1. На основании энергетических характеристик атомов элементов, энергетически устойчивы электронные конфигурации с полностью или наполовину заполненными подуровнями. В связи с этим для ряда элементов наблюдается провал электрона с текущего уровня на предыдущий.
 Примеры 1. Элементы подгруппы меди наблюдается провал электрона с ns-подуровня на (n-1)d-подуровень. текущего 2. Аналогичное явление наблюдается для элементов хрома и молибдена.
Примеры 1. Элементы подгруппы меди наблюдается провал электрона с ns-подуровня на (n-1)d-подуровень. текущего 2. Аналогичное явление наблюдается для элементов хрома и молибдена.
 Электронные конфигурации этих элементов: Cu - 104 s 1; … 3 d Ag - 105 s 1; … 4 d Au – Cr - 106 s 1; 5 d 54 s 1; … 3 d Mo - 55 s 1 … 4 d
Электронные конфигурации этих элементов: Cu - 104 s 1; … 3 d Ag - 105 s 1; … 4 d Au – Cr - 106 s 1; 5 d 54 s 1; … 3 d Mo - 55 s 1 … 4 d
 2. С увеличением заряда ядра и количества электронов во внешнем уровне изменение свойств химических элементов не совершается непрерывно в одном и том же направлении (от типично металлических до неметаллических), а имеет периодический характер. Таким образом элементы выделены в электронные аналоги. Электронные аналоги имеют общее строение валентных подуровней, а следовательно общую электронную формулу. Общую формулу и общие свойства оксидов и т. д.
2. С увеличением заряда ядра и количества электронов во внешнем уровне изменение свойств химических элементов не совершается непрерывно в одном и том же направлении (от типично металлических до неметаллических), а имеет периодический характер. Таким образом элементы выделены в электронные аналоги. Электронные аналоги имеют общее строение валентных подуровней, а следовательно общую электронную формулу. Общую формулу и общие свойства оксидов и т. д.
 • 3. Свойства и характеристики атомов элементов изменяются в известной последовательности как в горизонтальном, так и в вертикальном направлениях. Изменение некоторых свойств и характеристик по таблице Д. И. Менделеева приведено на следующем слайде • 4. На основании положения элемента в п. с. можно дать его характеристику и характеристику его соединений.
• 3. Свойства и характеристики атомов элементов изменяются в известной последовательности как в горизонтальном, так и в вертикальном направлениях. Изменение некоторых свойств и характеристик по таблице Д. И. Менделеева приведено на следующем слайде • 4. На основании положения элемента в п. с. можно дать его характеристику и характеристику его соединений.
 Изменение некоторых характеристик атомов и свойств элементов в периодической системе Д. И. Менделеева Уменьшение радиуса атома Увеличение значений энергий ионизации, сродства к электрону, ОЭО Усиление неметаллических и окислительных свойств элементов Ослабление основных свойств оксидов Уменьшение температур кипения и плавления простых веществ.
Изменение некоторых характеристик атомов и свойств элементов в периодической системе Д. И. Менделеева Уменьшение радиуса атома Увеличение значений энергий ионизации, сродства к электрону, ОЭО Усиление неметаллических и окислительных свойств элементов Ослабление основных свойств оксидов Уменьшение температур кипения и плавления простых веществ.
 Подгруппы аналогов 1. Подгруппа щелочных металлов. 1. Общая электронная формула …ns Возбужденного состояния нет. Максимальная степень окисления +1. Общая формула оксидов Ме 2 О. Водородные соединения Ме. Нгидриды.
Подгруппы аналогов 1. Подгруппа щелочных металлов. 1. Общая электронная формула …ns Возбужденного состояния нет. Максимальная степень окисления +1. Общая формула оксидов Ме 2 О. Водородные соединения Ме. Нгидриды.
 Подгруппа бериллия. 2. Общая электронная формула …ns Возбужденное состояние есть. Максимальная степень окисления +2. Общая формула оксидов Ме. О. Водородные соединения Ме. Н 2 -гидриды.
Подгруппа бериллия. 2. Общая электронная формула …ns Возбужденное состояние есть. Максимальная степень окисления +2. Общая формула оксидов Ме. О. Водородные соединения Ме. Н 2 -гидриды.
 3. Подгруппа бора Общая электронная формула …ns 2 np 1. Возбужденное состояние есть. Максимальная степень окисления +3. Общая формула оксидов Э 2 О 3. Бор – неметалл. Простейшее водородное соединение ВН 3 бороводород. Остальные элементы металлы. Водородные соединения Ме. Н 3 -гидриды
3. Подгруппа бора Общая электронная формула …ns 2 np 1. Возбужденное состояние есть. Максимальная степень окисления +3. Общая формула оксидов Э 2 О 3. Бор – неметалл. Простейшее водородное соединение ВН 3 бороводород. Остальные элементы металлы. Водородные соединения Ме. Н 3 -гидриды
 4. Подгруппа углерода. . Общая электронная формула …ns 2 np 2. Возбужденное состояние есть. Максимальная степень окисления +4. Минимальная степень окисления – 4. Общая формула оксидов ЭО 2. Формула водородных соединений ЭН 4
4. Подгруппа углерода. . Общая электронная формула …ns 2 np 2. Возбужденное состояние есть. Максимальная степень окисления +4. Минимальная степень окисления – 4. Общая формула оксидов ЭО 2. Формула водородных соединений ЭН 4
 Характеристика элемента по его положению в периодической системе. 1. Положение в п. с. (порядковый номер, период, подгруппа).
Характеристика элемента по его положению в периодической системе. 1. Положение в п. с. (порядковый номер, период, подгруппа).
 ПРОДОЛЖЕНИЕ 2. Характеристика атома элемента: Заряд ядра Z, число протонов Nр, число нейтронов Nn, число электронов Ne. Полная электронная формула. Графическая электронная конфигурация валентных уровней в нормальном и возбужденном состояниях.
ПРОДОЛЖЕНИЕ 2. Характеристика атома элемента: Заряд ядра Z, число протонов Nр, число нейтронов Nn, число электронов Ne. Полная электронная формула. Графическая электронная конфигурация валентных уровней в нормальном и возбужденном состояниях.
 3. Электронное семейство к которому относится элемент, металл или неметалл, формула и характер высшего оксида (основной, амфотерный, кислотный) и соответствующего ему гидрата. Реакции подтверждающие свойства оксида и гидрата.
3. Электронное семейство к которому относится элемент, металл или неметалл, формула и характер высшего оксида (основной, амфотерный, кислотный) и соответствующего ему гидрата. Реакции подтверждающие свойства оксида и гидрата.
 Примеры 1. Дайте характеристику элемента № 56 по положению в п. с. 1)Элемент № 56 – барий 56 Ва. Ва находится в 6 периоде во второй группе главной подгруппы (IIA).
Примеры 1. Дайте характеристику элемента № 56 по положению в п. с. 1)Элемент № 56 – барий 56 Ва. Ва находится в 6 периоде во второй группе главной подгруппы (IIA).
 продолжение 2) Z=+56, A=137 1 p)=56, N(e)=56, N( 1 1 n)=A-N(1 p)=137 -56=81 N( 0 1 Электронная формула: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 6 2 6 s
продолжение 2) Z=+56, A=137 1 p)=56, N(e)=56, N( 1 1 n)=A-N(1 p)=137 -56=81 N( 0 1 Электронная формула: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 6 2 6 s
 Основное состояние: … 6 s 26 р0 В(Ва)=0 В(Ва*)=2 Возбужденное состояние … 6 s 16 р1
Основное состояние: … 6 s 26 р0 В(Ва)=0 В(Ва*)=2 Возбужденное состояние … 6 s 16 р1
 продолжение • 3. Ва – s-элемент, металл, ОЭО=0, 9. • Высший оксид Ва. О – основной. • Гидрат – Ва(ОН)2 -основание • Ва. О+Н 2 О=Ва(ОН)2; Ва. О+СО 2= Ва. СО 3; • Ва. О+2 HCl=Ba. Cl 2+ Н 2 О;
продолжение • 3. Ва – s-элемент, металл, ОЭО=0, 9. • Высший оксид Ва. О – основной. • Гидрат – Ва(ОН)2 -основание • Ва. О+Н 2 О=Ва(ОН)2; Ва. О+СО 2= Ва. СО 3; • Ва. О+2 HCl=Ba. Cl 2+ Н 2 О;
 Ba(OH)2+2 HCl=Ba. Cl 2+ Н 2 О Ba(OH)2+CO 2= Ba. CO 3 + Н 2 О Ba(OH)2 +K 2 SO 4= Ba. SO 4 + 2 KOН 2. Дайте характеристику элемента № 6, 17, 25, 74 по положению в п. с.
Ba(OH)2+2 HCl=Ba. Cl 2+ Н 2 О Ba(OH)2+CO 2= Ba. CO 3 + Н 2 О Ba(OH)2 +K 2 SO 4= Ba. SO 4 + 2 KOН 2. Дайте характеристику элемента № 6, 17, 25, 74 по положению в п. с.
 Проверочная работа 4 1. Что общего для элементов 5 периода А) число валентных электронов равно 5 Б) Число энергетических уровней равно 5 В) главное квантовое число равно 5 2. Запишите электронную формулу для атома бора (5 В). 3. Распределите электроны валентных подуровней по квантовым ячейкам для возбужденного состоянии. 4. Запишите значения квантовых чисел для 5 -го электрона атома бора.
Проверочная работа 4 1. Что общего для элементов 5 периода А) число валентных электронов равно 5 Б) Число энергетических уровней равно 5 В) главное квантовое число равно 5 2. Запишите электронную формулу для атома бора (5 В). 3. Распределите электроны валентных подуровней по квантовым ячейкам для возбужденного состоянии. 4. Запишите значения квантовых чисел для 5 -го электрона атома бора.
 Электронная конфигурация некоторых атомов Н 1 1 s H • He 2 1 s He: Al 1 s 2 2 p 1 Al •
Электронная конфигурация некоторых атомов Н 1 1 s H • He 2 1 s He: Al 1 s 2 2 p 1 Al •
 Спектр электромагнитного излучения Спектр видимого излучения 4· 10 -7 м 7· 10 -7 м
Спектр электромагнитного излучения Спектр видимого излучения 4· 10 -7 м 7· 10 -7 м
 Проверочная работа • Na. HCO 3 • 1 - назовите • 2 - укажите класс соединения • 3 - рассчитайте молярную массу соединения
Проверочная работа • Na. HCO 3 • 1 - назовите • 2 - укажите класс соединения • 3 - рассчитайте молярную массу соединения


