Acupan для врачей короткая.pptx
- Количество слайдов: 52
 ACUPAN® Nefopam Новый неопиатный анальгетик!
ACUPAN® Nefopam Новый неопиатный анальгетик!
 Лечение хирургической боли все еще является проблемой? Да
Лечение хирургической боли все еще является проблемой? Да
 Эпидемиология и стоимость хронической боли от 10 до 50% послеоперационных пациентов страдает от персистирующих болей 61% послеоперационных пациентов страдает от аномальных болей через год после торакотомии 22% мирового населения страдает от персистирующих болей 90 млн. $/год стоит лечение хронической боли в США (88 млн. населения) Dr Simonet SFAR 2009 Kehlet H, Lancet 2006; 367: 1618– 25
Эпидемиология и стоимость хронической боли от 10 до 50% послеоперационных пациентов страдает от персистирующих болей 61% послеоперационных пациентов страдает от аномальных болей через год после торакотомии 22% мирового населения страдает от персистирующих болей 90 млн. $/год стоит лечение хронической боли в США (88 млн. населения) Dr Simonet SFAR 2009 Kehlet H, Lancet 2006; 367: 1618– 25
 Влияние хирургической боли Негативные клинические последствия – Тромбоз глубоких вен – Лёгочная эмболия – Коронарная ишемия и инфаркт миокарда – Пневмония – Медленное заживление ран и выздоровление – Бессонница – Деморализация – Хроническая боль – Когнитивная дисфункция Apfebaum JL et Al Anesth anal 2003, 97: 534 -540 Carr Db, et Al Lancet 1999, 353: 2051 -2058 Kehlet H, et Al. Br J Anaesth 2001: 87: 62 -72
Влияние хирургической боли Негативные клинические последствия – Тромбоз глубоких вен – Лёгочная эмболия – Коронарная ишемия и инфаркт миокарда – Пневмония – Медленное заживление ран и выздоровление – Бессонница – Деморализация – Хроническая боль – Когнитивная дисфункция Apfebaum JL et Al Anesth anal 2003, 97: 534 -540 Carr Db, et Al Lancet 1999, 353: 2051 -2058 Kehlet H, et Al. Br J Anaesth 2001: 87: 62 -72
 Какие могут быть пути решения?
Какие могут быть пути решения?
 Мультимодальная стратегия обезболивания МУЛЬТИМОДАЛЬНАЯ (Сбалансированная) АНАЛЬГЕЗИЯ: Мультимодальная анальгезия - использование двух или более анальгетиков с разными механизмами действия для достижения максимального анальгезирующего эффекта без увеличения вероятности побочных эффектов по сравнению с аналогичной дозой монопрепарата. Комбинация препаратов может иметь аддитивный или синергический эффект² За исключением противопоказаний анестезиологи должны применять мультимодальную анальгезию 3 1. Kehlet H, Dahl JB. The value of « multimodal or « balanced analgesia » in postoperative treatment. Anesth Analg 1993; 77: 1048 -56 2. L’analgésie multimodale Les Essentiels 2005, p. 295 -308. http: //www. anesthesie-foch. org/s/article. php 3? id_article=631 09. 2009 3. Delage Anesthesiology, V 102, No 6, Jun 2005
Мультимодальная стратегия обезболивания МУЛЬТИМОДАЛЬНАЯ (Сбалансированная) АНАЛЬГЕЗИЯ: Мультимодальная анальгезия - использование двух или более анальгетиков с разными механизмами действия для достижения максимального анальгезирующего эффекта без увеличения вероятности побочных эффектов по сравнению с аналогичной дозой монопрепарата. Комбинация препаратов может иметь аддитивный или синергический эффект² За исключением противопоказаний анестезиологи должны применять мультимодальную анальгезию 3 1. Kehlet H, Dahl JB. The value of « multimodal or « balanced analgesia » in postoperative treatment. Anesth Analg 1993; 77: 1048 -56 2. L’analgésie multimodale Les Essentiels 2005, p. 295 -308. http: //www. anesthesie-foch. org/s/article. php 3? id_article=631 09. 2009 3. Delage Anesthesiology, V 102, No 6, Jun 2005
 Мультимодальная аналгезия 1 Морфин Снижение дозы каждого анальгетика Улучшение обезболивания благодаря синергическим / аддитивным эффектам Другие препараты с другими механизмами действия 1. Снижается тяжесть побочных эффектов каждого отдельного препарата Kehlet H, Dahl JB. The value of « multimodal or « balanced analgesia » in postoperative treatment. nesth Analg 1993; 77: 1048 -56 A
Мультимодальная аналгезия 1 Морфин Снижение дозы каждого анальгетика Улучшение обезболивания благодаря синергическим / аддитивным эффектам Другие препараты с другими механизмами действия 1. Снижается тяжесть побочных эффектов каждого отдельного препарата Kehlet H, Dahl JB. The value of « multimodal or « balanced analgesia » in postoperative treatment. nesth Analg 1993; 77: 1048 -56 A
 Мультимодальная стратегия купирования боли Одобрено многими профессиональными организациями: – Американское общество анестезиологов 2 – Американское общество изучения боли 3 – SFAR – Французское общество анестезии и реанимации 4 1. 2. 3. 4. Kehlet H, Dahl JB. The value of « multimodal or « balanced analgesia » in postoperative treatment. nesth Analg 1993; 77: 1048 -56 A American Society of Anesthesiologists Task Force on Acute Pain Management. Practice guidelines for acute pain management in the perioperative setting: an updated report by the American Society of Anesthesiologists Task Force on Acute Pain Management. Anesthesiology. 2004; 100: 1573 -1581. Gordon DB, Dahl JL, Miaskowski C, et al. American Pain Society recommendations for improving the quality of acute and cancer pain management. Arch Intern Med. 2005; 165: 1574 -1580. http: //www. sfar. org/douleurpratique. html
Мультимодальная стратегия купирования боли Одобрено многими профессиональными организациями: – Американское общество анестезиологов 2 – Американское общество изучения боли 3 – SFAR – Французское общество анестезии и реанимации 4 1. 2. 3. 4. Kehlet H, Dahl JB. The value of « multimodal or « balanced analgesia » in postoperative treatment. nesth Analg 1993; 77: 1048 -56 A American Society of Anesthesiologists Task Force on Acute Pain Management. Practice guidelines for acute pain management in the perioperative setting: an updated report by the American Society of Anesthesiologists Task Force on Acute Pain Management. Anesthesiology. 2004; 100: 1573 -1581. Gordon DB, Dahl JL, Miaskowski C, et al. American Pain Society recommendations for improving the quality of acute and cancer pain management. Arch Intern Med. 2005; 165: 1574 -1580. http: //www. sfar. org/douleurpratique. html
 ACUPAN® описание INN: Терапевтический класс Nefopam Химический класс: Benzoxazocine Представлен: >более чем в 30 странах N 02 ANALGESICS N 02 BG “другие анальгетики и антипиретики” ” N 02 BG 06
ACUPAN® описание INN: Терапевтический класс Nefopam Химический класс: Benzoxazocine Представлен: >более чем в 30 странах N 02 ANALGESICS N 02 BG “другие анальгетики и антипиретики” ” N 02 BG 06
 Nefopam оригинальная молекула Нефопам гидрохлорид
Nefopam оригинальная молекула Нефопам гидрохлорид
 АКУПАН®: механизм действия Центральный анальгетик неморфинного ряда
АКУПАН®: механизм действия Центральный анальгетик неморфинного ряда
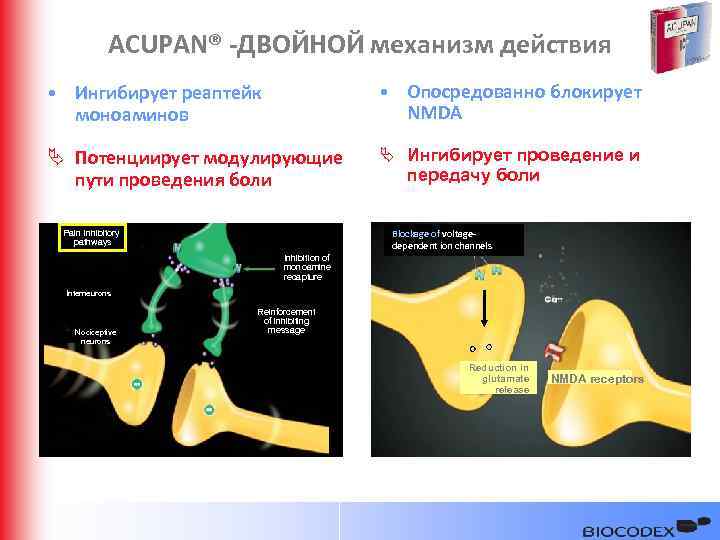 ACUPAN® -ДВОЙНОЙ механизм действия • Ингибирует реаптейк моноаминов • Опосредованно блокирует NMDA Ä Потенциирует модулирующие пути проведения боли Ä Ингибирует проведение и передачу боли Pain inhibitory pathways Blockage of voltagedependent ion channels Inhibition of monoamine recapture Interneurons Nociceptive neurons Reinforcement of inhibiting message Reduction in glutamate release NMDA receptors
ACUPAN® -ДВОЙНОЙ механизм действия • Ингибирует реаптейк моноаминов • Опосредованно блокирует NMDA Ä Потенциирует модулирующие пути проведения боли Ä Ингибирует проведение и передачу боли Pain inhibitory pathways Blockage of voltagedependent ion channels Inhibition of monoamine recapture Interneurons Nociceptive neurons Reinforcement of inhibiting message Reduction in glutamate release NMDA receptors
 Как АКУПАН® контролирует боль? Исследование Girard * 2006 г. => аффинность рецепторов АКУПАН® активирует адренергические, допаминергические и серотонинергические пути через: – Адренергические 1 и 2 – Допаминергические D 2 – Серотонинергические 5 -HT 1 B and 5 -HT 2 C Не действует на: – Допаминергические D 1 – Серотонинергические 5 -HT 1 A, 5 -HT 2 A, 5 -HT 3 и 5 -HT 4 АКУПАН® увеличивает концентрацию моноаминов в синаптической щели *Тест проводился с рецепторами агонистов Girard P, Pharmacol Res. 2006; 54: 195 -202
Как АКУПАН® контролирует боль? Исследование Girard * 2006 г. => аффинность рецепторов АКУПАН® активирует адренергические, допаминергические и серотонинергические пути через: – Адренергические 1 и 2 – Допаминергические D 2 – Серотонинергические 5 -HT 1 B and 5 -HT 2 C Не действует на: – Допаминергические D 1 – Серотонинергические 5 -HT 1 A, 5 -HT 2 A, 5 -HT 3 и 5 -HT 4 АКУПАН® увеличивает концентрацию моноаминов в синаптической щели *Тест проводился с рецепторами агонистов Girard P, Pharmacol Res. 2006; 54: 195 -202
 АКУПАН®: свойства АКУПАН® эквипотентен морфину в соотношении 1/3 20 мг нефопама = 6 - 12 мг морфина(1, 2) Экономия морфина (3, 4) = 22 - 50 % (1) (2) (3) (4) Philipps et al Brit. J. Anaesthesia 1979, 51 : 961 -65 Sunshine. Clin Pharmacol Ther 1975; 5(18) : 530 -4 Du Manoir BJA 2003, 91 : (6) Mimoz et al. Anaesthesia 2001 ; 56(6) : 520 -5
АКУПАН®: свойства АКУПАН® эквипотентен морфину в соотношении 1/3 20 мг нефопама = 6 - 12 мг морфина(1, 2) Экономия морфина (3, 4) = 22 - 50 % (1) (2) (3) (4) Philipps et al Brit. J. Anaesthesia 1979, 51 : 961 -65 Sunshine. Clin Pharmacol Ther 1975; 5(18) : 530 -4 Du Manoir BJA 2003, 91 : (6) Mimoz et al. Anaesthesia 2001 ; 56(6) : 520 -5
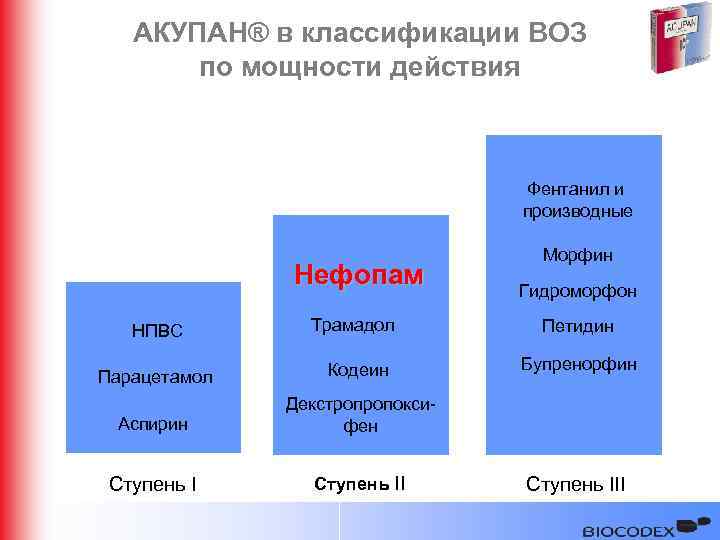 АКУПАН® в классификации ВОЗ по мощности действия Фентанил и производные Нефопам Морфин Гидроморфон НПВС Трамадол Петидин Парацетамол Кодеин Бупренорфин Аспирин Декстропропоксифен Ступень III
АКУПАН® в классификации ВОЗ по мощности действия Фентанил и производные Нефопам Морфин Гидроморфон НПВС Трамадол Петидин Парацетамол Кодеин Бупренорфин Аспирин Декстропропоксифен Ступень III
 Акупан vs Трамал Неопиатный анальгетик (производное бензоксазоцина, отдельный класс) средней анальгетической потенции Синтетический опиоид средней анальгетической потенции Двойной механизм действия: -ингибирует обратный захват NA, HT, D -снижает высвобождение глутамата и активирует NMDA рецепторы Двойной механизм действия: -ингибирует обратный захват NA и HT, активирует открытие К и Са каналов -слабый мю-агонист -разрешен с 12 лет -только острая боль -разрешен с 1 года (трамадол- с 14 лет) -показания в лечении боли у онкобольных -холинолитик (сухость во рту, противопоказан больным с аденомой, глаукомой) -воздействует на А 1 рецепторы, вызывает тахикардию -потливость, тошнота и головокружение - наиболее частые побочные эффекты -холинолитик -вызывает тахикардию -Сонливость, тошнота, головокружение и сухость во рту-наиболее частые побочные эффекты -не угнетает ЦНС -не воздействует на агрегацию тромбоцитов -не угнетает дыхание -не влияет на состояние слизистой ЖКТ и моторику -вызывает сонливость/седацию -не воздействует на агрегацию тромбоцитов -не угнетает дыхание -слабо влияет на состояние слизистой ЖКТ и моторику
Акупан vs Трамал Неопиатный анальгетик (производное бензоксазоцина, отдельный класс) средней анальгетической потенции Синтетический опиоид средней анальгетической потенции Двойной механизм действия: -ингибирует обратный захват NA, HT, D -снижает высвобождение глутамата и активирует NMDA рецепторы Двойной механизм действия: -ингибирует обратный захват NA и HT, активирует открытие К и Са каналов -слабый мю-агонист -разрешен с 12 лет -только острая боль -разрешен с 1 года (трамадол- с 14 лет) -показания в лечении боли у онкобольных -холинолитик (сухость во рту, противопоказан больным с аденомой, глаукомой) -воздействует на А 1 рецепторы, вызывает тахикардию -потливость, тошнота и головокружение - наиболее частые побочные эффекты -холинолитик -вызывает тахикардию -Сонливость, тошнота, головокружение и сухость во рту-наиболее частые побочные эффекты -не угнетает ЦНС -не воздействует на агрегацию тромбоцитов -не угнетает дыхание -не влияет на состояние слизистой ЖКТ и моторику -вызывает сонливость/седацию -не воздействует на агрегацию тромбоцитов -не угнетает дыхание -слабо влияет на состояние слизистой ЖКТ и моторику
 Акупан vs Трамал +++ -Антиноцицептивная активность -Антигипералгезическая активность -Противоознобная активность ++ -период полувыведения 4 часа -связывание с белками плазмы 71 -76% -выводится почками (87%) -передозировка по типу атропиновой комы (индекс ТТ=40) -период полувыведения 5 -6 часов -связывание с белками плазмы 20% -выводится почками (90%) -Благодаря механизму действия и отсутствию влияния на мю-рецепторы Акупан обладает выраженным антигиперальзическим эффектом, тем самым ограничивая процесс развития нейропластичности -Анальгетическая активность не зависит от CYP 2 D 6 -Действует на рецепторы 5 HT 3, не поддающиеся влиянию таких антагонистов 5 HT 3, как ондансетрон (Girard et al. Pharmacology 2009; 83: 243 -6). -Анальгетическая активность зависит от CYP 2 D 6 (как у кодеина) -Анальгетическая активность находится под влиянием таких антагонистов 5 HT 3, как ондансетрон (Arcioni et al. Anesth Analg 2002; 94: 1553 -7). АКУПАН НЕЛЬЗЯ сочетать с ТРАМАДОЛОМ в рамках ММА
Акупан vs Трамал +++ -Антиноцицептивная активность -Антигипералгезическая активность -Противоознобная активность ++ -период полувыведения 4 часа -связывание с белками плазмы 71 -76% -выводится почками (87%) -передозировка по типу атропиновой комы (индекс ТТ=40) -период полувыведения 5 -6 часов -связывание с белками плазмы 20% -выводится почками (90%) -Благодаря механизму действия и отсутствию влияния на мю-рецепторы Акупан обладает выраженным антигиперальзическим эффектом, тем самым ограничивая процесс развития нейропластичности -Анальгетическая активность не зависит от CYP 2 D 6 -Действует на рецепторы 5 HT 3, не поддающиеся влиянию таких антагонистов 5 HT 3, как ондансетрон (Girard et al. Pharmacology 2009; 83: 243 -6). -Анальгетическая активность зависит от CYP 2 D 6 (как у кодеина) -Анальгетическая активность находится под влиянием таких антагонистов 5 HT 3, как ондансетрон (Arcioni et al. Anesth Analg 2002; 94: 1553 -7). АКУПАН НЕЛЬЗЯ сочетать с ТРАМАДОЛОМ в рамках ММА
 Акупан® - основные преимущества Снижает потребление опиатов на 35 -50% Не обладает побочными эффектами НПВС (не влияет на агрегацию тромбоцитов, на состояние слизистой ЖКТ и моторику ) – препарат выбора для больных с заболеваниями ЖКТ Профилактика посленаркозного озноба Возможен внутримышечный и внутривенный способы введения Разрешен к применению с 12 лет 1. Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5 2. Du Manoir BJA 2003, 91: (6) 3. Tirault M. Anesth Analg. 2006 Jan; 102(1): 110 -7. 4. Rôhm KD. Anaesthesia. 2005 May; 60(5): 433 -8
Акупан® - основные преимущества Снижает потребление опиатов на 35 -50% Не обладает побочными эффектами НПВС (не влияет на агрегацию тромбоцитов, на состояние слизистой ЖКТ и моторику ) – препарат выбора для больных с заболеваниями ЖКТ Профилактика посленаркозного озноба Возможен внутримышечный и внутривенный способы введения Разрешен к применению с 12 лет 1. Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5 2. Du Manoir BJA 2003, 91: (6) 3. Tirault M. Anesth Analg. 2006 Jan; 102(1): 110 -7. 4. Rôhm KD. Anaesthesia. 2005 May; 60(5): 433 -8
 Мультимодальная/сбалансированная аналгезия АКУПАН® и опиоидные анальгетики Акупан® и неопиоидные анальгетики
Мультимодальная/сбалансированная аналгезия АКУПАН® и опиоидные анальгетики Акупан® и неопиоидные анальгетики
 Рандомизированнное проспективное исследование анальгетического эффекта нефопама после ортопедических операций Du Manoir B, Aubrun F, Langlois M, Le Guern ME, Alquier C, Chauvin M, Fletcher D. Br J Anaesth. 2003 ; 91 : 836 -41.
Рандомизированнное проспективное исследование анальгетического эффекта нефопама после ортопедических операций Du Manoir B, Aubrun F, Langlois M, Le Guern ME, Alquier C, Chauvin M, Fletcher D. Br J Anaesth. 2003 ; 91 : 836 -41.
 Исследование Du Manoir: Цель: Оценить аналгезию и переносимость при использовании нефопама в комбинации с морфином после ортопедических операций. Основные критерии оценки – Суммарная доза морфина, введенного методом АУП в теч. 24 ч Пациенты: – – 201 пациент 18 - 75 лет, артропластика бедра под стандартной общей анестезией показатели по шкале ASA I ± III ASA = Американское общество анестезиологии Du Manoir B, Br J Anaesth. 2003 ; 91 : 836 -41.
Исследование Du Manoir: Цель: Оценить аналгезию и переносимость при использовании нефопама в комбинации с морфином после ортопедических операций. Основные критерии оценки – Суммарная доза морфина, введенного методом АУП в теч. 24 ч Пациенты: – – 201 пациент 18 - 75 лет, артропластика бедра под стандартной общей анестезией показатели по шкале ASA I ± III ASA = Американское общество анестезиологии Du Manoir B, Br J Anaesth. 2003 ; 91 : 836 -41.
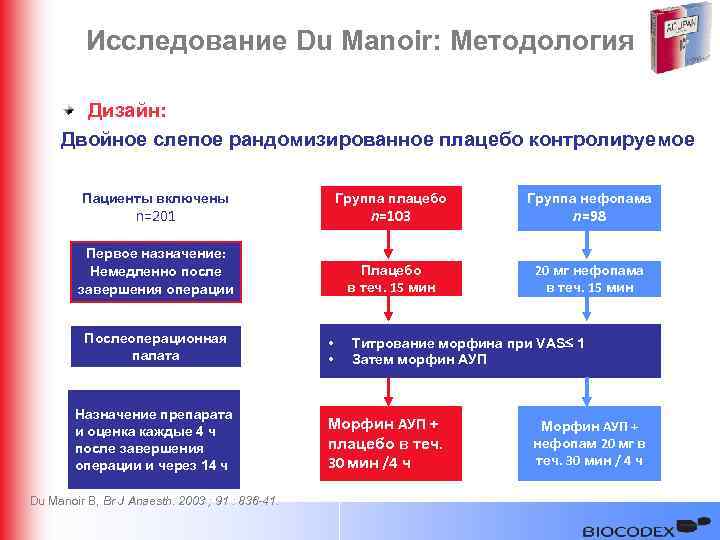 Исследование Du Manoir: Методология Дизайн: Двойное слепое рандомизированное плацебо контролируемое Пациенты включены Группа плацебо Группа нефопама Первое назначение: Немедленно после завершения операции Плацебо в теч. 15 мин 20 мг нефопама в теч. 15 мин n=201 Послеоперационная палата Назначение препарата и оценка каждые 4 ч после завершения операции и через 14 ч Du Manoir B, Br J Anaesth. 2003 ; 91 : 836 -41. n=103 • • n=98 Титрование морфина при VAS 1 Затем морфин АУП Морфин АУП + плацебо в теч. 30 мин /4 ч Морфин АУП + нефопам 20 мг в теч. 30 мин / 4 ч
Исследование Du Manoir: Методология Дизайн: Двойное слепое рандомизированное плацебо контролируемое Пациенты включены Группа плацебо Группа нефопама Первое назначение: Немедленно после завершения операции Плацебо в теч. 15 мин 20 мг нефопама в теч. 15 мин n=201 Послеоперационная палата Назначение препарата и оценка каждые 4 ч после завершения операции и через 14 ч Du Manoir B, Br J Anaesth. 2003 ; 91 : 836 -41. n=103 • • n=98 Титрование морфина при VAS 1 Затем морфин АУП Морфин АУП + плацебо в теч. 30 мин /4 ч Морфин АУП + нефопам 20 мг в теч. 30 мин / 4 ч
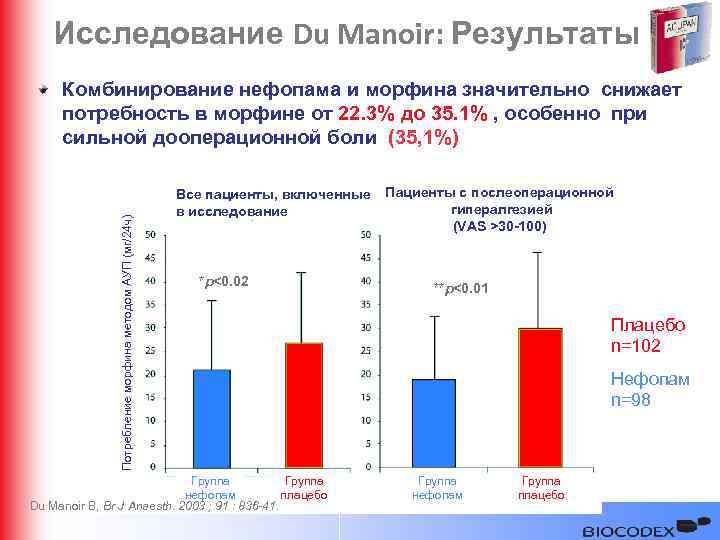 Исследование Du Manoir: Результаты Потребление морфина методом АУП (мг/24 ч) Комбинирование нефопама и морфина значительно снижает потребность в морфине от 22. 3% до 35. 1% , особенно при сильной дооперационной боли (35, 1%) Все пациенты, включенные в исследование *p<0. 02 Группа нефопам плацебо Du Manoir B, Br J Anaesth. 2003 ; 91 : 836 -41. Пациенты с послеоперационной гипералгезией (VAS >30 -100) **p<0. 01 Плацебо n=102 Нефопам n=98 Группа нефопам Группа плацебо
Исследование Du Manoir: Результаты Потребление морфина методом АУП (мг/24 ч) Комбинирование нефопама и морфина значительно снижает потребность в морфине от 22. 3% до 35. 1% , особенно при сильной дооперационной боли (35, 1%) Все пациенты, включенные в исследование *p<0. 02 Группа нефопам плацебо Du Manoir B, Br J Anaesth. 2003 ; 91 : 836 -41. Пациенты с послеоперационной гипералгезией (VAS >30 -100) **p<0. 01 Плацебо n=102 Нефопам n=98 Группа нефопам Группа плацебо
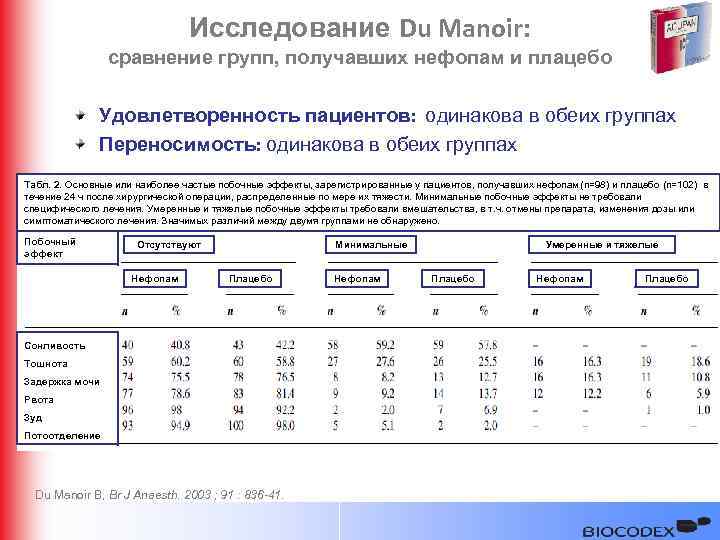 Исследование Du Manoir: сравнение групп, получавших нефопам и плацебо Удовлетворенность пациентов: одинакова в обеих группах Переносимость: одинакова в обеих группах Табл. 2. Основные или наиболее частые побочные эффекты, зарегистрированные у пациентов, получавших нефопам (n=98) и плацебо (n=102) в течение 24 ч после хирургической операции, распределенные по мере их тяжести. Минимальные побочные эффекты не требовали специфического лечения. Умеренные и тяжелые побочные эффекты требовали вмешательства, в т. ч. отмены препарата, изменения дозы или симптоматического лечения. Значимых различий между двумя группами не обнаружено. Побочный эффект Отсутствуют Нефопам Минимальные Плацебо Сонливость Тошнота Задержка мочи Рвота Зуд Потоотделение Du Manoir B, Br J Anaesth. 2003 ; 91 : 836 -41. Нефопам Умеренные и тяжелые Плацебо Нефопам Плацебо
Исследование Du Manoir: сравнение групп, получавших нефопам и плацебо Удовлетворенность пациентов: одинакова в обеих группах Переносимость: одинакова в обеих группах Табл. 2. Основные или наиболее частые побочные эффекты, зарегистрированные у пациентов, получавших нефопам (n=98) и плацебо (n=102) в течение 24 ч после хирургической операции, распределенные по мере их тяжести. Минимальные побочные эффекты не требовали специфического лечения. Умеренные и тяжелые побочные эффекты требовали вмешательства, в т. ч. отмены препарата, изменения дозы или симптоматического лечения. Значимых различий между двумя группами не обнаружено. Побочный эффект Отсутствуют Нефопам Минимальные Плацебо Сонливость Тошнота Задержка мочи Рвота Зуд Потоотделение Du Manoir B, Br J Anaesth. 2003 ; 91 : 836 -41. Нефопам Умеренные и тяжелые Плацебо Нефопам Плацебо
 Исследование Du Manoir: Выводы « В комбинации с введением морфина методом АУП нефопам дает значительную экономию морфина с более низкими показателями боли в ранний послеоперационный период без серьезных побочных эффектов. Этот анальгетический эффект представляется особенно значимым для пациентов с интенсивной дооперационной болью»
Исследование Du Manoir: Выводы « В комбинации с введением морфина методом АУП нефопам дает значительную экономию морфина с более низкими показателями боли в ранний послеоперационный период без серьезных побочных эффектов. Этот анальгетический эффект представляется особенно значимым для пациентов с интенсивной дооперационной болью»
 Анальгетическая эффективность и безопасность нефопама в сравнении с пропацетамолом при резекции печени Mimoz O, Incagnoli P, Josse C, Gillon MC, Kuhlman L, Mirand A, Soilleux H, Fletcher D. Anaesthesia. 2001 Jun; 56(6): 520 -5
Анальгетическая эффективность и безопасность нефопама в сравнении с пропацетамолом при резекции печени Mimoz O, Incagnoli P, Josse C, Gillon MC, Kuhlman L, Mirand A, Soilleux H, Fletcher D. Anaesthesia. 2001 Jun; 56(6): 520 -5
 Исследование Mimoz: Методология Обоснование: Применение НПВС не рекомендуется у пациентов с почечной или печеночной недостаточностью. Нефопам и пропацетамол представляются адекватной терапевтической альтернативой. Цель: Сравнить уровень экономии морфина, болеутоляющую эффективность и переносимость нефопама и пропацетамола, назначаемых в самых высоких рекомендуемых дозах больным, переносящим элективную резекции печени Пациенты – – 120 пациентов 18 - 75 лет Запланированная элективная резекция печени Результат по шкале ASA от 1 до 3 Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5 ASA = Американское общество анестезиологии
Исследование Mimoz: Методология Обоснование: Применение НПВС не рекомендуется у пациентов с почечной или печеночной недостаточностью. Нефопам и пропацетамол представляются адекватной терапевтической альтернативой. Цель: Сравнить уровень экономии морфина, болеутоляющую эффективность и переносимость нефопама и пропацетамола, назначаемых в самых высоких рекомендуемых дозах больным, переносящим элективную резекции печени Пациенты – – 120 пациентов 18 - 75 лет Запланированная элективная резекция печени Результат по шкале ASA от 1 до 3 Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5 ASA = Американское общество анестезиологии
 Исследование Mimoz : Методология (2) Дизайн: открытое рандомизированное исследование Контроль N=40 Сразу после операции Пропацетамол N=40 Пропацетамол 2 г в/в в теч 15 мин Нефопам N=40 Нефопам 20 мг в/в в теч 60 мин Послеопер ационная палата 1) Морфин титрование до результата < 4 по шкале VAS* 2) Морфин АУП Начало АУП (до 24 ч) Морфин АУП Морфин + пропацетамол 2 г/6 ч АУП морфин + нефопам 20 мг/4 ч Оценка боли каждые 4 ч. При результате по шкале VAS* > 3 => экстренная терапия = 5 мг морфина подкожно. * VAS: визуальная аналоговая шкала 0=нет боли 10=наиболее сильная боль Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5
Исследование Mimoz : Методология (2) Дизайн: открытое рандомизированное исследование Контроль N=40 Сразу после операции Пропацетамол N=40 Пропацетамол 2 г в/в в теч 15 мин Нефопам N=40 Нефопам 20 мг в/в в теч 60 мин Послеопер ационная палата 1) Морфин титрование до результата < 4 по шкале VAS* 2) Морфин АУП Начало АУП (до 24 ч) Морфин АУП Морфин + пропацетамол 2 г/6 ч АУП морфин + нефопам 20 мг/4 ч Оценка боли каждые 4 ч. При результате по шкале VAS* > 3 => экстренная терапия = 5 мг морфина подкожно. * VAS: визуальная аналоговая шкала 0=нет боли 10=наиболее сильная боль Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5
 Исследование Mimoz: Результаты 50% снижение Main Criteria: потребности морфина в группе Акупана p<0, 05 * * ** p<0, 05 vs morphine alone * p<0, 05 vs morphine + propacétamol h Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5 * ** 20 % снижение потребности морфина в группе пропацетамола p=0, 15.
Исследование Mimoz: Результаты 50% снижение Main Criteria: потребности морфина в группе Акупана p<0, 05 * * ** p<0, 05 vs morphine alone * p<0, 05 vs morphine + propacétamol h Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5 * ** 20 % снижение потребности морфина в группе пропацетамола p=0, 15.
 Исследование Mimoz: Результаты (2) Вторичные критерии Визуальная аналоговая шкала Акупан+морфин. Морфин к Акупан + приводят значимо большему снижению достоверно уменьшают боль боли, чем только морфин или чем морфин или + морфин + пропацетамол propacetamol после 4 и 24 ч (через 4 ч и 24 ч) * * p<0, 05 vs morphine alone or morphine + propacétamol Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5
Исследование Mimoz: Результаты (2) Вторичные критерии Визуальная аналоговая шкала Акупан+морфин. Морфин к Акупан + приводят значимо большему снижению достоверно уменьшают боль боли, чем только морфин или чем морфин или + морфин + пропацетамол propacetamol после 4 и 24 ч (через 4 ч и 24 ч) * * p<0, 05 vs morphine alone or morphine + propacétamol Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5
 Исследование Mimoz : Результаты (3) Вторичные критерии * Седация Тошнота Рвота Побочные эффекты Существенное Существенно снижение уменьшают частоты тошноту возникновения тошноты * ** Сухость во рту Тахикардия Потоотделение Головокруж. Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5 p<0, 05 vs morphine alone p<0, 05 morphine + propacétamol
Исследование Mimoz : Результаты (3) Вторичные критерии * Седация Тошнота Рвота Побочные эффекты Существенное Существенно снижение уменьшают частоты тошноту возникновения тошноты * ** Сухость во рту Тахикардия Потоотделение Головокруж. Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5 p<0, 05 vs morphine alone p<0, 05 morphine + propacétamol
 Исследование Mimoz : Выводы Удовлетворенность пациентов – Только морфин 82% – Пропацетамол + морфин: 74% – Акупан + морфин: 97 % « Для пациентов, переносящих резекцию печени, нефопам дает лучшие результаты по сравнению с пропацетамолом: – снижает потребность в морфине на 50% (пропацетамол только на 20%) – значимо большее снижение боли – существенное снижение побочных эффектов – удовлетворенность пациентов Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5
Исследование Mimoz : Выводы Удовлетворенность пациентов – Только морфин 82% – Пропацетамол + морфин: 74% – Акупан + морфин: 97 % « Для пациентов, переносящих резекцию печени, нефопам дает лучшие результаты по сравнению с пропацетамолом: – снижает потребность в морфине на 50% (пропацетамол только на 20%) – значимо большее снижение боли – существенное снижение побочных эффектов – удовлетворенность пациентов Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5
 Мультимодальная/сбалансированная аналгезия Акупан® и опиоидные анальгетики Акупан® и неопиоидные анальгетики
Мультимодальная/сбалансированная аналгезия Акупан® и опиоидные анальгетики Акупан® и неопиоидные анальгетики
 Средняя эффективная доза (ED 50) нефопама и кетопрофена у послеоперационных пациентов: исследование взаимодействия с использованием последовательного и изоболографического анализа Delage N, Maaliki H, Beloeil H, Benhamou D, Mazoit JX. Anesthesiology. 2005 Jun; 102(6): 1211 -6.
Средняя эффективная доза (ED 50) нефопама и кетопрофена у послеоперационных пациентов: исследование взаимодействия с использованием последовательного и изоболографического анализа Delage N, Maaliki H, Beloeil H, Benhamou D, Mazoit JX. Anesthesiology. 2005 Jun; 102(6): 1211 -6.
 Исследование Delage: Методология Обоснование НПВС действуют как на центральном, так и на периферическое уровне, главным образом уменьшая продукцию простогландинов. Кетопрофен широко используется. На животных было продемонстрировано синергическое действие морфина и НПВС. • Цель • определить средние эффективные болеутоляющие дозы каждого лекарственного средства и определить, синергично ли взаимодействие нефопама и кетопрофена Пациенты – 72 пациента – Результаты по шкале ASA I or II – Операции средней болезненности (такие как паховая грыжа, восстановительная хирургия или малая хирургия уха, носа, горла) ASA = Американское общество анестезиологии Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6.
Исследование Delage: Методология Обоснование НПВС действуют как на центральном, так и на периферическое уровне, главным образом уменьшая продукцию простогландинов. Кетопрофен широко используется. На животных было продемонстрировано синергическое действие морфина и НПВС. • Цель • определить средние эффективные болеутоляющие дозы каждого лекарственного средства и определить, синергично ли взаимодействие нефопама и кетопрофена Пациенты – 72 пациента – Результаты по шкале ASA I or II – Операции средней болезненности (такие как паховая грыжа, восстановительная хирургия или малая хирургия уха, носа, горла) ASA = Американское общество анестезиологии Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6.
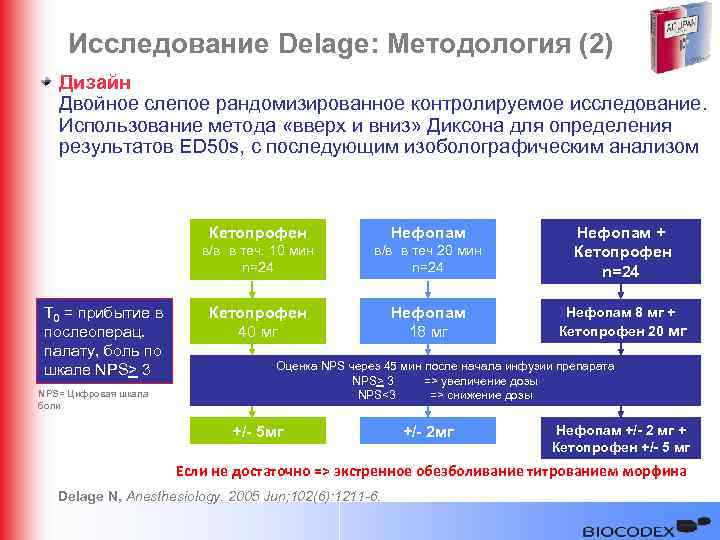 Исследование Delage: Методология (2) Дизайн Двойное слепое рандомизированное контролируемое исследование. Использование метода «вверх и вниз» Диксона для определения результатов ED 50 s, с последующим изоболографическим анализом Кетопрофен в/в в теч. 10 мин n=24 Т 0 = прибытие в послеоперац. палату, боль по шкале NPS> 3 NPS= Цифровая шкала боли Нефопам в/в в теч 20 мин n=24 Нефопам + Кетопрофен n=24 Кетопрофен 40 мг Нефопам 18 мг Нефопам 8 мг + Кетопрофен 20 мг Оценка NPS через 45 мин после начала инфузии препарата NPS> 3 => увеличение дозы NPS<3 => снижение дозы +/- 5 мг +/- 2 мг Нефопам +/- 2 мг + Кетопрофен +/- 5 мг Если не достаточно => экстренное обезболивание титрованием морфина Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6.
Исследование Delage: Методология (2) Дизайн Двойное слепое рандомизированное контролируемое исследование. Использование метода «вверх и вниз» Диксона для определения результатов ED 50 s, с последующим изоболографическим анализом Кетопрофен в/в в теч. 10 мин n=24 Т 0 = прибытие в послеоперац. палату, боль по шкале NPS> 3 NPS= Цифровая шкала боли Нефопам в/в в теч 20 мин n=24 Нефопам + Кетопрофен n=24 Кетопрофен 40 мг Нефопам 18 мг Нефопам 8 мг + Кетопрофен 20 мг Оценка NPS через 45 мин после начала инфузии препарата NPS> 3 => увеличение дозы NPS<3 => снижение дозы +/- 5 мг +/- 2 мг Нефопам +/- 2 мг + Кетопрофен +/- 5 мг Если не достаточно => экстренное обезболивание титрованием морфина Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6.
 Исследование Delage: Методология (3) Критерии: – ED 50 (срединная эффективная болеутоляющая доза) для каждого лекарственного средства, а также срединная ED 50 их комбинации с использованием стратегии «вверх и вниз» (NPS <3 = эффективность) – Изоболографический анализ: графический метод, позволяющий определить , как два (или более чем два) препарата ведут себя, когда используются в комбинации. Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6.
Исследование Delage: Методология (3) Критерии: – ED 50 (срединная эффективная болеутоляющая доза) для каждого лекарственного средства, а также срединная ED 50 их комбинации с использованием стратегии «вверх и вниз» (NPS <3 = эффективность) – Изоболографический анализ: графический метод, позволяющий определить , как два (или более чем два) препарата ведут себя, когда используются в комбинации. Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6.
 Исследование Delage: Результаты Средние Кетопрофен анальгетические дозы Нефопам Один препарат 30 мг (14 -46 мг) 28 мг (17 -39 мг) Комбинация 4, 3 мг (2, 2 -6, 5 мг) 1, 75 мг (0, 9 -2, 3 мг ) Существенный синергический эффект комбинации Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6. Изоболографическое представление действия кетопрофена и нефопама в комбинации.
Исследование Delage: Результаты Средние Кетопрофен анальгетические дозы Нефопам Один препарат 30 мг (14 -46 мг) 28 мг (17 -39 мг) Комбинация 4, 3 мг (2, 2 -6, 5 мг) 1, 75 мг (0, 9 -2, 3 мг ) Существенный синергический эффект комбинации Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6. Изоболографическое представление действия кетопрофена и нефопама в комбинации.
 Исследование Delage: Результаты Табл. 2. Частота побочных эффектов Потоотделение Тошнота Рвота Головокружение Сухость во рту Местная боль при инфузии Головная боль Боль в желудке Зуд Кожная сыпь Гипертензия Тахикардия Побочные эффекты регистрировались каждые 30 минут в послеоперационной палате до перевода в отделение (все пациенты оставались в послеоперационной палате не менее 60 минут ). Если отрицательное воздействие было отмечено в любое время в течение этого периода, это считалось положительным проявлением. * P 0. 05 по сравн. нефопам и комбинации нефопам+кетопрофен. Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6.
Исследование Delage: Результаты Табл. 2. Частота побочных эффектов Потоотделение Тошнота Рвота Головокружение Сухость во рту Местная боль при инфузии Головная боль Боль в желудке Зуд Кожная сыпь Гипертензия Тахикардия Побочные эффекты регистрировались каждые 30 минут в послеоперационной палате до перевода в отделение (все пациенты оставались в послеоперационной палате не менее 60 минут ). Если отрицательное воздействие было отмечено в любое время в течение этого периода, это считалось положительным проявлением. * P 0. 05 по сравн. нефопам и комбинации нефопам+кетопрофен. Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6.
 Исследование Delage: Выводы «Впервые определена срединная эффективная анальгетическая доза кетопрофена (30 мг) после умеренно болезненной хирургии» «Комбинация нефопама и кетопрофена показала существенный синергический эффект» Комбинация Акупана с кетопрофеном приводит к значительному снижению побочных эффектов препаратов «Мы полагаем, что эти результаты могут объясняться различием участков действия этих двух препаратов» Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6.
Исследование Delage: Выводы «Впервые определена срединная эффективная анальгетическая доза кетопрофена (30 мг) после умеренно болезненной хирургии» «Комбинация нефопама и кетопрофена показала существенный синергический эффект» Комбинация Акупана с кетопрофеном приводит к значительному снижению побочных эффектов препаратов «Мы полагаем, что эти результаты могут объясняться различием участков действия этих двух препаратов» Delage N, Anesthesiology. 2005 Jun; 102(6): 1211 -6.
 Мультимодальная/сбалансированная аналгезия Включение АКУПАНА® в мультимодальную аналгезию Уменьшает потребление морфия на 22 -50 % Увеличивает эффективность аналгезии у всех типов послеоперационных пациентов (от малой до большой хирургии) Акупан и кетопрофен: действуют синергически Эффективнее пропацетамола Существенное снижение побочных эффектов Не влияет на дыхательную функцию и на слизистую оболочку ЖКТ
Мультимодальная/сбалансированная аналгезия Включение АКУПАНА® в мультимодальную аналгезию Уменьшает потребление морфия на 22 -50 % Увеличивает эффективность аналгезии у всех типов послеоперационных пациентов (от малой до большой хирургии) Акупан и кетопрофен: действуют синергически Эффективнее пропацетамола Существенное снижение побочных эффектов Не влияет на дыхательную функцию и на слизистую оболочку ЖКТ
 ACUPAN® постоперационная анестезия ВЫВОДЫ ACUPAN® неморфиновый анальгетик центрального действия ACUPAN® обладает мощным анальгетическим эффектом при его использование в мультимодальной анальгезии ACUPAN® может комбинироваться с различными анальгетиками других групп, потенцируя их действие (в том числе и с НПВС) Применяется непосредственно перед окончанием операции (около 30 минут , можно 1 h до окончания операции): – Устраняет постоперационную боль – Снижает частоту постоперационного дрожания – Увеличивает переносимость боли
ACUPAN® постоперационная анестезия ВЫВОДЫ ACUPAN® неморфиновый анальгетик центрального действия ACUPAN® обладает мощным анальгетическим эффектом при его использование в мультимодальной анальгезии ACUPAN® может комбинироваться с различными анальгетиками других групп, потенцируя их действие (в том числе и с НПВС) Применяется непосредственно перед окончанием операции (около 30 минут , можно 1 h до окончания операции): – Устраняет постоперационную боль – Снижает частоту постоперационного дрожания – Увеличивает переносимость боли
 Акупан® - основные преимущества Снижает потребление опиатов на 35 -50% Не обладает побочными эффектами НПВС (не влияет на агрегацию тромбоцитов, на состояние слизистой ЖКТ и моторику ) – препарат выбора для больных с заболеваниями ЖКТ Профилактика посленаркозного озноба Возможен внутримышечный и внутривенный способы введения Разрешен к применению с 12 лет 1. Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5 2. Du Manoir BJA 2003, 91: (6) 3. Tirault M. Anesth Analg. 2006 Jan; 102(1): 110 -7. 4. Rôhm KD. Anaesthesia. 2005 May; 60(5): 433 -8
Акупан® - основные преимущества Снижает потребление опиатов на 35 -50% Не обладает побочными эффектами НПВС (не влияет на агрегацию тромбоцитов, на состояние слизистой ЖКТ и моторику ) – препарат выбора для больных с заболеваниями ЖКТ Профилактика посленаркозного озноба Возможен внутримышечный и внутривенный способы введения Разрешен к применению с 12 лет 1. Mimoz O, Anaesthesia. 2001 Jun; 56(6): 520 -5 2. Du Manoir BJA 2003, 91: (6) 3. Tirault M. Anesth Analg. 2006 Jan; 102(1): 110 -7. 4. Rôhm KD. Anaesthesia. 2005 May; 60(5): 433 -8
 ACUPAN® безопасность Предупреждение респираторных осложнений Предупреждение осложнений со стороны гемостаза Предупреждение ЖК осложнений, тошноты, рвоты Не обладает жаропонижающим свойством Sm. Pc
ACUPAN® безопасность Предупреждение респираторных осложнений Предупреждение осложнений со стороны гемостаза Предупреждение ЖК осложнений, тошноты, рвоты Не обладает жаропонижающим свойством Sm. Pc
 Acupan® показания НАША ЦЕЛЬПослеоперационная боль
Acupan® показания НАША ЦЕЛЬПослеоперационная боль
 Акупан®_ Противопоказания Гиперчувствительность к нефопаму или другим компонентам Дети младше 12 лет, из-за отсутствия клинических исследований Судороги или наличие судорожных расстройств в анамнезе Риск задержки мочи, связанный с уретропростатическими нарушениями Недостаточность резерва коронарного кровообращения Риск остроугольной глаукомы Беременность и период кормления грудью
Акупан®_ Противопоказания Гиперчувствительность к нефопаму или другим компонентам Дети младше 12 лет, из-за отсутствия клинических исследований Судороги или наличие судорожных расстройств в анамнезе Риск задержки мочи, связанный с уретропростатическими нарушениями Недостаточность резерва коронарного кровообращения Риск остроугольной глаукомы Беременность и период кормления грудью
 Акупан® _ взаимодействие Противопоказанные комбинации: Некоторые побочные эффекты Акупана могут усиливаться приеме симптоматических или антихолинергических средств, в частности: – Спазмолитиков на основе атропина – Антихолинергических антипаркинсонических препаратов – Антидепрессантов на основе имипрамина и фенотиазиновых нейролептиков – Н 1 -антигистаминных препаратов – Дизопирамида С осторожностью применять в комбинации с: Алкоголем (усиление седации) Другими успокаивающими средствами (морфиноподобными-Трамадол, нейролептиками, барбитуратами, БДЗ, анксиолитиками…)
Акупан® _ взаимодействие Противопоказанные комбинации: Некоторые побочные эффекты Акупана могут усиливаться приеме симптоматических или антихолинергических средств, в частности: – Спазмолитиков на основе атропина – Антихолинергических антипаркинсонических препаратов – Антидепрессантов на основе имипрамина и фенотиазиновых нейролептиков – Н 1 -антигистаминных препаратов – Дизопирамида С осторожностью применять в комбинации с: Алкоголем (усиление седации) Другими успокаивающими средствами (морфиноподобными-Трамадол, нейролептиками, барбитуратами, БДЗ, анксиолитиками…)
 Акупан® _ Форма выпуска Форма: ампулы из прозрачного стекла, содержащие 2 мл раствора Упаковка: – Коробка с 5 ампулами Условия хранения: при температуре не выше 25°С Срок хранения: 3 года
Акупан® _ Форма выпуска Форма: ампулы из прозрачного стекла, содержащие 2 мл раствора Упаковка: – Коробка с 5 ампулами Условия хранения: при температуре не выше 25°С Срок хранения: 3 года
 Акупан®_ Режим дозирования Дозу необходимо подбирать в зависимости от интенсивности послеоперационной боли. Внутримышечное введение: Акупан внутримышечно вводится глубоко. Обычно рекомендуемая доза – 20 мг/инъекция. При необходимости введение повторяют каждые 6 часов, не превышая общую дозу 120 мг/24 часа. Внутривенное введение: Акупан вводится в виде медленной в/в перфузии, в течение 15 -30 минут, при этом пациент должен находиться в лежачем положении для предотвращения нежелательных побочных эффектов (тошнота, головокружение, потоотделение). Обычно рекомендуемая однократная доза – 20 мг/инъекция, при необходимости введение повторяют каждые 4 часа, не превышая общую дозу 120 мг/24 часа.
Акупан®_ Режим дозирования Дозу необходимо подбирать в зависимости от интенсивности послеоперационной боли. Внутримышечное введение: Акупан внутримышечно вводится глубоко. Обычно рекомендуемая доза – 20 мг/инъекция. При необходимости введение повторяют каждые 6 часов, не превышая общую дозу 120 мг/24 часа. Внутривенное введение: Акупан вводится в виде медленной в/в перфузии, в течение 15 -30 минут, при этом пациент должен находиться в лежачем положении для предотвращения нежелательных побочных эффектов (тошнота, головокружение, потоотделение). Обычно рекомендуемая однократная доза – 20 мг/инъекция, при необходимости введение повторяют каждые 4 часа, не превышая общую дозу 120 мг/24 часа.
 Акупан®_ Режим дозирования Процедура введения: – Обычная инфузия: • Изотонический раствор натрия хлорида • 5% раствор глюкозы Длительность: не более 8 -10 дней Не рекомендуется смешивать Акупан с другими инъекционными препаратами в одном и том же шприце Возможно смешивание Акупана в одном мешке емкостью не менее 100 мл с кетопрофеном, кетамином и парацетамолом
Акупан®_ Режим дозирования Процедура введения: – Обычная инфузия: • Изотонический раствор натрия хлорида • 5% раствор глюкозы Длительность: не более 8 -10 дней Не рекомендуется смешивать Акупан с другими инъекционными препаратами в одном и том же шприце Возможно смешивание Акупана в одном мешке емкостью не менее 100 мл с кетопрофеном, кетамином и парацетамолом
 Пример практического протокола для внутривенного введения Интраоперационно После операции Медленная инфузия 1 Непрерывная инфузия 2 1 ампула в теч. 30 мин 4 -6 ампул в теч. 24 ч или Медленные инфузии с перерывами 1 1 ампула в теч. 30 -60 мин Повторять каждые 4 часа
Пример практического протокола для внутривенного введения Интраоперационно После операции Медленная инфузия 1 Непрерывная инфузия 2 1 ампула в теч. 30 мин 4 -6 ампул в теч. 24 ч или Медленные инфузии с перерывами 1 1 ампула в теч. 30 -60 мин Повторять каждые 4 часа
 Acupan® мощный анальгетик NSAI Opioids others МУЛЬТИМОДАЛЬНАЯ АНАЛЬГЕЗИЯ Paracetamol ACUPAN Антигипераналь гезия Powerful Analgesia +… Предупреждение постоперационного дрожания Меньше побочных эффектов опиоидов
Acupan® мощный анальгетик NSAI Opioids others МУЛЬТИМОДАЛЬНАЯ АНАЛЬГЕЗИЯ Paracetamol ACUPAN Антигипераналь гезия Powerful Analgesia +… Предупреждение постоперационного дрожания Меньше побочных эффектов опиоидов


