Презент.абс2.pptx
- Количество слайдов: 36
Абсорбционная спектроскопия в видимой и УФ области Молекулярная спектроскопия

Спектроскопия — разделы физики и аналитической химии, посвящённые изучению спектров взаимодействия излучения (в том числе, электромагнитного излучения, акустических волн и др. ) • Атомный и молекулярный спектральные анализы позволяют определять элементный и молекулярный состав вещества, соответственно. В эмиссионном и абсорбционном методах состав определяется по спектрам испускания и поглощения. • M* → M + hν (эмиссия) • M + hν → M* (абсорбция)

Электромагнитный спектр Излучение λ, нм Е, эв γ-Лучи 0. 1 -10 -4 ~ 107 Рентгеновские лучи 10 -10 -2 ~ 105 Ультрафиолетовое 10 -400 Видимый свет 400 -760 ~ 10 Инфракрасное 760 - 106 ~ 10 -1 Микроволновое или СВЧ 10 -3 - 1 м ~ 10 -3 Радиоволны > 1 м ~ 10 -6 Процессы, происходящие при поглощении или излучении Изменения в энергетичес-ком состоянии ядер (спект-роскопия γ-резонанса) Изменения в энергетичес-ком состоянии внутренних электронов атомов (рентгеноспектроскопия) Изменение энергетического состояния внешних элект-ронов (электронная спектроскопия) Колебание атомов в молекуле (ИКспектроскопия) Колебание атомов в кристаллической решетке; изменение вращательного энергетического состояния (ЭПР) Изменение энергетического состояния спинов ядер и электронов (спектроскопия ЯМР и ОЖЕ-спектроскопия)
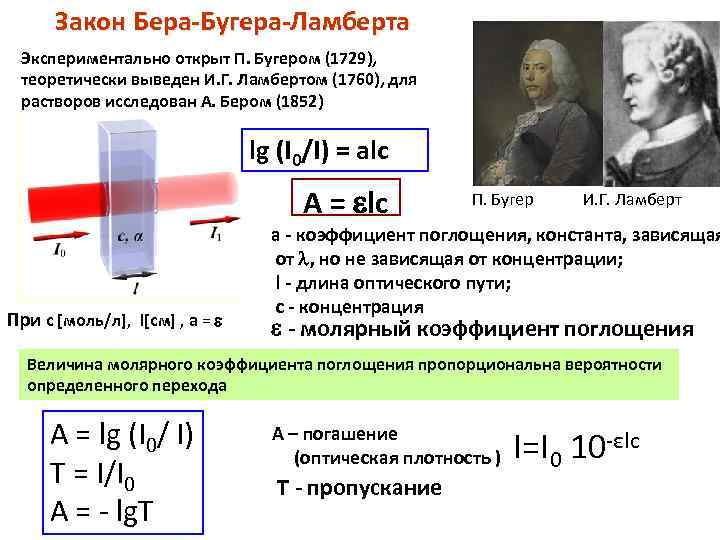
Закон Бера-Бугера-Ламберта Экспериментально открыт П. Бугером (1729), теоретически выведен И. Г. Ламбертом (1760), для растворов исследован А. Бером (1852) lg (I 0/I) = alc А = lc При с [моль/л], l[см] , a = П. Бугер И. Г. Ламберт а - коэффициент поглощения, константа, зависящая от , но не зависящая от концентрации; l - длина оптического пути; c - концентрация - молярный коэффициент поглощения Величина молярного коэффициента поглощения пропорциональна вероятности определенного перехода А = lg (I 0/ I) Т = I/I 0 А = - lg. Т А – погашение (оптическая плотность ) Т - пропускание I=I 0 10 -εlc

• Условия применения закона Бугера- Ламберта. Бера 1. Закон справедлив для монохроматического света не слишком большой интенсивности Аλ=ελ lc 2. Пучек света должен быть параллельным 3. Закон справедлив для не слишком концентрированных растворов ε= f(n) 4. Температура должна быть постоянной в пределах 12 градусов 5. Закон соблюдается для систем, где поглощающими центрами являются частицы одного сорта Cr 2 O 2 -7 + H 2 O = 2 HCr. O-4 = 2 Cr. O 42 - + 2 H+ Различие в εCr O 2 2 - 7 εCr. O 2 - 4

• Закон аддитивности • Поглощение света каким либо веществом не зависит от присутствия в растворе других веществ, как поглощающих свет, так и не поглощающих. A=A 1 + A 2 +…An • оптическая плотность смеси веществ равна сумме оптических плотностей каждого из них (при условии подчинения закону Бугера – Ламберта – Бера). Для одной и той же длины волны и толщины слоя для смеси веществ • A = ε 1 ∙l 1 ∙c 1 + ε 2 ∙l 2 ∙c 2 + …εn ∙ln ∙cn

Спектрофотометрический анализ по непосредственному измерению оптической плотности может быть проведен для веществ, обладающих лишь определенными особенностями строения(ароматические соединения, соединения с сопряженными кратными связями, соединения ряда металлов др. ) • • Е = Еэл + Екол + Евр Еэл: Екол: Евр= 1000: 1 Евр = 0, 125 -1, 25 к. Дж/моль Екол + Евр = 1, 25 -50 к. Дж/моль Еэл + Екол + Евр = 60 -600 к. Дж/моль ∆Е = Е 1 – Е 0 ∆Е =h = hc/λ

Схема энергетических состояний двухатомной молекулы ne. v. r. nv. r Еr Еv Ее nr Схема энергетических состояний двухатомной молекулы: Ее – различные электронные состояния; Еv – различные колебательные состояния; Еr – различные вращательные состояния; νе. v. r – переходы, соответствующие электронно-колебательно-вращательному спектру; νv. r – переходы, соответствующие колебательно-вращательному спектру; νr – переходы, соответствующие вращательному спектру
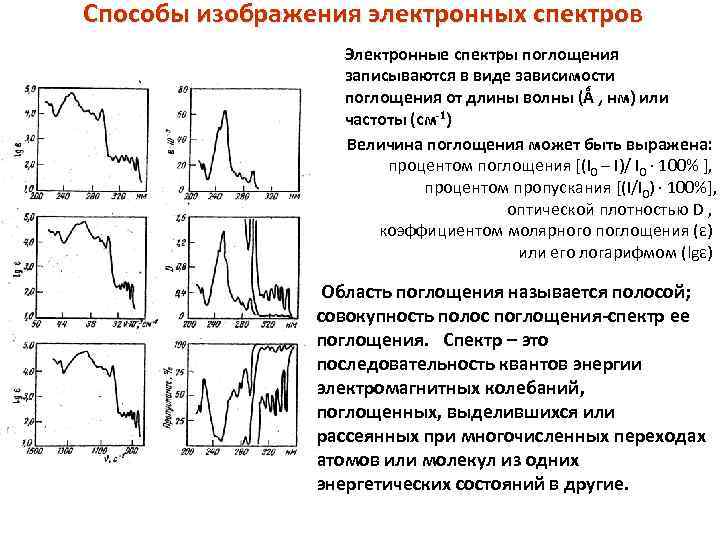
Способы изображения электронных спектров Электронные спектры поглощения записываются в виде зависимости поглощения от длины волны (Ǻ , нм) или частоты (см-1) Величина поглощения может быть выражена: процентом поглощения [(I 0 – I)/ I 0 · 100% ], процентом пропускания [(I/I 0) · 100%], оптической плотностью D , коэффициентом молярного поглощения (ε) или его логарифмом (lgε) Область поглощения называется полосой; совокупность полос поглощения-спектр ее поглощения. Спектр – это последовательность квантов энергии электромагнитных колебаний, поглощенных, выделившихся или рассеянных при многочисленных переходах атомов или молекул из одних энергетических состояний в другие.

Вид полосы поглощения

Характеристики спектра поглощения Положение максимума по шкале длин волн – характеризуется типом электронных переходов и их энергией. Это качественная характеристика спектра E= hc/ max Высота максимума – соответствует вероятности электронного перехода. Чем больше вероятность перехода, тем выше максимум, тем больше величины А, . Это количественная характеристика спектра. Характер, форма максимума –определяется расстоянием между половинными значениями max. Зависит и определяется глубиной расположения орбиты на которую осуществляются переходы , температурой и окружением молекулами растворителя. Число полос поглощения (число максимумов) в спектре поглощения –определяется числом разрешенных переходов.

Относительные энергии электронных переходов • -связи характерны для молекул с одинарными связями (метан, этан) • -связи преимущественны для молекул с двойными и кратными связями (ароматические соединения) • n-орбитали имеют спирты, органические сульфиды, эфиры и многие другие.

Типы молекулярных орбиталей • пять типов молекулярных орбиталей: -, -, * и n. • переходы - *, n *, • -орбитали-электроны одинарных связей (C–C, C–H, C–O, C–N, C–S, C–Hlg) • -орбитали-электроны кратных связей (С=С, С=N, C=O, и др. ) • n-орбитали -молекулы, содержащие гетероатомы с неподелёнными электронными парами (O: , N: , S: , Hlg: и др. )

Классификация полос поглощения. K-полосы (нем. konjugiert – сопряженный) –полосы высокой интенсивности, характерные для систем, содержащих сопряженные связи. *-переходы 103 R-полосы (нем. radikalartig – радикальный) – полосы средней или низкой интенсивности характерные для систем, содержащих не поделенные электронные пары гетероатомных функциональных групп и радикалов. n *-переходы с 102 При переходе от неполярного растворителя к полярному или введении полярного заместителя K-полосы претерпевают батохромный сдвиг, а R-полосы – гипсохромный сдвиг. Полосы, обусловленные наличием в молекуле кратной (этиленовой) связи называют E-полосами (ethylenic), а бензоидной системы – B-полосами (benzenoid) *переходы ( от 102 до 103 )

Взаимосвязь электронных спектров и структуры органических молекул Хромофоры Хромофор -простая функциональная группа, ответственная за поглощение с характеристическими величинами и X - - Y спектр соединения - сумма спектральных характеристик индивидуальных хромофоров X и Y X - Y новый, хромофор с новыми спектральными характеристиками Ауксохром – функциональная группа, которая сама по себе не поглощает в близком ультрафиолете, но может влиять на поведение сопряженного с ней хромофора Типичные ауксохромы: -SH, -NH 2 , -OH

Основные хромофорные группы Хромофор Тип перехода λmax log(ε) нитрилы n → π* 160 <1. 0 алкины π→ π* 170 3. 0 алкены π→ π* 175 3. 0 спирты n→σ* 180 2. 5 простые эфиры n→σ* 180 3. 5 π→ π* 180 3. 0 n → π* 280 1. 5 π→ π* 190 2. 0 n → π* 290 1. 0 n→σ* 190 3. 5 кислоты n → π* 205 1. 5 сложные эфиры n → π* 205 1. 5 амиды n → π* 210 1. 5 тиоспирты n → π* 210 3. 0 нитросоединения n → π* 271 <1. 0 азосоединения n → π* 340 <1. 0 кетоны альдегиды амины

Взаимосвязь электронных спектров и структуры органических молекул Для характеристики спектральных изменений, вызванных модификацией структуры, введены специальные термины: гипсохромный сдвиг (синий сдвиг) – для смещения полос поглощения в коротковолновую область спектра; батохромный сдвиг (красный сдвиг) – для смещения полос поглощения в область длинных волн; гиперхромный эффект – увеличение интенсивности поглощения; гипохромный эффект – уменьшение интенсивности поглощения.

Типы смещений полосы поглощения в УФ-спектре

Изменение спектральных характеристик систем с сопряженными связями • Наличие системы сопряженных кратных связей вносит принципиальные изменения в спектры: в этих случаях наблюдается изменение и максимума и интенсивности поглощения. В этих системах полосы поглощения невозможно приписать отдельным структурным элементам , ответственной за поглощение становится вся система сопряженных связей. • в сопряженных системах полосы поглощения обладают гораздо большей интенсивностью (К-полосы, lgε > 4), чем в несопряженных, причем коэффициент экстинкции возрастает с увеличением цепи сопряжения. CH 2=CH–CH=CH 2 λмакс. , нм = 218 ; ε (л/моль • см)=23000 • CH 3 CH=CH–CH=CH 2 λмакс. , нм =223 ε(л /моль • см) = 25000 • (CH 3)2 C=CH–CH=C(CH 3)2 λмакс. , нм = 242 ε (л/моль • см)= 26000 • Сопряжение ненасыщенных хромофоров приводит к батохромному смещению соответствующих полос поглощения. • смещение полосы поглощения закономерно зависит от протяженности системы сопряженных связей. • для сопряженных систем характерно увеличение интенсивности поглощения.

Механизм возникновения гипсо- и батохромных сдвигов в электронных спектрах поглощения под влиянием растворителя.

группы в следующем ряду соединений (H-, H-); (H-, CH 3 -); (CH 3 -, Cl-); (CH 3 -, NH 2 -); (CH 3 -, C 2 H 5 O-).

Гипсохромный и батохромный сдвиги для n → π* и π → π* переходов (карбонильная группа) в ряду растворителей: гексан, диэтиловый эфир, этанол, метанол, вода.

Электронные спектры поглощения основных классов органических соединений s → s* переходы Предельные углеводороды Соответствующие им полосы поглощения лежат в далеком ультрафиолете: · метан – 122 нм · этан – 135 нм · алканы - < 150 нм Насыщенные углеводороды с гетероатомами (О, S, N, галогены) s → s* и n → s* переходы соединение → *, нм n→ *, нм CH 3 OH 150 177 CH 3 NH 2 170 215 CH 3 Cl 150 173 В области 200 – 800 нм большинство углеводородов и их производных «прозрачны» , что позволяет использовать их в качестве растворителей. Для функциональных производных эта область чуть уже: 250 – 800 нм.

Электронные спектры поглощения основных классов органических соединений Этилены s → s* → p* (lmax =165 нм, emax > 104) переходы Алкильные заместители в этилене смещают → * полосу поглощения в красную область, и с ростом числа алкильных заместителей величина батохромного сдвига увеличивается. Соединения с сопряженными двойными связями Сопряжение проявляется в УФ-спектрах батохромным сдвигом для полосы → * перехода Структура Фрагмента Величина инкремента, нм Диеновая система в одном кольце 36 Дополнительное сопряжение, двойная связь 30 Экзоциклическая двойная связь (двойная связь вне цикла) 5 Заместители: · алкил · -OR · -OCOR · SR · -NR 2 · -Cl, -Br 5 6 0 30 60 5
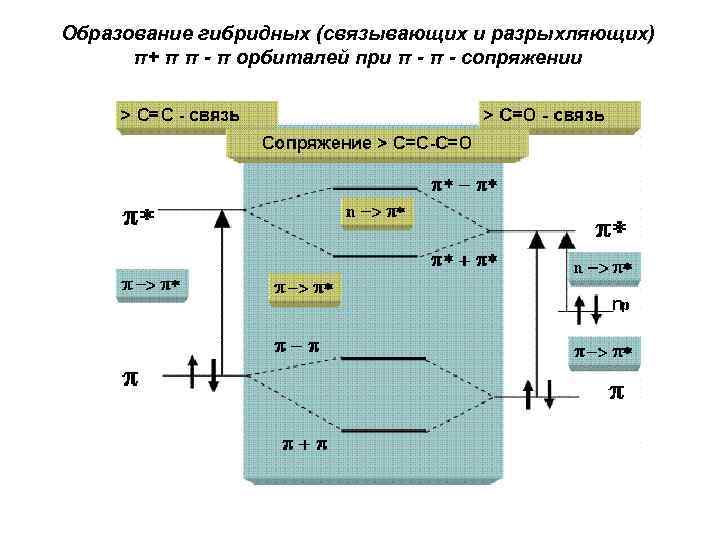
Образование гибридных (связывающих и разрыхляющих) π+ π π - π орбиталей при π - сопряжении

Электронные спектры поглощения основных классов органических соединений Карбонилсодержащие соединения n → * переходы Обнаруживается в УФ-спектре по полосе n → * перехода. Положение чувствительно к полярности растворителя и характеру заместителей X, Y. В полярных растворителях (особенно склонных к образованию водородных связей) эта полоса смещается гипсохромно. Замена Н-атома другими заместителями X, Y также приводит к гипсохромному сдвигу.

Электронные спектры поглощения основных классов органических соединений Ароматические соединения λ, нм ε, л/моль см 180 6 104 203 8 103 230 -260 200 В бензоле → * переходы Полоса бензольного поглощения На положение полосы в области 200 – 300 нм значительное влияние оказывают заместители и растворители Влияния заместителей на положение полосы поглощения ароматическим кольцом определяется характером заместителя. Заместители с I-эффектом практически не меняют вид спектра

Вид спектра монозамещенных бензола


• Количественный спектральный анализ 1. Метод градуировочного (калибровочного) графика 2. Метод молярного коэффициента погашения: ε=Aст/l. Cст Cx =Ax/εl 3. Метод добавок: Ах = εl. Cx Ах+ст = εl(Сх + Сст) Сх = Сст Ах/ Ах+ст - Ах

→ 4. Метод дифференциальной фотометрии Применяется для фотометрирования интенсивно окрашенных растворов Тх= Ix /I 0 Т/х= Ix /I ср Тср= Iср/I 0 Ix / I ср= Т/х= Тх / Тср / А x =Ax – Aср / А x =εl. Cx -Aср

Нефелометрический и турбидиметрический анализ


В нефелометрическом и турбидиметрическом анализе используется явление рассеяния света твердыми частицами, находящимися в растворе во взвешенном состоянии. Метод, в котором используют интенсивность прошедшего света It, называют турбидиметрией • S = lg (I 0/ It) = k b N • S – мутность; k – коэффициент мутности; b – длина пути; N – число рассеивающих частиц в единице объема. А=εlc Для турбидиметрических измерений используют фотометр или спектрофотометр. Для нефелометрических измерений используют нефелометр или флуориметр. максимальная чувствительность достигается при использовании излучения голубой (400 нм) или ближней ультрафиолетовой области.

• Метод с измерением интенсивности рассеянного света под углом 90 о (или какимлибо другим) называют нефелометрией. Зависимость интенсивности рассеянного света от концентрации передается уравнением Релея • Ip=I 0 [ n 21 – n 22 / n 22 Nv 2/λ 4 r 2 (1 + cos 2β ) ] • Ip=I 0 k Nv 2/λ 4 C=N/NAV • Ip=I 0 k NACV v 2/λ 4 • При V, v, λ=const Ip=I 0 k/C Ip / I 0. =k/C • Aкаж=-lg Ip / I 0 Aкаж= -lg. C -lg k/

Применение методов, основанных на измерении рассеяния света, достаточно ограничено, прежде всего потому, что на измеряемый сигнал сильно влияет размер частиц. Поэтому необходимо строгое соблюдение идентичности условий построения градуировочного графика и анализа исследуемого раствора. Нефелометрия, и турбидиметрия могут быть полезными для селективных аналитических реакций, в результате которых образуется твердое соединение. Описаны методики определения аммиака иодидом ртути (реактив Несслера), фосфата в виде малорастворимого соединения с молибденом и стрихнином, сульфата бария с пределами обнаружения десятые-сотые доли микрограмма в миллилитре и др. Практическое использования таких методов – это применение лазеров для дистанционного определения частиц, содержащихся в воздушном пространстве, определение средней молекулярной массы полимеров в растворах.
Презент.абс2.pptx