lecture_9_2013.pptx
- Количество слайдов: 82

А. С. Спирин Молекулярная биология: Лекция 9. Инициация и регуляция трансляции у эукариот 10 апреля 2013 г.

Особенности инициации трансляции у эукариот

ОСОБЕННОСТИ ЭУКАРИОТИЧЕСКОЙ м. РНК: • Пространственное разделение транскрипции и трансляции. • Моноцистронность. • Функциональная стабильность ( «долгоживучесть» ). • Нуклеопротеидная форма существования (м. РНП). • Множественность и мультимерность белковых факторов инициации. • Пространственная разделенность рибосомо-связывающего участка (RBS) и инициаторного кодона (AUG). • Специфические регуляторные последовательности и пространственные структуры (аптамерные модули) в 3' НТО. • Взаимодействия 5' и 3' концов и нетранслируемых участков (НТО) в ходе трансляции.

ФУНКЦИОНАЛЬНЫЕ УЧАСТКИ ЭУКАРИОТИЧЕСКОЙ м. РНК • «Кэп» и 5'-НТО: Концевая инициация. Разделенность RBS и AUG. Сканирование. • Длинные 3'-НТО + поли(А)-хвост: Регуляторные третичные структуры. Усилители инициации ( «энхансеры» ).
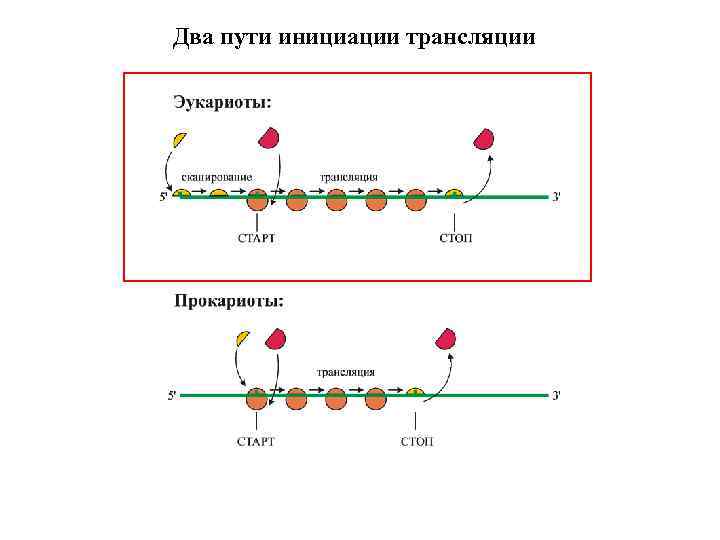
Два пути инициации трансляции

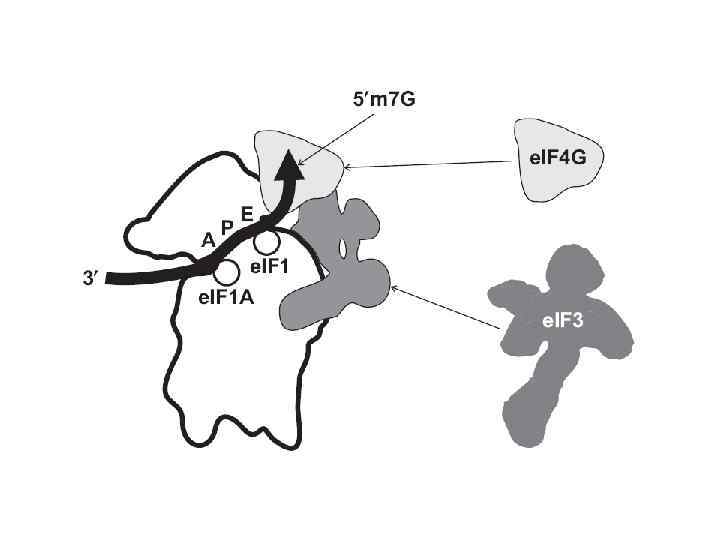
Схема расположения функциональных областей эукариотической м. РНК e. IF 4
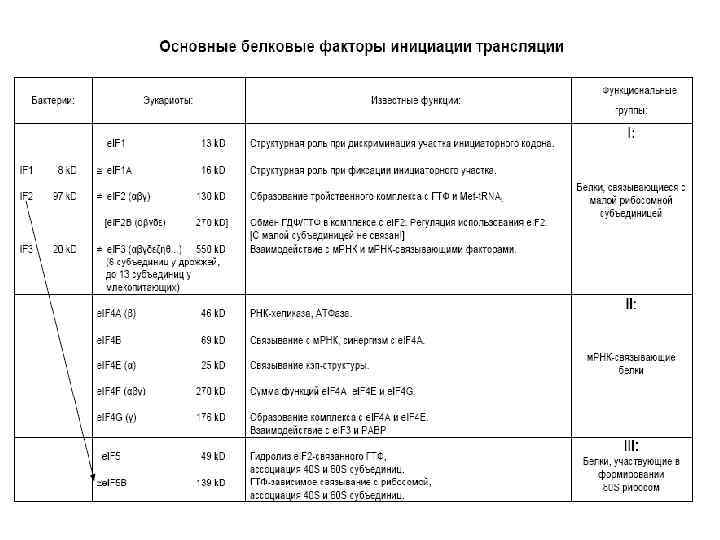

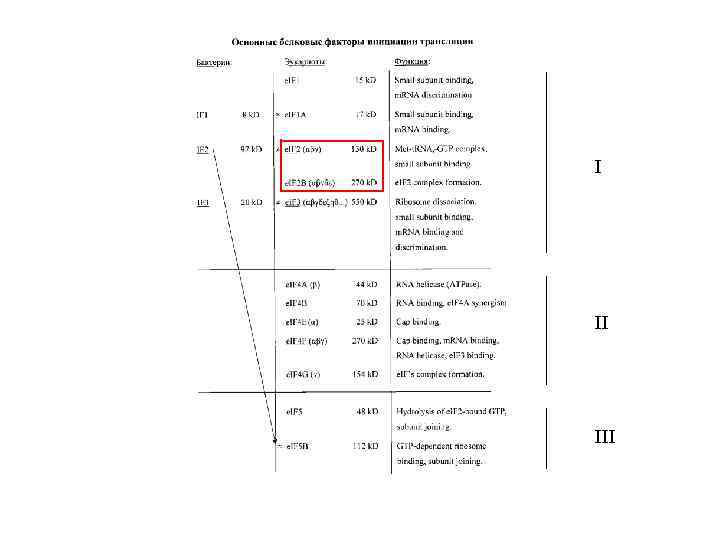
Три функциональные группы факторов: I: 40 Sсвязывающие II: м. РНКсвязывающие III: 60 Sсодействующие

“Native” 40 S subunit = 40 S: e. IF 3: e. IF 1 A: e. IF 1: e. IF 2 abg e. IF 4 F (= e. IF 4 G: e. IF 4 E: e. IF 4 A)
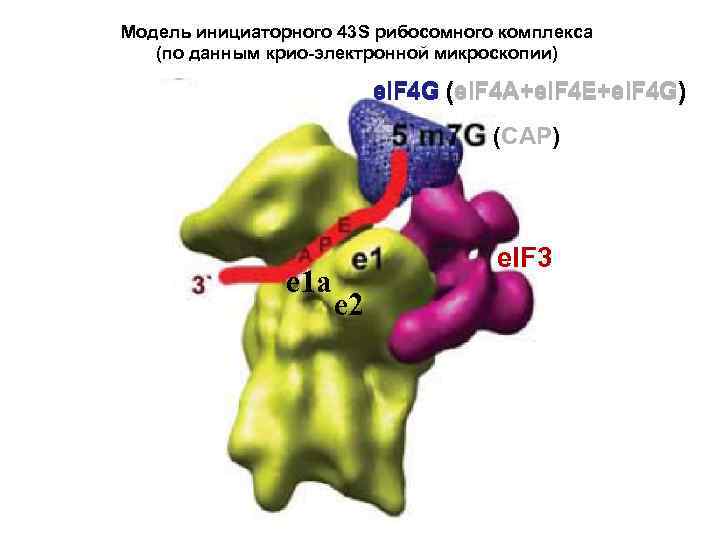
Модель инициаторного 43 S рибосомного комплекса (по данным крио-электронной микроскопии) e. IF 4 G (e. IF 4 A+e. IF 4 E+e. IF 4 G) (CAP) e 1 a e. IF 3 e 2
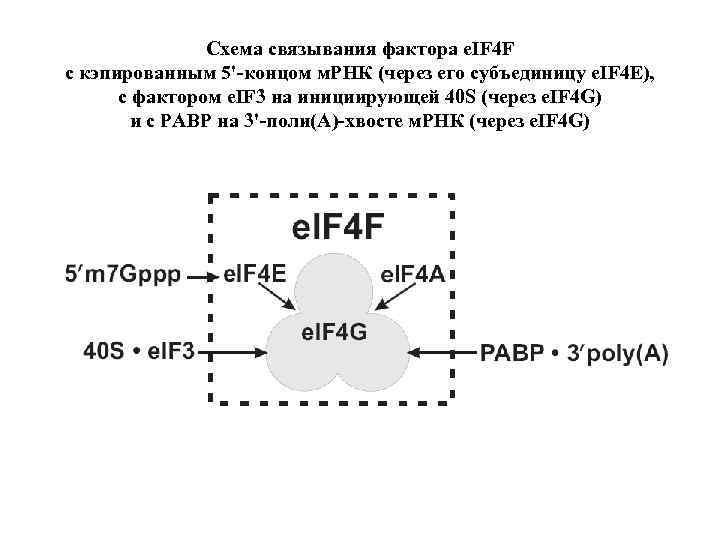
Схема связывания фактора e. IF 4 F с кэпированным 5'-концом м. РНК (через его субъединицу e. IF 4 Е), с фактором e. IF 3 на инициирующей 40 S (через e. IF 4 G) и с PABP на 3'-поли(А)-хвосте м. РНК (через e. IF 4 G)

Инициация трансляции у эукариот: АТФ-зависимое сканирование 5'-нетранслируемой области
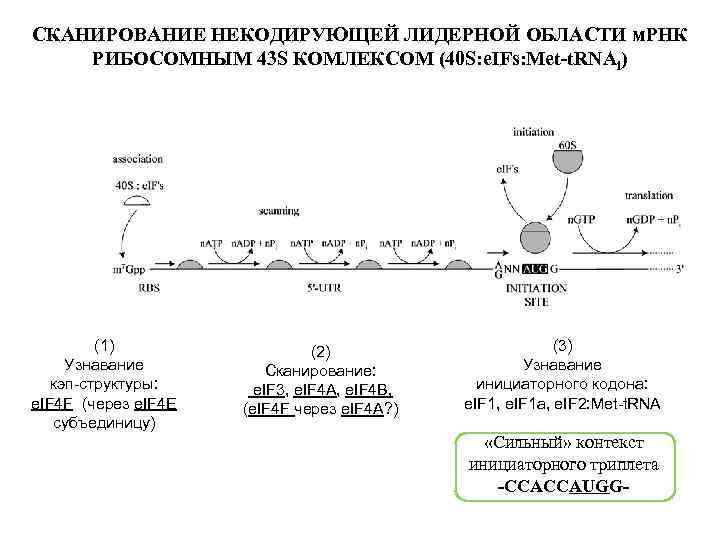
СКАНИРОВАНИЕ НЕКОДИРУЮЩЕЙ ЛИДЕРНОЙ ОБЛАСТИ м. РНК РИБОСОМНЫМ 43 S КОМЛЕКСОМ (40 S: e. IFs: Met-t. RNAi) (1) Узнавание кэп-структуры: e. IF 4 F (через e. IF 4 E субъединицу) (2) Сканирование: e. IF 3, e. IF 4 А, e. IF 4 В, (e. IF 4 F через e. IF 4 А? ) (3) Узнавание инициаторного кодона: e. IF 1, e. IF 1 а, e. IF 2: Met-t. RNA «Сильный» контекст инициаторного триплета -CCACCAUGG-

DRIVING WITHOUT ENGINE
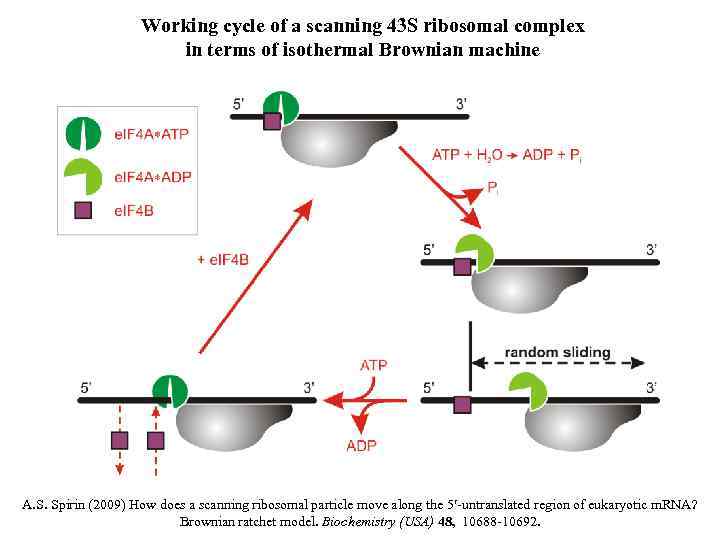
Working cycle of a scanning 43 S ribosomal complex in terms of isothermal Brownian machine A. S. Spirin (2009) How does a scanning ribosomal particle move along the 5 -untranslated region of eukaryotic m. RNA? Brownian ratchet model. Biochemistry (USA) 48, 10688 -10692.

Особенности инициации на вирусных РНК (IRESes, internal ribosome entry sites; ITAFs, IRES trans-acting factors; polyproteins)
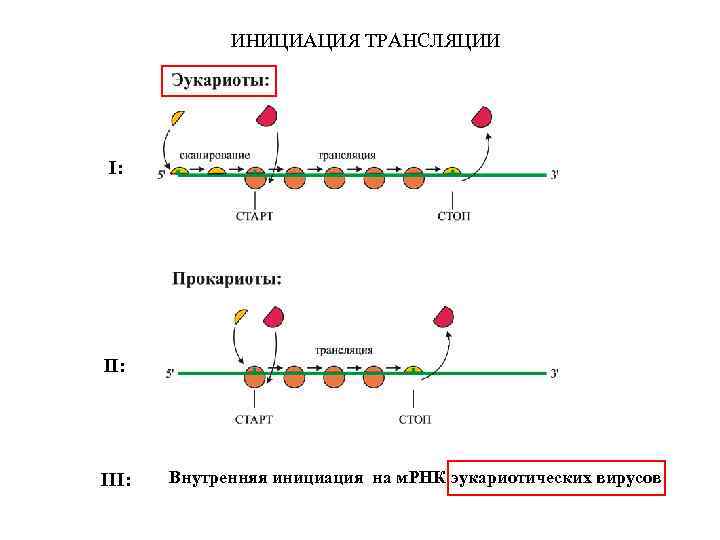
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ I: III: Внутренняя инициация на м. РНК эукариотических вирусов
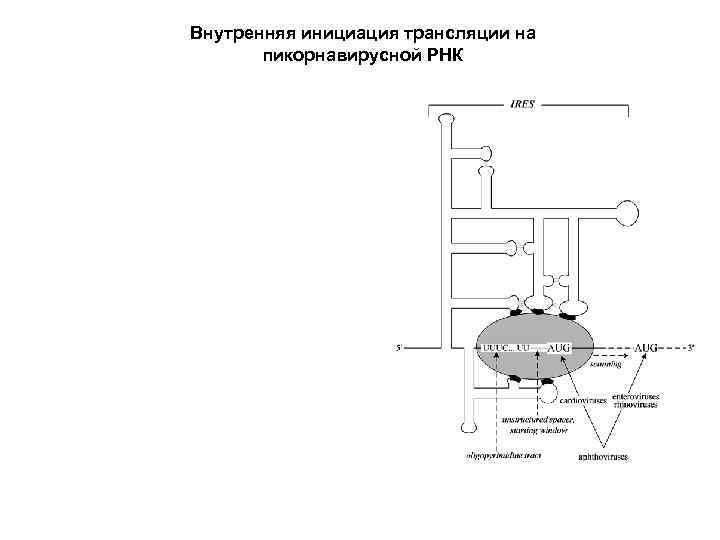
Внутренняя инициация трансляции на пикорнавирусной РНК
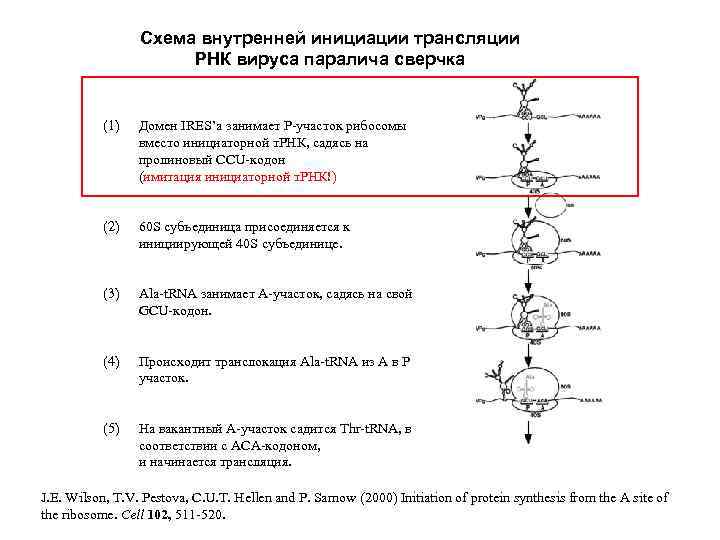
Схема внутренней инициации трансляции РНК вируса паралича сверчка (1) Домен IRES’a занимает Р-участок рибосомы вместо инициаторной т. РНК, садясь на пролиновый CCU-кодон (имитация инициаторной т. РНК!) (2) 60 S субъединица присоединяется к инициирующей 40 S субъединице. (3) Ala-t. RNA занимает А-участок, садясь на свой GCU-кодон. (4) Происходит транслокация Ala-t. RNA из А в Р участок. (5) На вакантный А-участок садится Thr-t. RNA, в соответствии с АСА-кодоном, и начинается трансляция. J. E. Wilson, T. V. Pestova, C. U. T. Hellen and P. Sarnow (2000) Initiation of protein synthesis from the A site of the ribosome. Cell 102, 511 -520.

Регуляция трансляции у эукариот: м. РНК-специфическая негативная регуляция (трансляционная репрессия)
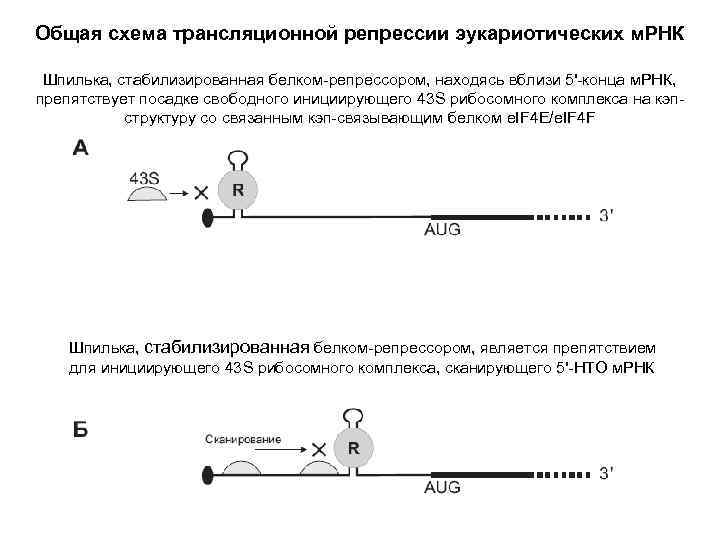
Общая схема трансляционной репрессии эукариотических м. РНК Шпилька, стабилизированная белком-репрессором, находясь вблизи 5'-конца м. РНК, препятствует посадке свободного инициирующего 43 S рибосомного комплекса на кэпструктуру со связанным кэп-связывающим белком e. IF 4 E/e. IF 4 F Шпилька, стабилизированная белком-репрессором, является препятствием для инициирующего 43 S рибосомного комплекса, сканирующего 5'-НТО м. РНК
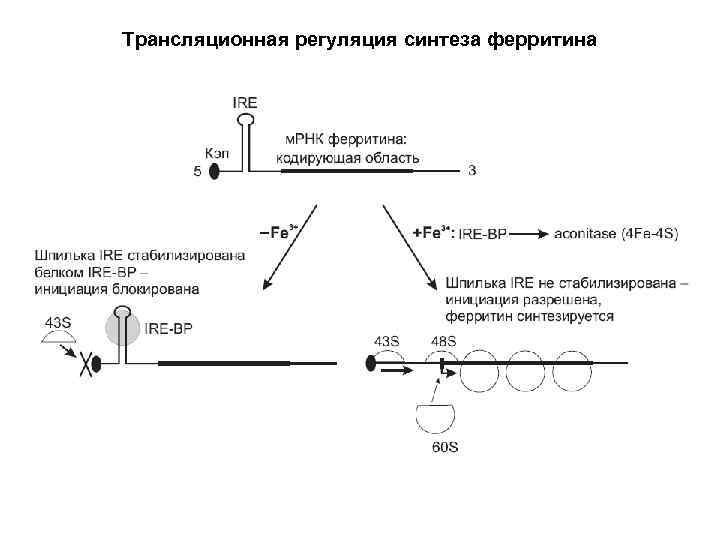
Трансляционная регуляция синтеза ферритина

Регуляция трансляции у эукариот: Тотальная негативная регуляция
I II III
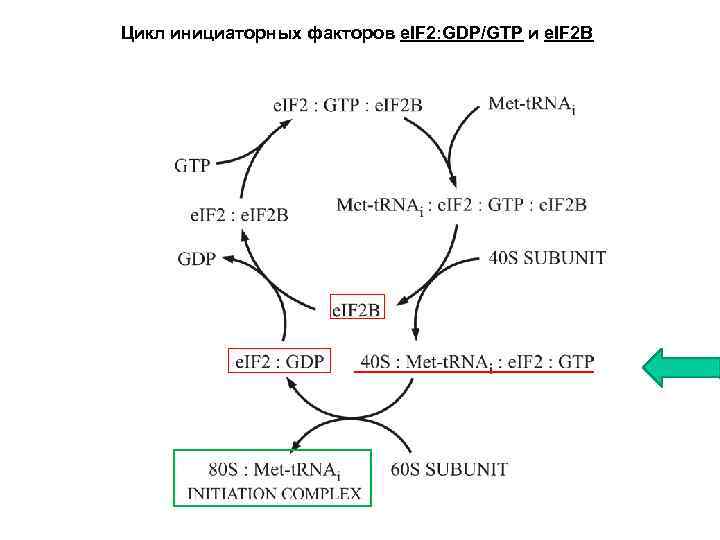
Цикл инициаторных факторов e. IF 2: GDP/GTP и e. IF 2 B

e. IF 2 -киназы: фосфорилирование Ser 51 a-субъединицы e. IF 2 Индукторы e. IF 2 -киназ: (1) Недостаток Fe 3+ и/или гема (2) Вирусная инфекция (3) Голодание (4) Недостаток ростовых факторов (5) Тепловой шок
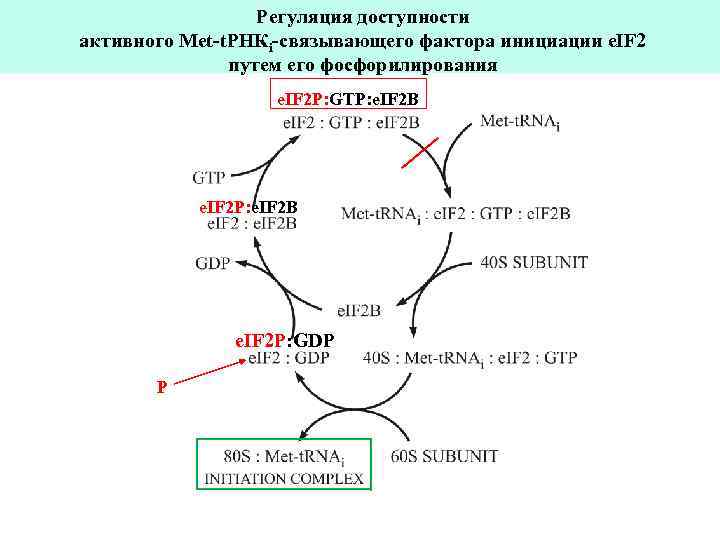
Регуляция доступности активного Met-t. РНКi-связывающего фактора инициации e. IF 2 путем его фосфорилирования e. IF 2 P: GTP: e. IF 2 B e. IF 2 P: GDP P

Активация гем-регулируемой e. IF 2 -киназы (“HCR”): Индуктор: Недостаток Fe 3+ и/или гема
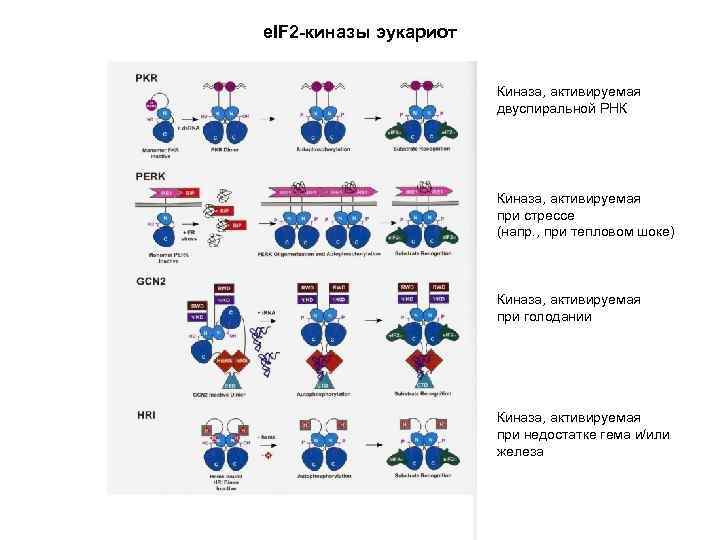
e. IF 2 -киназы эукариот Киназа, активируемая двуспиральной РНК Киназа, активируемая при стрессе (напр. , при тепловом шоке) Киназа, активируемая при голодании Киназа, активируемая при недостатке гема и/или железа
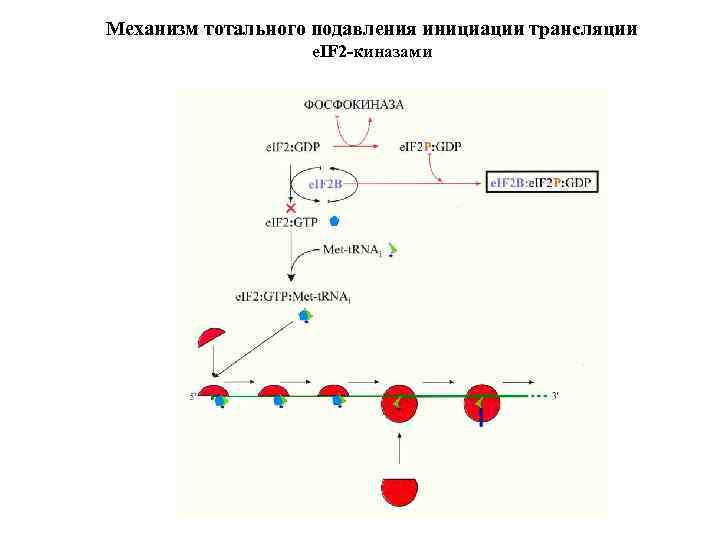
Механизм тотального подавления инициации трансляции e. IF 2 -киназами
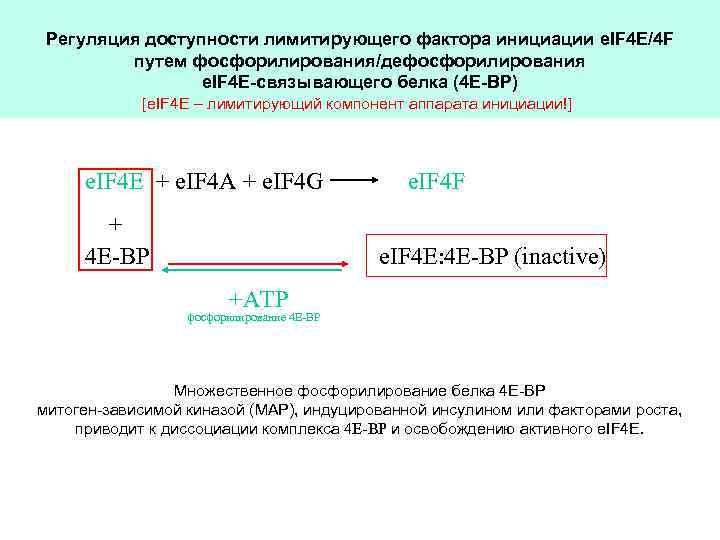
Регуляция доступности лимитирующего фактора инициации e. IF 4 E/4 F путем фосфорилирования/дефосфорилирования e. IF 4 E-связывающего белка (4 E-ВР) [e. IF 4 E – лимитирующий компонент аппарата инициации!] e. IF 4 E + e. IF 4 A + e. IF 4 G e. IF 4 F + 4 E-BP +ATP фосфорилирование 4 Е-ВР e. IF 4 E: 4 E-BP (inactive) Множественное фосфорилирование белка 4 Е-ВР митоген-зависимой киназой (МАР), индуцированной инсулином или факторами роста, приводит к диссоциации комплекса 4 E-BP и освобождению активного e. IF 4 Е.

Регуляция трансляции у эукариот: 3'-концевые инициаторы и усилители инициации

Поли(А)-хвост как усилитель инициации трансляции

Связывание фактора инициации e. IF 4 F с кэп-структрой на 5'-конце м. РНК, с инициирующей рибосомной субъединицей и с поли(А)-хвостом e. IF 4 F = 40 S – e. IF 3 ––– (4 G) ––– PABP – 3'poly(A) m. RNA – 5'cap –(4 E) (4 А)

Модель нековалентной циркуляризации эукариотческой м. РНК путем образования белковых мостиков “poly(A)-PABP-e. IF 4 G-e. IF 4 E-cap” и “…PABP-e. IF 4 G-e. IF 3 -40 S” e. IF 4·e. IF 3 PABP

Circular polyribosomes (pentasomes) translating globin m. RNA (ca. 430 nt) from rabbit reticulocytes A. P. Mathias, R. Williamson, H. E. Huxley & S. Page (1964) Occurrence and function of polysomes in rabbit reticulocytes. J. Mol. Biol. 9, 154 -167. 430 -nt coding region
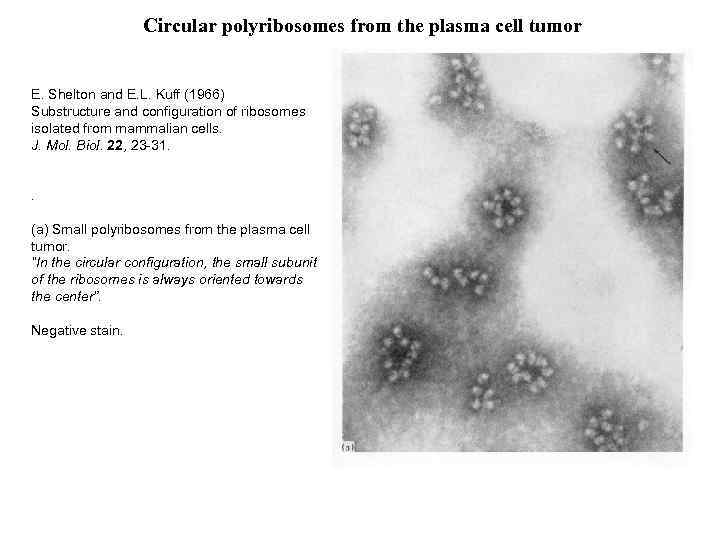
Circular polyribosomes from the plasma cell tumor E. Shelton and E. L. Kuff (1966) Substructure and configuration of ribosomes isolated from mammalian cells. J. Mol. Biol. 22, 23 -31. . (a) Small polyribosomes from the plasma cell tumor. “In the circular configuration, the small subunit of the ribosomes is always oriented towards the center”. Negative stain.
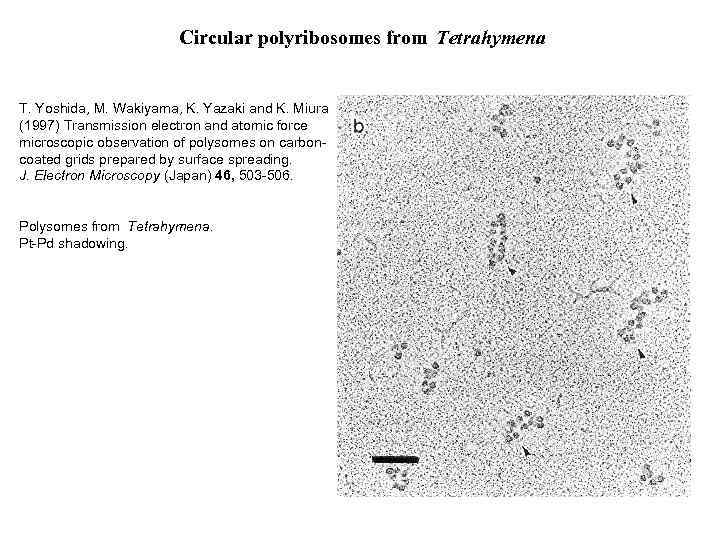
Circular polyribosomes from Tetrahymena T. Yoshida, M. Wakiyama, K. Yazaki and K. Miura (1997) Transmission electron and atomic force microscopic observation of polysomes on carboncoated grids prepared by surface spreading. J. Electron Microscopy (Japan) 46, 503 -506. Polysomes from Tetrahymena. Pt-Pd shadowing.
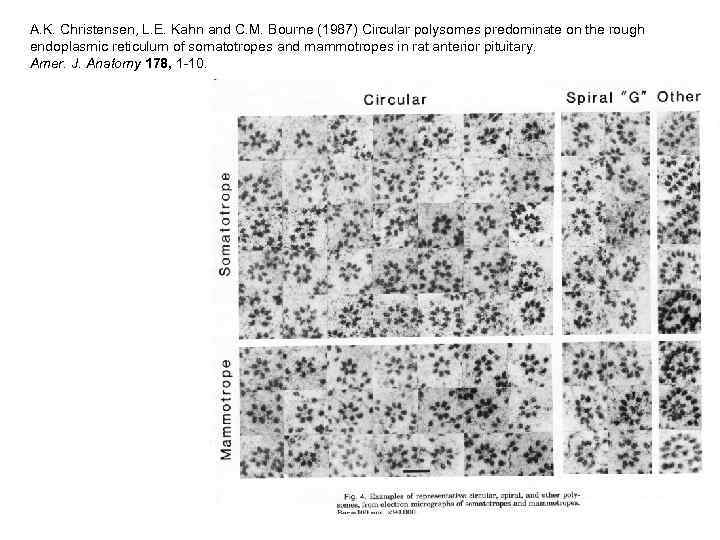
A. K. Christensen, L. E. Kahn and C. M. Bourne (1987) Circular polysomes predominate on the rough endoplasmic reticulum of somatotropes and mammotropes in rat anterior pituitary. Amer. J. Anatomy 178, 1 -10.
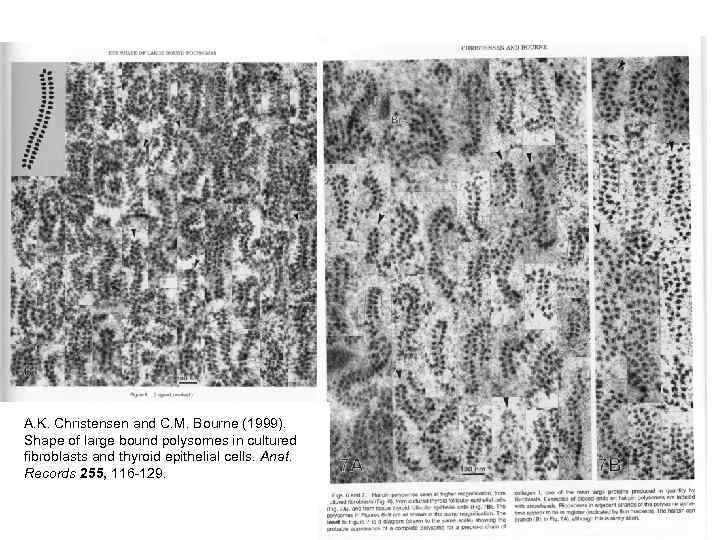
A. K. Christensen and C. M. Bourne (1999). Shape of large bound polysomes in cultured fibroblasts and thyroid epithelial cells. Anat. Records 255, 116 -129.
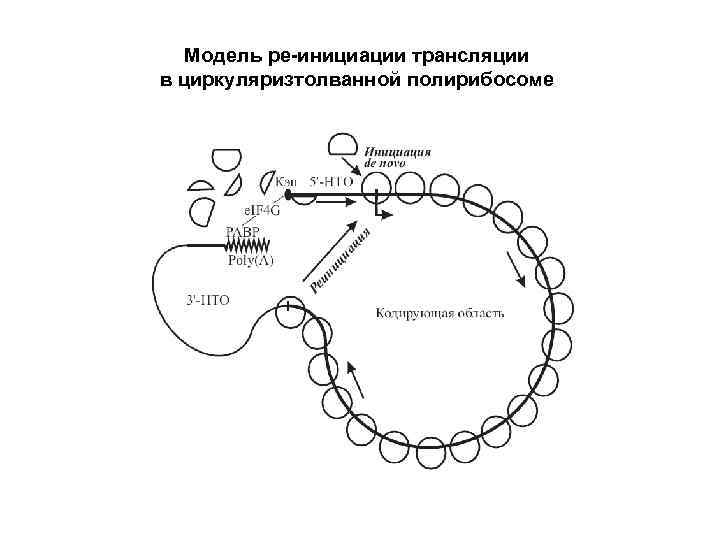
Модель ре-инициации трансляции в циркуляризтолванной полирибосоме

Взаимодействия AU-модулей (ARE) 3' нетранслируемой области: Взаимодействия ARE-BP – Cap и ARE-BP – 5'-UTR
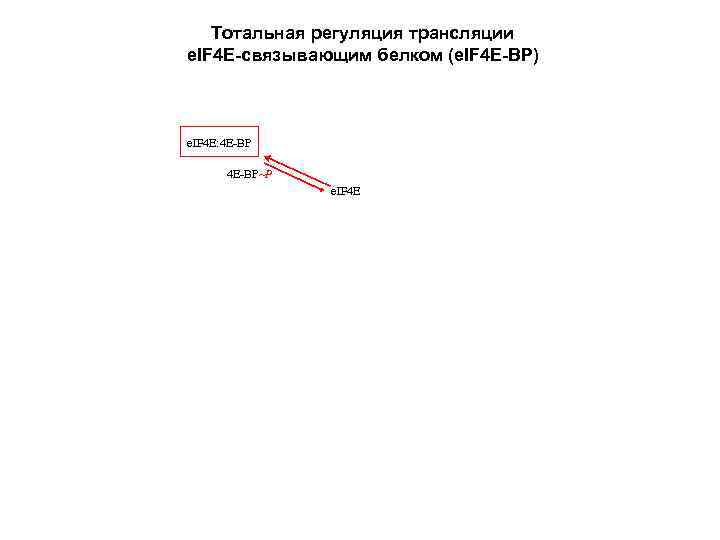
Тотальная регуляция трансляции e. IF 4 E-связывающим белком (e. IF 4 E-BP) e. IF 4 E: 4 E-BP P e. IF 4 E

м. РНК-специфическая регуляция трансляции e. IF 4 E-связывающими белками, локализованными на 3'-НТО e. IF 4 E ARE-BP ARE

Регуляция трансляции у эукариот: Маскирование – демаскирование м. РНК

МАСКИРОВАННАЯ м. РНК (1) Запасенная в процессе оогенеза м. РНК ооцитов, а также запасенная в сперматогенезе м. РНК сперматоцитов. (2) Маскирование-демаскирование м. РНК в процессе эмбриогенеза и клеточной дифференцировки. (3) Маскирование-демаскирование м. РНК в ответ на физиологические и гормональные воздействия. (4) Транспорт маскированной м. РНК внутри клетки и ее демаскирование в местах внутриклеточной локализации. Особенности маскированных м. РНК: нетранслируемость; стабильность, неатакуемость нуклеазами; неподверженность полиаденилированию-деаденилированию.

Spisula solidissima Оогенез: Синтез и маскирование м. РНК, кодирующих малую субъединицу рибонуклеотид-редуктазы, циклин А, etc. , накопление м. РНП (информосом) в цитоплазме. Оплодотворение: Демаскирование этих м. РНК в цитоплазме, переход из информосом в полисомы. м. РНП in vitro: Демаскирование путем обработки солью (диссоциация белка м. РНП). Демаскирование с помощью антисмысловых РНК (“competitive unmasking assay”). Открытие «маскирующего элемента» (“masking box”) в 3'-НТО: N. Standart et al. (1990) Genes Dev. 4: 2157 -2168. Открытие маскирующего белка, специфически связывающегося с 3'-НТО: N. Standart (1992) Semin. Dev. Biol. 3: 367 -379.
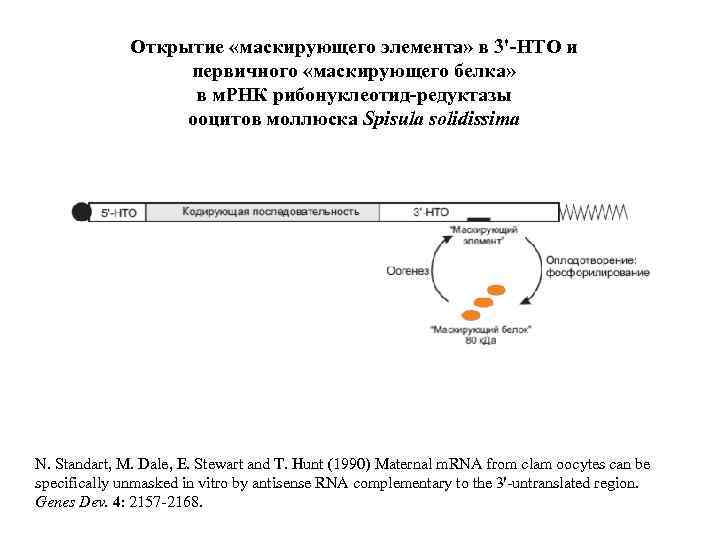
Открытие «маскирующего элемента» в 3'-НТО и первичного «маскирующего белка» в м. РНК рибонуклеотид-редуктазы ооцитов моллюска Spisula solidissima N. Standart, M. Dale, E. Stewart and T. Hunt (1990) Maternal m. RNA from clam oocytes can be specifically unmasked in vitro by antisense RNA complementary to the 3'-untranslated region. Genes Dev. 4: 2157 -2168.
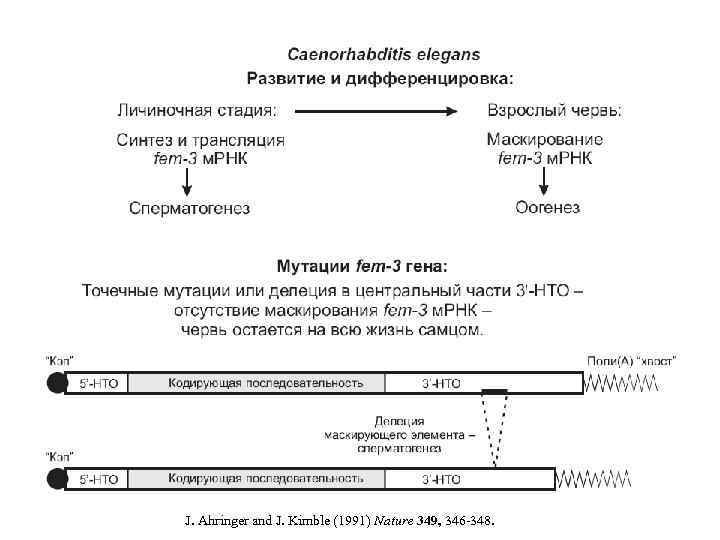
J. Ahringer and J. Kimble (1991) Nature 349, 346 -348.

A. Ostareck-Lederer, D. H. Ostareck, N. Standart and B. J. Thiele (1994) Translation of 15 -lipoxygenase m. RNA is inhibited by a protein that binds to a repeated sequence in the 3'-untranslated region. ENBO J. 13: 1476 -1481.
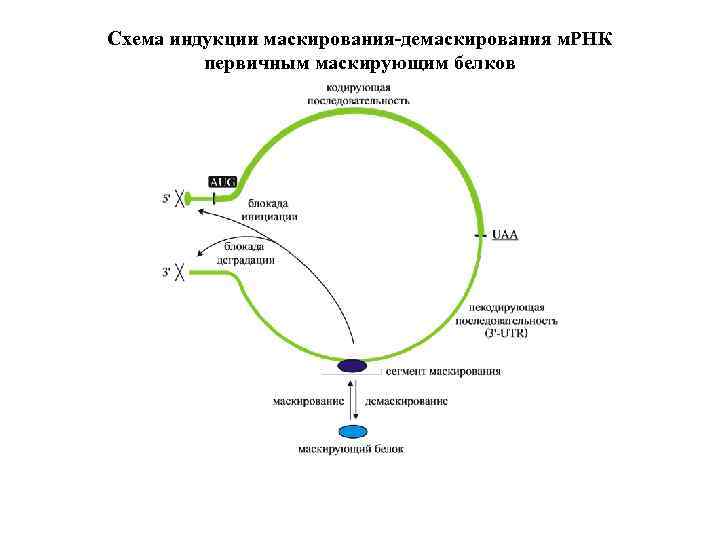
Схема индукции маскирования-демаскирования м. РНК первичным маскирующим белков
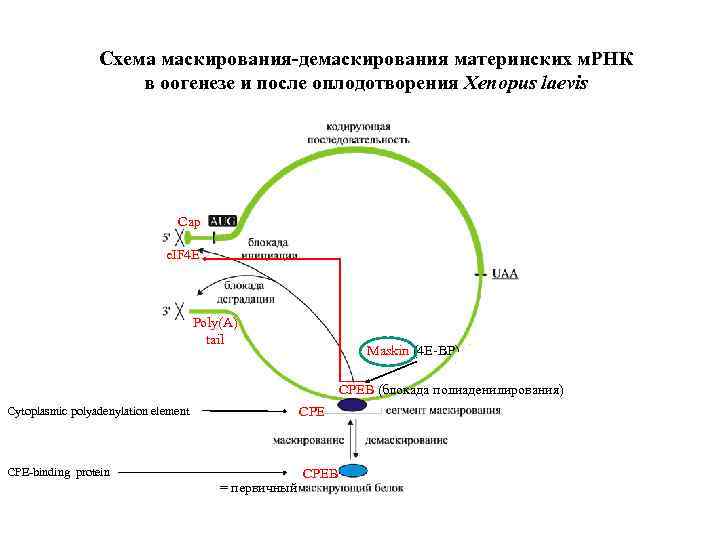
Схема маскирования-демаскирования материнских м. РНК в оогенезе и после оплодотворения Xenopus laevis Cap e. IF 4 E Poly(A) tail Maskin (4 Е-ВР) CPEB (блокада полиаденилирования) Cytoplasmic polyadenylation element CPE-binding protein = первичный CPEB
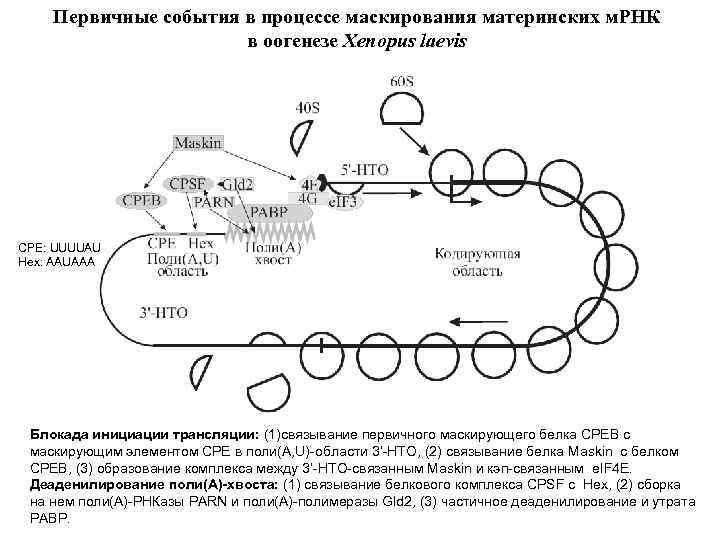
Первичные события в процессе маскирования материнских м. РНК в оогенезе Xenopus laevis CPE: UUUUAU Hex: AAUAAA Блокада инициации трансляции: (1)связывание первичного маскирующего белка СРЕВ с маскирующим элементом СРЕ в поли(A, U)-области 3’-НТО, (2) связывание белка Maskin с белком CPEB, (3) образование комплекса между 3’-НТО-связанным Maskin и кэп-связанным e. IF 4 E. Деаденилирование поли(А)-хвоста: (1) связывание белкового комплекса CPSF c Hex, (2) сборка на нем поли(А)-РНКазы PARN и поли(А)-полимеразы Gld 2, (3) частичное деаденилирование и утрата РАВР.
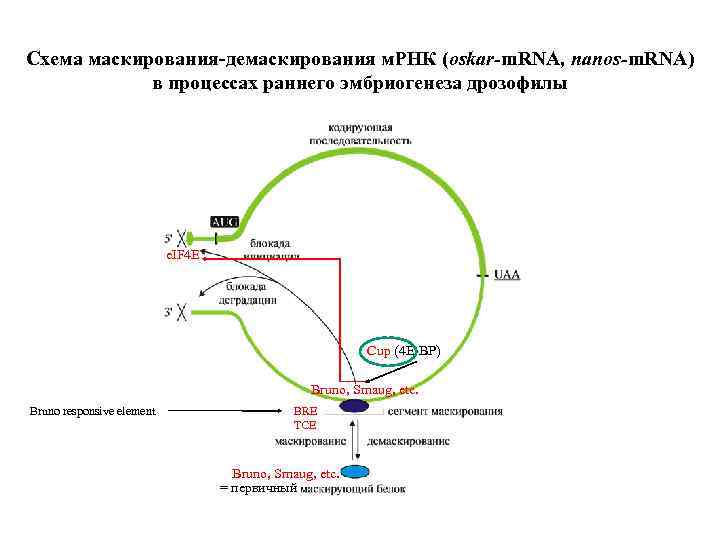
Схема маскирования-демаскирования м. РНК (oskar-m. RNA, nanos-m. RNA) в процессах раннего эмбриогенеза дрозофилы e. IF 4 E Cup (4 Е-ВР) Bruno, Smaug, etc. Bruno responsive element BRE TCE Bruno, Smaug, etc. = первичный
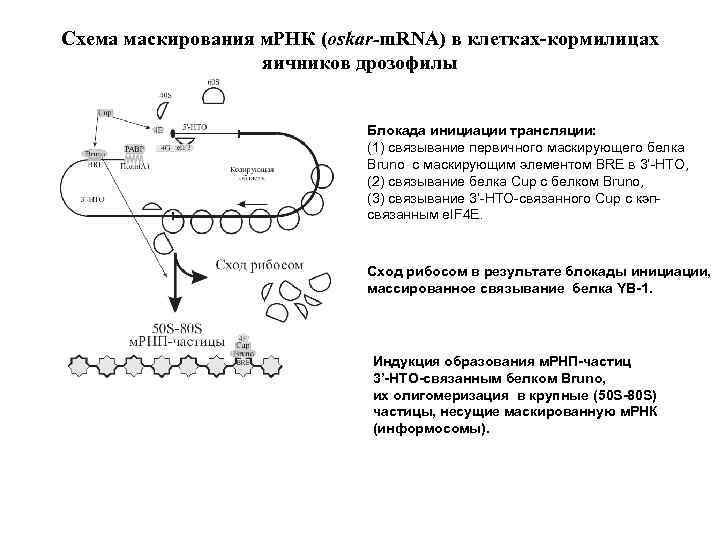
Схема маскирования м. РНК (oskar-m. RNA) в клетках-кормилицах яичников дрозофилы Блокада инициации трансляции: (1) связывание первичного маскирующего белка Bruno с маскирующим элементом BRE в 3’-НТО, (2) связывание белка Cup с белком Bruno, (3) связывание 3’-НТО-связанного Cup с кэпсвязанным e. IF 4 E. Сход рибосом в результате блокады инициации, массированное связывание белка YB-1. Индукция образования м. РНП-частиц 3’-НТО-связанным белком Bruno, их олигомеризация в крупные (50 S-80 S) частицы, несущие маскированную м. РНК (информосомы).
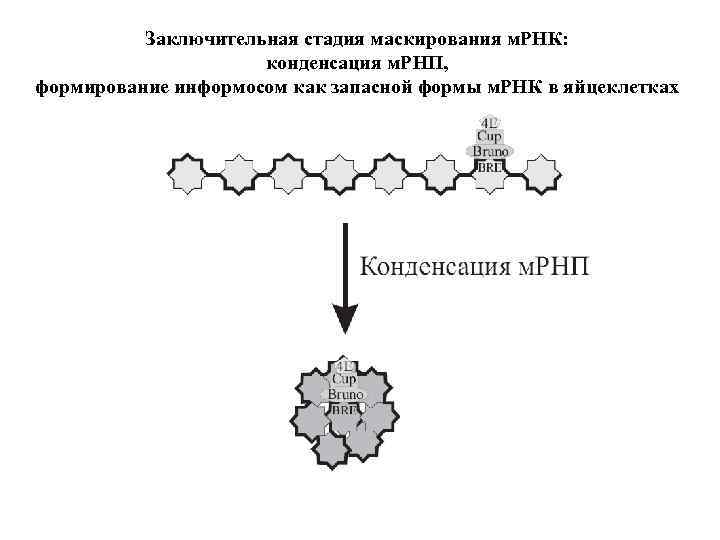
Заключительная стадия маскирования м. РНК: конденсация м. РНП, формирование информосом как запасной формы м. РНК в яйцеклетках
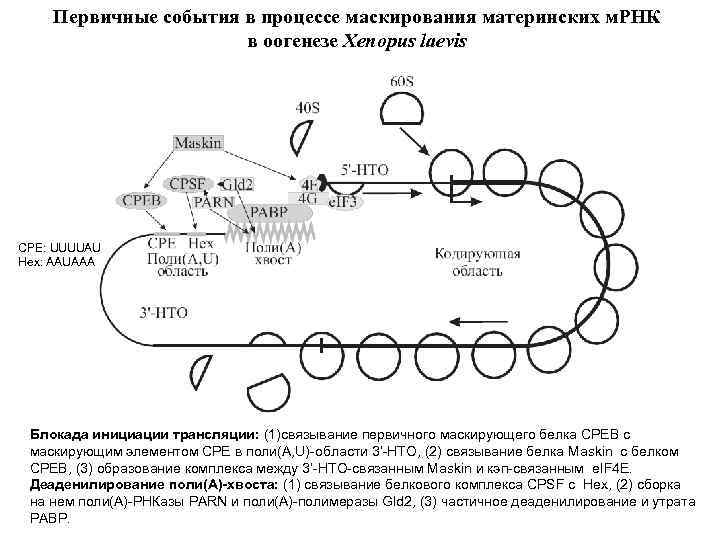
Первичные события в процессе маскирования материнских м. РНК в оогенезе Xenopus laevis CPE: UUUUAU Hex: AAUAAA Блокада инициации трансляции: (1)связывание первичного маскирующего белка СРЕВ с маскирующим элементом СРЕ в поли(A, U)-области 3’-НТО, (2) связывание белка Maskin с белком CPEB, (3) образование комплекса между 3’-НТО-связанным Maskin и кэп-связанным e. IF 4 E. Деаденилирование поли(А)-хвоста: (1) связывание белкового комплекса CPSF c Hex, (2) сборка на нем поли(А)-РНКазы PARN и поли(А)-полимеразы Gld 2, (3) частичное деаденилирование и утрата РАВР.

CPSF = Cleavage and Polyadenylation Specificity Factor, мультисубъединичный белок, связанный с AAUAAA
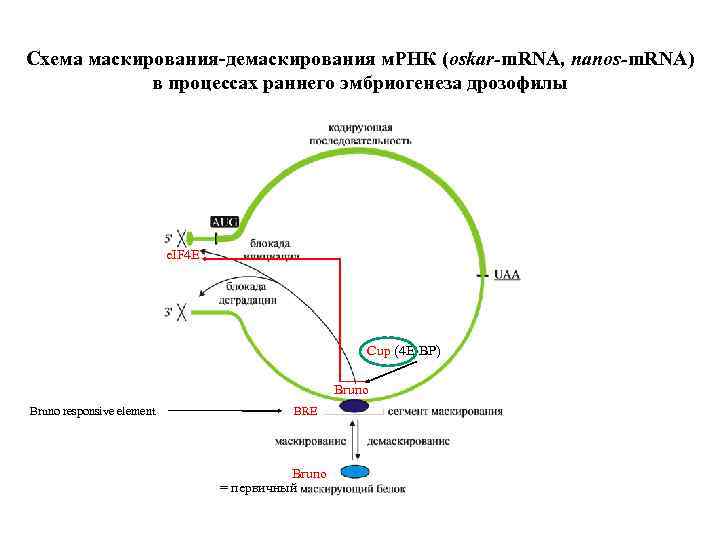
Схема маскирования-демаскирования м. РНК (oskar-m. RNA, nanos-m. RNA) в процессах раннего эмбриогенеза дрозофилы e. IF 4 E Cup (4 Е-ВР) Bruno responsive element BRE Bruno = первичный
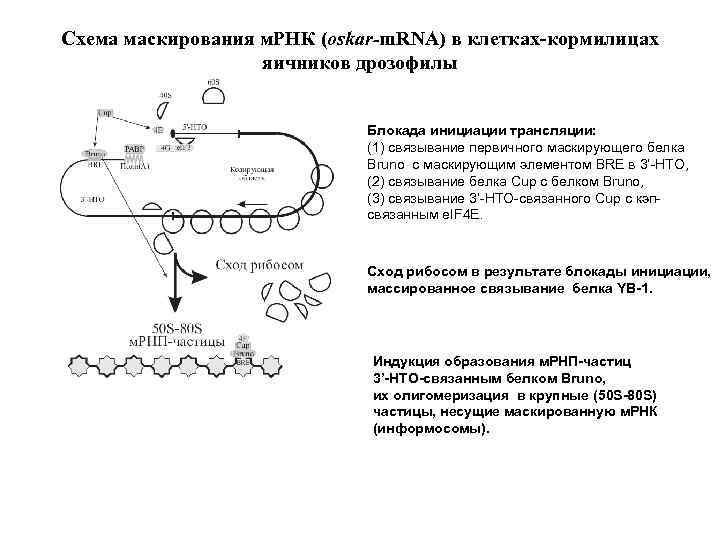
Схема маскирования м. РНК (oskar-m. RNA) в клетках-кормилицах яичников дрозофилы Блокада инициации трансляции: (1) связывание первичного маскирующего белка Bruno с маскирующим элементом BRE в 3’-НТО, (2) связывание белка Cup с белком Bruno, (3) связывание 3’-НТО-связанного Cup с кэпсвязанным e. IF 4 E. Сход рибосом в результате блокады инициации, массированное связывание белка YB-1. Индукция образования м. РНП-частиц 3’-НТО-связанным белком Bruno, их олигомеризация в крупные (50 S-80 S) частицы, несущие маскированную м. РНК (информосомы).
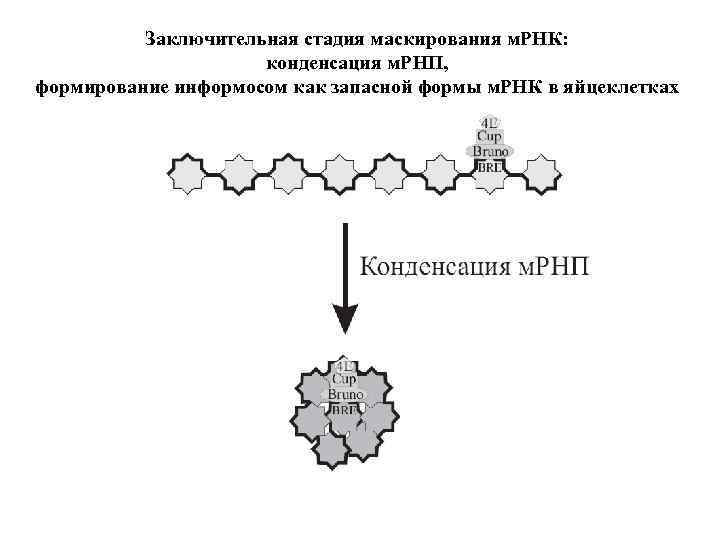
Заключительная стадия маскирования м. РНК: конденсация м. РНП, формирование информосом как запасной формы м. РНК в яйцеклетках

Регуляция трансляции у эукариот: Микро-РНК

Открытие микро. РНК и их регуляторного действия на трансляцию эукариотических м. РНК A. Fire, S. Xu, M. K. Montgomery, S. A. Kostas, S. E. Driver, and C. C. Mello (1998) Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391: 806 -811. S. Xu, M. K. Montgomery, and A. Fire (1998) RNA as a target of double-stranded RNA-mediated genetic interference in Caenorhabditis elegans. Proc. Natl. Acad. Sci. USA 95: 15502 -15507. A. A. Aravin, N. M. Naumova, A. V. Tulin, V. V. Vagin, Y. M. Rozovsky and V. A. Gvozdev (2001) Doublestranded RNA-mediated silencing of genomic tandem repeats and transposable elements in the D. melanogaster germline. Curr. Biol. 11: 1017 -1027. M. Lagos-Quintana, R. Rauhut, W. Lendeckel and T. Tuschl (2001) Identification of a novel genes coding for small expressed RNAs. Science 294: 853 -858. N. C. Lau, L. P. Lim, E. G. Weinstein and D. P. Bartel (2001) An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans. Science 294: 858 -862. R. C. Lee and V. Ambros (2001). An extensive class of small RNAs in Caenorhabditis elegans. Science 294: 862 -864. G. Ruvkun (2001) Glimpses of a tiny RNA world. Science 294: 797 -799. D. Baulcombe (2002) An RNA microcosm. Science 297: 2002 -2003. D. P. Bartel (2004) Micro. RNAs: Genomics, biogenesis, mechanism, and function. Cell 116: 281 -297.

Общие сведения о микро. РНК (1) Микро. РНК – открытый на рубеже тысячелетий вид некодирующих коротких (21 -25 нуклеотидных остатков) полирибонуклеотидов, контролирующих трансляцию м. РНК в клетках эукариот. (2) Белок-синтезирующий аппарат в клетках высших эукариот функционирует в море микро. РНК, и большая доля клеточных м. РНК находится под их контролем. У человека насчитываются сотни различных микро. РНК, и экспрессия по крайней мере трети его генов, кодирующих белки, контролируется этими микро. РНК. (3) Под контролем каждой каждого вида микро. РНК обычно находится целая группа (семейство) м. РНК, так или иначе вместе участвующих в определенных процессах эмбрионального развития, клеточной дифференцировки, органогенеза, и т. п. (4) Контроль осуществляется через комплементарное (полное или частичное) связывание молекул микро. РНК с клеточными м. РНК – как правило, с их 3'-нетранслируемыми областями, что индуцирует избирательное выключение трансляции с последующей деградацией соответствующих м. РНК, или с их маскированием. (5) Накапливающиеся экспериментальные данные все больше наводят на мысль, что основной механизм действия микро. РНК и его белкового партнера (Argonaute) должен заключаться в прямом воздействии на транслирующие полирибосомы. Однако, молекулярный механизм (или механизмы) действия микро. РНК на полирибосомы остается пока полной загадкой.

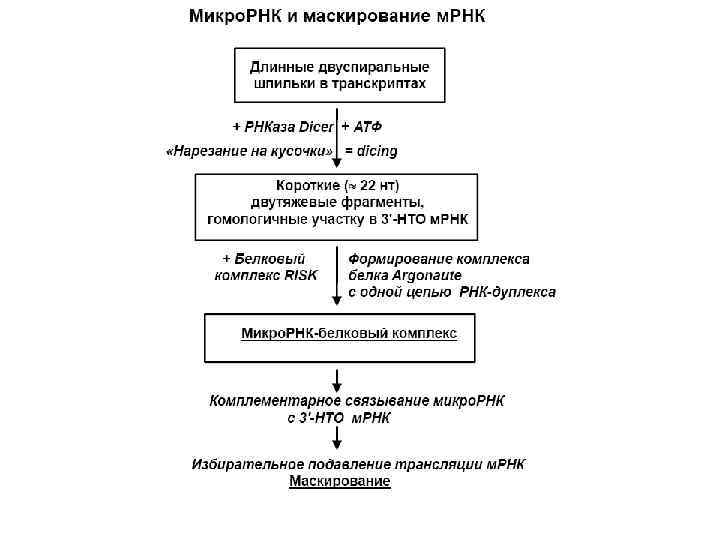
Биогенез микро. РНК (1) Микро. РНК в клетках образуются из специальных некодирующих транскриптов, формирующих длинные двуспиральные шпильки с многочисленными боковыми петлями. В ядре происходит выщепление укороченной шпильки из более длинного транскрипта. (2) После транспорта в цитоплазму шпилька связывается со специальной мультидоменной эндонуклеазой под названием «Dicer» , которая вырезает двуспиральный участок длиной около 22 -24 нуклеотидных пар. (3) Этот дуплекс расплетается хеликазой, и одна из цепей, представляющая собой зрелую микро. РНК, передается от Dicer на белковый комплекс, обозначаемый как «RISK» (RNA-Induced Silencing Complex), а комплементарная цепь освобождается и разрушается. (4) Основой комплекса RISK является крупный (около 100 к. Да) белок, обозначаемый как «Argonaute» ; именно с ним оказывается связанной цепь микро. РНК. (5) Микро. РНК в комплексе с RISK (белком Argonaute) специфически взаимодействует с полностью или частично комплементарными участками в 3 -НТО молекул м. РНК, что приводит к инактивации этих м. РНК.

Общая схема механизмов регуляции трансляции
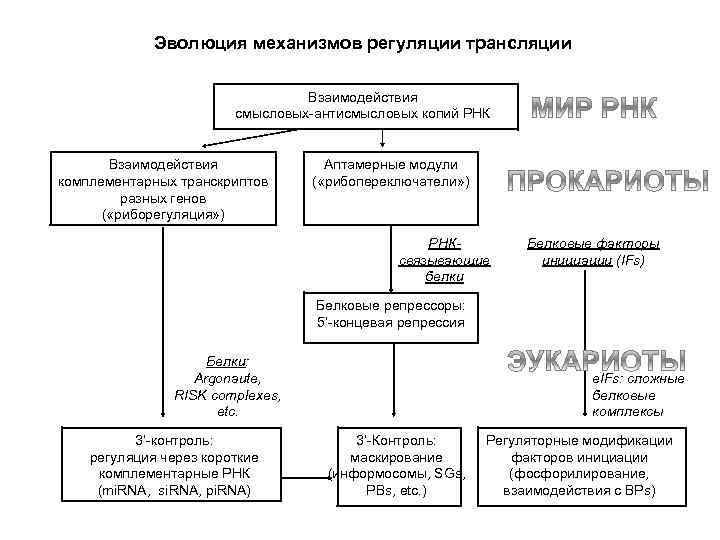
Эволюция механизмов регуляции трансляции Взаимодействия смысловых-антисмысловых копий РНК Взаимодействия комплементарных транскриптов разных генов ( «риборегуляция» ) Аптамерные модули ( «рибопереключатели» ) РНКсвязывающие белки Белковые факторы инициации (IFs) Белковые репрессоры: 5’-концевая репрессия Белки: Argonaute, RISK complexes, etc. 3’-контроль: регуляция через короткие комплементарные РНК (mi. RNA, si. RNA, pi. RNA) e. IFs: сложные белковые комплексы 3’-Контроль: маскирование (информосомы, SGs, PBs, etc. ) Регуляторные модификации факторов инициации (фосфорилирование, взаимодействия с ВРs)

Конец лекции. Спасибо за внимание!


Три функциональные группы факторов: I: 40 Sсвязывающие II: м. РНКсвязывающие III: 60 Sсодействующие
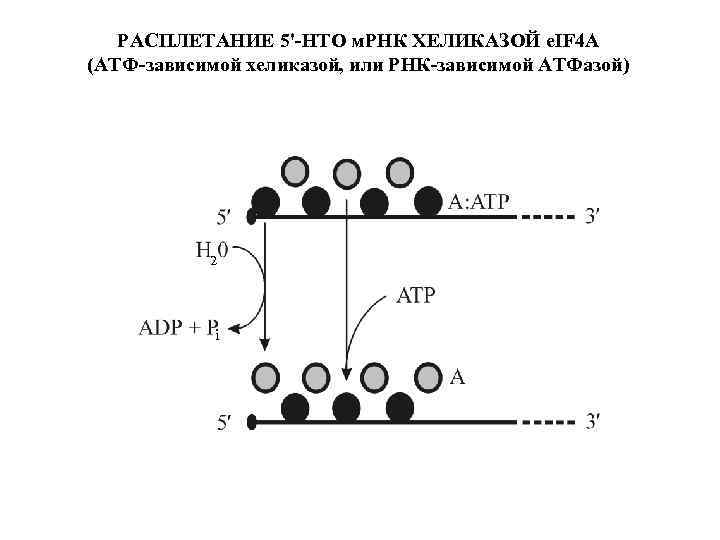
РАСПЛЕТАНИЕ 5'-НТО м. РНК ХЕЛИКАЗОЙ e. IF 4 A (АТФ-зависимой хеликазой, или РНК-зависимой АТФазой) 2 i
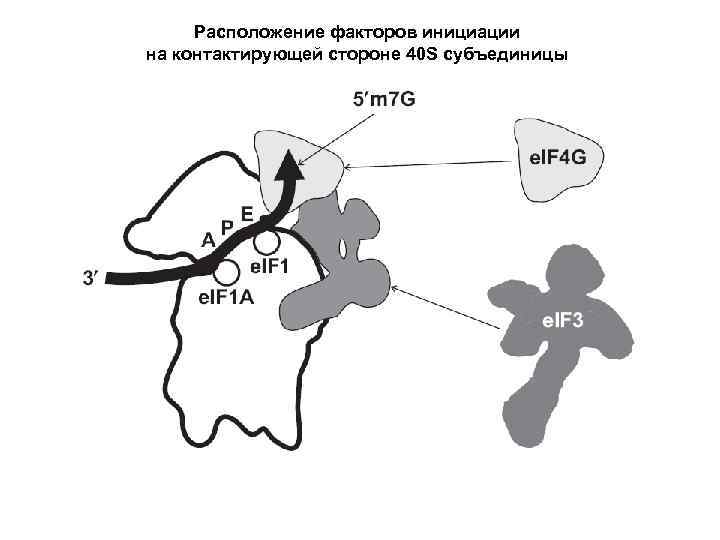
Расположение факторов инициации на контактирующей стороне 40 S субъединицы
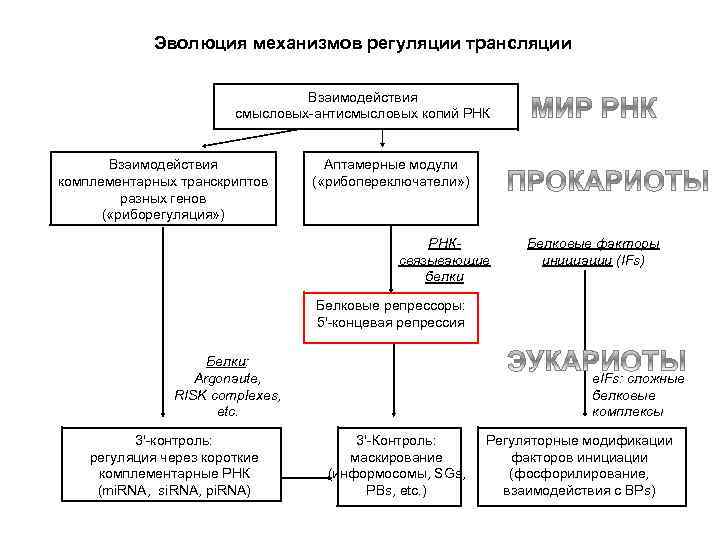
Эволюция механизмов регуляции трансляции Взаимодействия смысловых-антисмысловых копий РНК Взаимодействия комплементарных транскриптов разных генов ( «риборегуляция» ) Аптамерные модули ( «рибопереключатели» ) РНКсвязывающие белки Белковые факторы инициации (IFs) Белковые репрессоры: 5'-концевая репрессия Белки: Argonaute, RISK complexes, etc. 3'-контроль: регуляция через короткие комплементарные РНК (mi. RNA, si. RNA, pi. RNA) e. IFs: сложные белковые комплексы 3'-Контроль: маскирование (информосомы, SGs, PBs, etc. ) Регуляторные модификации факторов инициации (фосфорилирование, взаимодействия с ВРs)
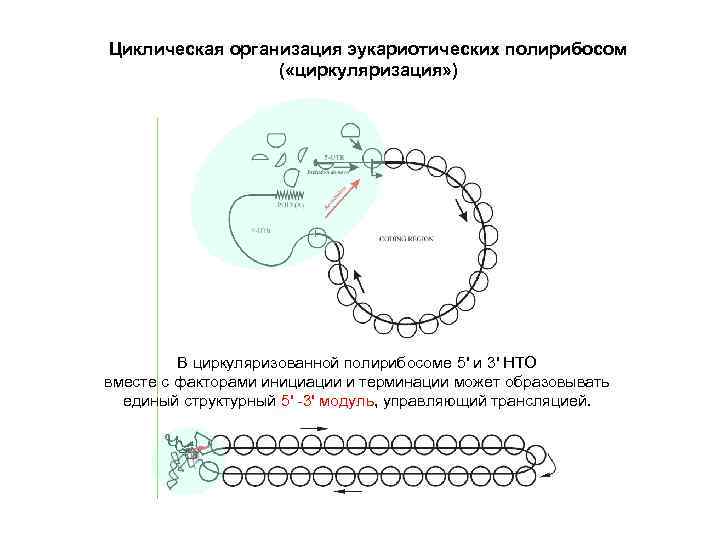
Циклическая организация эукариотических полирибосом ( «циркуляризация» ) В циркуляризованной полирибосоме 5' и 3' НТО вместе с факторами инициации и терминации может образовывать единый структурный 5' -3' модуль, управляющий трансляцией.
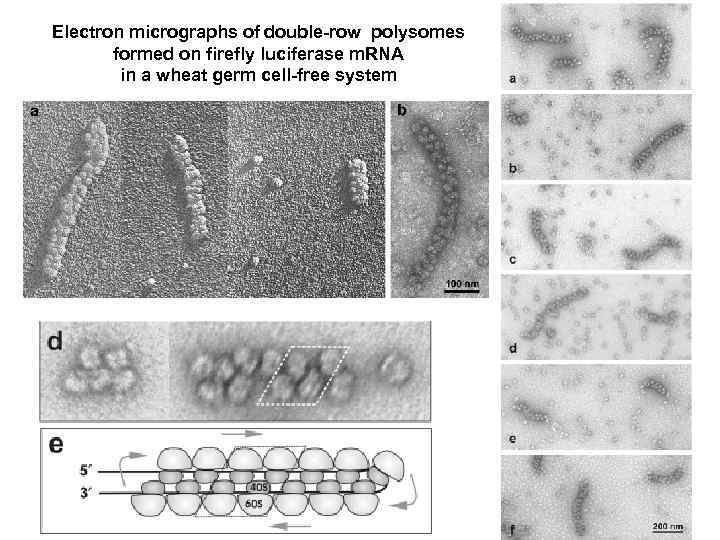
Electron micrographs of double-row polysomes formed on firefly luciferase m. RNA in a wheat germ cell-free system

Циркуляризация эукариотических полирибосом и круговая трансляция полисомных м. РНК (ре-инициация трансляции терминирующими рибосомами) (1) Последовательные акты инициации трансляции на эукариотических м. РНК приводят к формированию полирибосом и их циркуляризации (сближенности 5' и 3' НТО). В случае длинных м. РНК сформированные циркулярные полирибосомы видны как двойные ряды рибосом. (2) В циркулярных полирибосомах обмен полисомных рибосом на свободные требует многих раундов трансляции, что указывает на ре-инициацию трансляции (3' 5' переход терминирующих рибосом на той же м. РНК). (3) В отличие от de novo инициации, ре-инициация проходит без сканирования 5' НТО. (4) Скорость ре-инициации значительно превышает таковую de novo инициации. G. S. Kopeina, Zh. A. Afonina, K. V. Gromova, V. A. Shirokov, V. D. Vasiliev, A. S. Spirin (2008) Step-wise formation of eukaryotic double-row polyribosomes and circular translation of polysomal m. RNA. Nucleic Acids Research 36, 2476 -2488.
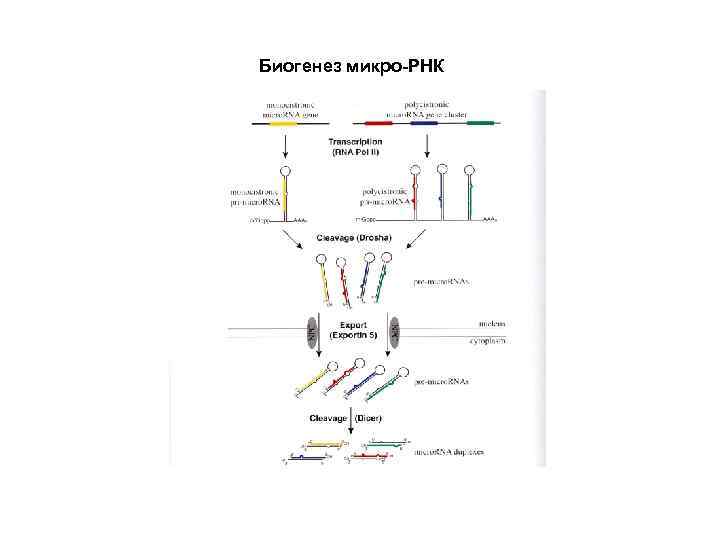
Биогенез микро-РНК
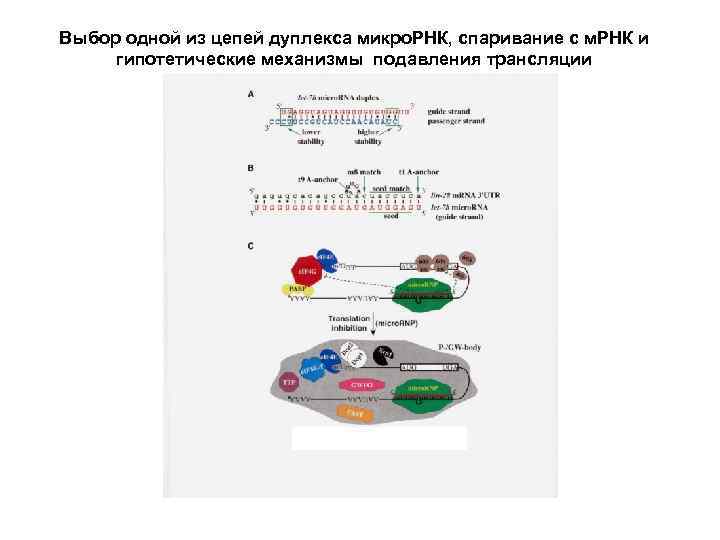
Выбор одной из цепей дуплекса микро. РНК, спаривание с м. РНК и гипотетические механизмы подавления трансляции
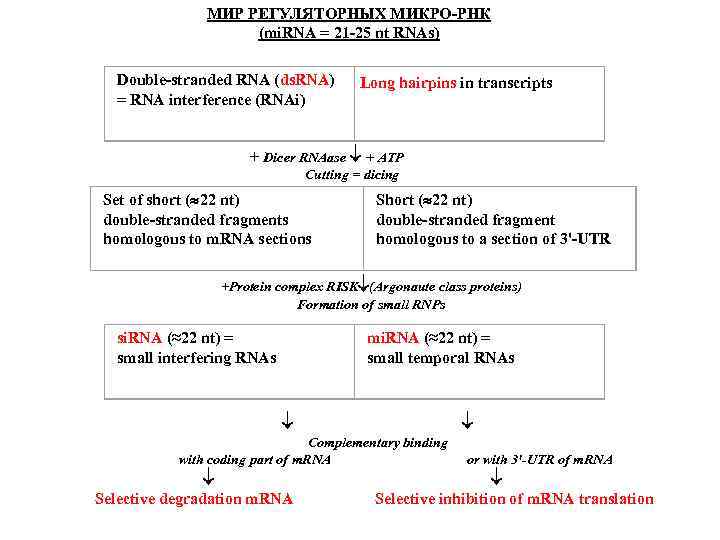
МИР РЕГУЛЯТОРНЫХ МИКРО-РНК (mi. RNA = 21 -25 nt RNAs) Double-stranded RNA (ds. RNA) = RNA interference (RNAi) Long hairpins in transcripts + Dicer RNAase + АТP Cutting = dicing Set of short ( 22 nt) double-stranded fragments homologous to m. RNA sections Short ( 22 nt) double-stranded fragment homologous to a section of 3'-UTR +Protein complex RISK (Argonaute class proteins) Formation of small RNPs si. RNA (≈22 nt) = small interfering RNAs mi. RNA (≈22 nt) = small temporal RNAs Complementary binding with coding part of m. RNA Selective degradation m. RNA or with 3'-UTR of m. RNA Selective inhibition of m. RNA translation

Резервные слайды
lecture_9_2013.pptx