lecture_3_2013.pptx
- Количество слайдов: 57

А. С. Спирин Молекулярная биология: Лекция 3. Структура рибосомы: рибосомная РНК, рибосомные белки, четвертичные структуры рибосомных субъединиц 27 февраля 2013 г.
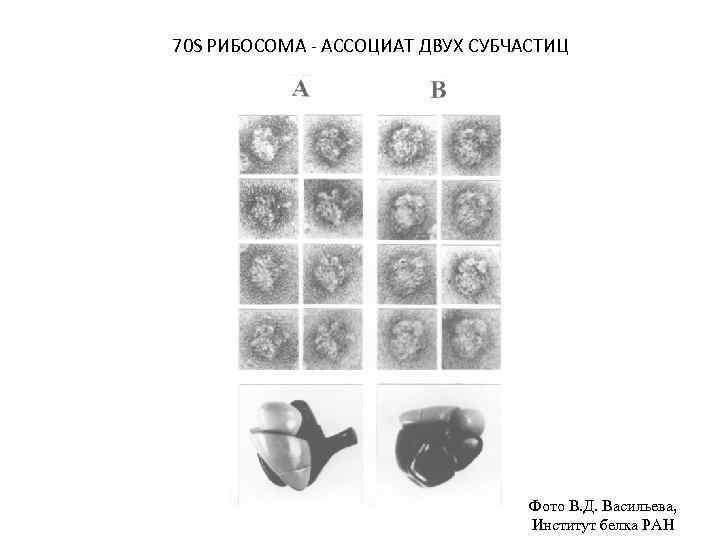
70 S РИБОСОМА - АССОЦИАТ ДВУХ СУБЧАСТИЦ Фото В. Д. Васильева, Институт белка РАН
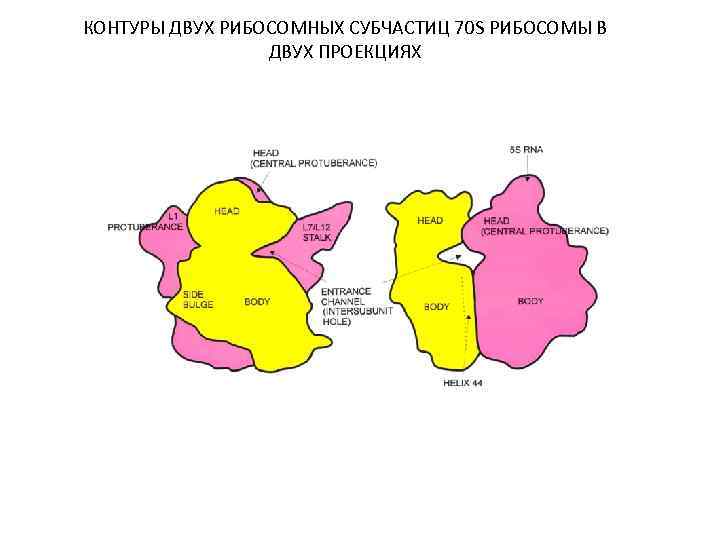
КОНТУРЫ ДВУХ РИБОСОМНЫХ СУБЧАСТИЦ 70 S РИБОСОМЫ В ДВУХ ПРОЕКЦИЯХ

Рибосомные РНК
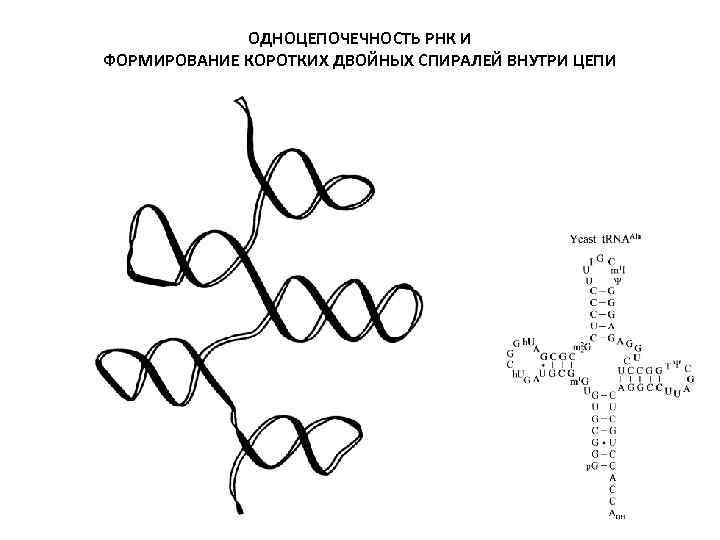
ОДНОЦЕПОЧЕЧНОСТЬ РНК И ФОРМИРОВАНИЕ КОРОТКИХ ДВОЙНЫХ СПИРАЛЕЙ ВНУТРИ ЦЕПИ
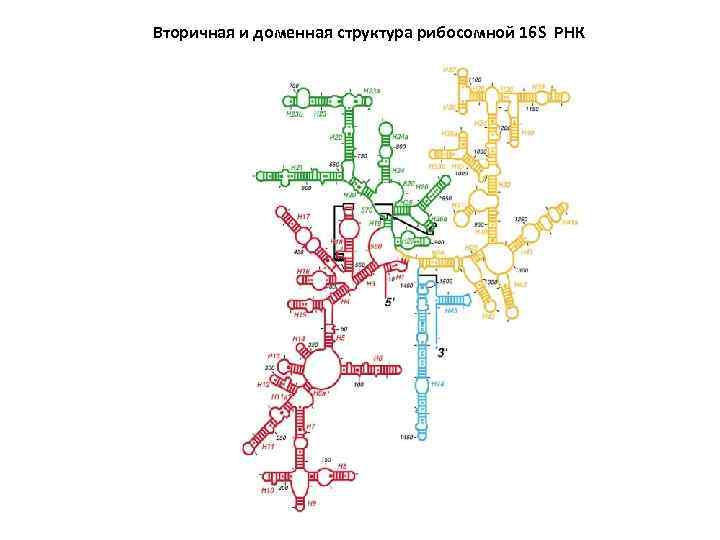
Вторичная и доменная структура рибосомной 16 S РНК
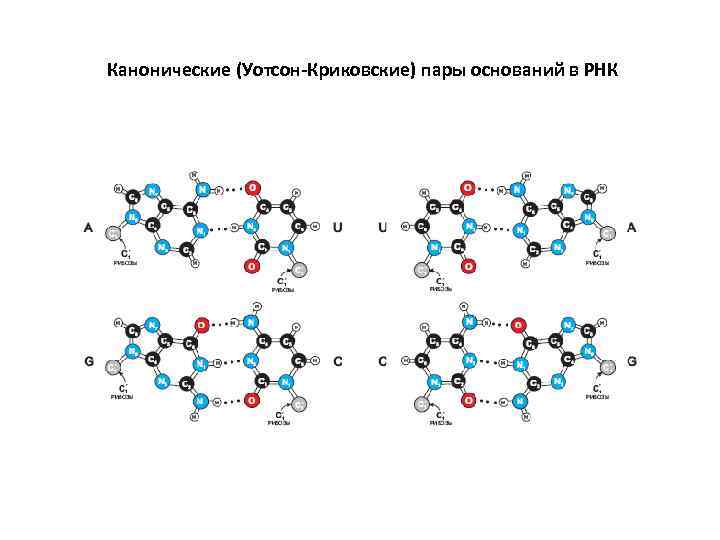
Канонические (Уотсон-Криковские) пары оснований в РНК

Канонические (Уотсон-Криковские) пары оснований

А и В формы ДНКмодели) А и В формы ДНК (атомные модели) А форма РНК В форма ДНК
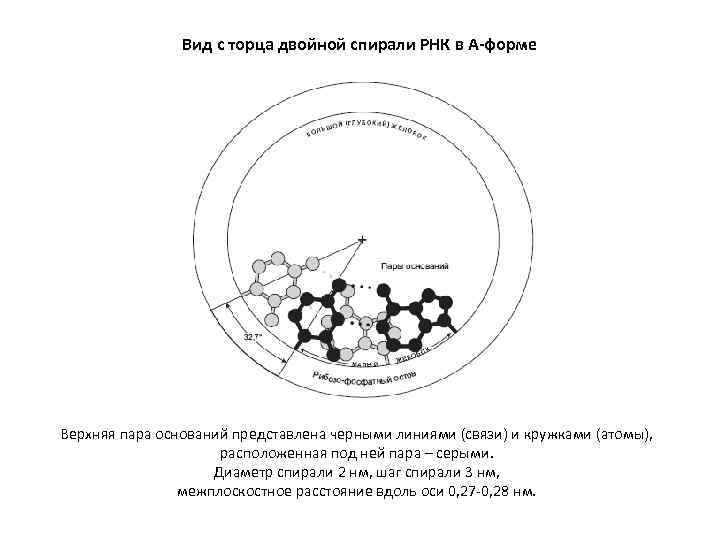
Вид с торца двойной спирали РНК в А-форме Верхняя пара оснований представлена черными линиями (связи) и кружками (атомы), расположенная под ней пара – серыми. Диаметр спирали 2 нм, шаг спирали 3 нм, межплоскостное расстояние вдоль оси 0, 27 -0, 28 нм.
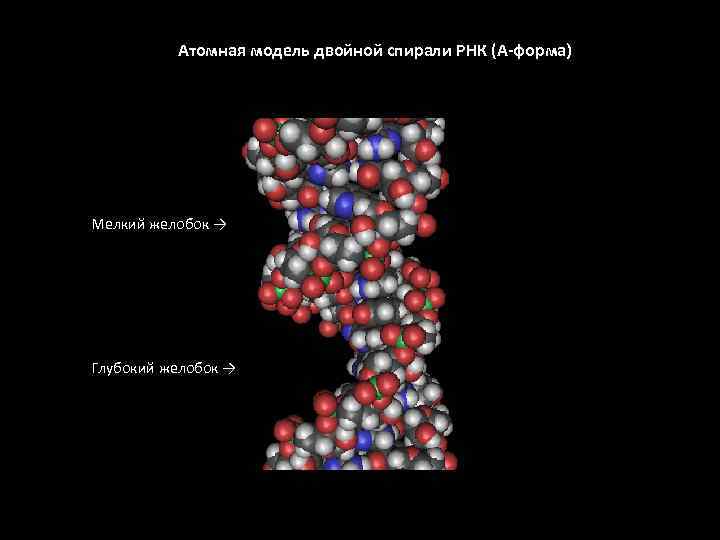
Атомная модель двойной спирали РНК (А-форма) Мелкий желобок → Глубокий желобок →

Канонические (Уотсон-Криковские) пары оснований и неканоническая пара G: U в спиральных участках РНК
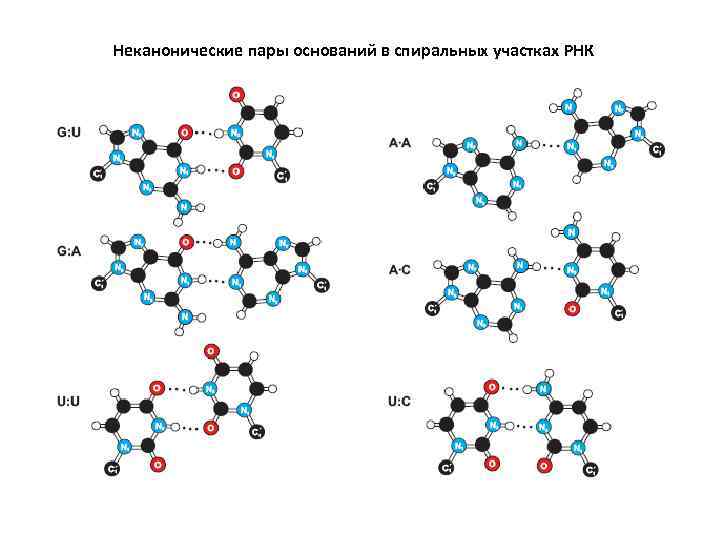
Неканонические пары оснований в спиральных участках РНК
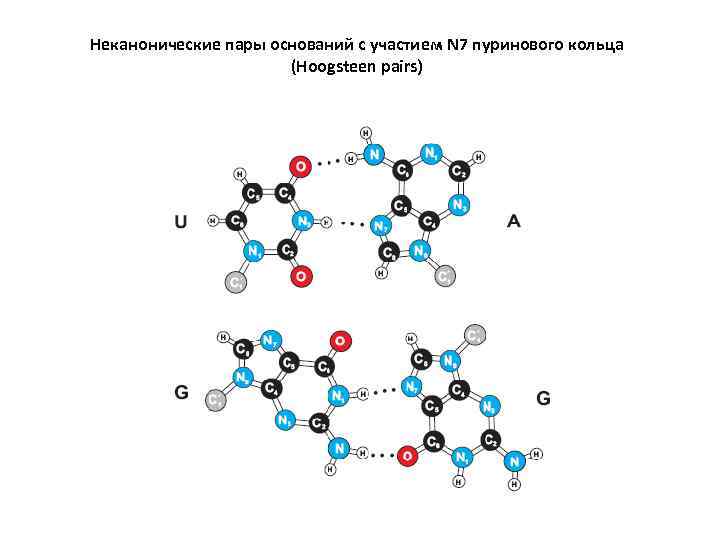
Неканонические пары оснований с участием N 7 пуринового кольца (Hoogsteen pairs)
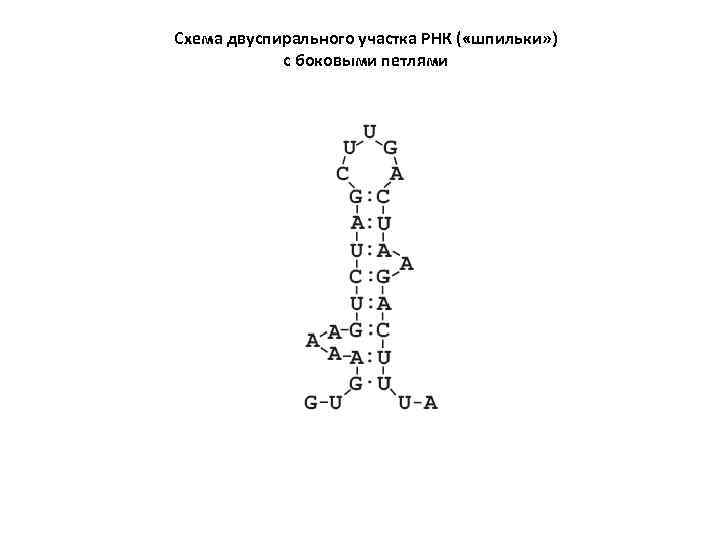
Схема двуспирального участка РНК ( «шпильки» ) с боковыми петлями
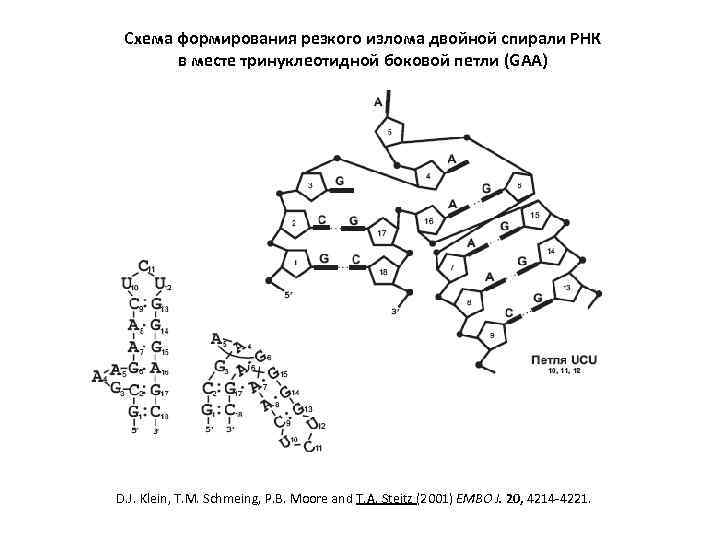
Схема формирования резкого излома двойной спирали РНК в месте тринуклеотидной боковой петли (GAA) D. J. Klein, T. M. Schmeing, P. B. Moore and T. A. Steitz (2001) EMBO J. 20, 4214 -4221.
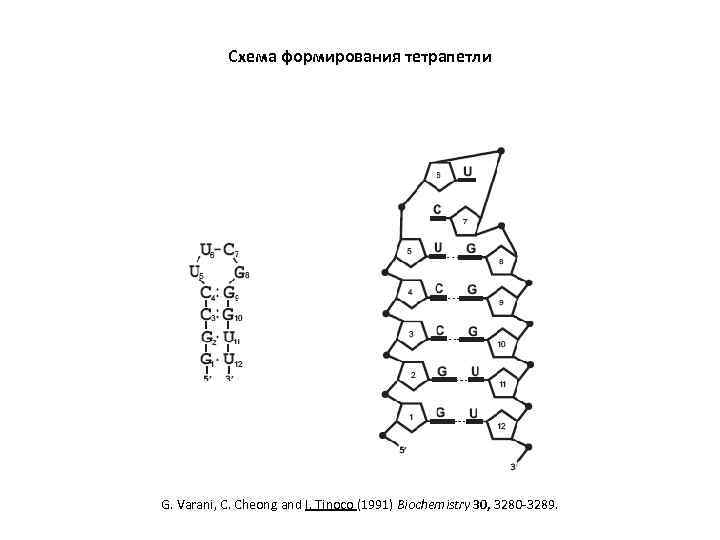
Схема формирования тетрапетли G. Varani, C. Cheong and I. Tinoco (1991) Biochemistry 30, 3280 -3289.
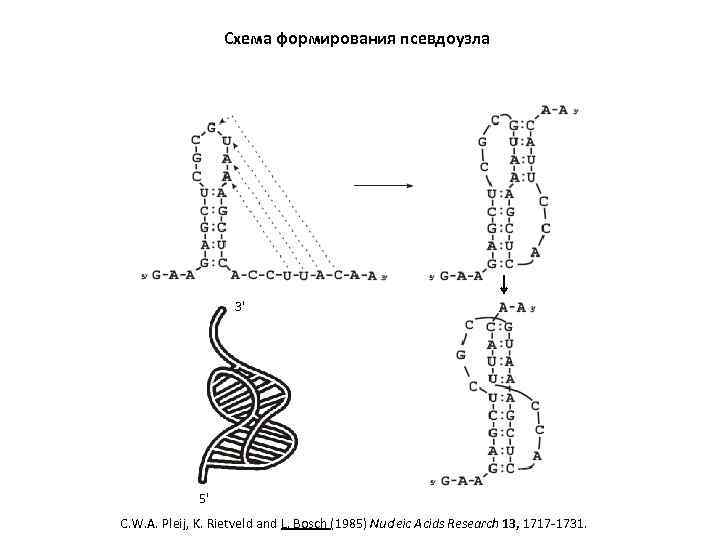
Схема формирования псевдоузла 3' 5' C. W. A. Pleij, K. Rietveld and L. Bosch (1985) Nucleic Acids Research 13, 1717 -1731.

ВТОРИЧНАЯ СТРУКТУРА РНК: «дефекты» двойных спиралей и отклонения от двуспиральной структуры (1) Нестандартные спаривания и «противостояния» в двойной спирали. (2) Выпетливания нуклеотидов одной из спаренных цепей в двойной спирали. (3) Изломы двойных спиралей. (4) «Тетрапетли» (Tetraloops). (5) Псевдоузлы (Preudoknots).

Структура рибосомной 30 S субчастицы B. T. Wimberly, D. E. Brodersen, W. M. Clemons Jr, R. J. Morgan-Warren, A. P. Carter, C. Vonrhen, T. Hartch, and V. Ramakrishnan (2000) Nature 407: 327 -339.
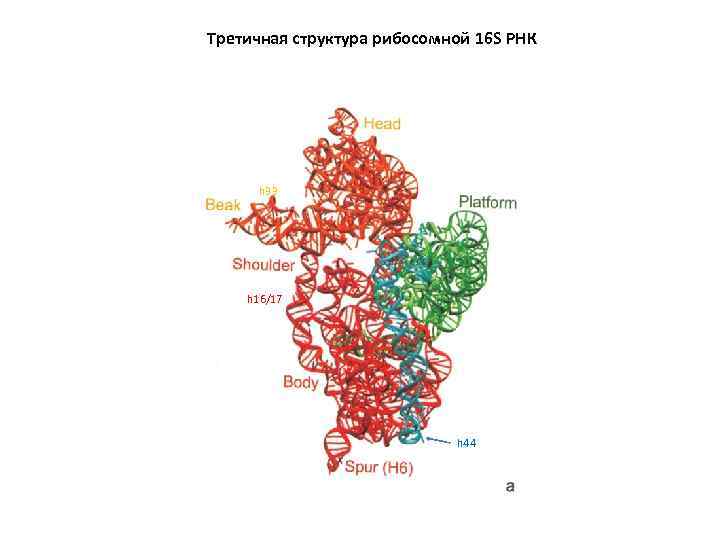
Третичная структура рибосомной 16 S РНК h 33 h 16/17 h 44
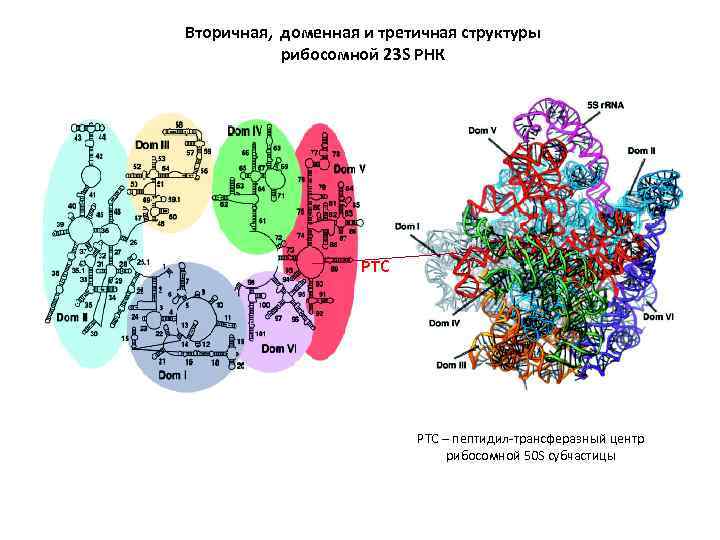
Вторичная, доменная и третичная структуры рибосомной 23 S РНК PTC – пептидил-трансферазный центр рибосомной 50 S субчастицы
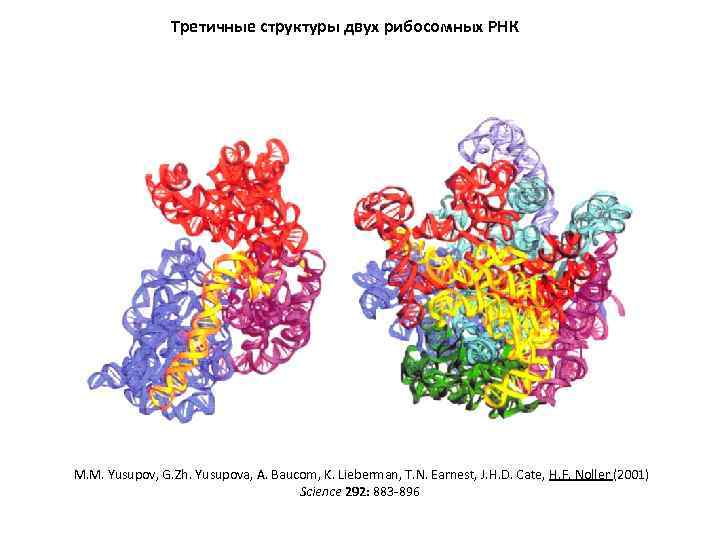
Третичные структуры двух рибосомных РНК M. M. Yusupov, G. Zh. Yusupova, A. Baucom, K. Lieberman, T. N. Earnest, J. H. D. Cate, H. F. Noller (2001) Science 292: 883 -896
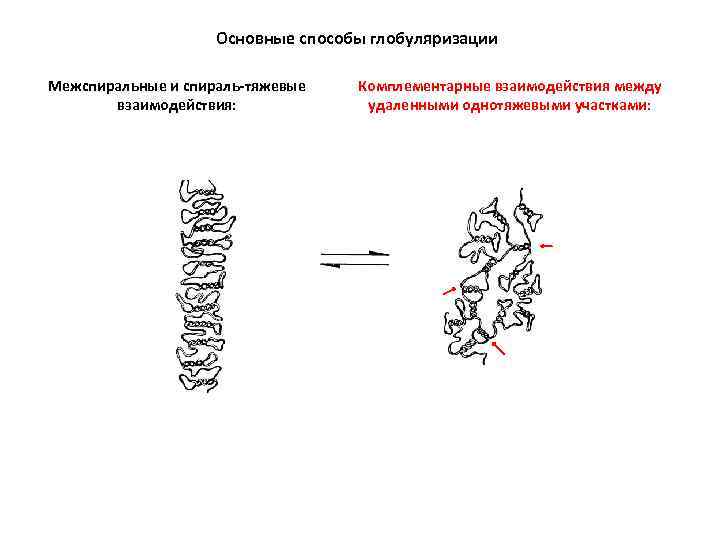
Основные способы глобуляризации Межспиральные и спираль-тяжевые взаимодействия: Комплементарные взаимодействия между удаленными однотяжевыми участками:
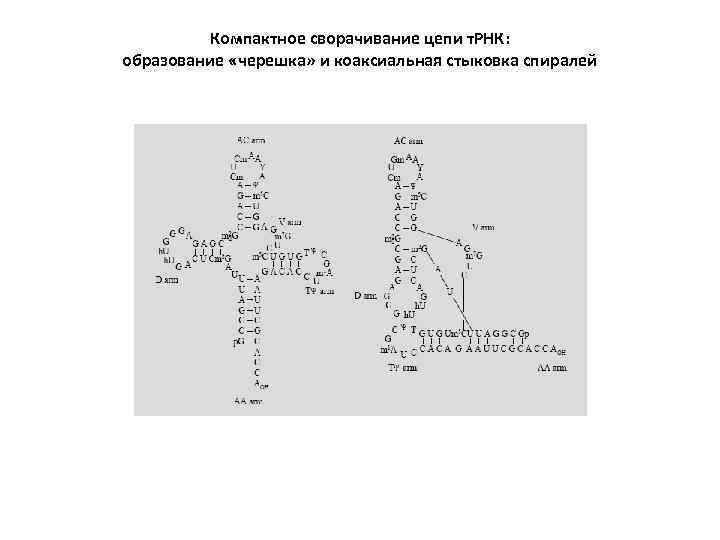
Компактное сворачивание цепи т. РНК: образование «черешка» и коаксиальная стыковка спиралей
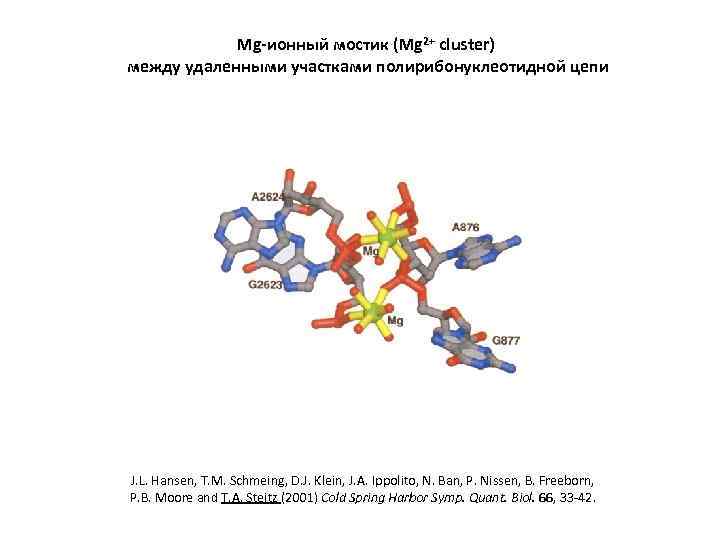
Mg-ионный мостик (Mg 2+ cluster) между удаленными участками полирибонуклеотидной цепи J. L. Hansen, T. M. Schmeing, D. J. Klein, J. A. Ippolito, N. Ban, P. Nissen, B. Freeborn, P. B. Moore and T. A. Steitz (2001) Cold Spring Harbor Symp. Quant. Biol. 66, 33 -42.
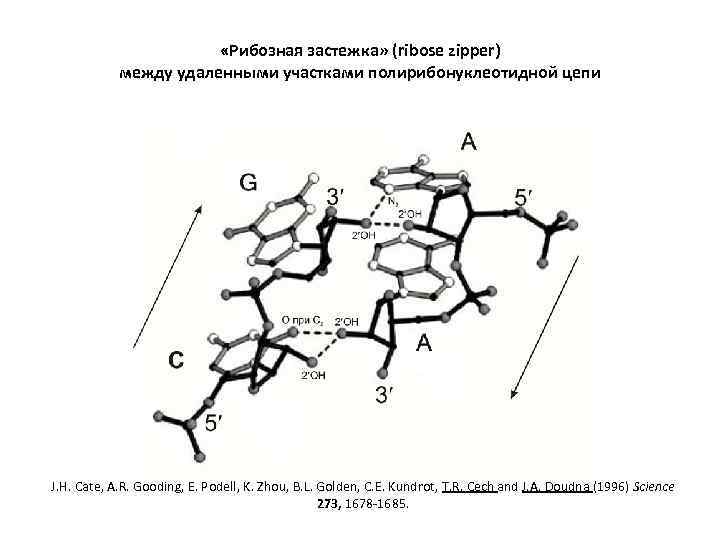
«Рибозная застежка» (ribose zipper) между удаленными участками полирибонуклеотидной цепи J. H. Cate, A. R. Gooding, E. Podell, K. Zhou, B. L. Golden, C. E. Kundrot, T. R. Cech and J. A. Doudna (1996) Science 273, 1678 -1685.
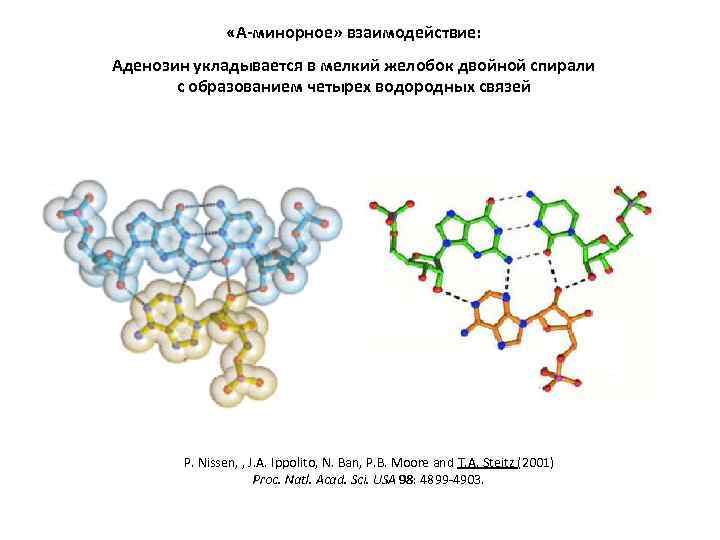
«А-минорное» взаимодействие: Аденозин укладывается в мелкий желобок двойной спирали с образованием четырех водородных связей P. Nissen, , J. A. Ippolito, N. Ban, P. B. Moore and T. A. Steitz (2001) Proc. Natl. Acad. Sci. USA 98: 4899 -4903.
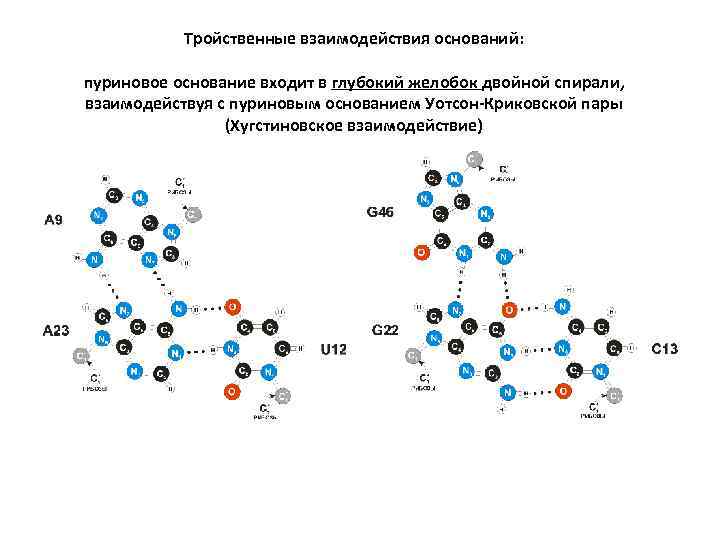
Тройственные взаимодействия оснований: пуриновое основание входит в глубокий желобок двойной спирали, взаимодействуя с пуриновым основанием Уотсон-Криковской пары (Хугстиновское взаимодействие)

Тройственные взаимодействия оснований: Пуриновое основание входит в глубокий желобок двойной спирали, взаимодействуя с пуриновым основанием Уотсон-Криковской пары (Хугстиновское взаимодействие)

ТРЕТИЧНАЯ СТРУКТУРА РНК: дальние взаимодействия, обеспечивающие компактное сворачивание РНК (1) Комплементарное спаривание отдаленных участков цепи. Образование черешков и доменов. (2) Спаривание торцевых петель с дальними однотяжевывми участками ( «дальние псевдоузлы» ). (3) Коаксиальный стэкинг двойных спиралей. Образование «составных спиралей» . (4) Mg-ионные мостики между фосфатами. (5) «Рибозные застежки» . (6) Взаимодействия аденозинов с мелким желобком спиралей ( «А-минорные взаимодействия» ). (7) Внедрения пуриновых нуклеозидов в глубокий желобок спиралей ( «тройственные взаимодействия оснований» , формирование элементов тройных спиралей).
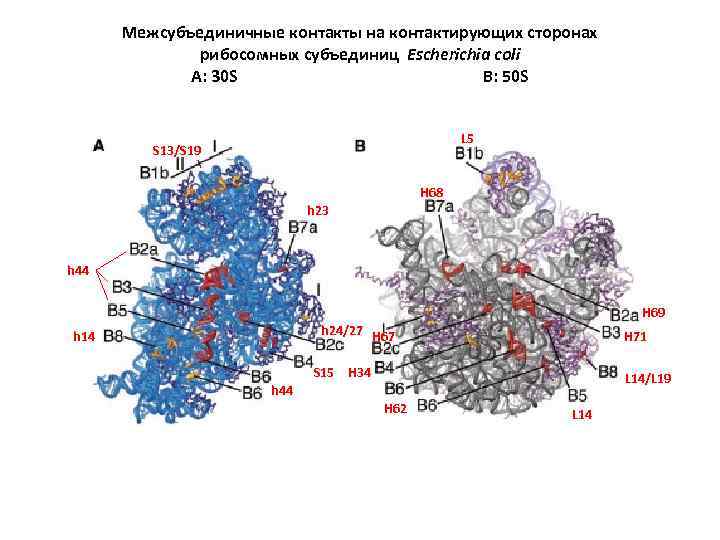
Межсубъединичные контакты на контактирующих сторонах рибосомных субъединиц Escherichia coli A: 30 S B: 50 S L 5 S 13/S 19 H 68 h 23 h 44 H 69 h 24/27 H 67 h 14 S 15 H 71 H 34 L 14/L 19 h 44 H 62 L 14
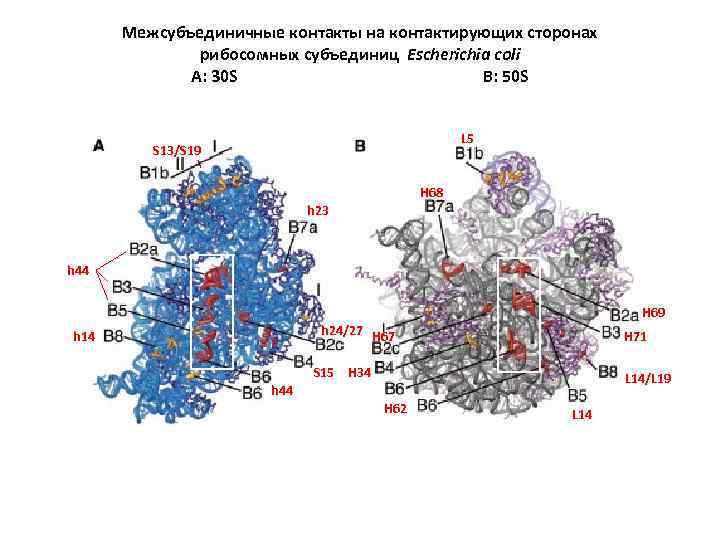
Межсубъединичные контакты на контактирующих сторонах рибосомных субъединиц Escherichia coli A: 30 S B: 50 S L 5 S 13/S 19 H 68 h 23 h 44 H 69 h 24/27 H 67 h 14 S 15 H 71 H 34 L 14/L 19 h 44 H 62 L 14

Рибосомные белки
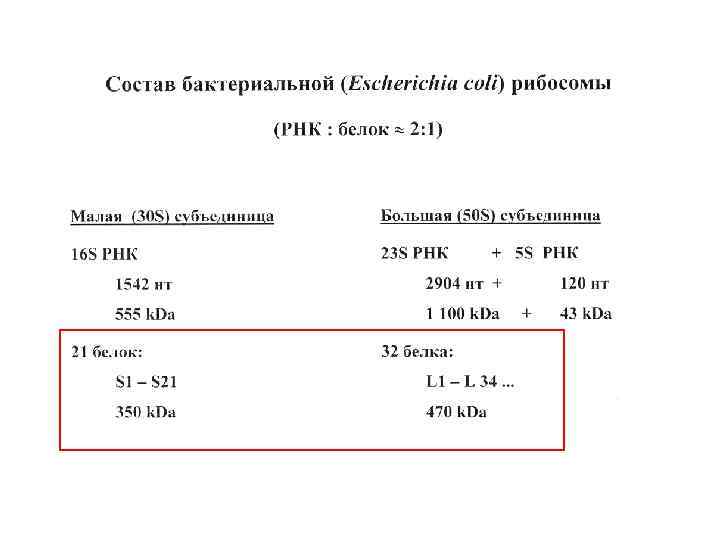

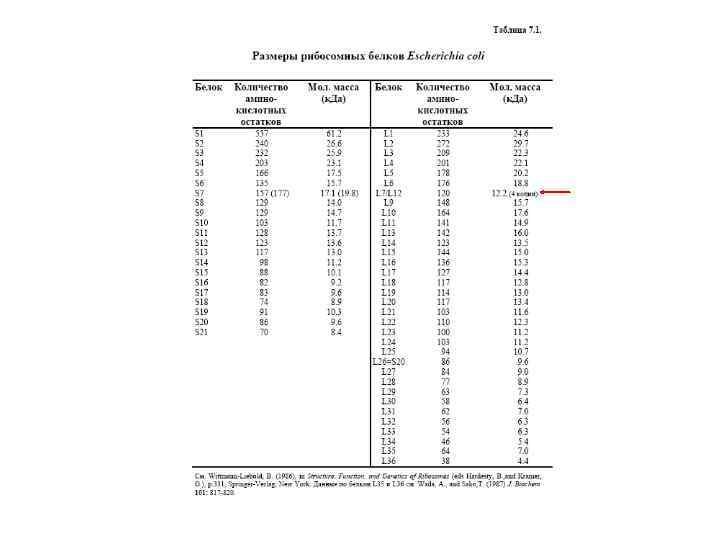
Белки рибосомной 30 S субчастицы E. coli

Белки рибосомной 50 S субчастицы E. coli

Четвертичные структуры рибосомных субъединиц
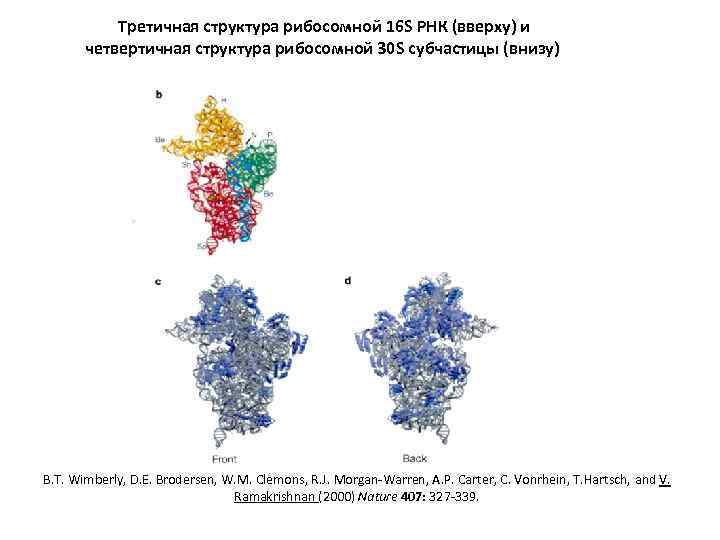
Третичная структура рибосомной 16 S РНК (вверху) и четвертичная структура рибосомной 30 S субчастицы (внизу) B. T. Wimberly, D. E. Brodersen, W. M. Clemons, R. J. Morgan-Warren, A. P. Carter, C. Vonrhein, T. Hartsch, and V. Ramakrishnan (2000) Nature 407: 327 -339.
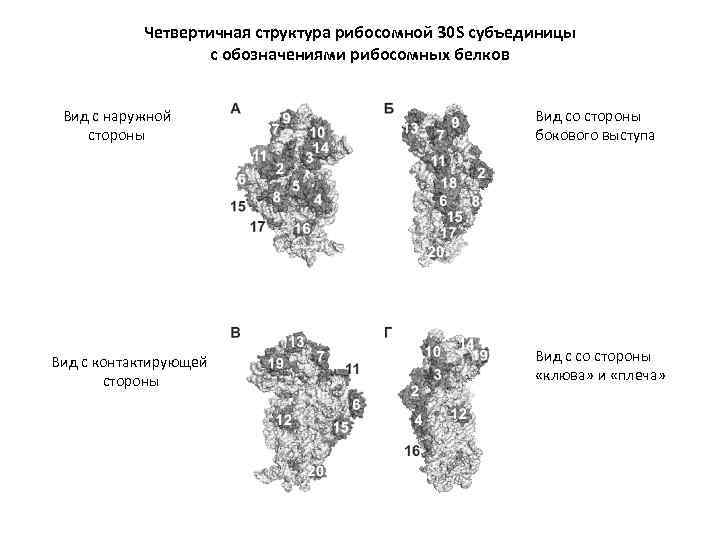
Четвертичная структура рибосомной 30 S субъединицы с обозначениями рибосомных белков Вид с наружной стороны Вид с контактирующей стороны Вид со стороны бокового выступа Вид с со стороны «клюва» и «плеча»
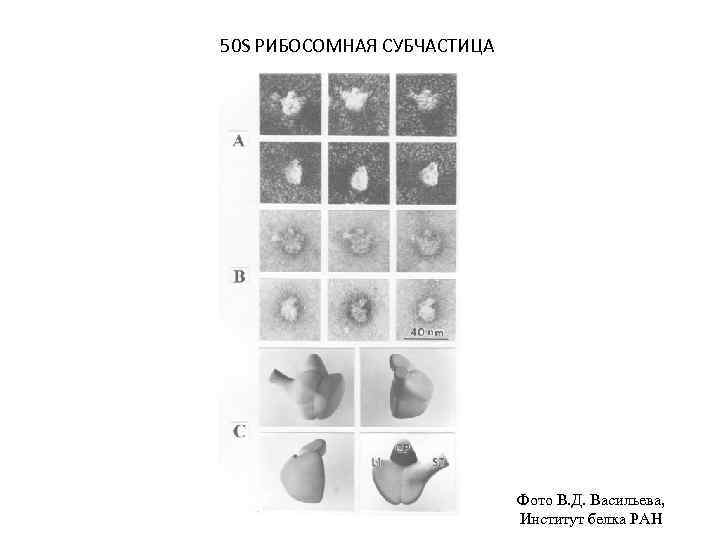
50 S РИБОСОМНАЯ СУБЧАСТИЦА Фото В. Д. Васильева, Институт белка РАН
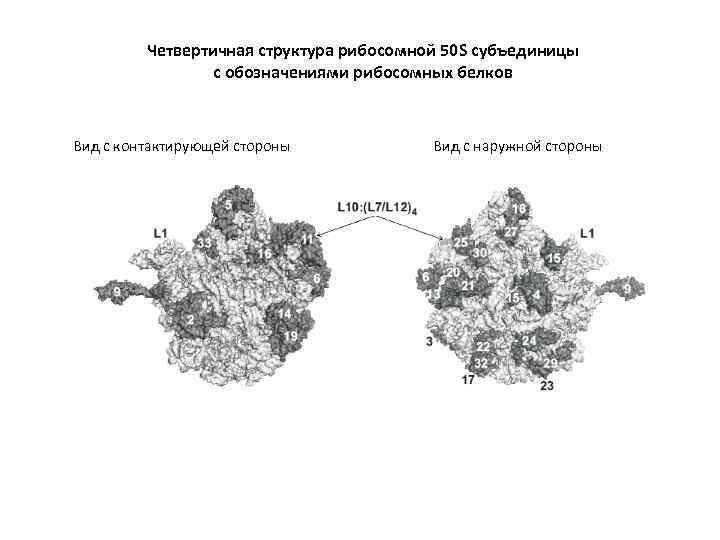
Четвертичная структура рибосомной 50 S субъединицы с обозначениями рибосомных белков Вид с контактирующей стороны Вид с наружной стороны
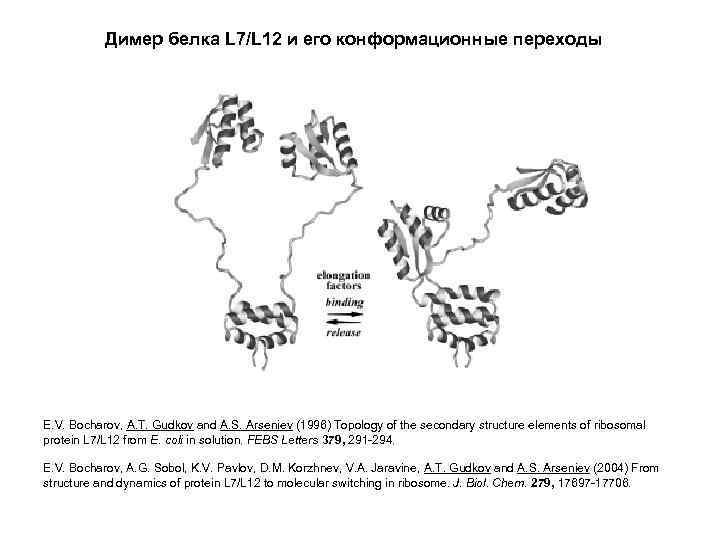
Димер белка L 7/L 12 и его конформационные переходы E. V. Bocharov, A. T. Gudkov and A. S. Arseniev (1996) Topology of the secondary structure elements of ribosomal protein L 7/L 12 from E. coli in solution. FEBS Letters 379, 291 -294. E. V. Bocharov, A. G. Sobol, K. V. Pavlov, D. M. Korzhnev, V. A. Jaravine, A. T. Gudkov and A. S. Arseniev (2004) From structure and dynamics of protein L 7/L 12 to molecular switching in ribosome. J. Biol. Chem. 279, 17697 -17706.


Структурные превращения рибосомных частиц
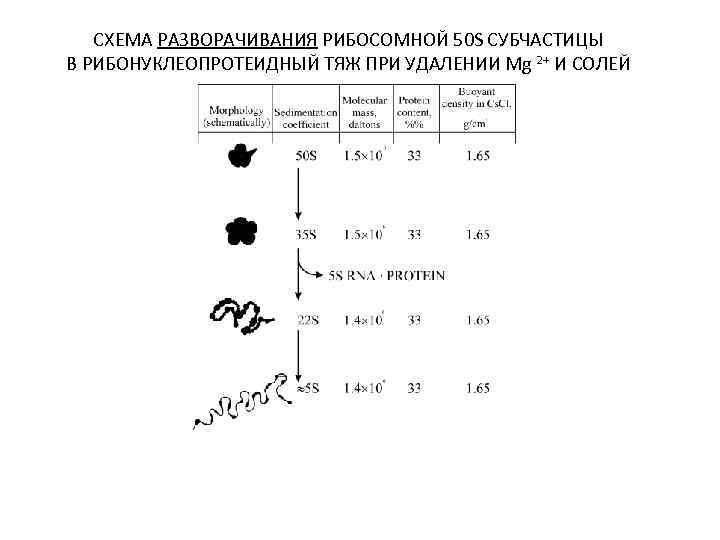
СХЕМА РАЗВОРАЧИВАНИЯ РИБОСОМНОЙ 50 S СУБЧАСТИЦЫ В РИБОНУКЛЕОПРОТЕИДНЫЙ ТЯЖ ПРИ УДАЛЕНИИ Mg 2+ И СОЛЕЙ

СХЕМА РАЗБОРКИ 30 S СУБЧАСТИЦЫ
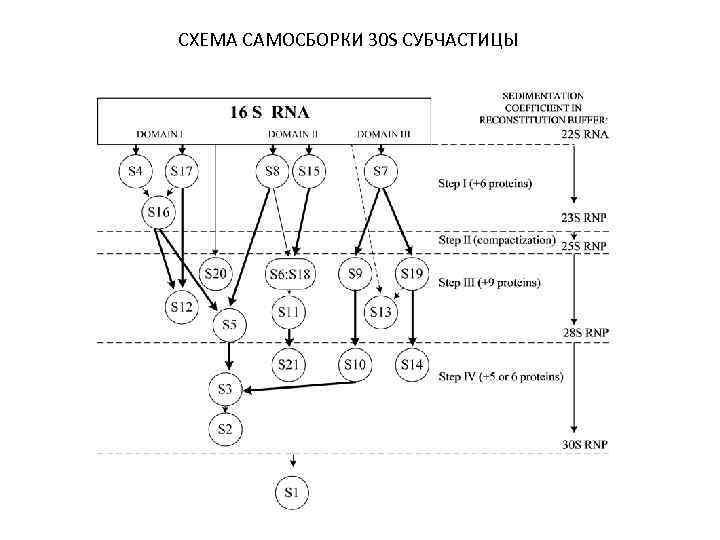
СХЕМА САМОСБОРКИ 30 S СУБЧАСТИЦЫ

Митохондриальные рибосомы

Рибосомы митохондрий ( «миторибосомы)» млекопитающих Размеры, морфология и детальная молекулярная архитектура практически идентичны у миторибосом и бактериальных рибосом! Коэффициент седиментации 55 S (39 S + 28 S) [E. coli: 70 S (50 S + 30 S)] Молекулярная масса 3. 57× 106 Da [E. coli: 2. 49× 106 Da] Соотношение РНК/белок 1: 2 [E. coli 2 : 1]

Рибосомы митохондрий ( «миторибосомы)» млекопитающих Размеры, морфология и детальная молекулярная архитектура практически идентичны у миторибосом и бактериальных рибосом! Коэффициент седиментации 55 S (39 S + 28 S) [E. coli: 70 S (50 S + 30 S)] Молекулярная масса 3. 57× 106 Da [E. coli: 2. 49× 106 Da] Соотношение РНК/белок 1: 2 [E. coli 2 : 1] «Значительные части доменов рибосомных РНК замещены белковыми компонентами в ходе эволюции митохондрий от бактериоподобных эндосимбионтов к предшественникам эукариотических клеток» K. Watanabe et al. (2001) Structural compensation for the deficit of r. RNA with proteins in the mammalian mitochondrial ribosome. J. Biol. Chem. 276: 21724 -21736.
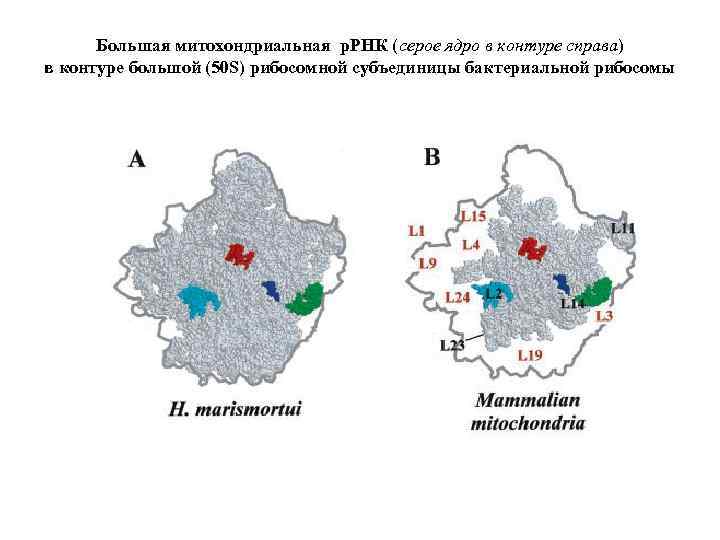
Большая митохондриальная р. РНК (серое ядро в контуре справа) в контуре большой (50 S) рибосомной субъединицы бактериальной рибосомы
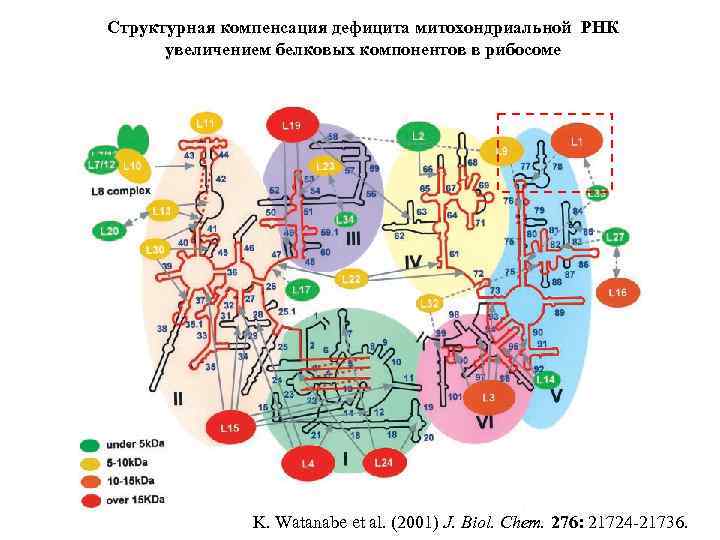
Структурная компенсация дефицита митохондриальной РНК увеличением белковых компонентов в рибосоме K. Watanabe et al. (2001) J. Biol. Chem. 276: 21724 -21736.

“The mitoribosome thus serves … for an experimental verification of the concept of transition from the ‘RNA world’ to the ‘RNP world’ in the early process of evolution of life”. K. Watanabe et al. (2001) J. Biol. Chem. 276: 21724 -21736.

lecture_3_2013.pptx