 А М О Е НИ Е ОЯ 2 Р Т КЦИ С Л Е АТ
А М О Е НИ Е ОЯ 2 Р Т КЦИ С Л Е АТ
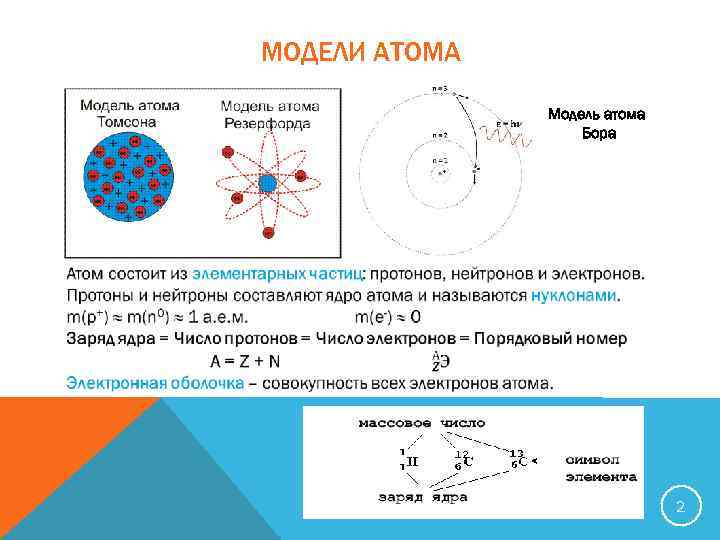 МОДЕЛИ АТОМА V Модель атома Бора 2
МОДЕЛИ АТОМА V Модель атома Бора 2
 ИЗОТОПЫ И НУКЛИДЫ 3
ИЗОТОПЫ И НУКЛИДЫ 3
 ДЕФЕКТ МАССЫ 4
ДЕФЕКТ МАССЫ 4
 РАДИОАКТИВНОСТЬ Изотопы химических элементов могут быть стабильными и радиоактивными. 5
РАДИОАКТИВНОСТЬ Изотопы химических элементов могут быть стабильными и радиоактивными. 5
 6
6
 7
7
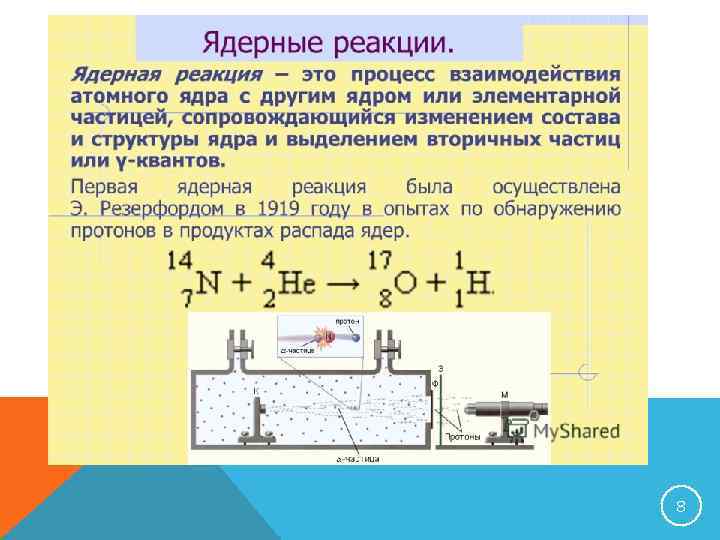 8
8
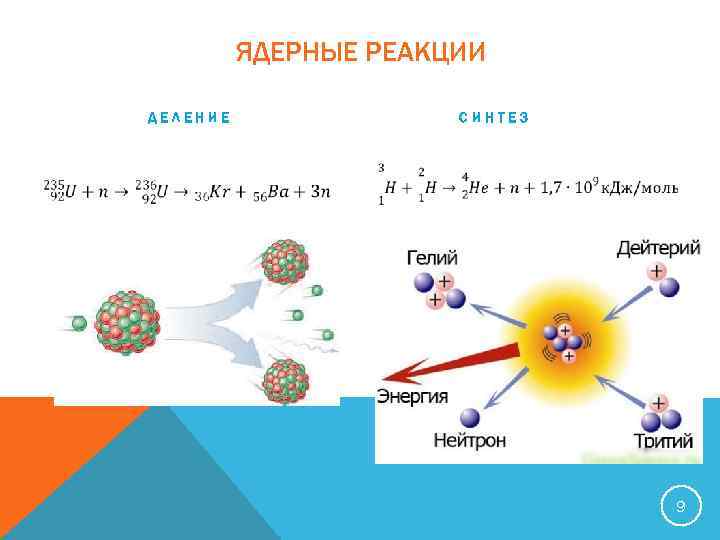 ЯДЕРНЫЕ РЕАКЦИИ ДЕЛЕНИЕ СИНТЕЗ 9
ЯДЕРНЫЕ РЕАКЦИИ ДЕЛЕНИЕ СИНТЕЗ 9
 ПРИМЕНЕНИЕ РАДИОНУКЛИДОВ 10
ПРИМЕНЕНИЕ РАДИОНУКЛИДОВ 10
 АТОМНЫЕ ОРБИТАЛИ Электронное облако — модель состояния электрона в атоме. Плотность участков облака пропорциональна вероятности нахождения там электрона. 11
АТОМНЫЕ ОРБИТАЛИ Электронное облако — модель состояния электрона в атоме. Плотность участков облака пропорциональна вероятности нахождения там электрона. 11
 ЭНЕРГЕТИЧЕСКИЕ УРОВНИ 12
ЭНЕРГЕТИЧЕСКИЕ УРОВНИ 12
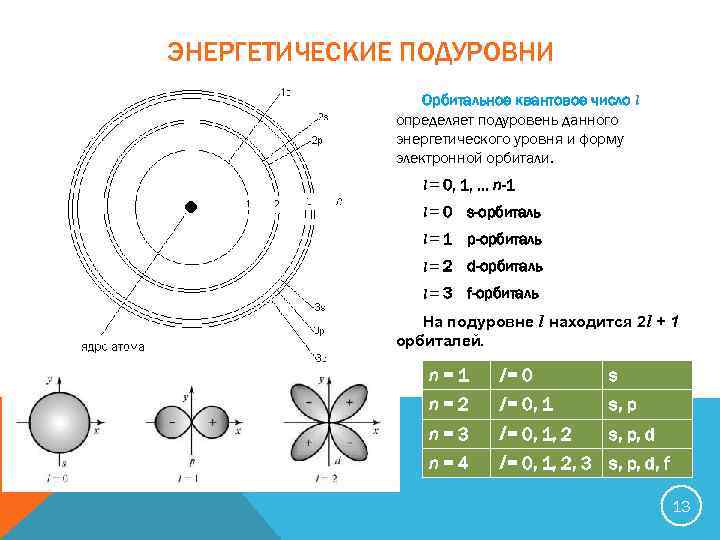 ЭНЕРГЕТИЧЕСКИЕ ПОДУРОВНИ Орбитальное квантовое число l определяет подуровень данного энергетического уровня и форму электронной орбитали. l = 0, 1, … n-1 l = 0 s-орбиталь l = 1 p-орбиталь l = 2 d-орбиталь l = 3 f-орбиталь На подуровне l находится 2 l + 1 орбиталей. n=1 l=0 s n=2 l = 0, 1 s, p n=3 l = 0, 1, 2 s, p, d n=4 l = 0, 1, 2, 3 s, p, d, f 13
ЭНЕРГЕТИЧЕСКИЕ ПОДУРОВНИ Орбитальное квантовое число l определяет подуровень данного энергетического уровня и форму электронной орбитали. l = 0, 1, … n-1 l = 0 s-орбиталь l = 1 p-орбиталь l = 2 d-орбиталь l = 3 f-орбиталь На подуровне l находится 2 l + 1 орбиталей. n=1 l=0 s n=2 l = 0, 1 s, p n=3 l = 0, 1, 2 s, p, d n=4 l = 0, 1, 2, 3 s, p, d, f 13
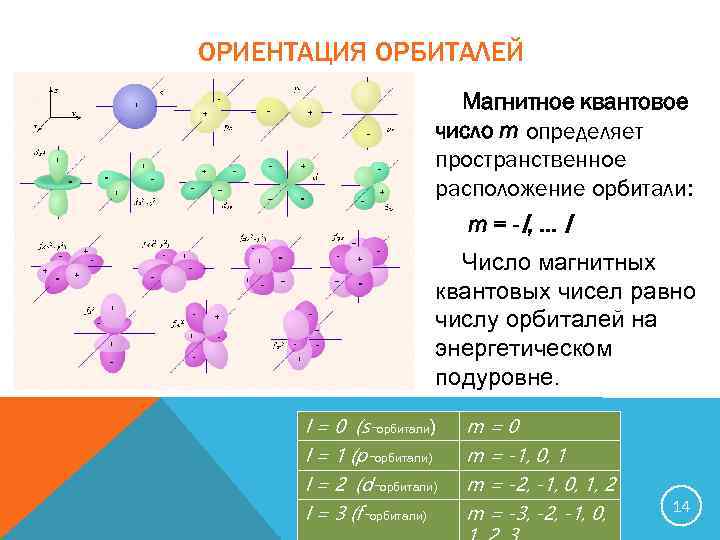 ОРИЕНТАЦИЯ ОРБИТАЛЕЙ Магнитное квантовое число m определяет пространственное расположение орбитали: m = -l , … l Число магнитных квантовых чисел равно числу орбиталей на энергетическом подуровне. l = 0 (s-орбитали) m=0 l = 1 (p-орбитали) m = -1, 0, 1 l = 2 (d-орбитали) m = -2, -1, 0, 1, 2 l = 3 (f-орбитали) m = -3, -2, -1, 0, 14
ОРИЕНТАЦИЯ ОРБИТАЛЕЙ Магнитное квантовое число m определяет пространственное расположение орбитали: m = -l , … l Число магнитных квантовых чисел равно числу орбиталей на энергетическом подуровне. l = 0 (s-орбитали) m=0 l = 1 (p-орбитали) m = -1, 0, 1 l = 2 (d-орбитали) m = -2, -1, 0, 1, 2 l = 3 (f-орбитали) m = -3, -2, -1, 0, 14
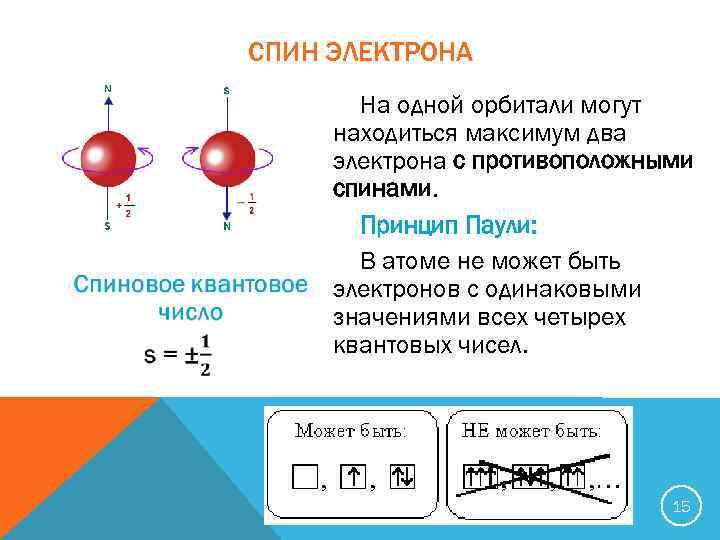 СПИН ЭЛЕКТРОНА На одной орбитали могут находиться максимум два электрона с противоположными спинами. Принцип Паули: В атоме не может быть электронов с одинаковыми значениями всех четырех квантовых чисел. 15
СПИН ЭЛЕКТРОНА На одной орбитали могут находиться максимум два электрона с противоположными спинами. Принцип Паули: В атоме не может быть электронов с одинаковыми значениями всех четырех квантовых чисел. 15
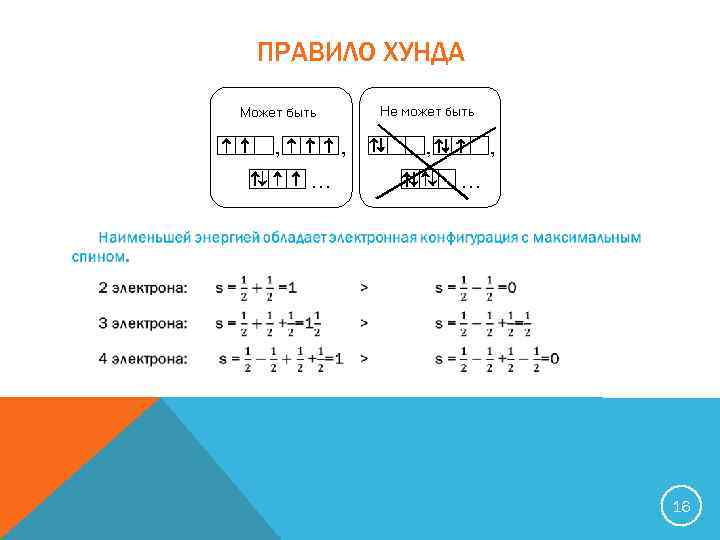 ПРАВИЛО ХУНДА 16
ПРАВИЛО ХУНДА 16
 ЗАПОЛНЕНИЕ ЭНЕРГЕТИЧЕСКИХ ПОДУРОВНЕЙ Принцип наименьшей энергии: Электрон в атоме занимает такое положение, чтобы его энергия была минимальна. Правило Клечковского: Заполнение орбиталей происходит так, чтобы значение n+l было минимально. 17
ЗАПОЛНЕНИЕ ЭНЕРГЕТИЧЕСКИХ ПОДУРОВНЕЙ Принцип наименьшей энергии: Электрон в атоме занимает такое положение, чтобы его энергия была минимальна. Правило Клечковского: Заполнение орбиталей происходит так, чтобы значение n+l было минимально. 17
 18
18
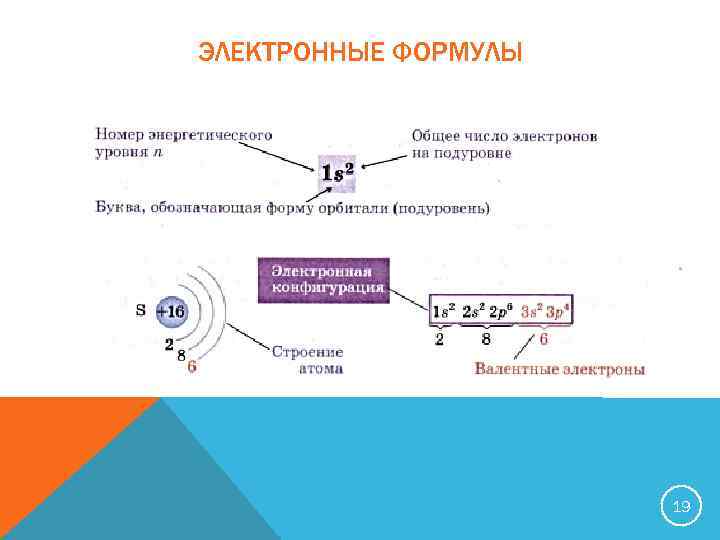 ЭЛЕКТРОННЫЕ ФОРМУЛЫ 19
ЭЛЕКТРОННЫЕ ФОРМУЛЫ 19
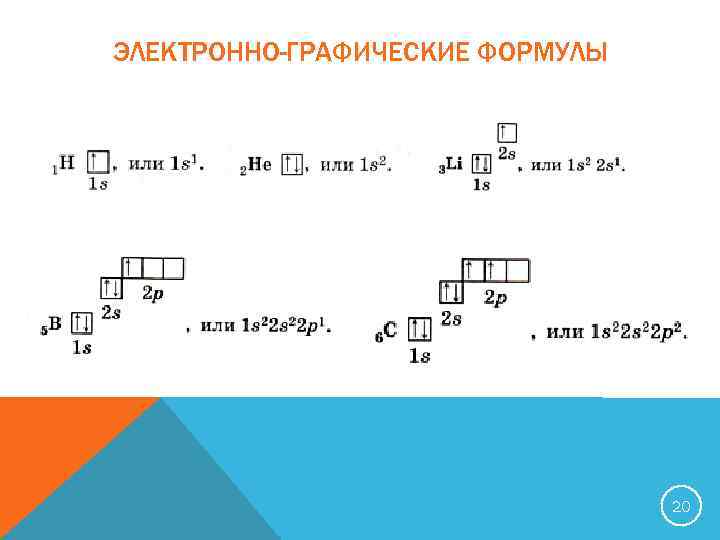 ЭЛЕКТРОННО-ГРАФИЧЕСКИЕ ФОРМУЛЫ 20
ЭЛЕКТРОННО-ГРАФИЧЕСКИЕ ФОРМУЛЫ 20
![ПРОСКОК ЭЛЕКТРОНОВ Cr [Ar] 3 d 54 s 1 Cu [Ar] 3 d 104 ПРОСКОК ЭЛЕКТРОНОВ Cr [Ar] 3 d 54 s 1 Cu [Ar] 3 d 104](https://present5.com/presentation/1/10273170_437019378.pdf-img/10273170_437019378.pdf-21.jpg) ПРОСКОК ЭЛЕКТРОНОВ Cr [Ar] 3 d 54 s 1 Cu [Ar] 3 d 104 s 1 21
ПРОСКОК ЭЛЕКТРОНОВ Cr [Ar] 3 d 54 s 1 Cu [Ar] 3 d 104 s 1 21
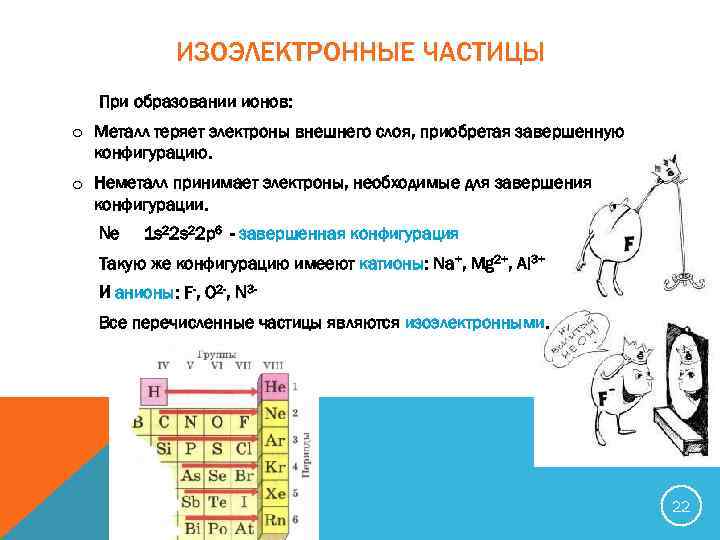 ИЗОЭЛЕКТРОННЫЕ ЧАСТИЦЫ При образовании ионов: o Металл теряет электроны внешнего слоя, приобретая завершенную конфигурацию. o Неметалл принимает электроны, необходимые для завершения конфигурации. Ne 1 s 22 p 6 - завершенная конфигурация Такую же конфигурацию имееют катионы: Na+, Mg 2+, Al 3+ И анионы: F-, O 2 -, N 3 Все перечисленные частицы являются изоэлектронными. 22
ИЗОЭЛЕКТРОННЫЕ ЧАСТИЦЫ При образовании ионов: o Металл теряет электроны внешнего слоя, приобретая завершенную конфигурацию. o Неметалл принимает электроны, необходимые для завершения конфигурации. Ne 1 s 22 p 6 - завершенная конфигурация Такую же конфигурацию имееют катионы: Na+, Mg 2+, Al 3+ И анионы: F-, O 2 -, N 3 Все перечисленные частицы являются изоэлектронными. 22
![ВОЗБУЖДЕННЫЕ СОСТОЯНИЯ АТОМОВ S [Ne]3 s 23 p 4 23 ВОЗБУЖДЕННЫЕ СОСТОЯНИЯ АТОМОВ S [Ne]3 s 23 p 4 23](https://present5.com/presentation/1/10273170_437019378.pdf-img/10273170_437019378.pdf-23.jpg) ВОЗБУЖДЕННЫЕ СОСТОЯНИЯ АТОМОВ S [Ne]3 s 23 p 4 23
ВОЗБУЖДЕННЫЕ СОСТОЯНИЯ АТОМОВ S [Ne]3 s 23 p 4 23
 А! К ТИ К РЬ Е А РА П ЕП Т 24
А! К ТИ К РЬ Е А РА П ЕП Т 24