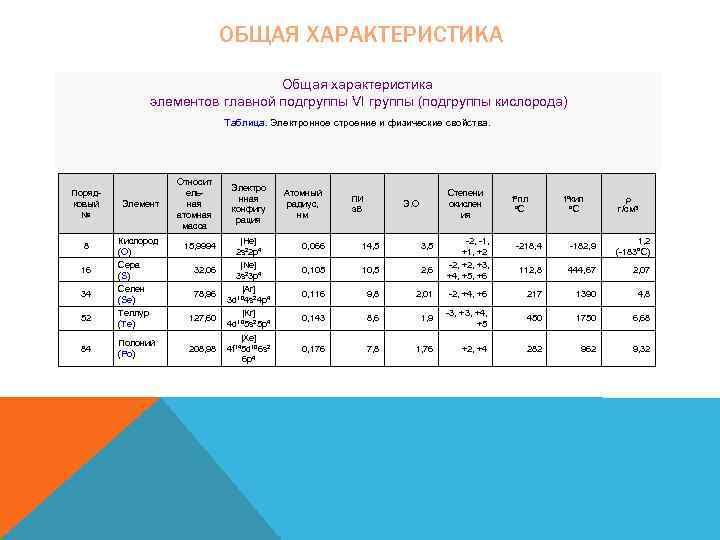
 ОБЩАЯ ХАРАКТЕРИСТИКА Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода) 1 Таблица. Электронное строение и физические свойства. Порядковый № 8 16 34 52 84 Элемент Кислород (O) Сера (S) Селен (Se) Теллур (Te) Полоний (Po) Относит ельная атомная масса 15, 9994 32, 06 78, 96 127, 60 208, 98 Электро нная конфигу рация [He] 2 s 22 p 4 [Ne] 3 s 23 p 4 [Ar] 3 d 104 s 24 p 4 [Kr] 4 d 105 s 25 p 4 [Xe] 4 f 145 d 106 s 2 6 p 4 Атомный радиус, нм ПИ э. В Степени окислен ия Э. О t°кип °С r г/см 3 -218, 4 -182, 9 1, 2 (-183°C) 112, 8 444, 67 2, 07 -2, +4, +6 217 1390 4, 8 1, 9 -3, +4, +5 450 1750 6, 68 1, 76 +2, +4 282 962 9, 32 0, 066 14, 5 3, 5 0, 105 10, 5 2, 6 0, 116 9, 8 2, 01 0, 143 8, 6 0, 176 7, 8 -2, -1, +2 -2, +3, +4, +5, +6 t°пл °С
ОБЩАЯ ХАРАКТЕРИСТИКА Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода) 1 Таблица. Электронное строение и физические свойства. Порядковый № 8 16 34 52 84 Элемент Кислород (O) Сера (S) Селен (Se) Теллур (Te) Полоний (Po) Относит ельная атомная масса 15, 9994 32, 06 78, 96 127, 60 208, 98 Электро нная конфигу рация [He] 2 s 22 p 4 [Ne] 3 s 23 p 4 [Ar] 3 d 104 s 24 p 4 [Kr] 4 d 105 s 25 p 4 [Xe] 4 f 145 d 106 s 2 6 p 4 Атомный радиус, нм ПИ э. В Степени окислен ия Э. О t°кип °С r г/см 3 -218, 4 -182, 9 1, 2 (-183°C) 112, 8 444, 67 2, 07 -2, +4, +6 217 1390 4, 8 1, 9 -3, +4, +5 450 1750 6, 68 1, 76 +2, +4 282 962 9, 32 0, 066 14, 5 3, 5 0, 105 10, 5 2, 6 0, 116 9, 8 2, 01 0, 143 8, 6 0, 176 7, 8 -2, -1, +2 -2, +3, +4, +5, +6 t°пл °С
 КИСЛОРОД O 2 (К. В. ШЕЕЛЕ 1772 Г. , ДЖ. ПРИСТЛИ 1774 Г. ) Самый распространенный элемент на Земле; в воздухе - 21% по объему; в земной коре - 49% по массе; в гидросфере - 89% по массе; в составе живых организмов-- до 65% по массе. Строение атома
КИСЛОРОД O 2 (К. В. ШЕЕЛЕ 1772 Г. , ДЖ. ПРИСТЛИ 1774 Г. ) Самый распространенный элемент на Земле; в воздухе - 21% по объему; в земной коре - 49% по массе; в гидросфере - 89% по массе; в составе живых организмов-- до 65% по массе. Строение атома
 Ф. С. Физические свойства Газ - без цвета, вкуса и запаха; в 100 V H 2 O растворяется 3 V O 2 (н. у. ); t°кип= -183°С; t°пл = -219°C; d по воздуху = 1, 1. Способы получения 1. Промышленный способ (перегонка жидкого воздуха). 2. Лабораторный способ (разложение некоторых кислородосодержащих веществ) 2 KMn. O 4 –t°® K 2 Mn. O 4 + Mn. O 2 + O 2 2 KCl. O 3 –t°; Mn. O 2® 2 KCl + 3 O 2 2 H 2 O 2 –Mn. O 2® 2 H 2 O + O 2 Вытеснением воды Способы собирания Вытеснением воздуха
Ф. С. Физические свойства Газ - без цвета, вкуса и запаха; в 100 V H 2 O растворяется 3 V O 2 (н. у. ); t°кип= -183°С; t°пл = -219°C; d по воздуху = 1, 1. Способы получения 1. Промышленный способ (перегонка жидкого воздуха). 2. Лабораторный способ (разложение некоторых кислородосодержащих веществ) 2 KMn. O 4 –t°® K 2 Mn. O 4 + Mn. O 2 + O 2 2 KCl. O 3 –t°; Mn. O 2® 2 KCl + 3 O 2 2 H 2 O 2 –Mn. O 2® 2 H 2 O + O 2 Вытеснением воды Способы собирания Вытеснением воздуха
 ХИМИЧЕСКИЕ СВОЙСТВА Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель. С неметаллами C + O 2 ® CO 2 S + O 2 ® SO 2 2 H 2 + O 2 ® 2 H 2 O С металлами 2 Mg + O 2 ® 2 Mg. O 2 Cu + O 2 –t°® 2 Cu. O Со сложными веществами 4 Fe. S 2 + 11 O 2 ® 2 Fe 2 O 3 + 8 SO 2 2 H 2 S + 3 O 2 ® 2 SO 2 + 2 H 2 O CH 4 + 2 O 2 ® CO 2 + 2 H 2 O Горение в кислороде
ХИМИЧЕСКИЕ СВОЙСТВА Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель. С неметаллами C + O 2 ® CO 2 S + O 2 ® SO 2 2 H 2 + O 2 ® 2 H 2 O С металлами 2 Mg + O 2 ® 2 Mg. O 2 Cu + O 2 –t°® 2 Cu. O Со сложными веществами 4 Fe. S 2 + 11 O 2 ® 2 Fe 2 O 3 + 8 SO 2 2 H 2 S + 3 O 2 ® 2 SO 2 + 2 H 2 O CH 4 + 2 O 2 ® CO 2 + 2 H 2 O Горение в кислороде
 ОЗОН O 3 Физические свойства Газ, запах свежей хвои, бесцветный, растворим в воде; t°кип= -112°С; t°пл= -193°C. Получение 3 O 2 ® 2 O 3 1. Во время грозы (в природе), (в лаборатории) в озонаторе 1. 2. Действием серной кислоты на пероксид бария. 3 Ba. O 2 + 3 H 2 SO 4 ® 3 Ba. SO 4 + 3 H 2 O + O 3
ОЗОН O 3 Физические свойства Газ, запах свежей хвои, бесцветный, растворим в воде; t°кип= -112°С; t°пл= -193°C. Получение 3 O 2 ® 2 O 3 1. Во время грозы (в природе), (в лаборатории) в озонаторе 1. 2. Действием серной кислоты на пероксид бария. 3 Ba. O 2 + 3 H 2 SO 4 ® 3 Ba. SO 4 + 3 H 2 O + O 3
 ХИМИЧЕСКИЕ СВОЙСТВА 1. Неустойчив: O 3 ® O 2 + O _________________________________ 2. Сильный окислитель: 2 KI + O 3 + H 2 O ® 2 KOH + I 2 + O 2 Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.
ХИМИЧЕСКИЕ СВОЙСТВА 1. Неустойчив: O 3 ® O 2 + O _________________________________ 2. Сильный окислитель: 2 KI + O 3 + H 2 O ® 2 KOH + I 2 + O 2 Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.