8_SOOH-2014_karbon_k-ty_2.pptx
- Количество слайдов: 52

№ 8. Нуклеофильное замещение у карбоновых кислот и их функциональных производных, SN у Csp 2

ОСОБЕННОСТИ СТРОЕНИЯ и РЕАКЦИОННОЙ СПОСОБНОСТИ КАРБОНОВЫХ КИСЛОТ И их моно. ФУНКЦИОНАЛЬНЫХ ПРОИЗВОДНЫХ
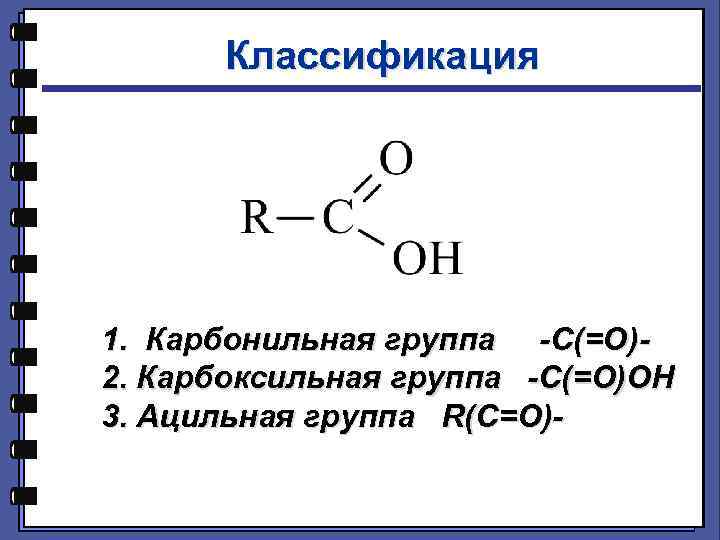
Классификация 1. Карбонильная группа -С(=О)2. Карбоксильная группа -С(=О)ОН 3. Ацильная группа R(C=O)-
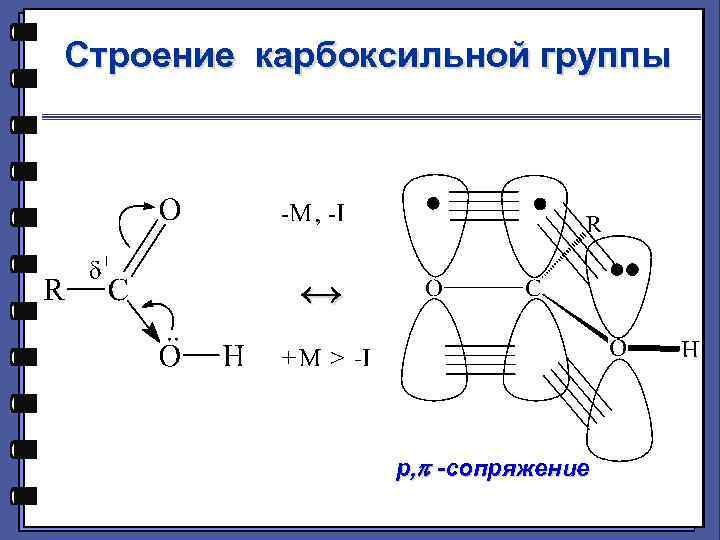
Строение карбоксильной группы ↔ р, -сопряжение

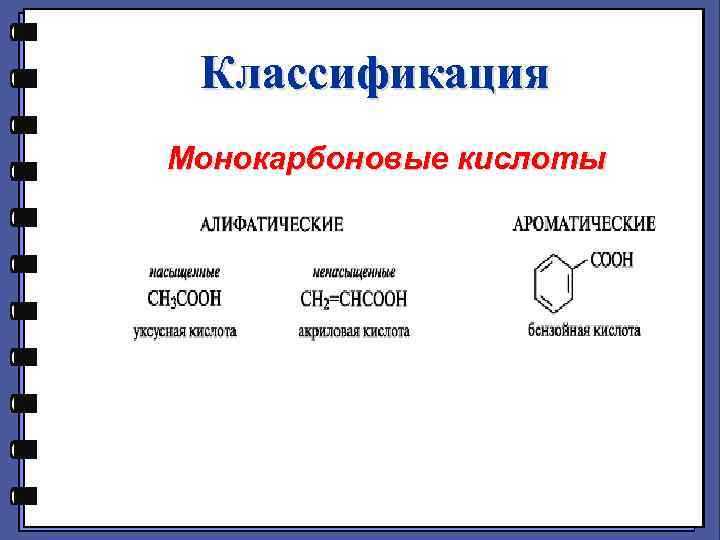
Классификация Монокарбоновые кислоты
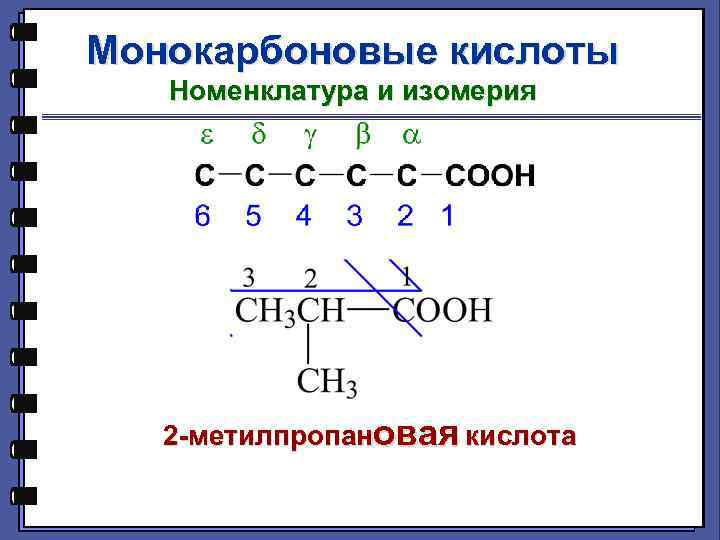
Монокарбоновые кислоты Номенклатура и изомерия 2 -метилпропановая кислота

Монокарбоновые кислоты Номенклатура и изомерия 2 -метилбензойная кислота

Монокарбоновые кислоты Физические свойства

носит регулярный характер

Перв. спирт
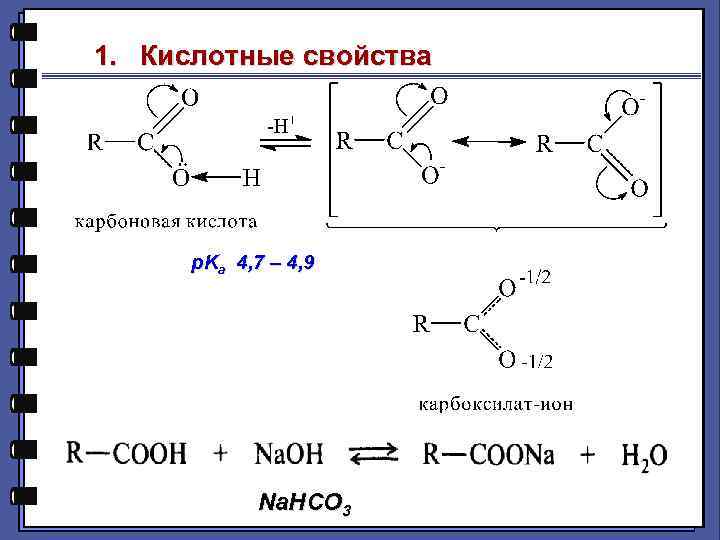
1. Кислотные свойства p. Ka 4, 7 – 4, 9 Na. HCO 3

+I -I α ЭА Заместитель X- в α- положении: М=0 !!!, I эф.
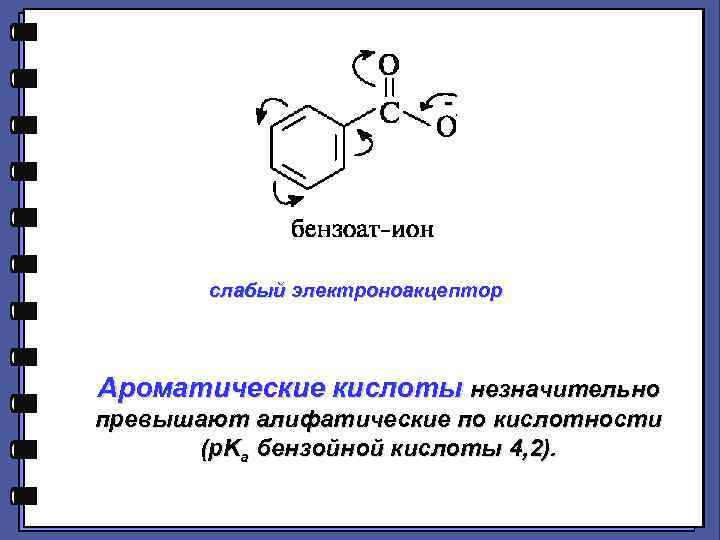
- слабый электроноакцептор Ароматические кислоты незначительно превышают алифатические по кислотности (p. Ka бензойной кислоты 4, 2).

Реакционные центры в молекуле карбоновых кислот:
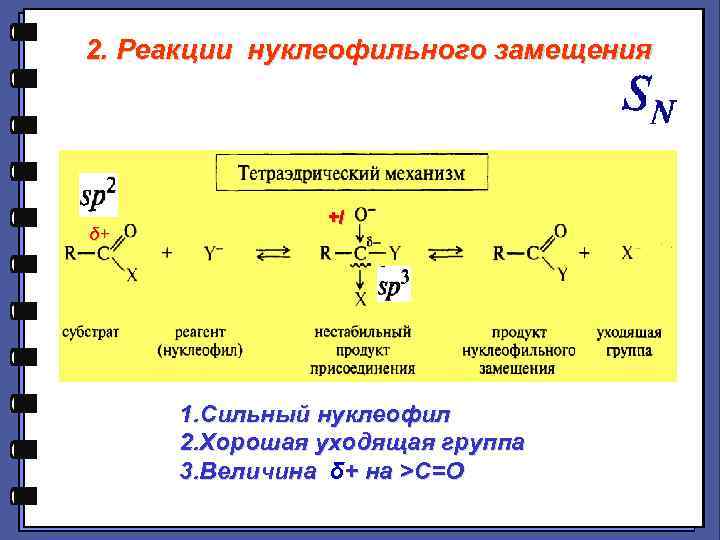
2. Реакции нуклеофильного замещения δ+ +I +I 1. Сильный нуклеофил 2. Хорошая уходящая группа 3. Величина δ+ на >С=О
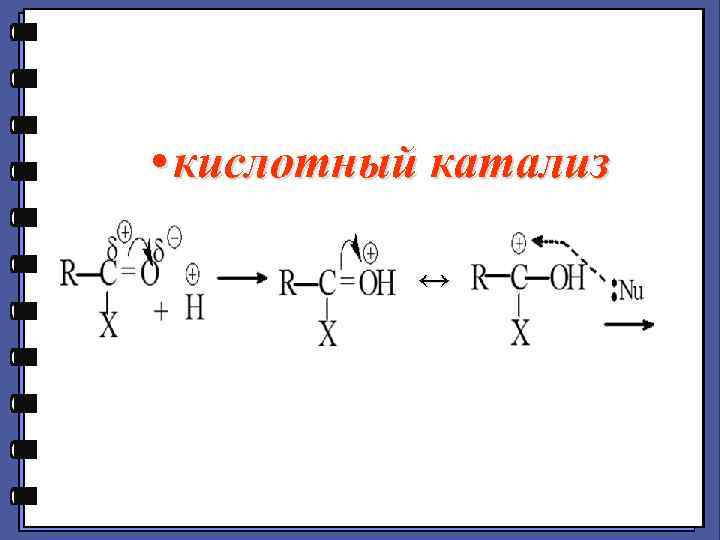
• кислотный катализ ↔
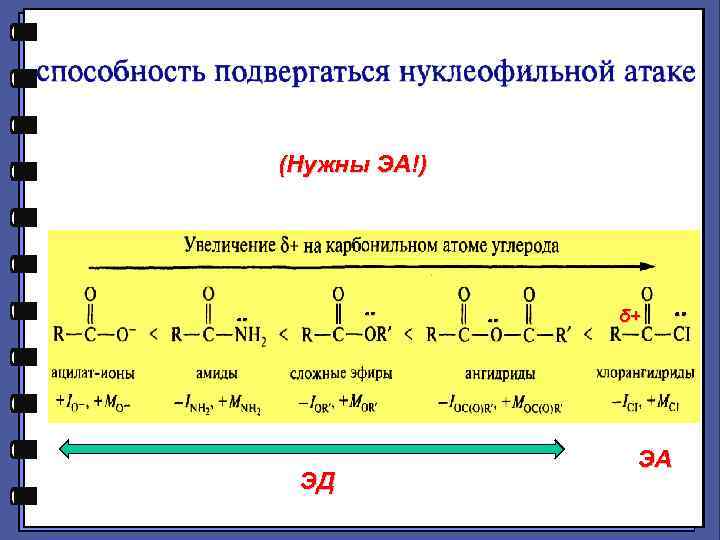
(Нужны ЭА!) ЭД δ+ ЭА
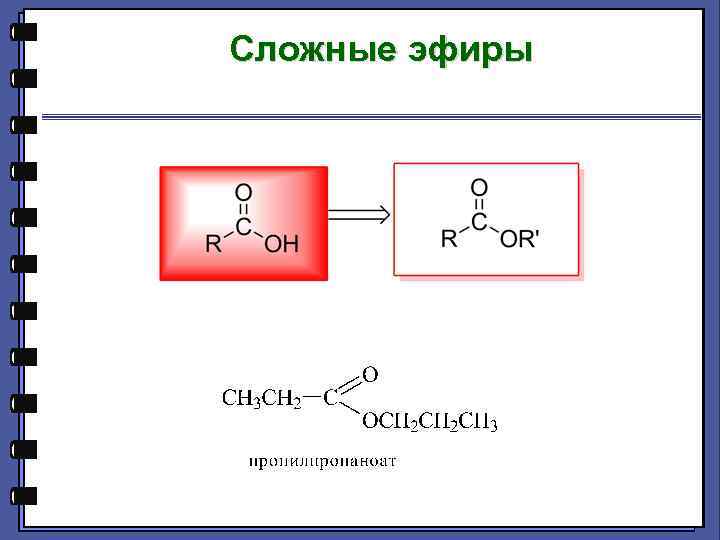
Сложные эфиры
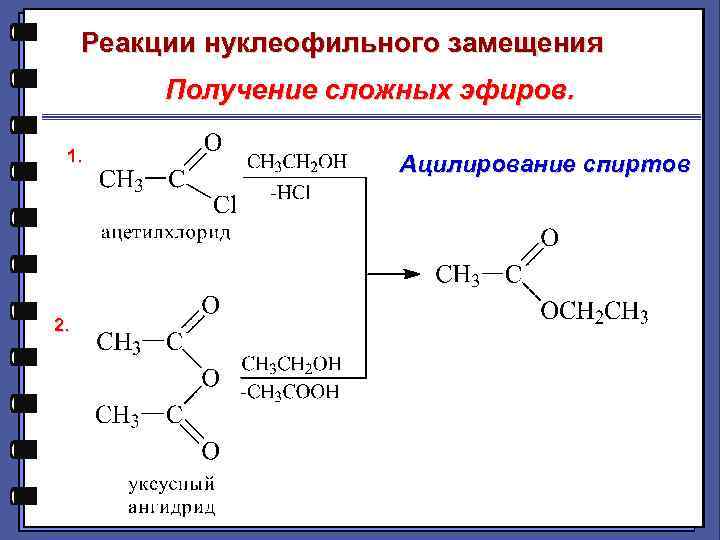
Реакции нуклеофильного замещения Получение сложных эфиров. 1. 2. Ацилирование спиртов
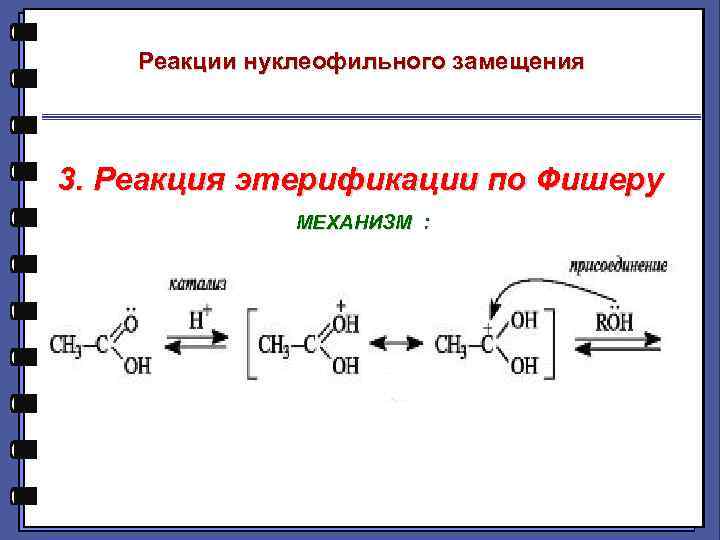
Реакции нуклеофильного замещения 3. Реакция этерификации по Фишеру МЕХАНИЗМ :
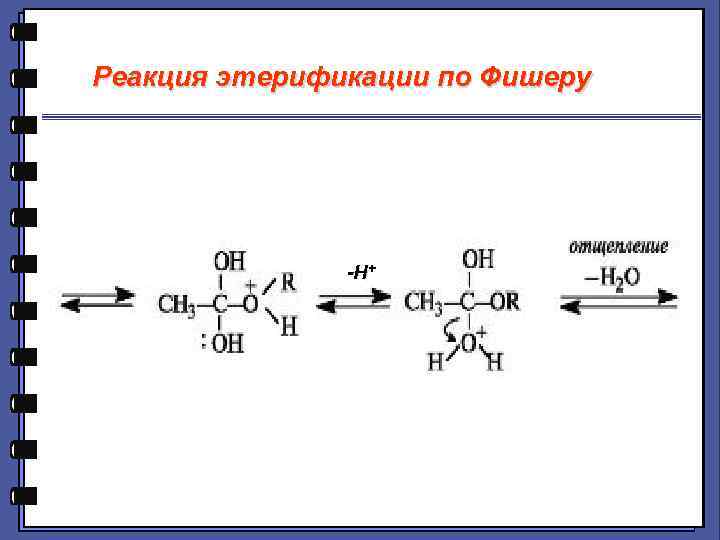
Реакция этерификации по Фишеру -H+
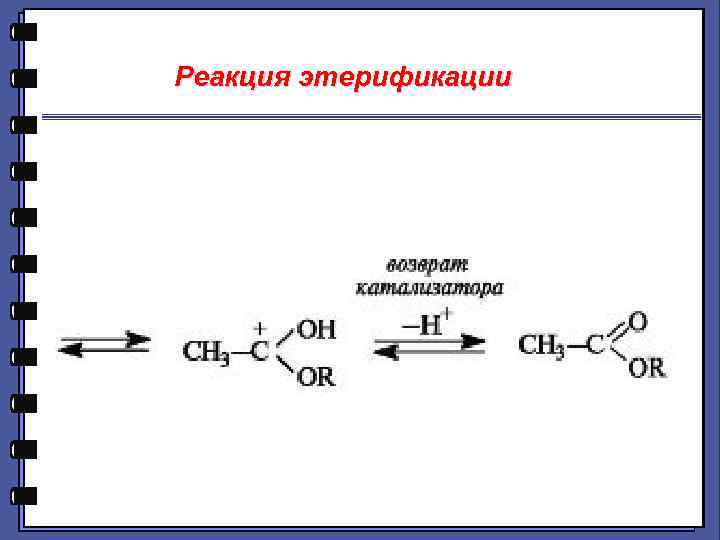
Реакция этерификации
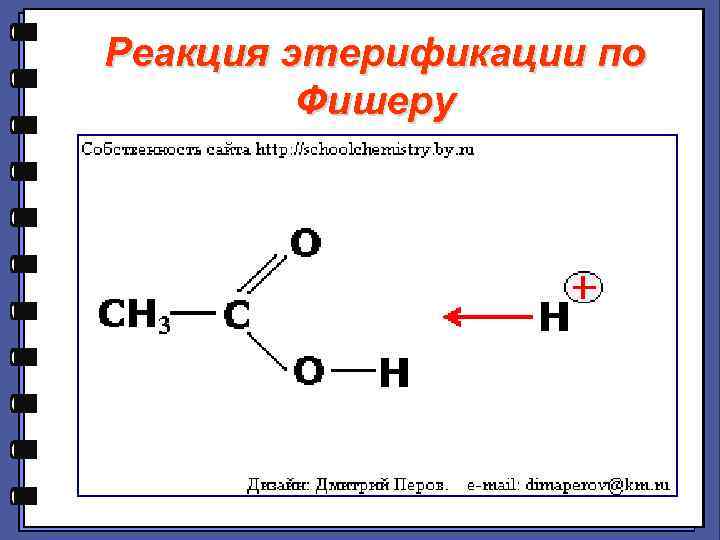
Реакция этерификации по Фишеру


Переэтерификация
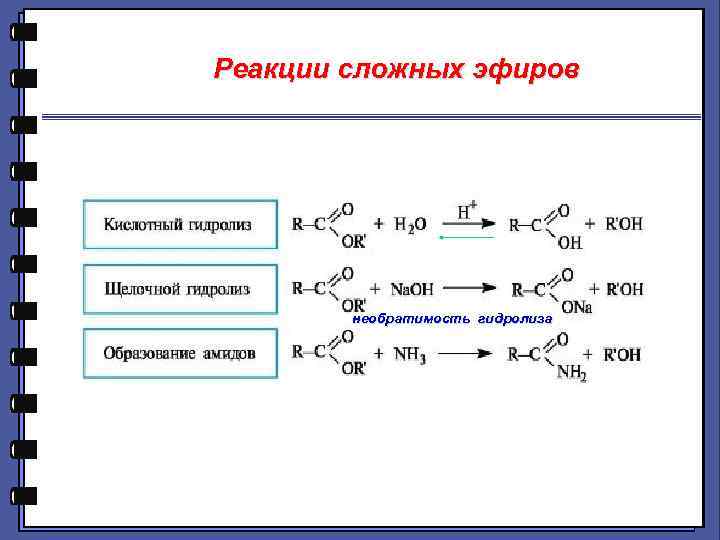
Реакции сложных эфиров необратимость гидролиза

Легкость нуклеофильной атаки δ+

Коэнзим А, Кофермент А, Ко. А, - кофермент ацетилирования (или ацилирования), принимает участие в реакциях переноса ацильных групп R(C=O)-

функционирует в качестве тиола

ацил-Ко. А тиоэфир

1) -I -I 2) группа R'S является лучшей уходящей группой, чем группа R'O

Ацилирование In vivo : ацетилкофермент А спирт тиоэфир ацетил-Ко. А посредник при передаче нервного возбуждения в нервных тканях (нейромедиатор)

Образование галогенангидридов

Образование ангидридов кислот 1.
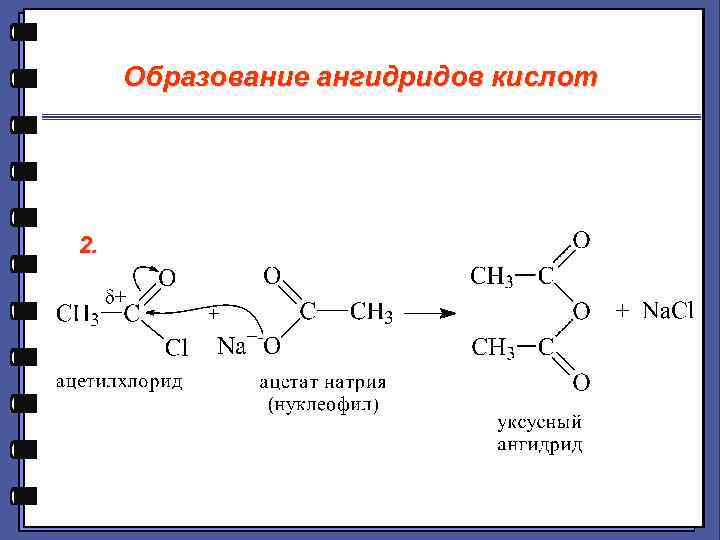
Образование ангидридов кислот 2.

Ацилфосфаты in vivo смешанный ангидрид

Амиды чрезвычайно низкая основность атома азота амидной группы
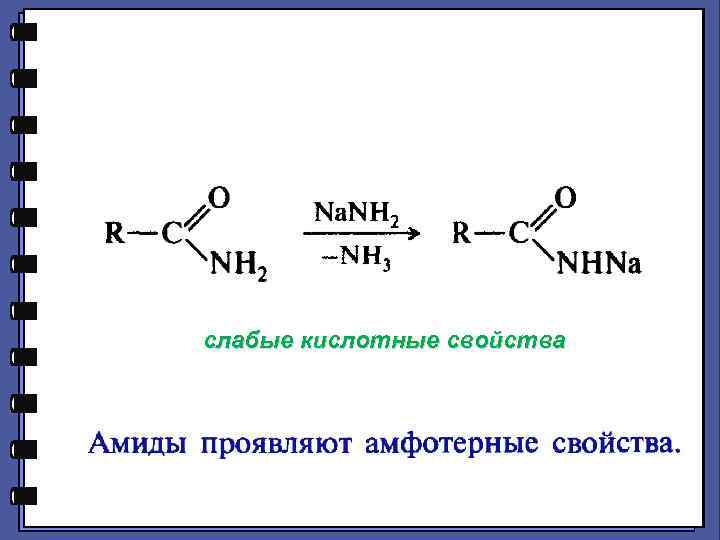
слабые кислотные свойства

Реакция дезаминирования амидов: R C(=O)NH 2 + HNO 2 RCOOH + N 2 + H 2 O. амид азотистая кислота карбоновая кислота

Амиды Образование амидов. 1. Аммонолиз галогенангидридов.
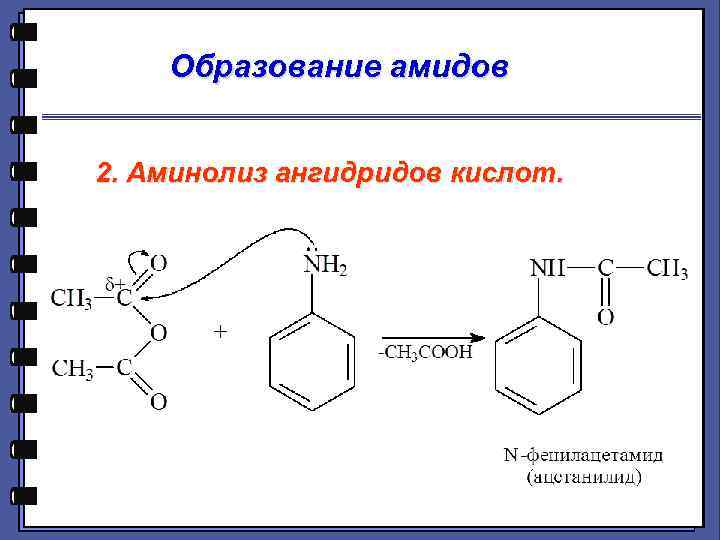
Образование амидов 2. Аминолиз ангидридов кислот.

Образование амидов 3. Аммонолиз карбоновых кислот t

4. Аминолиз сложных эфиров

Амиды. Гидролиз Высокая устойчивость амидов к гидролизу

гидразин H 2 N-NH 2
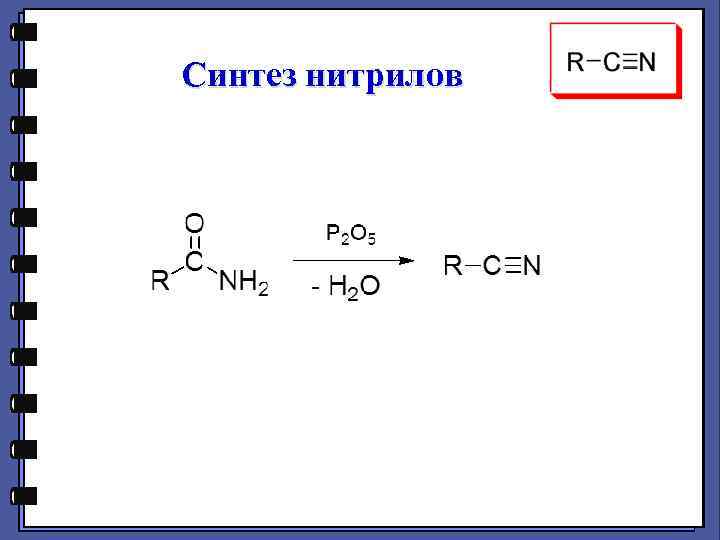
Синтез нитрилов
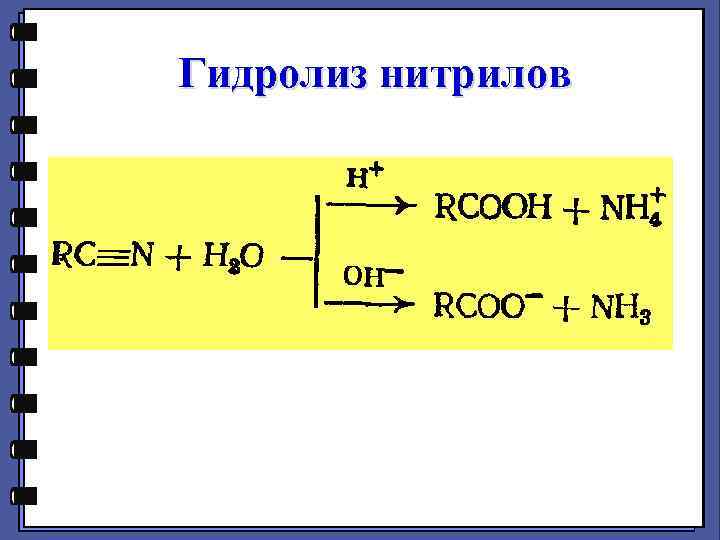
Гидролиз нитрилов


Монокарбоновые кислоты Ацилирующая способность функциональных производных карбоновых кислот
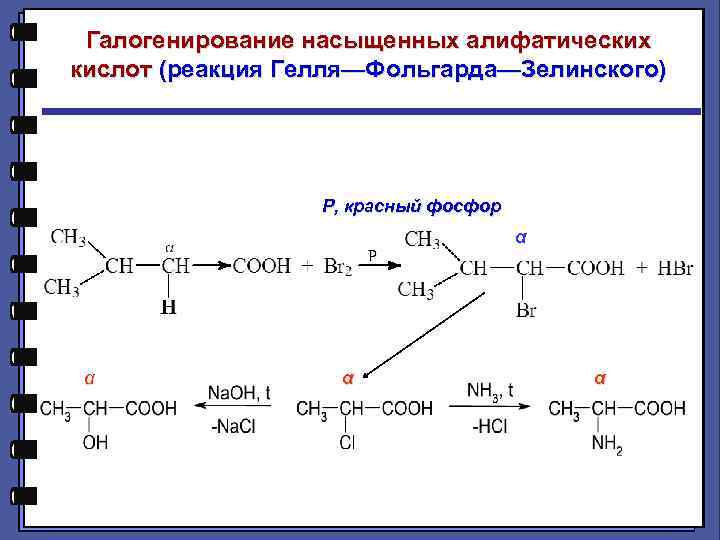
Галогенирование насыщенных алифатических кислот (реакция Гелля—Фольгарда—Зелинского) Р, красный фосфор α α

Спасибо за внимание!
8_SOOH-2014_karbon_k-ty_2.pptx