8+Лекция+ОХТ+2010.ppt
- Количество слайдов: 19

8 лекция ТИПЫ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ И СПОСОБЫ ИХ ИНТЕНСИФИКАЦИИ Общая химическая технология д. т. н. , профессор Бишимбаева Г. К.


КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИИ ПО ФАЗОВОМУ ПРИЗНАКУ l l РАЗЛИЧАЮТ ГОМОГЕННЫЕ И ГЕТЕРОГЕННЫЕ РЕАКЦИИ. ПО ЭТОМУ ЖЕ ПРИЗНАКУ ПОДРАЗДЕЛЯЮТ ХИМИЧЕСКИЕ ПРОЦЕССЫ И РЕАКТОРЫ, В КОТОРЫХ ЭТИ ПРОЦЕССЫ ОСУЩЕСТВЛЯЮТСЯ.

l l l l В гомогенных системах все реагирующие вещества находятся в одной какой-либо фазе: газовой (г), жидкой (ж) или твердой (т). В гетерогенных системах реагирующие вещества находятся в разных фазах, газ-жидкость (г – ж), газ-твердое (г – т), жидкость-твердое (ж – т), две несмешивающиеся жидкости (ж – ж) и две твердые фазы (т – т).

ГОМОГЕННЫЕ ПРОЦЕССЫ l Число условно гомогенных процессов велико в l технологии и неорганических, и органических веществ. Например, в производстве серной кислоты 2 H 2 S + 3 О 2 = 2 SO 2 + 2 Н 2 О + Q, S + O 2 = SO 2 + Q в производстве азотной кислоты 2 NO + O 2 2 NO 2 + Q

l В технологии органических веществ сущность многих гомогенных процессов в газовой фазе состоит в том, что газообразные исходные вещества или пары, полученные испарением жидкости, обрабатываются тем или иным газообразным компонентом: хлором, сернистым ангидридом, окислами азота и др. , при этом обычно протекают параллельные и последовательные реакции.

l Например, при термическом воздействии хлора на метан при 250… 400 °С получают ряд соединений СН 4 + С 12 → НС 1 + СН 3 Сl (хлористый метил), СН 3 Сl + С 12 → НС 1+ CH 2 CL 2 (хлористый метилен), CH 2 Cl 2 + Cl 2 → НС 1 + CHCI 3 (хлороформ), СНС 13 + С 12 → НС 1 + ССl 4 (четыреххлористый углерод).

l К гомогенным процессам, протекающим в жидкой фазе относятся такие, как нейтрализация водных растворов кислот водными растворами щелочей. l l Например, при взаимодействии аммиачной воды и серной кислоты в коксохимическом производстве получают сульфат аммония 2 NH 4 OH + H 2 SO 4 = (NH 4)2 SO 4 + 2 Н 2 О. Обменные реакции в растворах KCl + Na. NO 3 Na. Cl + KNO 3

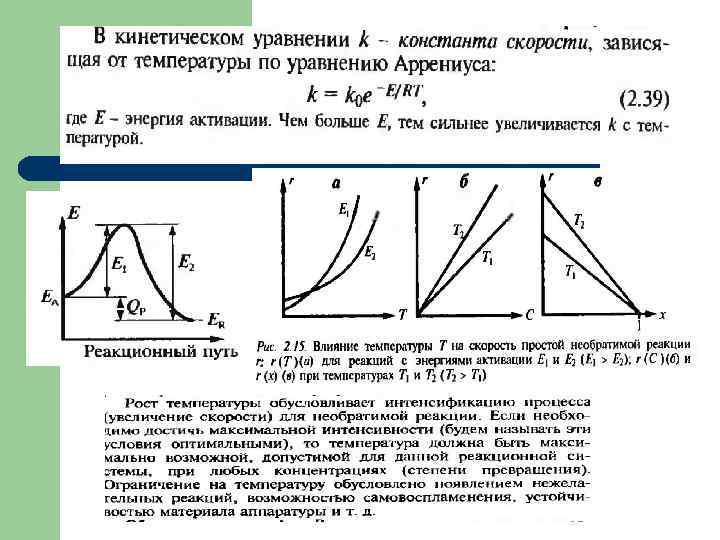
Скорость гомогенных процессов l Гомогенные процессы в большинстве случаев протекают в кинетической области, т. е. общая скорость процесса определяется скоростью химической реакции и подчиняется закономерностям, установленным для процессов, протекающих на микроуровне. l Скорости гомогенных процессов, в основе которых лежат простые необратимые реакции первого и второго порядков A → R и 2 A → R , выражаются уравнениями: х- степень превращения для повышения скорости необходимо увеличивать значения k (путем повышения температуры или применения катализатора) и CA, 0
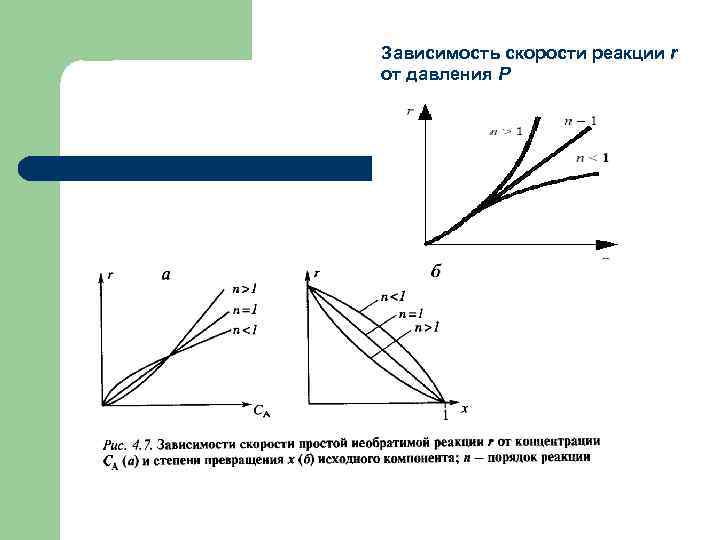
Зависимость скорости реакции r от давления P

l На практике в большинстве случаев гомогенные реакции являются сложными (параллельными или последовательными) l В зависимости от значения констант скоростей этих реакций концентрация продуктов реакций будет изменяться во времени различно. l При этом, чем выше порядок реакции, тем большее влияние оказывает концентрация исходного реагента на скорость соответствующей реакции.



l ГОМОГЕННЫЙ ПРОЦЕСС НА МАКРОУРОВНЕ ПРОТЕКАЕТ В ТОМ СЛУЧАЕ, КОГДА НА ХИМИЧЕСКУЮ РЕАКЦИЮ НАКЛАДЫВАЮТСЯ ДРУГИЕ ФИЗИЧЕСКИЕ ИЛИ ФИЗИКОХИМИЧЕСКИЕ ПРОЦЕССЫ. l НАПРИМЕР, ПРИ ВЗАИМОДЕЙСТВИИ ДВУХ ЖИДКИХ ИСХОДНЫХ РЕАГЕНТОВ ИЛИ ИХ РАСТВОРОВ СКОРОСТЬ ГОМОГЕННОГО ПРОЦЕССА ЗАВИСИТ ОТ УСЛОВИЙ И СКОРОСТИ ПЕРЕМЕШИВАНИЯ ЖИДКОСТЕЙ; l ЕСЛИ ХИМИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ПРОТЕКАЕТ ПРИ ПОДОГРЕВЕ, ТО СКОРОСТЬ ГОМОГЕННОГО ПРОЦЕССА БУДЕТ ЗАВИСЕТЬ ТАКЖЕ ОТ СПОСОБА ПОДВОДА ТЕПЛА.
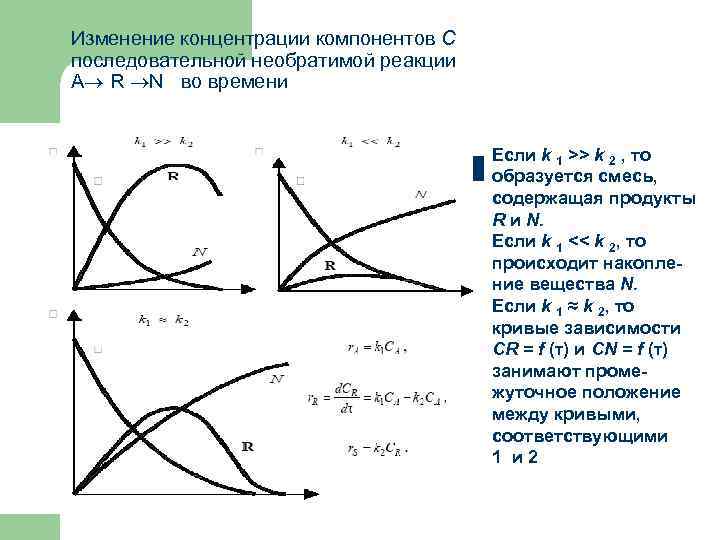
Изменение концентрации компонентов C последовательной необратимой реакции А R N во времени Если k 1 >> k 2 , то образуется смесь, содержащая продукты R и N. Если k 1 << k 2, то происходит накопление вещества N. Если k 1 ≈ k 2, то кривые зависимости CR = f (τ) и CN = f (τ) занимают промежуточное положение между кривыми, соответствующими 1 и 2

l МЕХАНИЗМ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ СЛОЖНЕЕ ГОМОГЕННЫХ, ТАК КАК РЕАГИРУЮЩИЕ ВЕЩЕСТВА НАХОДЯТСЯ В РАЗНЫХ ФАЗАХ И ПОДВОД ИХ К ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ, ГДЕ ПРОИСХОДИТ ХИМИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ, А ТАКЖЕ МАССООБМЕН МЕЖДУ ФАЗАМИ ОСУЩЕСТВЛЯЮТСЯ В РЕЗУЛЬТАТЕ МОЛЕКУЛЯРНОЙ И КОНВЕКТИВНОЙ ДИФФУЗИИ, КОТОРЫЕ НАКЛАДЫВАЮТСЯ НА ОСНОВНОЙ ХИМИЧЕСКИЙ ПРОЦЕСС. ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ l l УСЛОЖНЕНИЕ ВНОСЯТ ТАКЖЕ ПРОЦЕССЫ ТЕПЛООБМЕНА И ПРОЦЕССЫ, ОБУСЛОВЛЕННЫЕ ОСОБЕННОСТЯМИ ГИДРОДИНАМИКИ ПОТОКА. С УЧЕТОМ ВСЕХ ФАКТОРОВ, ВЛИЯЮЩИХ НА ТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС, МОЖНО УСТАНОВИТЬ УСЛОВИЯ, ОБЕСПЕЧИВАЮЩИЕ МАКСИМАЛЬНУЮ ЕГО ИНТЕНСИВНОСТЬ, И УПРАВЛЯТЬ ЭТИМ ПРОЦЕССОМ.
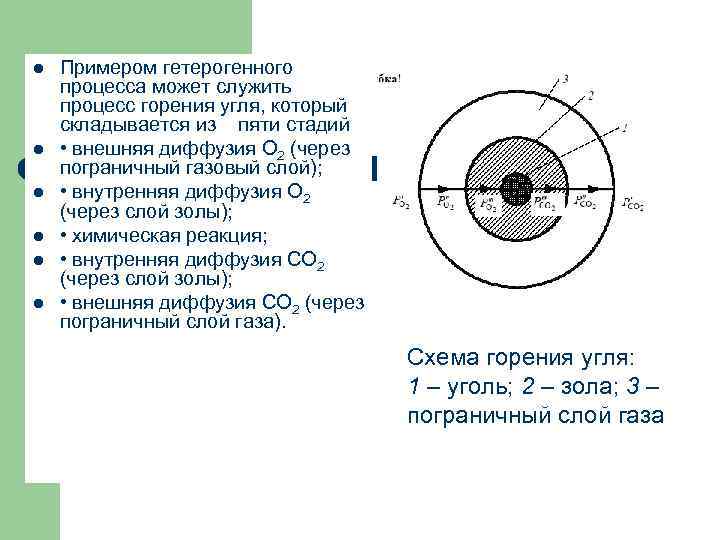
l l l Примером гетерогенного процесса может служить процесс горения угля, который складывается из пяти стадий • внешняя диффузия О 2 (через пограничный газовый слой); • внутренняя диффузия О 2 (через слой золы); • химическая реакция; • внутренняя диффузия СО 2 (через слой золы); • внешняя диффузия СО 2 (через пограничный слой газа). Схема горения угля: 1 – уголь; 2 – зола; 3 – пограничный слой газа

l l l в любом гетерогенном химическом процессе можно выделить три основных одновременно протекающих процесса: 1) диффузия реагентов к границе раздела фаз; 2) химическая реакция; 3) диффузия продуктов реакции из зоны реакции.
8+Лекция+ОХТ+2010.ppt