8. Коррозия металлов
















 8. Коррозия металлов Самопроизвольный физико-химический процесс взаимодействия металлов с внешней (коррозионной) средой, приводящий к их разрушению или изменению их эксплуатационных характеристик. Причина - термодинамическая неустойчивость системы, состоящей из металла и компонентов окружающей среды G 0 r Me 0 Men+ + nē металл Me 0 Mex. Oy; Me(OH)n; Mex. Any Ox + nē Ox-n окруж. среда металл продукты коррозии [зависят от окружающей (внешней среды)] Массовый показатель (скорость убыли массы Ме) Скорость общей коррозии Глубинный показатель (скорость проникновения)
8. Коррозия металлов Самопроизвольный физико-химический процесс взаимодействия металлов с внешней (коррозионной) средой, приводящий к их разрушению или изменению их эксплуатационных характеристик. Причина - термодинамическая неустойчивость системы, состоящей из металла и компонентов окружающей среды G 0 r Me 0 Men+ + nē металл Me 0 Mex. Oy; Me(OH)n; Mex. Any Ox + nē Ox-n окруж. среда металл продукты коррозии [зависят от окружающей (внешней среды)] Массовый показатель (скорость убыли массы Ме) Скорость общей коррозии Глубинный показатель (скорость проникновения)
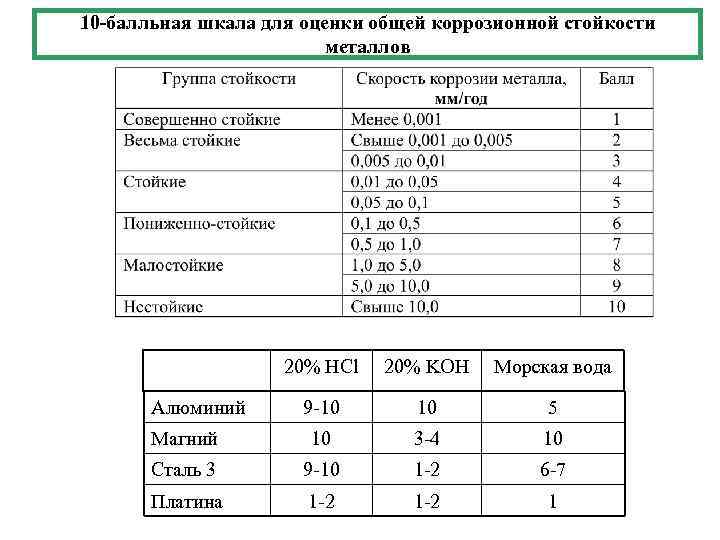
 10 -балльная шкала для оценки общей коррозионной стойкости металлов 20% НCl 20% KOH Морская вода Алюминий 9 -10 5 Магний 10 3 -4 10 Сталь 3 9 -10 1 -2 6 -7 Платина 1 -2 1
10 -балльная шкала для оценки общей коррозионной стойкости металлов 20% НCl 20% KOH Морская вода Алюминий 9 -10 5 Магний 10 3 -4 10 Сталь 3 9 -10 1 -2 6 -7 Платина 1 -2 1
 Классификация коррозионных процессов (по различным признакам) • по геометрич. характеру коррозионных Сплошная(общая) коррозия: разрушений поверхности или объёма равномерная; неравномерная металла Местная(локальная, точечная): пятна; язвы; питтинг Газовая Атмосферная • по составу коррозионной среды В жидких средах: электролитах и неэлектролитах. . . Химическая коррозия • по механизму коррозионного процесса Электрохимическая коррозия • по характеру дополнительных Механические нагрузки воздействий с действием корр. среды Радиация; блуждающие токи…
Классификация коррозионных процессов (по различным признакам) • по геометрич. характеру коррозионных Сплошная(общая) коррозия: разрушений поверхности или объёма равномерная; неравномерная металла Местная(локальная, точечная): пятна; язвы; питтинг Газовая Атмосферная • по составу коррозионной среды В жидких средах: электролитах и неэлектролитах. . . Химическая коррозия • по механизму коррозионного процесса Электрохимическая коррозия • по характеру дополнительных Механические нагрузки воздействий с действием корр. среды Радиация; блуждающие токи…
 8. 1 Химическая коррозия Гетерогенная окислительно-восстановительная реакция (между Ме и окислителем). Окисление металла и восстановление окислителя окружающей среды протекает в одном акте при непосредственном переходе электронов металла на окислитель с образованием продуктов коррозии. Коррозионная среда не проводит электрический ток • Коррозия газовая и в неэлектропроводных жидкостях Высокотемпературная газовая коррозия (нет конденсации паров окислителя) окислитель - газ: атмосферный кислород (О 2); СО 2; пары воды; SO 2; Cl 2; … ∆G < 0 для большинства Ме при взаимодействии с О 2 – самопризв. окисление x. Me + y/2 O 2 = Mex. Oy тв. газ тв. • это гетерогенная химическая реакция с изменением поверхности: на границе раздела металл-газовая среда возникает пленка твёрдых продуктов окисления (продукт окисления - оксидная плёнка Mex. Oy)
8. 1 Химическая коррозия Гетерогенная окислительно-восстановительная реакция (между Ме и окислителем). Окисление металла и восстановление окислителя окружающей среды протекает в одном акте при непосредственном переходе электронов металла на окислитель с образованием продуктов коррозии. Коррозионная среда не проводит электрический ток • Коррозия газовая и в неэлектропроводных жидкостях Высокотемпературная газовая коррозия (нет конденсации паров окислителя) окислитель - газ: атмосферный кислород (О 2); СО 2; пары воды; SO 2; Cl 2; … ∆G < 0 для большинства Ме при взаимодействии с О 2 – самопризв. окисление x. Me + y/2 O 2 = Mex. Oy тв. газ тв. • это гетерогенная химическая реакция с изменением поверхности: на границе раздела металл-газовая среда возникает пленка твёрдых продуктов окисления (продукт окисления - оксидная плёнка Mex. Oy)
 Схема роста оксидной пленки 1. Переход в оксидную пленку 1. Сорбция молекул O 2, иона Меn+; ē диссоциация и ионизация 2. Диффузия ионов Меn+; ē O + 2ē О 2 - 2. Диффузия ионов О 2 - Меx. Oy O 2 Пример ион Меn+ Ион О 2 - Сu|Cu 2 O|Cu. O|O 2
Схема роста оксидной пленки 1. Переход в оксидную пленку 1. Сорбция молекул O 2, иона Меn+; ē диссоциация и ионизация 2. Диффузия ионов Меn+; ē O + 2ē О 2 - 2. Диффузия ионов О 2 - Меx. Oy O 2 Пример ион Меn+ Ион О 2 - Сu|Cu 2 O|Cu. O|O 2
 Кинетика роста оксидных пленок (определяется свойствами оксидной пленки и температурой) Кинет. уравн. роста оксидной пленки( x. Me + y/2 O 2 = Mex. Oy ) для газ. коррозии- зависимость толщины пленки ( ) от времени(t); (r –скорость газовой коррозии) имеют две формы: дифференциальное уравнение - r = интегральное уравнение - =f(t) Коррозия - гетерогенная хим. реакция (может протекать в кинетич. или диффузионном режиме - разные законы изменения во времени - лимитируется скоростью подвода(отвода) регентов или - лимитируется скоростью химической реакции 1. Лимитирующая стадия химическая реакция (плёнка несплошная, пористая). Закон действующих масс (ЗДМ) для реакции окисления Ме: Линейный закон роста (щелочные и щ/з Ме)
Кинетика роста оксидных пленок (определяется свойствами оксидной пленки и температурой) Кинет. уравн. роста оксидной пленки( x. Me + y/2 O 2 = Mex. Oy ) для газ. коррозии- зависимость толщины пленки ( ) от времени(t); (r –скорость газовой коррозии) имеют две формы: дифференциальное уравнение - r = интегральное уравнение - =f(t) Коррозия - гетерогенная хим. реакция (может протекать в кинетич. или диффузионном режиме - разные законы изменения во времени - лимитируется скоростью подвода(отвода) регентов или - лимитируется скоростью химической реакции 1. Лимитирующая стадия химическая реакция (плёнка несплошная, пористая). Закон действующих масс (ЗДМ) для реакции окисления Ме: Линейный закон роста (щелочные и щ/з Ме)
 Кинетика роста оксидной пленки 2. Лимитирующая стадия диффузия(наличие сплошной оксидной плёнки). Скорость коррозии (роста пленки) определяется законами диффузии : Параболический закон роста (Fe, Co, Ni, Cu и др. ) 3. D 0 Логарифмический закон роста 40 нм – тонкие, невидимые пленки (Al, Cr)-замедление диффузии ~ 40 - 500 нм – «цвета побежалости» при росте толщины плёнки 500 нм – «окалина»
Кинетика роста оксидной пленки 2. Лимитирующая стадия диффузия(наличие сплошной оксидной плёнки). Скорость коррозии (роста пленки) определяется законами диффузии : Параболический закон роста (Fe, Co, Ni, Cu и др. ) 3. D 0 Логарифмический закон роста 40 нм – тонкие, невидимые пленки (Al, Cr)-замедление диффузии ~ 40 - 500 нм – «цвета побежалости» при росте толщины плёнки 500 нм – «окалина»
 Факторы, влияющие на скорость газовой коррозии (определяется св-вами оксидной пленки) 1. Защитные свойства пленок • сплошность ЗАЩИТА : • адгезия (сцепление с поверхностью Ме) • легирование • механические свойства • защитные покрытия • коэффициент линейного расширения 2. Температура(возрастание скорости газ. коррозии с ростом Т) • • изменение закона роста пленок; • разрушение пленок при колебании Т 3. Состав газовой среды • концентрация (парциальное давление) • защитные среды газа-окислителя (инертные газы, • водяные пары, соединения серы и др. вакуум)
Факторы, влияющие на скорость газовой коррозии (определяется св-вами оксидной пленки) 1. Защитные свойства пленок • сплошность ЗАЩИТА : • адгезия (сцепление с поверхностью Ме) • легирование • механические свойства • защитные покрытия • коэффициент линейного расширения 2. Температура(возрастание скорости газ. коррозии с ростом Т) • • изменение закона роста пленок; • разрушение пленок при колебании Т 3. Состав газовой среды • концентрация (парциальное давление) • защитные среды газа-окислителя (инертные газы, • водяные пары, соединения серы и др. вакуум)
 8. 2 Водородная коррозия (охрупчивание) Уменьшение пластичности металла (охрупчивание) в газовой среде содержащий водород (Н 2) из-за растворения водорода в металле => разрушение Ме конструкций Протекают процессы: Сорбция водорода на поверхности Ме с последующей диссоциацией: Н 2 2 Н Диффузия атомов Н в объём Ме и возможные химические реакции: • Fe 3 C + 4 H 3 Fe + CH 4 • Me + n. H Me. Hn (гидриды металлов) • Образование газовых полостей ( «пузырей» ) [рекомбинация 2 Н Н 2, ] =>равновесие : газ(Н 2 ) в полость<=>газ (Н 2 ) из полости (при давлении 2000 ат – большие внутренние напряжения в объёме металла, потеря пластичности(охрупчивание)
8. 2 Водородная коррозия (охрупчивание) Уменьшение пластичности металла (охрупчивание) в газовой среде содержащий водород (Н 2) из-за растворения водорода в металле => разрушение Ме конструкций Протекают процессы: Сорбция водорода на поверхности Ме с последующей диссоциацией: Н 2 2 Н Диффузия атомов Н в объём Ме и возможные химические реакции: • Fe 3 C + 4 H 3 Fe + CH 4 • Me + n. H Me. Hn (гидриды металлов) • Образование газовых полостей ( «пузырей» ) [рекомбинация 2 Н Н 2, ] =>равновесие : газ(Н 2 ) в полость<=>газ (Н 2 ) из полости (при давлении 2000 ат – большие внутренние напряжения в объёме металла, потеря пластичности(охрупчивание)
 8. 3 Электрохимическая коррозия • контакт металла с электролитом (водные растворы) • образование участков с различными значениями электродных потенциалов (φ)ЕА < (φ)ЕК Меē Меn+ Ox H 2 O + О 2 + H+ или (ОН)-+ An– • короткозамкнутый гальванический элемент (гальванопара) • электродные реакции разделены в пространстве и времени окисление Ме (А: Me 0 Men+ + nē) – анод(А)(-) восстановление (К: Ox + nē Red) – катод(К)(+) компонетов окружающей среды
8. 3 Электрохимическая коррозия • контакт металла с электролитом (водные растворы) • образование участков с различными значениями электродных потенциалов (φ)ЕА < (φ)ЕК Меē Меn+ Ox H 2 O + О 2 + H+ или (ОН)-+ An– • короткозамкнутый гальванический элемент (гальванопара) • электродные реакции разделены в пространстве и времени окисление Ме (А: Me 0 Men+ + nē) – анод(А)(-) восстановление (К: Ox + nē Red) – катод(К)(+) компонетов окружающей среды
 Электродные реакции анодные–окисления, катодные–восстановления (деполяризации) А: Me 0 Men+ + nē Деполяризация – компенсация заряда в катодном процессе электролит: H 2 O + О 2 + H+ + An– Водородная деполяризация К: 2 H+ + 2ē → H 2 p. H 7 К: 2 H 2 O + 2ē →H 2 + 2 OH- p. H 7 Кислородная деполяризация К: О 2 + 4 H+ + 4ē → 2 H 2 O p. H 7 К: О 2 + 2 H 2 O + 4ē → 4 OH- p. H 7
Электродные реакции анодные–окисления, катодные–восстановления (деполяризации) А: Me 0 Men+ + nē Деполяризация – компенсация заряда в катодном процессе электролит: H 2 O + О 2 + H+ + An– Водородная деполяризация К: 2 H+ + 2ē → H 2 p. H 7 К: 2 H 2 O + 2ē →H 2 + 2 OH- p. H 7 Кислородная деполяризация К: О 2 + 4 H+ + 4ē → 2 H 2 O p. H 7 К: О 2 + 2 H 2 O + 4ē → 4 OH- p. H 7
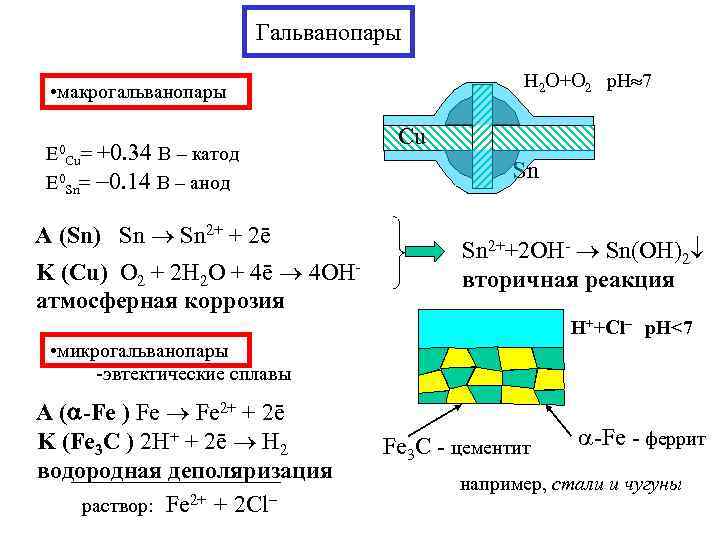
 Гальванопары H 2 O+O 2 p. H 7 • макрогальванопары Cu E 0 +0. 34 В – катод Cu= E 0 Sn= 0. 14 В – анод Sn A (Sn) Sn 2+ + 2ē Sn 2++2 OH- Sn(OH)2 K (Cu) О 2 + 2 H 2 O + 4ē 4 OH- вторичная реакция атмосферная коррозия H++Cl– p. H<7 • микрогальванопары -эвтектические сплавы A ( -Fe ) Fe 2+ + 2ē K (Fe 3 C ) 2 H+ + 2ē H 2 Fe 3 C - цементит -Fe - феррит водородная деполяризация например, стали и чугуны раствор: Fe 2+ + 2 Cl–
Гальванопары H 2 O+O 2 p. H 7 • макрогальванопары Cu E 0 +0. 34 В – катод Cu= E 0 Sn= 0. 14 В – анод Sn A (Sn) Sn 2+ + 2ē Sn 2++2 OH- Sn(OH)2 K (Cu) О 2 + 2 H 2 O + 4ē 4 OH- вторичная реакция атмосферная коррозия H++Cl– p. H<7 • микрогальванопары -эвтектические сплавы A ( -Fe ) Fe 2+ + 2ē K (Fe 3 C ) 2 H+ + 2ē H 2 Fe 3 C - цементит -Fe - феррит водородная деполяризация например, стали и чугуны раствор: Fe 2+ + 2 Cl–
 • неоднородность среды (С, Т, р. Н…. ) - коррозия под каплей воды A (Ме) Ме Меn+ + nē (неравномерная аэрация) K (Ме) О 2 + 2 H 2 O + 4ē 4 OH- О 2 Меn+ +n. OH- Ме(OH)n H 2 O + О 2 К А К φА < φК H 2 O+O 2 - коррозия деталей неоднородной (сложной) поверхности
• неоднородность среды (С, Т, р. Н…. ) - коррозия под каплей воды A (Ме) Ме Меn+ + nē (неравномерная аэрация) K (Ме) О 2 + 2 H 2 O + 4ē 4 OH- О 2 Меn+ +n. OH- Ме(OH)n H 2 O + О 2 К А К φА < φК H 2 O+O 2 - коррозия деталей неоднородной (сложной) поверхности
 • механические напряжения А электролит К Е А< Е К A (Ме) Ме Меn+ + nē K (Ме) О 2 + 2 H 2 O + 4ē 4 OH- Меn+ +n. OH- Ме(OH)n
• механические напряжения А электролит К Е А< Е К A (Ме) Ме Меn+ + nē K (Ме) О 2 + 2 H 2 O + 4ē 4 OH- Меn+ +n. OH- Ме(OH)n
 Термодинамические условия коррозии металлов r. G 0 Е А< Е К анод – металл катод - кислородный или водородный электроды +1. 23 В +0. 81 В +0. 40 В 0. 41 В 0. 83 В кислая p. H 7 щелочная
Термодинамические условия коррозии металлов r. G 0 Е А< Е К анод – металл катод - кислородный или водородный электроды +1. 23 В +0. 81 В +0. 40 В 0. 41 В 0. 83 В кислая p. H 7 щелочная
 Диаграмма воды 1. 23 В III 0. 40 В I -0. 83 В
Диаграмма воды 1. 23 В III 0. 40 В I -0. 83 В
 Факторы влияющие на скорость коррозии rкорр iкорр • ЭДС гальванопары ЕК ЕК 1 ЕК 2 iк 2 ЕМе 3 • поляризация i ЕМе 2 к 3 iк 1 i ЕМе 1 ЕМе rкорр • р. Н среды амфотерные Al, Zn кислоты Mo, W защитные свойства пленки продуктов коррозии основания 14 Ni, Cd кислота р. Н=7 щелочь • Температура ; деаэрация
Факторы влияющие на скорость коррозии rкорр iкорр • ЭДС гальванопары ЕК ЕК 1 ЕК 2 iк 2 ЕМе 3 • поляризация i ЕМе 2 к 3 iк 1 i ЕМе 1 ЕМе rкорр • р. Н среды амфотерные Al, Zn кислоты Mo, W защитные свойства пленки продуктов коррозии основания 14 Ni, Cd кислота р. Н=7 щелочь • Температура ; деаэрация

