8_2011.ppt
- Количество слайдов: 23
 8. Концепция самоорганизации природных систем. 8. 1. Методы описания многочастичных систем. 8. 2. Обратимые и необратимые процессы. Энтропия. 8. 3. Открытые термодинамические системы. 8. 4. Концепция самоорганизации в сильнонеравновесных системах. 8. 5. Самоорганизация и энтропия. 8. 6. Самоорганизация и развитие эволюционных представлений. КСЕ
8. Концепция самоорганизации природных систем. 8. 1. Методы описания многочастичных систем. 8. 2. Обратимые и необратимые процессы. Энтропия. 8. 3. Открытые термодинамические системы. 8. 4. Концепция самоорганизации в сильнонеравновесных системах. 8. 5. Самоорганизация и энтропия. 8. 6. Самоорганизация и развитие эволюционных представлений. КСЕ
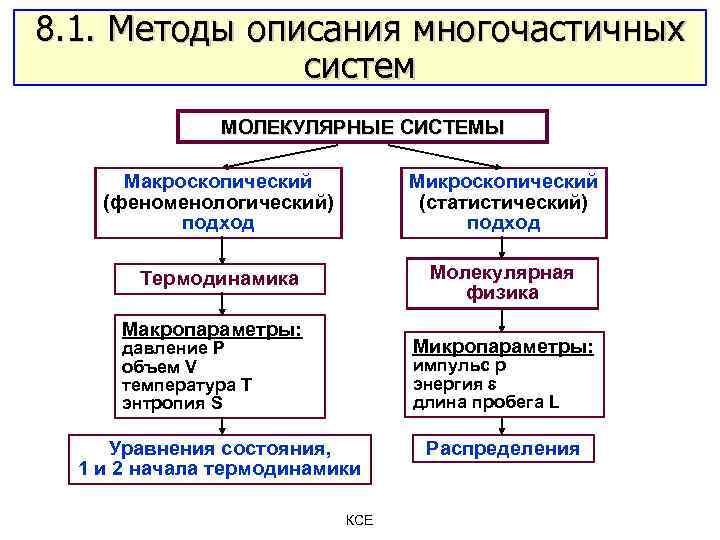 8. 1. Методы описания многочастичных систем МОЛЕКУЛЯРНЫЕ СИСТЕМЫ Макроскопический (феноменологический) подход Микроскопический (статистический) подход Термодинамика Молекулярная физика Макропараметры: Микропараметры: давление Р объем V температура Т энтропия S импульс р энергия длина пробега L Уравнения состояния, 1 и 2 начала термодинамики КСЕ Распределения
8. 1. Методы описания многочастичных систем МОЛЕКУЛЯРНЫЕ СИСТЕМЫ Макроскопический (феноменологический) подход Микроскопический (статистический) подход Термодинамика Молекулярная физика Макропараметры: Микропараметры: давление Р объем V температура Т энтропия S импульс р энергия длина пробега L Уравнения состояния, 1 и 2 начала термодинамики КСЕ Распределения
 Термодинамический метод Термодинамика - теория описания процессов в молекулярной системе с помощью макропараметров. Классическая термодинамика изучает только равновесные состояния и процессы. Термодинамическое равновесие – состояние системы, когда во всех ее частях значения макропараметров одинаковы. Связь макропараметров системы называется уравнением состояния. Уравнение состояния идеального газа Менделеева – Клапейрона Классическая термодинамика представляет собой теорию динамического типа. КСЕ
Термодинамический метод Термодинамика - теория описания процессов в молекулярной системе с помощью макропараметров. Классическая термодинамика изучает только равновесные состояния и процессы. Термодинамическое равновесие – состояние системы, когда во всех ее частях значения макропараметров одинаковы. Связь макропараметров системы называется уравнением состояния. Уравнение состояния идеального газа Менделеева – Клапейрона Классическая термодинамика представляет собой теорию динамического типа. КСЕ
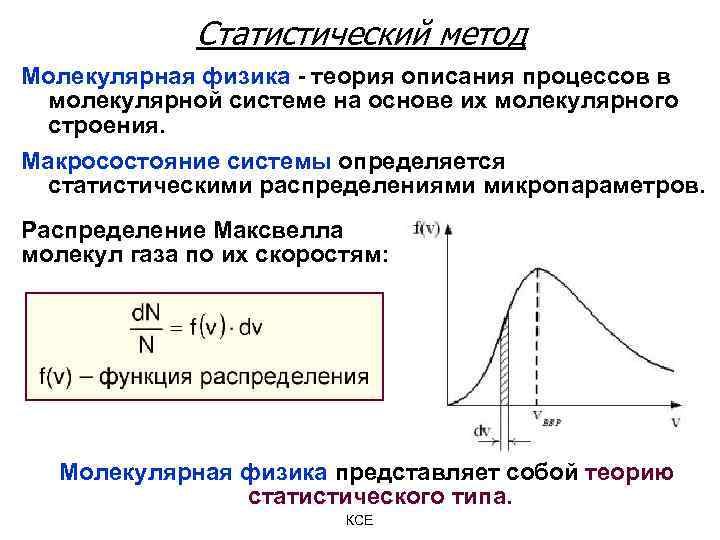 Статистический метод Молекулярная физика - теория описания процессов в молекулярной системе на основе их молекулярного строения. Макросостояние системы определяется статистическими распределениями микропараметров. Распределение Максвелла молекул газа по их скоростям: Молекулярная физика представляет собой теорию статистического типа. КСЕ
Статистический метод Молекулярная физика - теория описания процессов в молекулярной системе на основе их молекулярного строения. Макросостояние системы определяется статистическими распределениями микропараметров. Распределение Максвелла молекул газа по их скоростям: Молекулярная физика представляет собой теорию статистического типа. КСЕ
 8. 2. Обратимые и необратимые процессы. Энтропия Первое начало термодинамики: Теплота, сообщаемая системе, расходуется на увеличение ее внутренней энергии и на совершение этой системой работы. КСЕ
8. 2. Обратимые и необратимые процессы. Энтропия Первое начало термодинамики: Теплота, сообщаемая системе, расходуется на увеличение ее внутренней энергии и на совершение этой системой работы. КСЕ
 Второе начало термодинамики: Формулировка Р. Клаузиуса: не существует процесса, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому. Формулировка У. Кельвина и М. Планка: невозможен циклический процесс, единственным результатом которого является превращение теплоты в работу. КСЕ
Второе начало термодинамики: Формулировка Р. Клаузиуса: не существует процесса, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому. Формулировка У. Кельвина и М. Планка: невозможен циклический процесс, единственным результатом которого является превращение теплоты в работу. КСЕ
 Обратимые и необратимые процессы Обратимым называется процесс, который может быть проведен в прямом и обратном направлении без остаточных изменений в окружающей среде. Большинство процессов в природе необратимы и связаны с диссипацией (рассеянием) энергии. Мера необратимого рассеяния энергии – энтропия В процессах важно знать изменение энтропии КСЕ
Обратимые и необратимые процессы Обратимым называется процесс, который может быть проведен в прямом и обратном направлении без остаточных изменений в окружающей среде. Большинство процессов в природе необратимы и связаны с диссипацией (рассеянием) энергии. Мера необратимого рассеяния энергии – энтропия В процессах важно знать изменение энтропии КСЕ
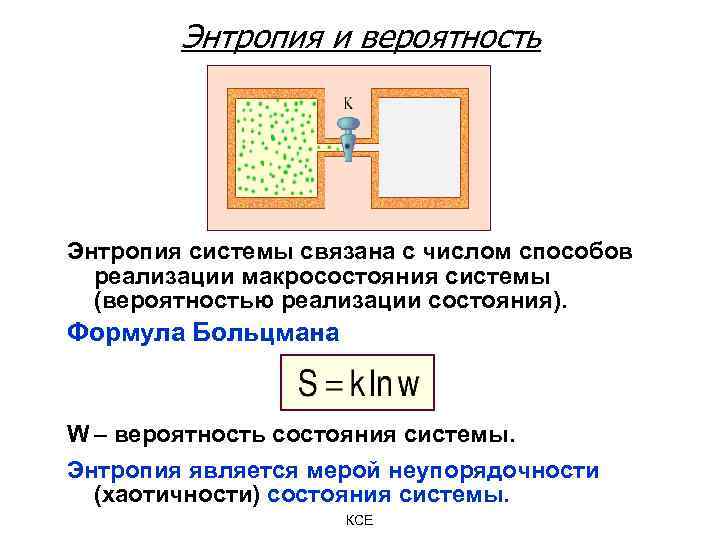 Энтропия и вероятность Энтропия системы связана с числом способов реализации макросостояния системы (вероятностью реализации состояния). Формула Больцмана W – вероятность состояния системы. Энтропия является мерой неупорядочности (хаотичности) состояния системы. КСЕ
Энтропия и вероятность Энтропия системы связана с числом способов реализации макросостояния системы (вероятностью реализации состояния). Формула Больцмана W – вероятность состояния системы. Энтропия является мерой неупорядочности (хаотичности) состояния системы. КСЕ
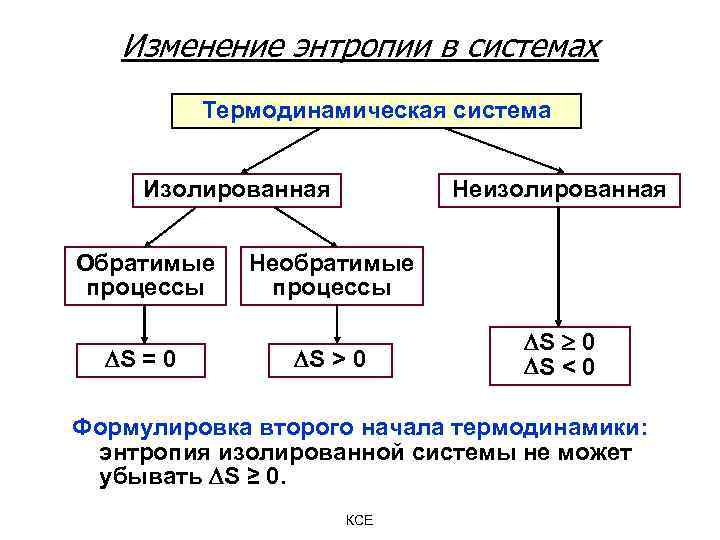 Изменение энтропии в системах Термодинамическая система Изолированная Обратимые процессы S = 0 Неизолированная Необратимые процессы S > 0 S 0 S < 0 Формулировка второго начала термодинамики: энтропия изолированной системы не может убывать S ≥ 0. КСЕ
Изменение энтропии в системах Термодинамическая система Изолированная Обратимые процессы S = 0 Неизолированная Необратимые процессы S > 0 S 0 S < 0 Формулировка второго начала термодинамики: энтропия изолированной системы не может убывать S ≥ 0. КСЕ
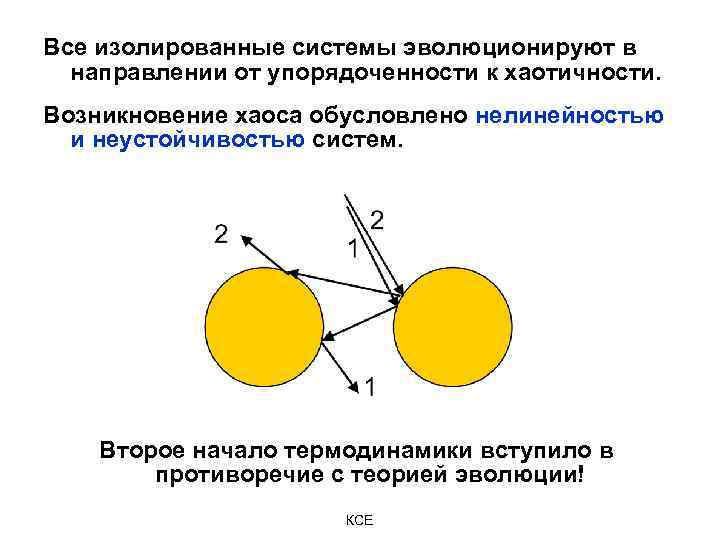 Все изолированные системы эволюционируют в направлении от упорядоченности к хаотичности. Возникновение хаоса обусловлено нелинейностью и неустойчивостью систем. Второе начало термодинамики вступило в противоречие с теорией эволюции! КСЕ
Все изолированные системы эволюционируют в направлении от упорядоченности к хаотичности. Возникновение хаоса обусловлено нелинейностью и неустойчивостью систем. Второе начало термодинамики вступило в противоречие с теорией эволюции! КСЕ
 8. 3. Открытые термодинамические системы Эволюционная парадигма: В процессе развития происходит переход к новым, более упорядоченным формам. Второе начало термодинамики описывает эволюцию изолированных равновесных систем. Природные объекты – открытые неравновесные системы. В таких системах возникает неоднородное распределение термодинамических параметров и происходит обмен энергией, веществом, информацией и т. д. Процессы в открытых неравновесных системах исследует неравновесная термодинамика. КСЕ
8. 3. Открытые термодинамические системы Эволюционная парадигма: В процессе развития происходит переход к новым, более упорядоченным формам. Второе начало термодинамики описывает эволюцию изолированных равновесных систем. Природные объекты – открытые неравновесные системы. В таких системах возникает неоднородное распределение термодинамических параметров и происходит обмен энергией, веществом, информацией и т. д. Процессы в открытых неравновесных системах исследует неравновесная термодинамика. КСЕ
 Градиент – физическая величина, характеризующая степень неоднородности распределения какой-либо величины. Наличие градиента вызывает появление потока другой физической величины (градиент температуры – поток тепла…). Различают слабонеравновесные и сильнонеравновесные открытые системы. В слабонеравновесной системе ( близкой к термодинамическому равновесию) поток переносимой величины линейно связан с соответствующим градиентом. В сильнонеравновесной системе потоки являются нелинейными функциями соответствующих градиентов. КСЕ
Градиент – физическая величина, характеризующая степень неоднородности распределения какой-либо величины. Наличие градиента вызывает появление потока другой физической величины (градиент температуры – поток тепла…). Различают слабонеравновесные и сильнонеравновесные открытые системы. В слабонеравновесной системе ( близкой к термодинамическому равновесию) поток переносимой величины линейно связан с соответствующим градиентом. В сильнонеравновесной системе потоки являются нелинейными функциями соответствующих градиентов. КСЕ
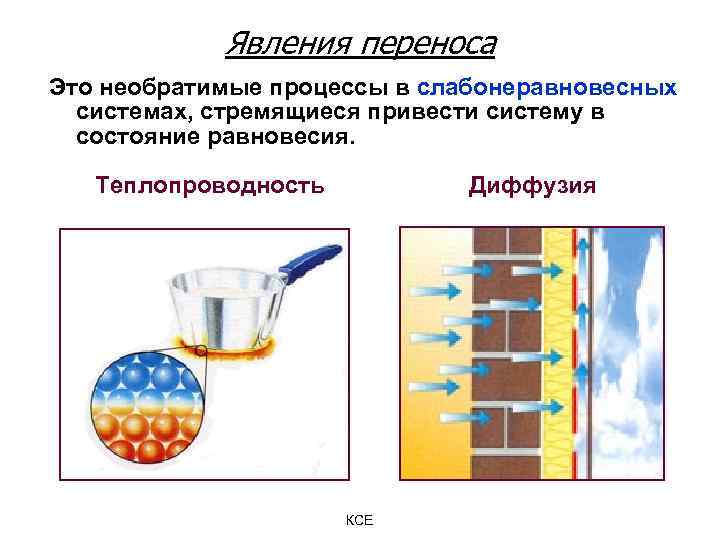 Явления переноса Это необратимые процессы в слабонеравновесных системах, стремящиеся привести систему в состояние равновесия. Теплопроводность Диффузия КСЕ
Явления переноса Это необратимые процессы в слабонеравновесных системах, стремящиеся привести систему в состояние равновесия. Теплопроводность Диффузия КСЕ
 8. 4. Концепция самоорганизации в сильнонеравновесных открытых системах И. Пригожин, бельгийский физик (1917 -2003 г. ): теория неравновесной термодинамики в сильнонеравновесных системах. Самоорганизация - процесс образования в системе упорядоченной структуры без внешнего организующего воздействия. Флуктуация - случайное, локальное отклонение параметров от их среднего значения в данной точке. КСЕ
8. 4. Концепция самоорганизации в сильнонеравновесных открытых системах И. Пригожин, бельгийский физик (1917 -2003 г. ): теория неравновесной термодинамики в сильнонеравновесных системах. Самоорганизация - процесс образования в системе упорядоченной структуры без внешнего организующего воздействия. Флуктуация - случайное, локальное отклонение параметров от их среднего значения в данной точке. КСЕ
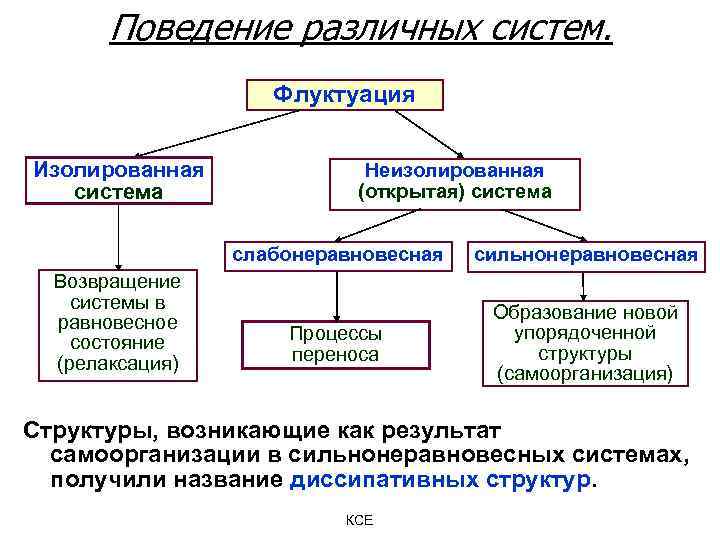 Поведение различных систем. Флуктуация Изолированная система Неизолированная (открытая) система слабонеравновесная Возвращение системы в равновесное состояние (релаксация) сильнонеравновесная Процессы переноса Образование новой упорядоченной структуры (самоорганизация) Структуры, возникающие как результат самоорганизации в сильнонеравновесных системах, получили название диссипативных структур. КСЕ
Поведение различных систем. Флуктуация Изолированная система Неизолированная (открытая) система слабонеравновесная Возвращение системы в равновесное состояние (релаксация) сильнонеравновесная Процессы переноса Образование новой упорядоченной структуры (самоорганизация) Структуры, возникающие как результат самоорганизации в сильнонеравновесных системах, получили название диссипативных структур. КСЕ
 Диссипативные структуры: Диссипация – переход части энергии упорядоченного движения в энергию беспорядка. § существуют за счет больших потоков энергии извне § способствуют рассеянию энергии. КСЕ
Диссипативные структуры: Диссипация – переход части энергии упорядоченного движения в энергию беспорядка. § существуют за счет больших потоков энергии извне § способствуют рассеянию энергии. КСЕ
 Ячейки Бенара КСЕ
Ячейки Бенара КСЕ
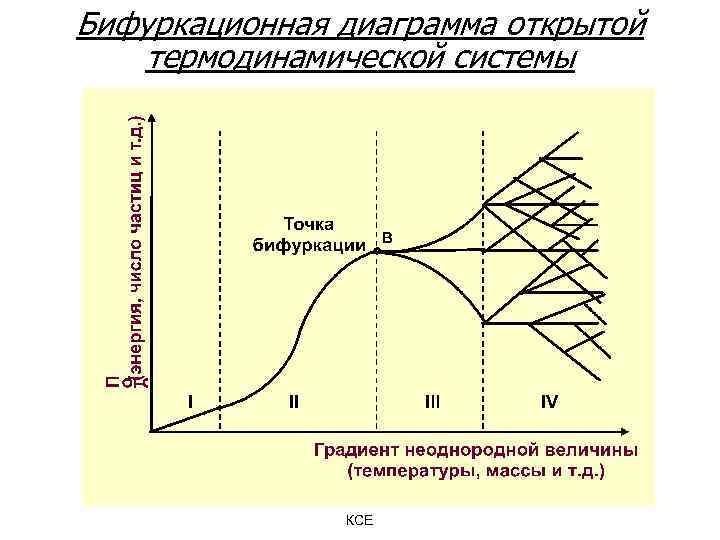 Бифуркационная диаграмма открытой термодинамической системы КСЕ
Бифуркационная диаграмма открытой термодинамической системы КСЕ
 Точка бифуркации - состояние, при котором в сильнонеравновесной системе происходит переход к новому типу поведения. В этой точке у системы появляется возможность выбора. Выбор системы носит вероятностный характер, что делает эволюцию системы необратимой. В поведении открытой сильнонеравновесной системы сочетаются случайность и определенность. Хаос и порядок – две стороны одной медали, работает принцип дополнительности Бора. КСЕ
Точка бифуркации - состояние, при котором в сильнонеравновесной системе происходит переход к новому типу поведения. В этой точке у системы появляется возможность выбора. Выбор системы носит вероятностный характер, что делает эволюцию системы необратимой. В поведении открытой сильнонеравновесной системы сочетаются случайность и определенность. Хаос и порядок – две стороны одной медали, работает принцип дополнительности Бора. КСЕ
 8. 5. Самоорганизация и энтропия Шутка физиков: Термодинамика - старая властная тетка, которую все недолюбливают, но которая всегда права. В открытых системах за счет подпитки энергии от внешней среды могут возникать диссипативные структуры с меньшей энтропией. Открытые системы как бы структурируют энергию из внешней среды: - упорядоченная часть энергии остается в системе, - неупорядоченную энергию система «сбрасывает» , возвращая в природу. Производство энтропии: КСЕ
8. 5. Самоорганизация и энтропия Шутка физиков: Термодинамика - старая властная тетка, которую все недолюбливают, но которая всегда права. В открытых системах за счет подпитки энергии от внешней среды могут возникать диссипативные структуры с меньшей энтропией. Открытые системы как бы структурируют энергию из внешней среды: - упорядоченная часть энергии остается в системе, - неупорядоченную энергию система «сбрасывает» , возвращая в природу. Производство энтропии: КСЕ
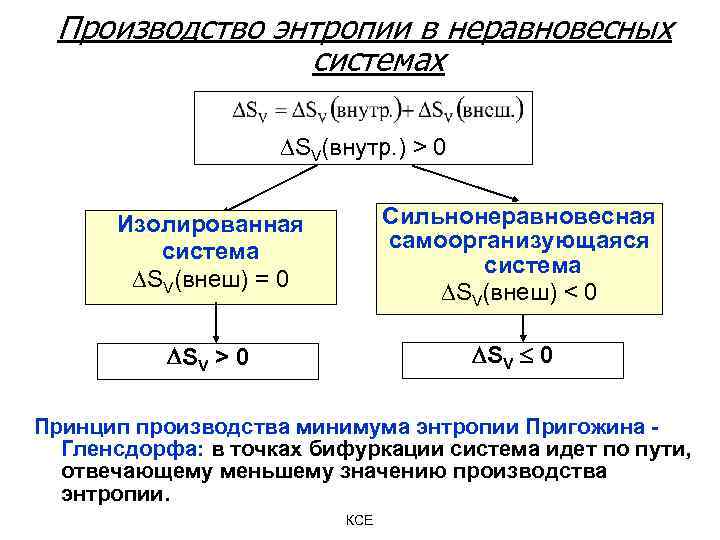 Производство энтропии в неравновесных системах SV(внутр. ) > 0 Изолированная система SV(внеш) = 0 Сильнонеравновесная самоорганизующаяся система SV(внеш) < 0 SV > 0 SV 0 Принцип производства минимума энтропии Пригожина - Гленсдорфа: в точках бифуркации система идет по пути, отвечающему меньшему значению производства энтропии. КСЕ
Производство энтропии в неравновесных системах SV(внутр. ) > 0 Изолированная система SV(внеш) = 0 Сильнонеравновесная самоорганизующаяся система SV(внеш) < 0 SV > 0 SV 0 Принцип производства минимума энтропии Пригожина - Гленсдорфа: в точках бифуркации система идет по пути, отвечающему меньшему значению производства энтропии. КСЕ
 8. 6. Самоорганизация и развитие эволюционных представлений Характерные признаки самоорганизации: 1. Система является сложной, т. е. состоит из большого числа элементов. 2. Система является открытой. 3. Неустойчивость и нелинейность свойств системы при увеличении внешнего воздействия. 4. Быстрая перестройка системы при согласованном поведении ее элементов. 5. Конкуренция состояний системы. 6. Уменьшение энтропии системы в результате обмена с внешней средой. КСЕ
8. 6. Самоорганизация и развитие эволюционных представлений Характерные признаки самоорганизации: 1. Система является сложной, т. е. состоит из большого числа элементов. 2. Система является открытой. 3. Неустойчивость и нелинейность свойств системы при увеличении внешнего воздействия. 4. Быстрая перестройка системы при согласованном поведении ее элементов. 5. Конкуренция состояний системы. 6. Уменьшение энтропии системы в результате обмена с внешней средой. КСЕ
 Эволюционно-синергетическая парадигма Герман Хакен, немецкий физик, (род. 1927 г) – основатель синергетики – науки, изучающей самоорганизацию в сложных, сильнонеравновесных системах любой природы. Эволюционно-синергетическая парадигма: социальные, физико-химические и биологические объекты подчиняются в своем развитии одним и тем же фундаментальным законам. Любой объект проходит три стадии: 1. Рождение (самоорганизация). 2. Развитие (смена упорядоченных форм). 3. Распад (переход к неупорядоченному равновесному состоянию). КСЕ
Эволюционно-синергетическая парадигма Герман Хакен, немецкий физик, (род. 1927 г) – основатель синергетики – науки, изучающей самоорганизацию в сложных, сильнонеравновесных системах любой природы. Эволюционно-синергетическая парадигма: социальные, физико-химические и биологические объекты подчиняются в своем развитии одним и тем же фундаментальным законам. Любой объект проходит три стадии: 1. Рождение (самоорганизация). 2. Развитие (смена упорядоченных форм). 3. Распад (переход к неупорядоченному равновесному состоянию). КСЕ


