7_Hal-galogenopr_spirty_Sn_2014.pptx
- Количество слайдов: 80
 № 7. Нуклеофильное замещение у насыщенного атома углерода, SN у Csp 3 1
№ 7. Нуклеофильное замещение у насыщенного атома углерода, SN у Csp 3 1
 ОСОБЕННОСТИ СТРОЕНИЯ и РЕАКЦИОННОЙ СПОСОБНОСТИ ГАЛОГЕНо. ПРОИЗВОДНЫХ 2
ОСОБЕННОСТИ СТРОЕНИЯ и РЕАКЦИОННОЙ СПОСОБНОСТИ ГАЛОГЕНо. ПРОИЗВОДНЫХ 2
 Моногалогенопроизводные углеводородов 3
Моногалогенопроизводные углеводородов 3
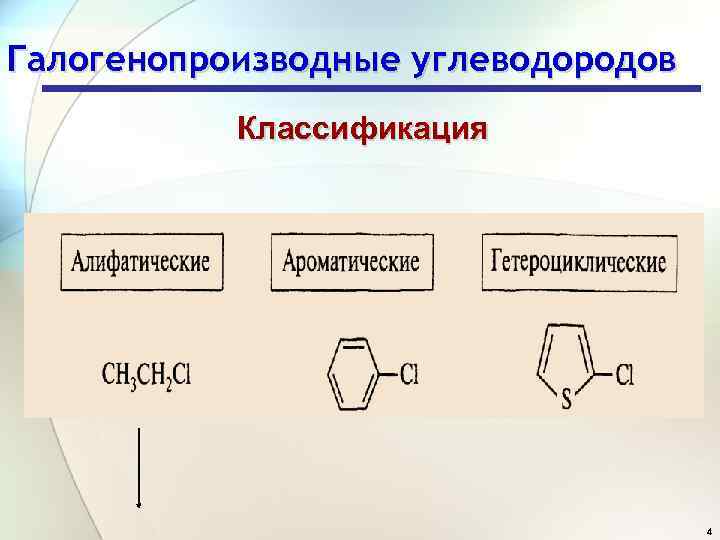 Галогенопроизводные углеводородов Классификация 4
Галогенопроизводные углеводородов Классификация 4
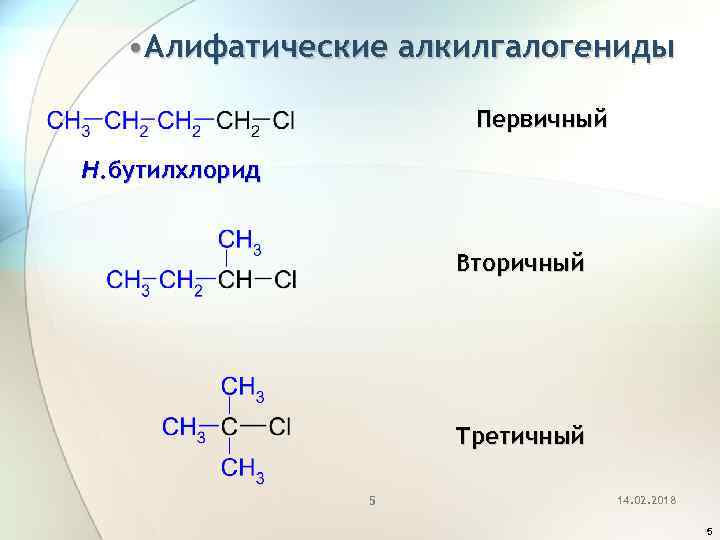 • Алифатические алкилгалогениды Первичный Н. бутилхлорид Вторичный Третичный 5 14. 02. 2018 5
• Алифатические алкилгалогениды Первичный Н. бутилхлорид Вторичный Третичный 5 14. 02. 2018 5
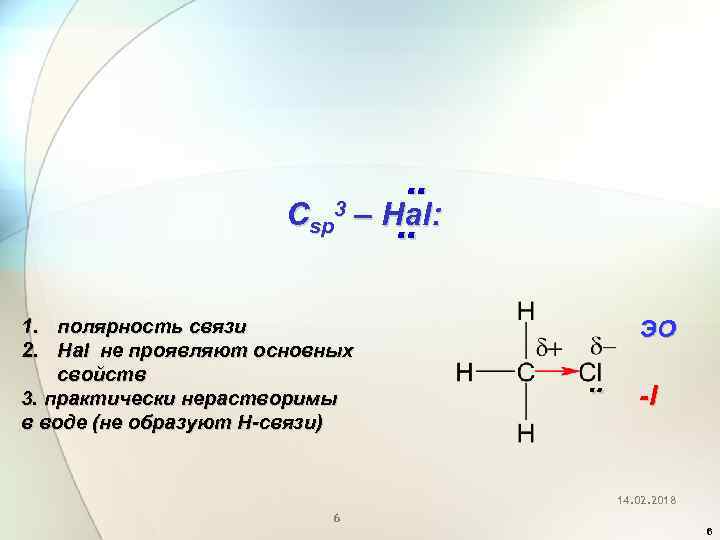 Csp 3 – Hal: 1. полярность связи 2. Hal не проявляют основных свойств 3. практически нерастворимы в воде (не образуют Н-связи) ЭО -I 14. 02. 2018 6 6
Csp 3 – Hal: 1. полярность связи 2. Hal не проявляют основных свойств 3. практически нерастворимы в воде (не образуют Н-связи) ЭО -I 14. 02. 2018 6 6
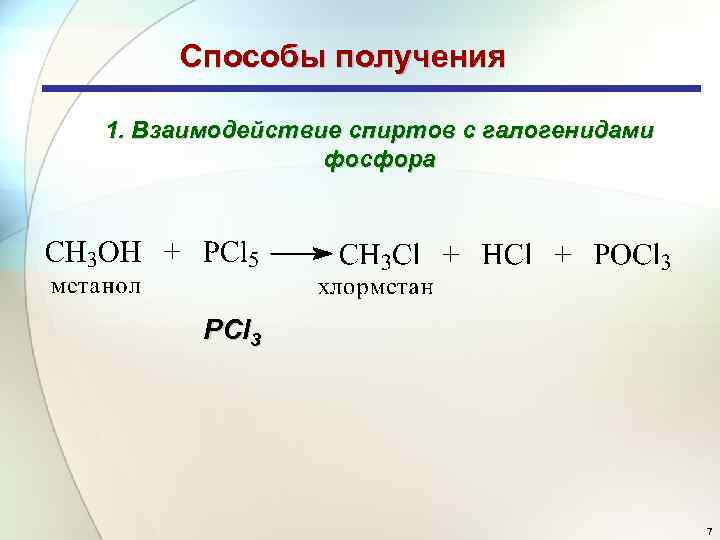 Способы получения 1. Взаимодействие спиртов с галогенидами фосфора PCl 3 7
Способы получения 1. Взаимодействие спиртов с галогенидами фосфора PCl 3 7
 Способы получения 2. Взаимодействие спиртов с тионилхлоридом 8
Способы получения 2. Взаимодействие спиртов с тионилхлоридом 8
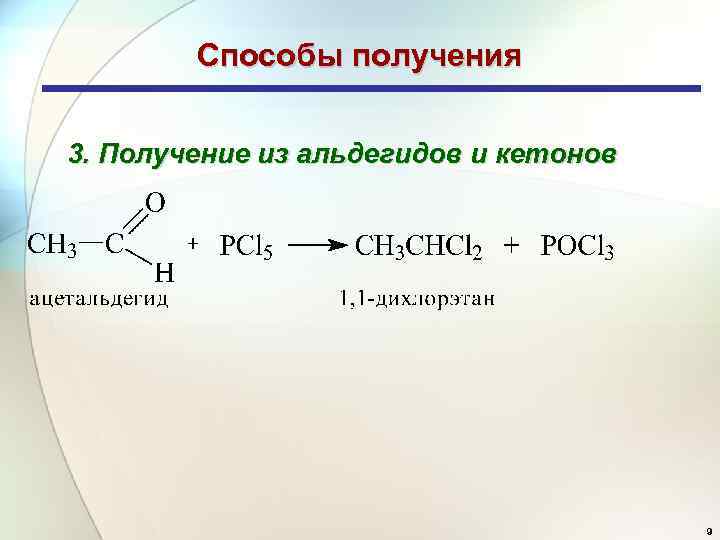 Способы получения 3. Получение из альдегидов и кетонов 9
Способы получения 3. Получение из альдегидов и кетонов 9
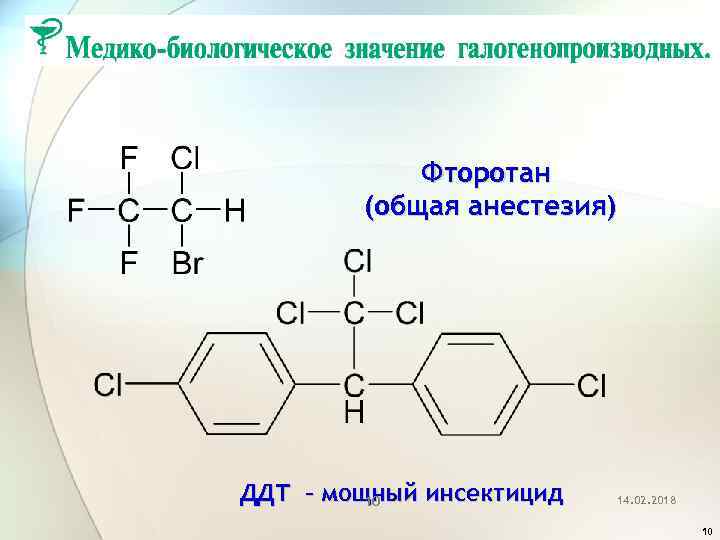 Фторотан (общая анестезия) ДДТ – мощный инсектицид 10 14. 02. 2018 10
Фторотан (общая анестезия) ДДТ – мощный инсектицид 10 14. 02. 2018 10
 Соединения с гидроксильной группой и их производные. 11
Соединения с гидроксильной группой и их производные. 11
 Одноатомные спирты и фенолы 12
Одноатомные спирты и фенолы 12
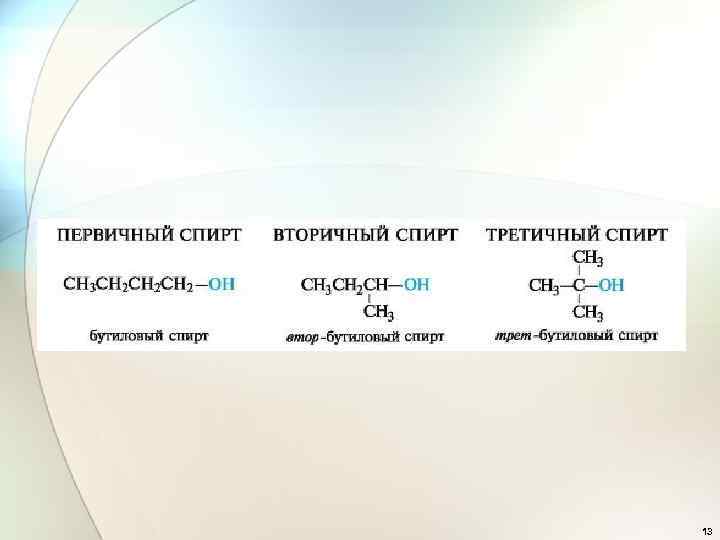 13
13
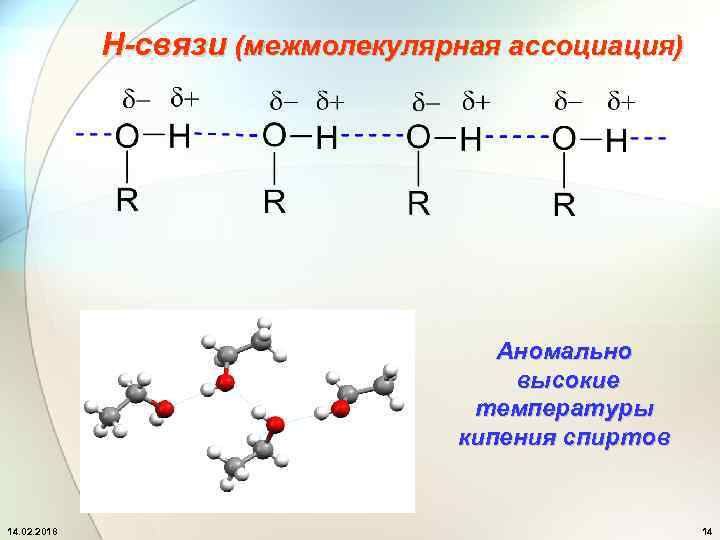 Н-связи (межмолекулярная ассоциация) Аномально высокие температуры кипения спиртов 14. 02. 2018 14
Н-связи (межмолекулярная ассоциация) Аномально высокие температуры кипения спиртов 14. 02. 2018 14
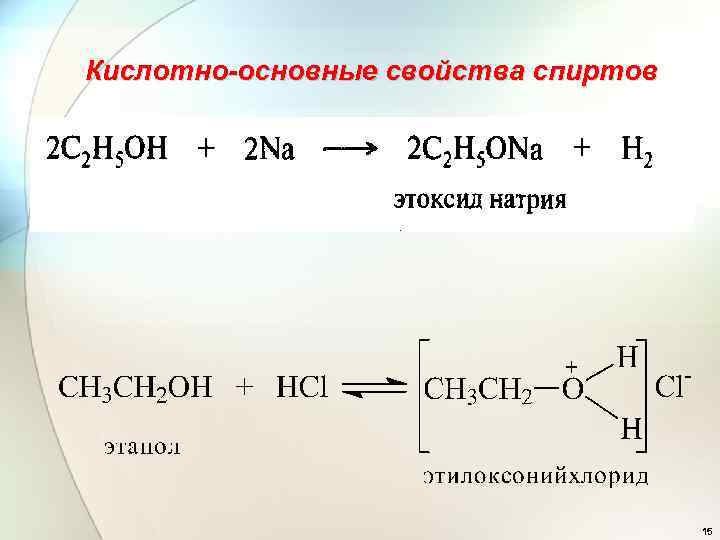 Кислотно-основные свойства спиртов 15
Кислотно-основные свойства спиртов 15
 Метиловый спирт считается самым ядовитым спиртом. Вызывает слепоту или смерть. 14. 02. 2018 16
Метиловый спирт считается самым ядовитым спиртом. Вызывает слепоту или смерть. 14. 02. 2018 16
 • Токсическое действие метанола связано с угнетением центральной нервной системы, развитием тяжелого метаболического ацидоза, поражением сетчатки глаза и дистрофией зрительного нерва. • Летальная доза приёме внутрь — 100 мл (без предварительного приёма этанола). Клиника интоксикации • Опьянение выражено слабо. Метиловый спирт обычно вызывает алкогольное оглушение без типичного опьянения. Далее наступает латентный период, который длится в среднем 12 -24 часа (от 1 часа до 40 часов). • С окончанием латентного периода усиливаются симптомы интоксикации — тошнота, рвота, боли в животе, головная боль, головокружение, боль в икроножных мышцах. Нарушается зрение (снижение остроты зрения, неясность видения, мелькание «мушек» перед глазами, диплопия, слепота); отмечаются мидриаз и ослабленная реакция зрачков на свет. • Сознание спутано, возможно психомоторное возбуждение или кома, судороги или гипертонус мышц конечностей. Развивается быстропрогрессирующая острая сердечно-сосудистая недостаточность в сочетании с центральными нарушениями дыхания. Смерть наступает от остановки дыхания, отёка мозга. 14. 02. 2018 17
• Токсическое действие метанола связано с угнетением центральной нервной системы, развитием тяжелого метаболического ацидоза, поражением сетчатки глаза и дистрофией зрительного нерва. • Летальная доза приёме внутрь — 100 мл (без предварительного приёма этанола). Клиника интоксикации • Опьянение выражено слабо. Метиловый спирт обычно вызывает алкогольное оглушение без типичного опьянения. Далее наступает латентный период, который длится в среднем 12 -24 часа (от 1 часа до 40 часов). • С окончанием латентного периода усиливаются симптомы интоксикации — тошнота, рвота, боли в животе, головная боль, головокружение, боль в икроножных мышцах. Нарушается зрение (снижение остроты зрения, неясность видения, мелькание «мушек» перед глазами, диплопия, слепота); отмечаются мидриаз и ослабленная реакция зрачков на свет. • Сознание спутано, возможно психомоторное возбуждение или кома, судороги или гипертонус мышц конечностей. Развивается быстропрогрессирующая острая сердечно-сосудистая недостаточность в сочетании с центральными нарушениями дыхания. Смерть наступает от остановки дыхания, отёка мозга. 14. 02. 2018 17
 Спирты Этанол Физические свойства CH 3 CH 2 OH J Bump 18
Спирты Этанол Физические свойства CH 3 CH 2 OH J Bump 18
 • Этиловый спирт оказывает опьяняющее действие. Злоупотребление этанолом ведёт к развитию алкоголизма, деградации личности психическим расстройствам и соматическим заболеваниям! 14. 02. 2018 19
• Этиловый спирт оказывает опьяняющее действие. Злоупотребление этанолом ведёт к развитию алкоголизма, деградации личности психическим расстройствам и соматическим заболеваниям! 14. 02. 2018 19
 - В высоких концентрациях этанол оказывает анестезирующее действие. - Используется для приготовления настоек и в качестве антисептического средства. 14. 02. 2018 20
- В высоких концентрациях этанол оказывает анестезирующее действие. - Используется для приготовления настоек и в качестве антисептического средства. 14. 02. 2018 20
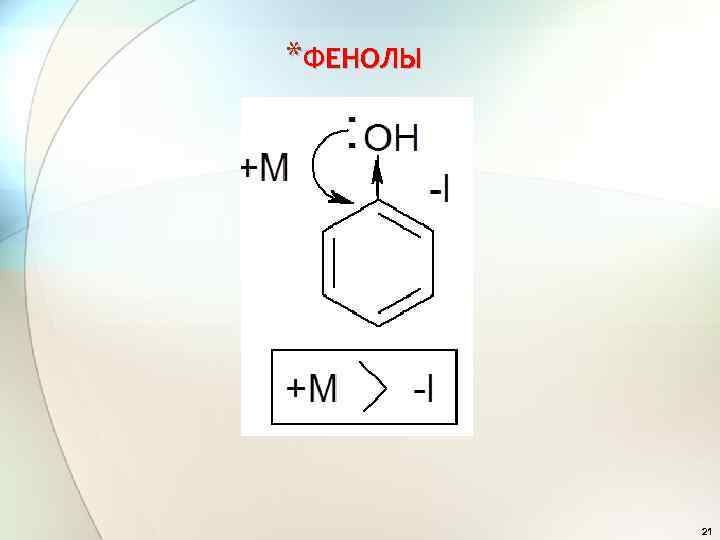 *ФЕНОЛЫ 21
*ФЕНОЛЫ 21
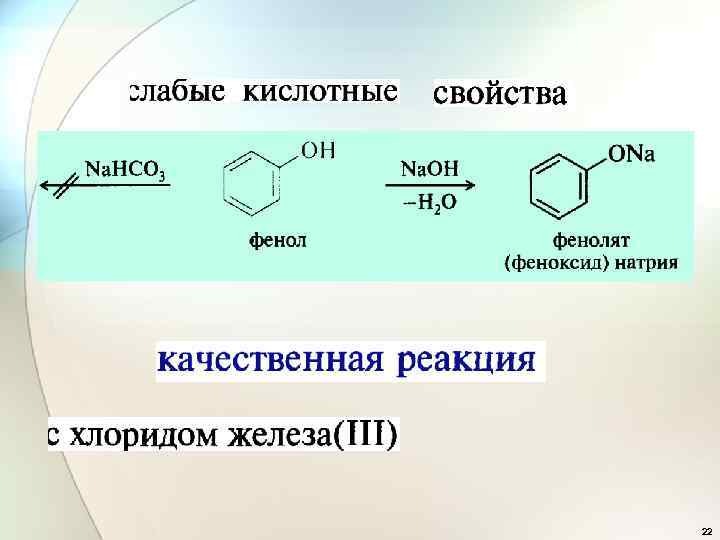 22
22
 *Фенол очень токсичен, при попадании на кожу вызывает ожоги. Фенол обладает хорошими дезинфицирующими свойствами; это было первое вещество, которое использовалось для дезинфекции (Дж. Листер, 1867) *Фенолы входят в состав креозота – жидкости, получаемой из каменноугольной смолы и используемой для пропитки шпал для предотвращения их гниения. Очищенный креозот используется как антисептик в медицине. *Пентахлорфенол применяется для пропитки древесины как антисептик, инсектицид и фунгицид. Пентахлорфенолятом натрия обработаны брёвна Кижских церквей. 23
*Фенол очень токсичен, при попадании на кожу вызывает ожоги. Фенол обладает хорошими дезинфицирующими свойствами; это было первое вещество, которое использовалось для дезинфекции (Дж. Листер, 1867) *Фенолы входят в состав креозота – жидкости, получаемой из каменноугольной смолы и используемой для пропитки шпал для предотвращения их гниения. Очищенный креозот используется как антисептик в медицине. *Пентахлорфенол применяется для пропитки древесины как антисептик, инсектицид и фунгицид. Пентахлорфенолятом натрия обработаны брёвна Кижских церквей. 23
 24
24
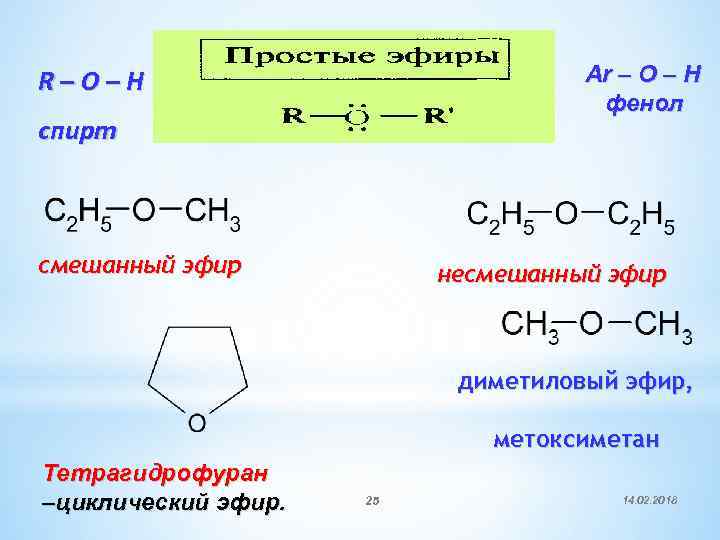 Ar – O – H фенол R–O–H спирт смешанный эфир несмешанный эфир диметиловый эфир, метоксиметан Тетрагидрофуран –циклический эфир. 25 14. 02. 2018
Ar – O – H фенол R–O–H спирт смешанный эфир несмешанный эфир диметиловый эфир, метоксиметан Тетрагидрофуран –циклический эфир. 25 14. 02. 2018
 *Основные свойства простых эфиров. слабые нейтральные n - основания конц. 26 14. 02. 2018
*Основные свойства простых эфиров. слабые нейтральные n - основания конц. 26 14. 02. 2018
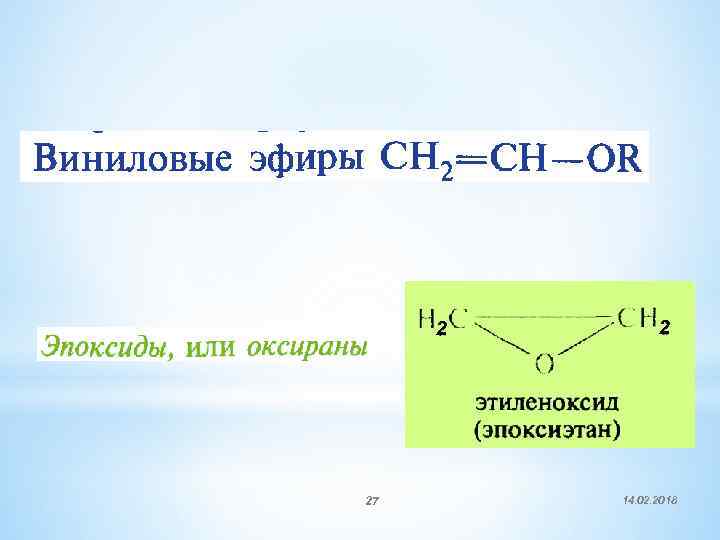 2 27 2 14. 02. 2018
2 27 2 14. 02. 2018
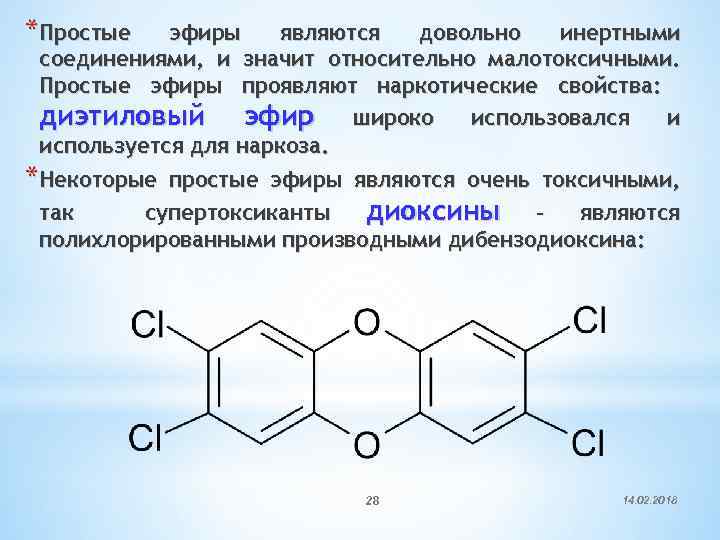 *Простые эфиры являются довольно инертными соединениями, и значит относительно малотоксичными. Простые эфиры проявляют наркотические свойства: диэтиловый эфир широко использовался и используется для наркоза. *Некоторые простые эфиры являются очень токсичными, так супертоксиканты диоксины – являются полихлорированными производными дибензодиоксина: 28 14. 02. 2018
*Простые эфиры являются довольно инертными соединениями, и значит относительно малотоксичными. Простые эфиры проявляют наркотические свойства: диэтиловый эфир широко использовался и используется для наркоза. *Некоторые простые эфиры являются очень токсичными, так супертоксиканты диоксины – являются полихлорированными производными дибензодиоксина: 28 14. 02. 2018
 Ранозаживляющее средство ВИНИЛИН - «бальзам Щостаковского» поливинилбутиловый эфир CH 3 CH 2 CH 2 – 0 – CH = CH 2 Обладает противомикробным действием, способствует очищению ран, регенерации тканей и эпителизации. При приеме внутрь действует как обволакивающее, противовоспалительное и бактериостатическое средство. 29 14. 02. 2018
Ранозаживляющее средство ВИНИЛИН - «бальзам Щостаковского» поливинилбутиловый эфир CH 3 CH 2 CH 2 – 0 – CH = CH 2 Обладает противомикробным действием, способствует очищению ран, регенерации тканей и эпителизации. При приеме внутрь действует как обволакивающее, противовоспалительное и бактериостатическое средство. 29 14. 02. 2018
 R–O–H спирт Ar – O – H фенол R-O-R R-O-O-R Простые Пероксиды эфиры H 2 S 30 14. 02. 2018
R–O–H спирт Ar – O – H фенол R-O-R R-O-O-R Простые Пероксиды эфиры H 2 S 30 14. 02. 2018
 Достаточно высокая кислотность: практически не обладают основными свойствами 31 14. 02. 2018
Достаточно высокая кислотность: практически не обладают основными свойствами 31 14. 02. 2018
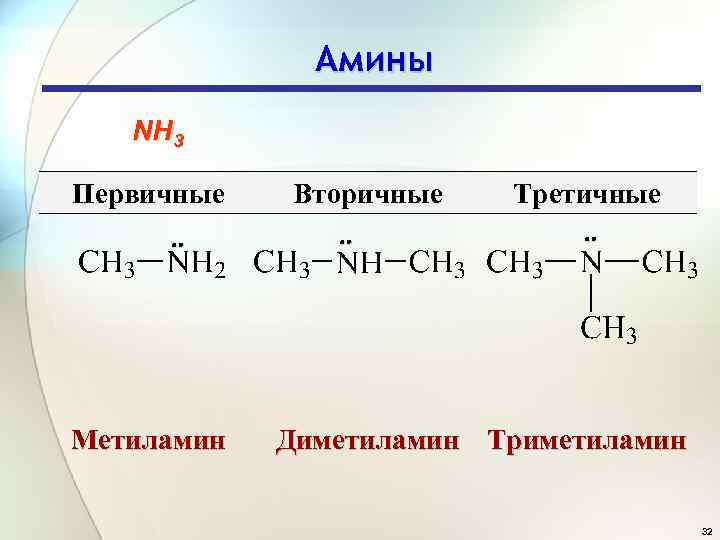 Амины NH 3 Первичные Метиламин Вторичные Третичные Диметиламин Триметиламин 32
Амины NH 3 Первичные Метиламин Вторичные Третичные Диметиламин Триметиламин 32
 сильное основание 33
сильное основание 33
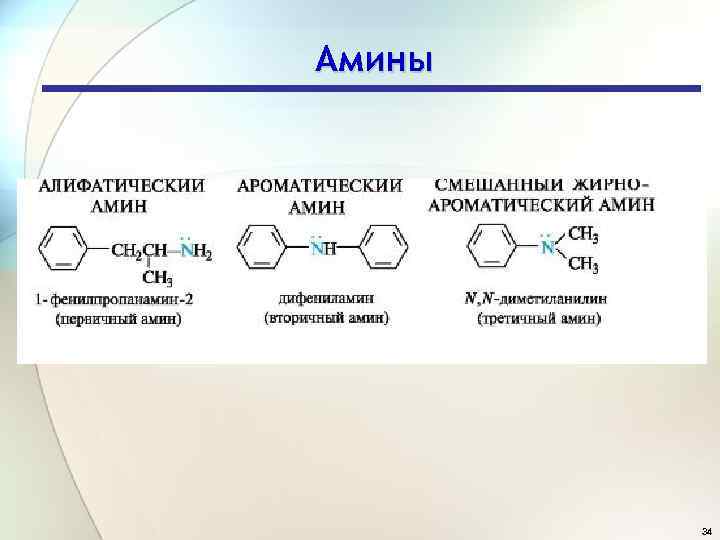 Амины 34
Амины 34
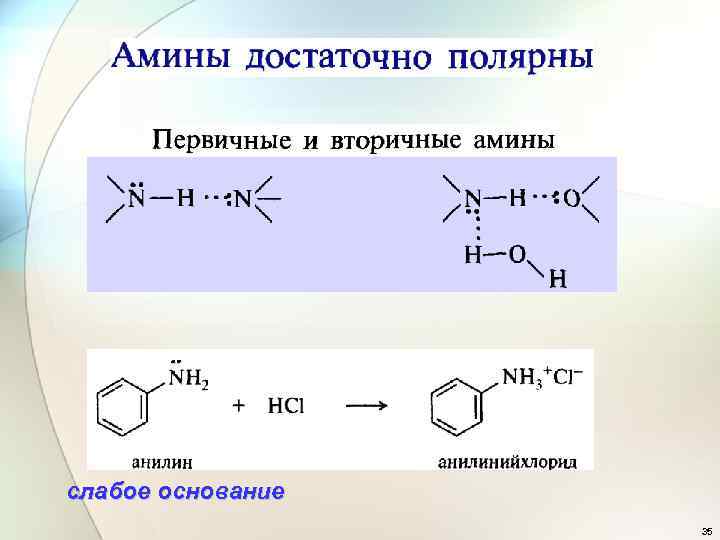 слабое основание 35
слабое основание 35
 36
36
 Общие закономерности реакций нуклеофильного замещения, SN 37
Общие закономерности реакций нуклеофильного замещения, SN 37
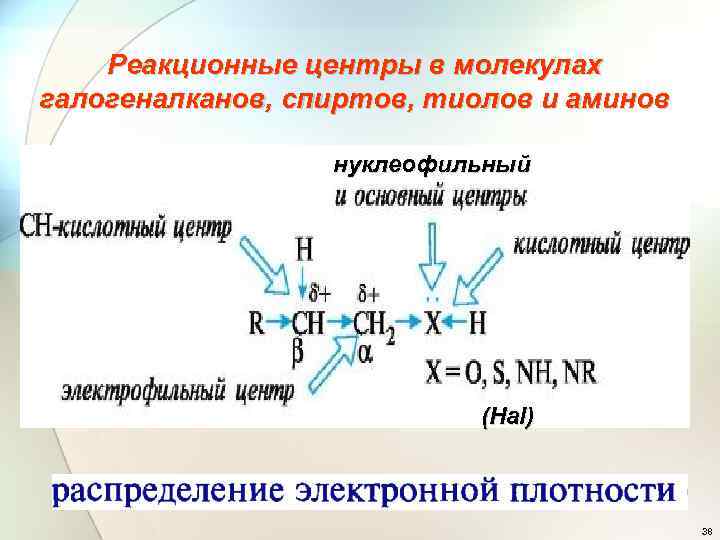 Реакционные центры в молекулах галогеналканов, спиртов, тиолов и аминов нуклеофильный (Hal) 38
Реакционные центры в молекулах галогеналканов, спиртов, тиолов и аминов нуклеофильный (Hal) 38
 Реакции нуклеофильного замещения SN . (от англ. substitution nucleophilic). δ+ - R X + Nu Субстрат Нуклеофил (реагент) - R Nu + X. Продукт Уходящая реакции группа 39
Реакции нуклеофильного замещения SN . (от англ. substitution nucleophilic). δ+ - R X + Nu Субстрат Нуклеофил (реагент) - R Nu + X. Продукт Уходящая реакции группа 39
 Бимолекулярное нуклеофильное замещение, SN 2 _ δ+ R X + Nu Субстрат 1. Нуклеофил (реагент) R Nu + X _ Уходящая Продукт реакции группа Кинетический признак _ • v = k RX ] [ Nu ] скорость реакции 40
Бимолекулярное нуклеофильное замещение, SN 2 _ δ+ R X + Nu Субстрат 1. Нуклеофил (реагент) R Nu + X _ Уходящая Продукт реакции группа Кинетический признак _ • v = k RX ] [ Nu ] скорость реакции 40
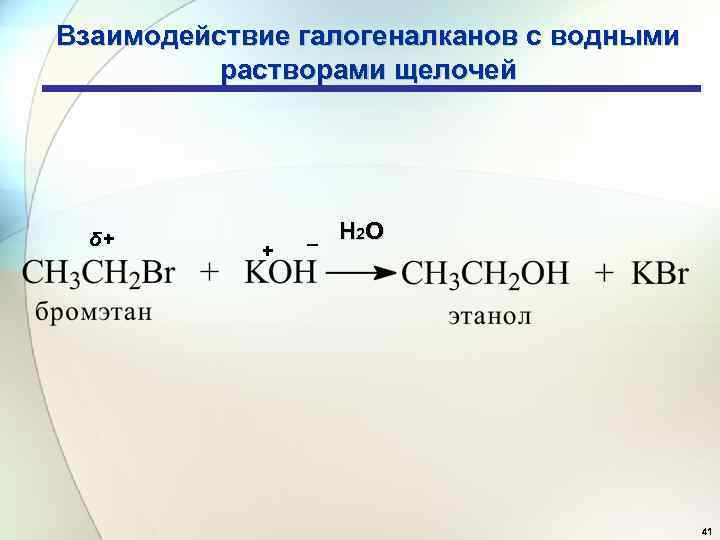 Взаимодействие галогеналканов с водными растворами щелочей δ+ + _ Н 2 О 41
Взаимодействие галогеналканов с водными растворами щелочей δ+ + _ Н 2 О 41
 Согласованный , синхронный механизм (ассоциативный). «атака с тыла» ПС 42
Согласованный , синхронный механизм (ассоциативный). «атака с тыла» ПС 42
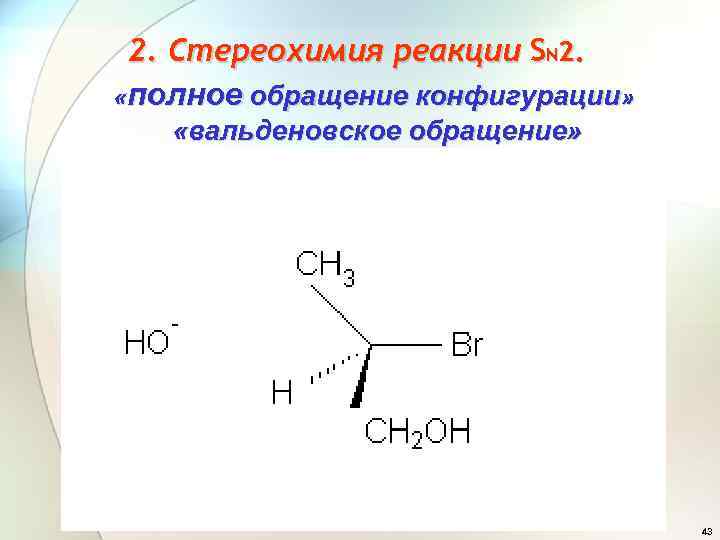 2. Стереохимия реакции SN 2. «полное обращение конфигурации» «вальденовское обращение» 43
2. Стереохимия реакции SN 2. «полное обращение конфигурации» «вальденовское обращение» 43
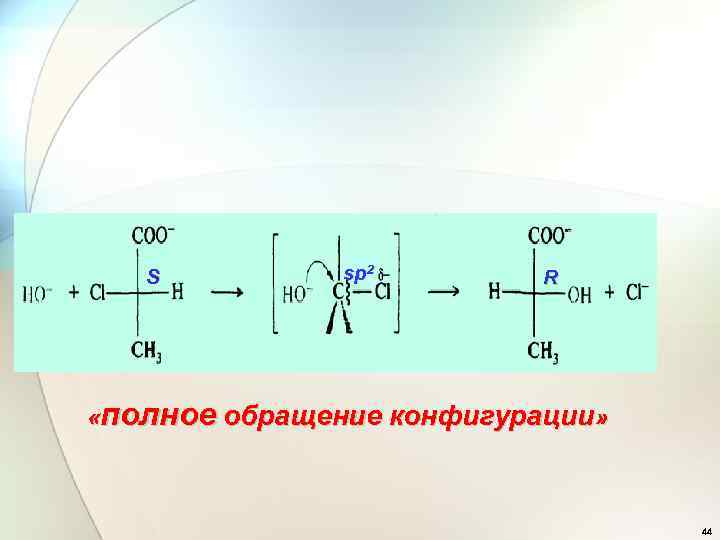 S sp 2 R «полное обращение конфигурации» 44
S sp 2 R «полное обращение конфигурации» 44
 3. Влияние степени замещения реакционного центра. Относительные скорости реакции SN 2: стерические препятствия первич Субстраты > втор. > трет. СН 3 Х и RСН 2 Х первич. галогеналканы 45
3. Влияние степени замещения реакционного центра. Относительные скорости реакции SN 2: стерические препятствия первич Субстраты > втор. > трет. СН 3 Х и RСН 2 Х первич. галогеналканы 45
 трет. галогеналкан 46
трет. галогеналкан 46
 • 4. Влияние растворителя. • Нужен неполярный растворитель! Nu Сольватация анионов и молекул с неподелёнными электронными парами понижает их нуклеофильность и реакционную способность 47
• 4. Влияние растворителя. • Нужен неполярный растворитель! Nu Сольватация анионов и молекул с неподелёнными электронными парами понижает их нуклеофильность и реакционную способность 47
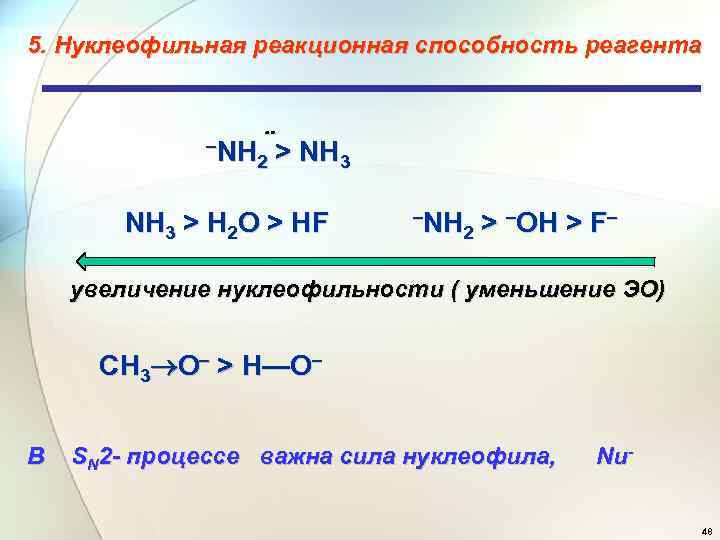 5. Нуклеофильная реакционная способность реагента –NH 2 > NH 3 > H 2 O > HF –NH 2 > –OH > F– увеличение нуклеофильности ( уменьшение ЭО) CH 3 O– > H—O– В SN 2 - процессе важна сила нуклеофила, Nu 48
5. Нуклеофильная реакционная способность реагента –NH 2 > NH 3 > H 2 O > HF –NH 2 > –OH > F– увеличение нуклеофильности ( уменьшение ЭО) CH 3 O– > H—O– В SN 2 - процессе важна сила нуклеофила, Nu 48
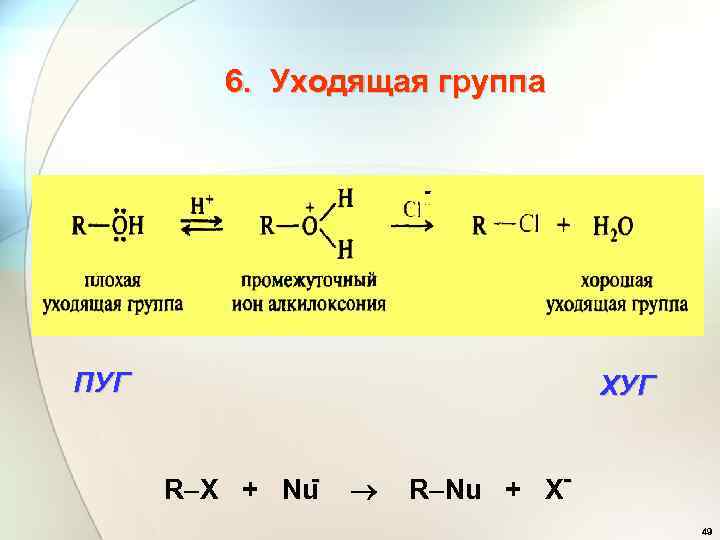 6. Уходящая группа - ПУГ ХУГ R X + Nu R Nu + X 49
6. Уходящая группа - ПУГ ХУГ R X + Nu R Nu + X 49
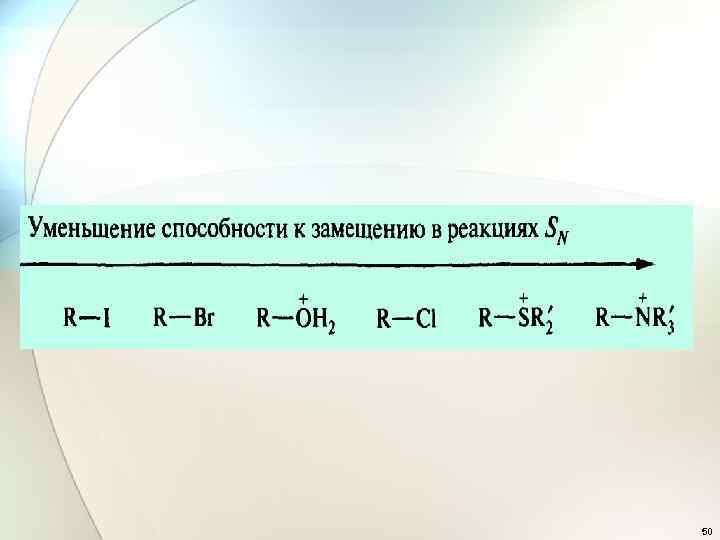 50
50
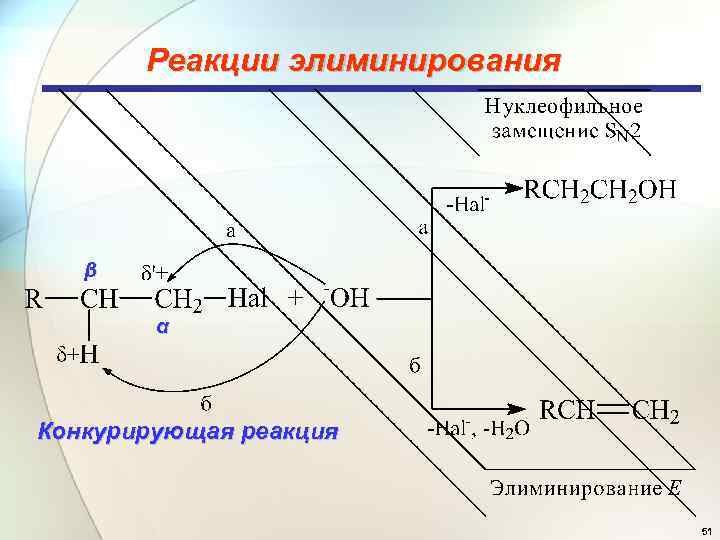 Реакции элиминирования β α Конкурирующая реакция 51
Реакции элиминирования β α Конкурирующая реакция 51
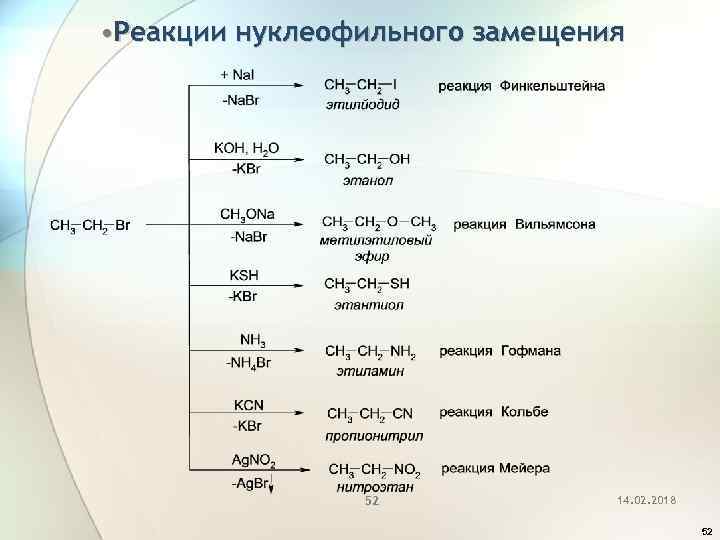 • Реакции нуклеофильного замещения 52 14. 02. 2018 52
• Реакции нуклеофильного замещения 52 14. 02. 2018 52
 Мономолекулярное нуклеофильное замещение, SN 1 (асинхронный механизм, диссоциативный) а - R X + Nu 1. R Nu + X - Кинетический признак • v = k RX 53
Мономолекулярное нуклеофильное замещение, SN 1 (асинхронный механизм, диссоциативный) а - R X + Nu 1. R Nu + X - Кинетический признак • v = k RX 53
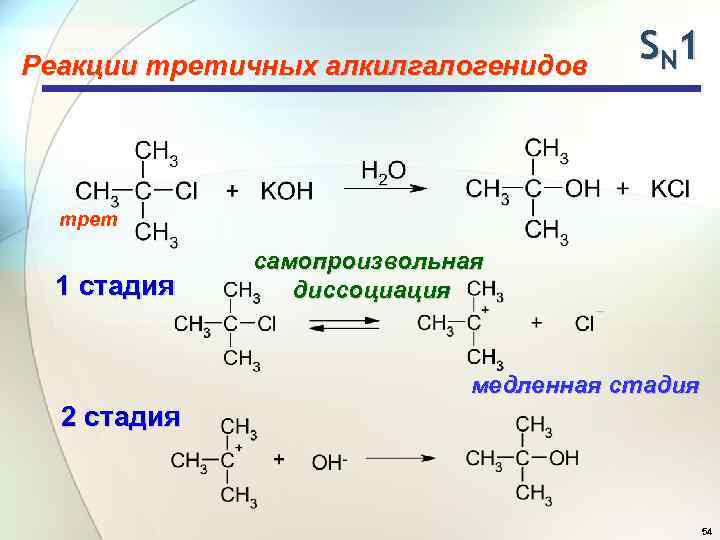 Реакции третичных алкилгалогенидов SN 1 трет 1 стадия самопроизвольная диссоциация медленная стадия 2 стадия 54
Реакции третичных алкилгалогенидов SN 1 трет 1 стадия самопроизвольная диссоциация медленная стадия 2 стадия 54
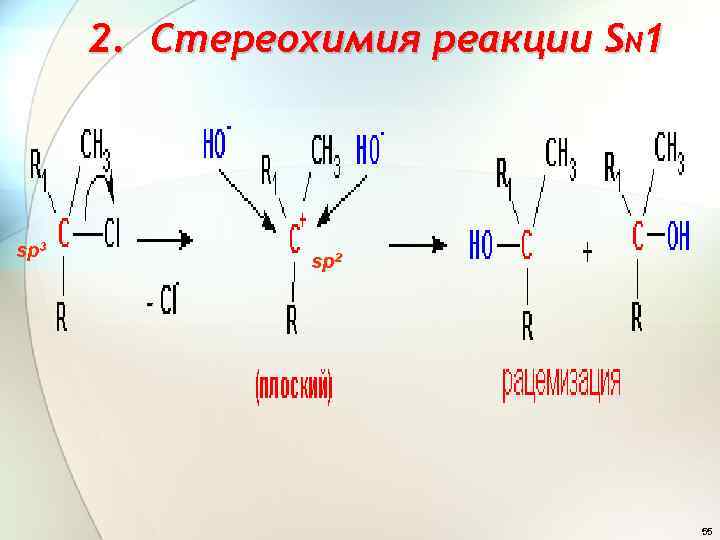 2. Cтереохимия реакции SN 1 sp 3 sp 2 - 55
2. Cтереохимия реакции SN 1 sp 3 sp 2 - 55
 3. Влияние R в субстрате стабильность возникающего карбкатиона возможность перегруппировок R+ 56
3. Влияние R в субстрате стабильность возникающего карбкатиона возможность перегруппировок R+ 56
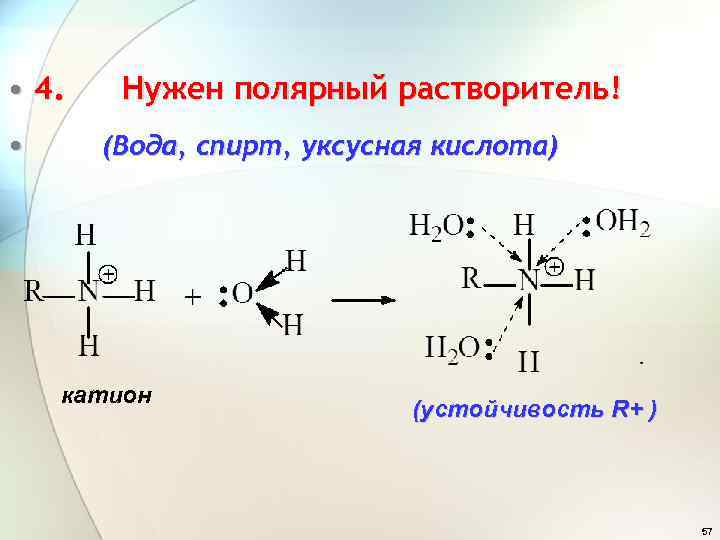 • 4. • Нужен полярный растворитель! (Вода, спирт, уксусная кислота) катион (устойчивость R+ ) 57
• 4. • Нужен полярный растворитель! (Вода, спирт, уксусная кислота) катион (устойчивость R+ ) 57
 • 5. Сила нуклеофила – не влияет • ( нейтральные реагенты C 2 H 5 OH ) 58
• 5. Сила нуклеофила – не влияет • ( нейтральные реагенты C 2 H 5 OH ) 58
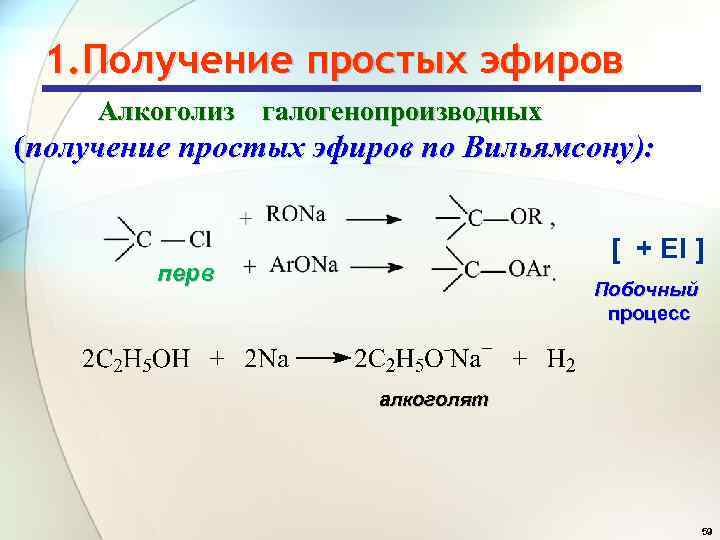 1. Получение простых эфиров Алкоголиз галогенопроизводных (получение простых эфиров по Вильямсону): [ + El ] перв Побочный процесс алкоголят 59
1. Получение простых эфиров Алкоголиз галогенопроизводных (получение простых эфиров по Вильямсону): [ + El ] перв Побочный процесс алкоголят 59
 2. Аминолиз галогенопроизводных Алкилирование аминов (реакция Гофмана, 1850) Гофман Фридрих 19. 02. 1660 - 12. 11. 1742, Галле 60
2. Аминолиз галогенопроизводных Алкилирование аминов (реакция Гофмана, 1850) Гофман Фридрих 19. 02. 1660 - 12. 11. 1742, Галле 60
 Амины основание Реагентнуклеофил 61
Амины основание Реагентнуклеофил 61
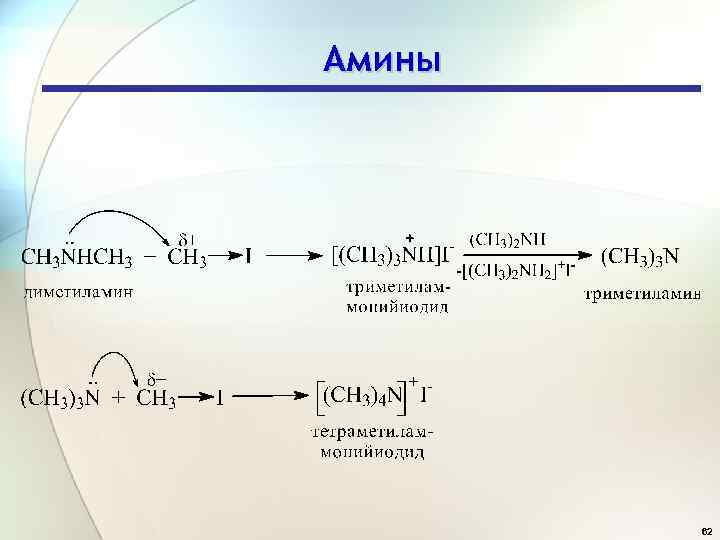 Амины 62
Амины 62
 3. Взаимодействие галогеналканов с цианидами 63
3. Взаимодействие галогеналканов с цианидами 63
 4. Гидролиз галогенопроизводных (получение спиртов): • RCl +H 2 O + KOH ROH + KCl + H 2 O. 64
4. Гидролиз галогенопроизводных (получение спиртов): • RCl +H 2 O + KOH ROH + KCl + H 2 O. 64
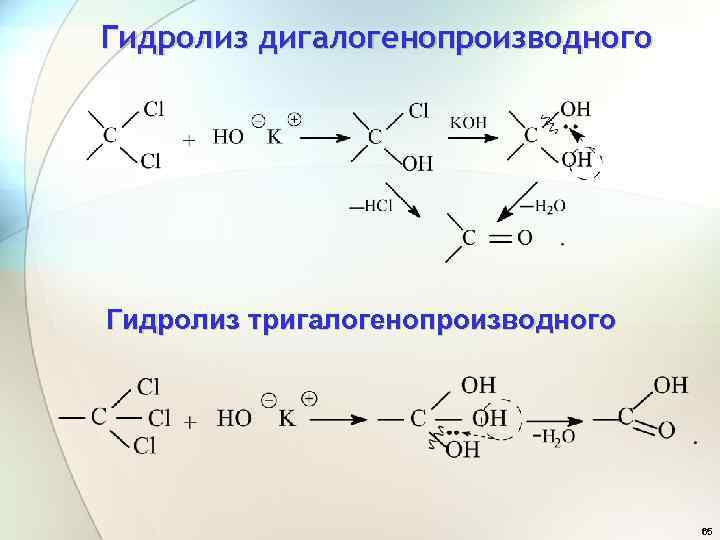 Гидролиз дигалогенопроизводного Гидролиз тригалогенопроизводного 65
Гидролиз дигалогенопроизводного Гидролиз тригалогенопроизводного 65
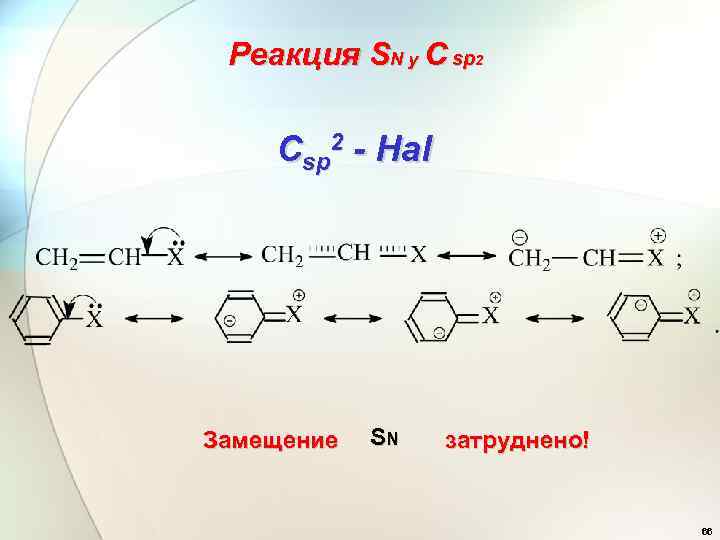 Реакция SN у C sp 2 Csp 2 - Hal Замещение SN затруднено! 66
Реакция SN у C sp 2 Csp 2 - Hal Замещение SN затруднено! 66
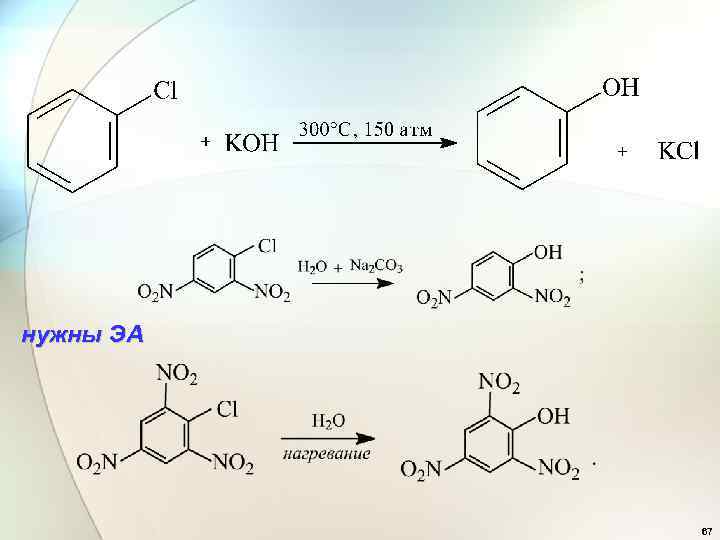 нужны ЭА 67
нужны ЭА 67
 6. Замещение на карбоксилат-анион (получение сложных эфиров): RHal + R'COO Na+ R OCOR' + Na. Hal. 7. Замещение на нуклеофильную серу: а) получение тиолов: ОН - RHal + H 2 S RSH + HHal; б) получение тиоэфиров: RHal + Na. SR 1 алкилтиолят натрия RSR 1 + Na. Hal. тиоэфир 68
6. Замещение на карбоксилат-анион (получение сложных эфиров): RHal + R'COO Na+ R OCOR' + Na. Hal. 7. Замещение на нуклеофильную серу: а) получение тиолов: ОН - RHal + H 2 S RSH + HHal; б) получение тиоэфиров: RHal + Na. SR 1 алкилтиолят натрия RSR 1 + Na. Hal. тиоэфир 68
 8. Замещение одного галогена на другой, более нуклеофильный ацетон RBr (RCl) + Na. J RJ + Na. Br (Na. Cl). нуклеофильность реагента J Br Cl F качество уходящей группы 69
8. Замещение одного галогена на другой, более нуклеофильный ацетон RBr (RCl) + Na. J RJ + Na. Br (Na. Cl). нуклеофильность реагента J Br Cl F качество уходящей группы 69
 Реакции спиртов 1. Замещение на галогенид-анион (получение алкилгалогенидов): ROH + HHal RHal + H 2 O Реакционная способность субстрата R 3 COH R 2 CHOH RCH 2 OH Активность галогеноводородов HCl HBr 70
Реакции спиртов 1. Замещение на галогенид-анион (получение алкилгалогенидов): ROH + HHal RHal + H 2 O Реакционная способность субстрата R 3 COH R 2 CHOH RCH 2 OH Активность галогеноводородов HCl HBr 70
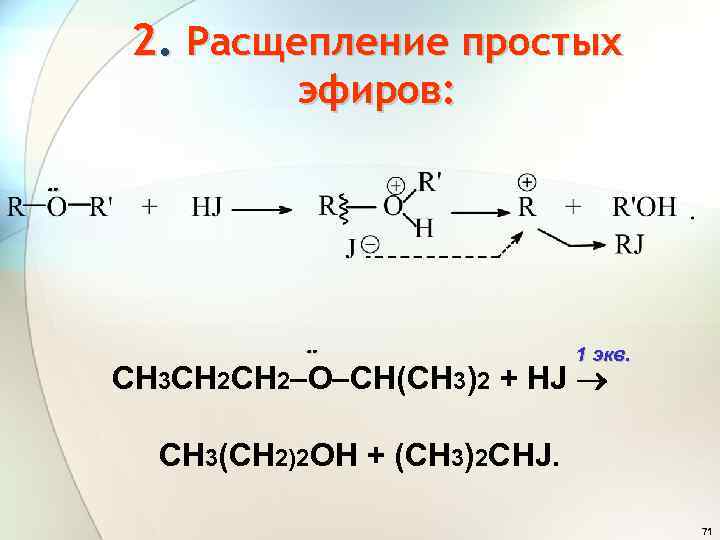 2. Расщепление простых эфиров: 1 экв. СН 3 СН 2 О СН(СН 3)2 + HJ CН 3(СH 2)2 OH + (CH 3)2 CHJ. 71
2. Расщепление простых эфиров: 1 экв. СН 3 СН 2 О СН(СН 3)2 + HJ CН 3(СH 2)2 OH + (CH 3)2 CHJ. 71
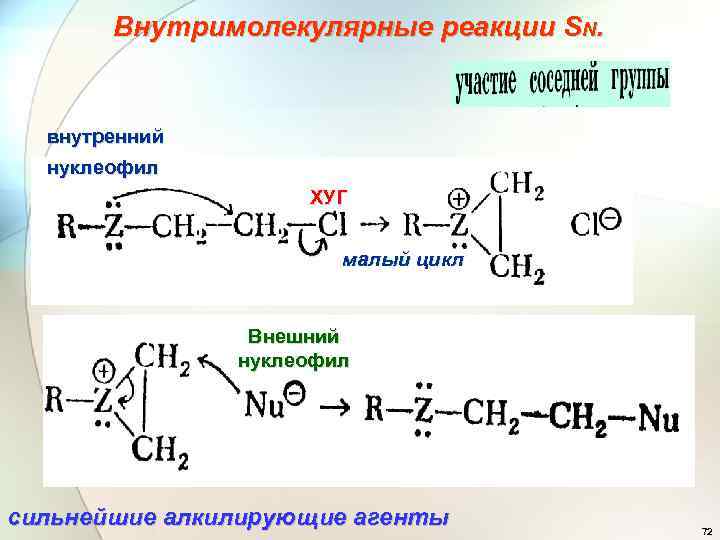 Внутримолекулярные реакции SN. внутренний нуклеофил ХУГ малый цикл Внешний нуклеофил сильнейшие алкилирующие агенты 72
Внутримолекулярные реакции SN. внутренний нуклеофил ХУГ малый цикл Внешний нуклеофил сильнейшие алкилирующие агенты 72
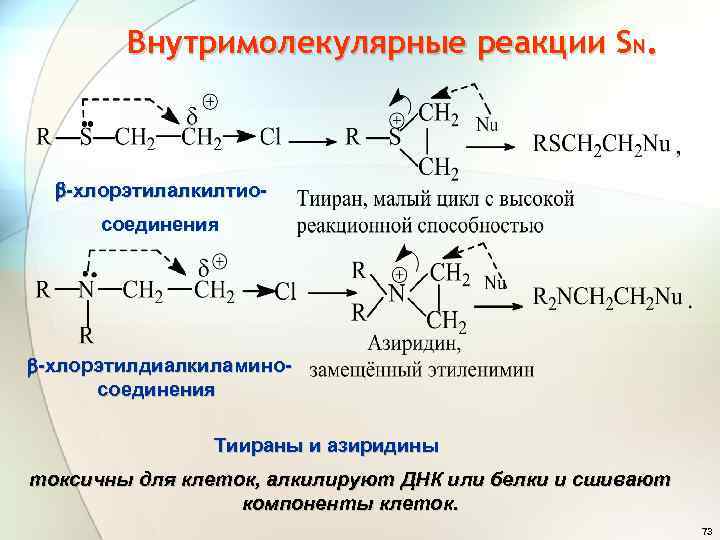 Внутримолекулярные реакции SN. -хлорэтилалкилтио- соединения -хлорэтилдиалкиламиносоединения Тиираны и азиридины токсичны для клеток, алкилируют ДНК или белки и сшивают компоненты клеток. 73
Внутримолекулярные реакции SN. -хлорэтилалкилтио- соединения -хлорэтилдиалкиламиносоединения Тиираны и азиридины токсичны для клеток, алкилируют ДНК или белки и сшивают компоненты клеток. 73
 • Цитотокси ческие препараты или ческие цитоста тики, — это лекарственные тики препараты, общим свойством которых является способность тормозить, угнетать или блокировать рост и размножение клеток макроорганизмов (человека и многоклеточных животных). 74
• Цитотокси ческие препараты или ческие цитоста тики, — это лекарственные тики препараты, общим свойством которых является способность тормозить, угнетать или блокировать рост и размножение клеток макроорганизмов (человека и многоклеточных животных). 74
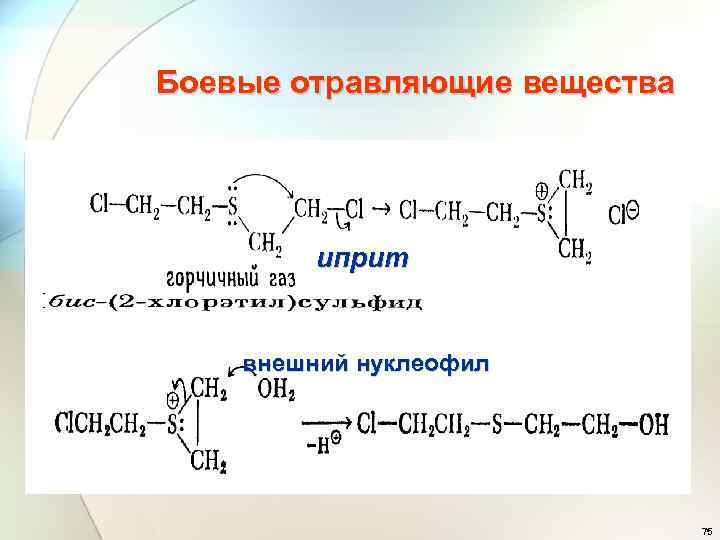 Боевые отравляющие вещества иприт внешний нуклеофил 75
Боевые отравляющие вещества иприт внешний нуклеофил 75
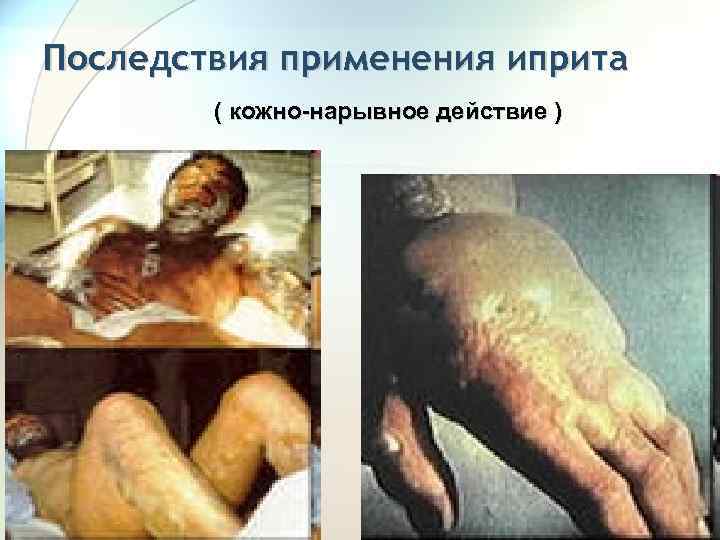 Последствия применения иприта ( кожно-нарывное действие ) 76
Последствия применения иприта ( кожно-нарывное действие ) 76
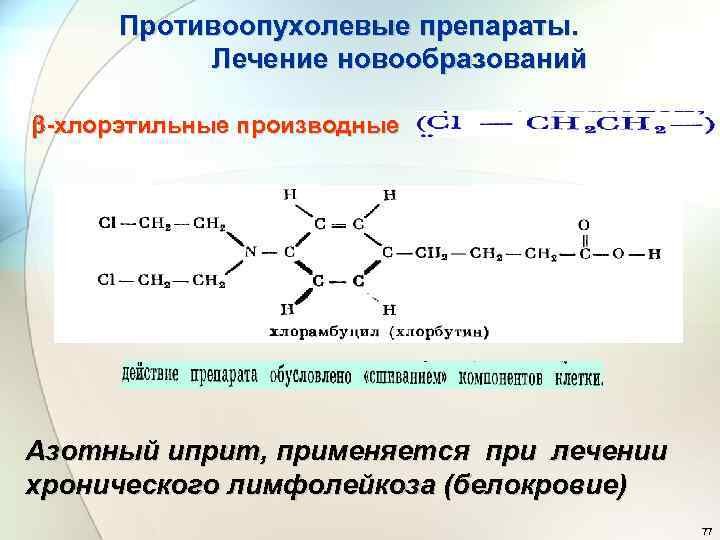 Противоопухолевые препараты. Лечение новообразований -хлорэтильные производные Азотный иприт, применяется при лечении хронического лимфолейкоза (белокровие) 77
Противоопухолевые препараты. Лечение новообразований -хлорэтильные производные Азотный иприт, применяется при лечении хронического лимфолейкоза (белокровие) 77
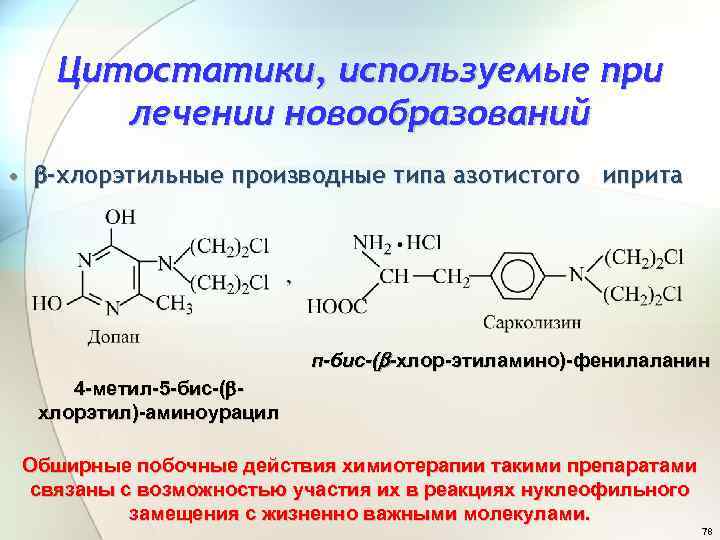 Цитостатики, используемые при лечении новообразований • -хлорэтильные производные типа азотистого иприта п-бис-( -хлор-этиламино)-фенилаланин 4 -метил-5 -бис-( хлорэтил)-аминоурацил Обширные побочные действия химиотерапии такими препаратами связаны с возможностью участия их в реакциях нуклеофильного замещения с жизненно важными молекулами. 78
Цитостатики, используемые при лечении новообразований • -хлорэтильные производные типа азотистого иприта п-бис-( -хлор-этиламино)-фенилаланин 4 -метил-5 -бис-( хлорэтил)-аминоурацил Обширные побочные действия химиотерапии такими препаратами связаны с возможностью участия их в реакциях нуклеофильного замещения с жизненно важными молекулами. 78
 Биологическое значение реакций SN R–OH спирт Фосфат-анион относится к хорошим уходящим группам. очень активные субстраты для последующих реакций SN 79
Биологическое значение реакций SN R–OH спирт Фосфат-анион относится к хорошим уходящим группам. очень активные субстраты для последующих реакций SN 79
 80
80


