6. ТЕРМОДИНАМИКА РАБОТА


6. ТЕРМОДИНАМИКА РАБОТА И ТЕПЛОПЕРЕДАЧА Найдем работу, совершаемую газом при изменении его объема. Рассмотрим газ, находящийся в цилиндрическом сосуде, и отделенный от атмосферы поршнем площадью S

Если газ, расширяясь, передвигает поршень на расстояние d. L, то он производит над ним работу: где d. V = S d. L - изменение объема газа. Полную работу А, совершаемую газом при изменении его объема от V 1 до V 2, найдем путем интегрирования:
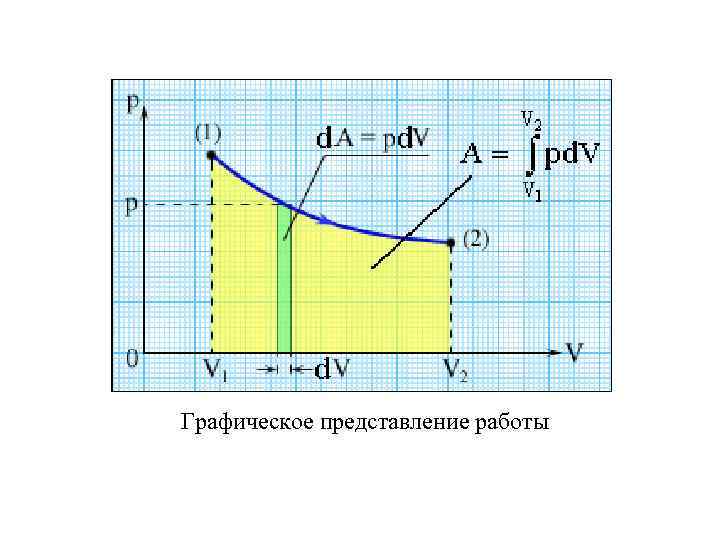
Графическое представление работы
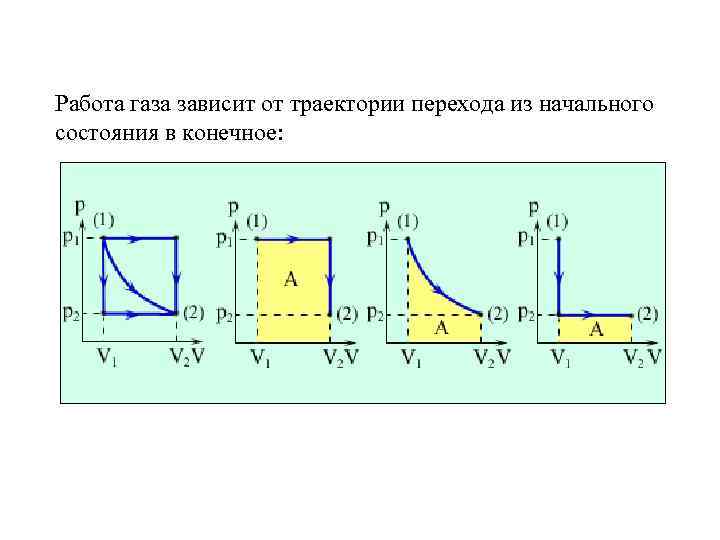
Работа газа зависит от траектории перехода из начального состояния в конечное:
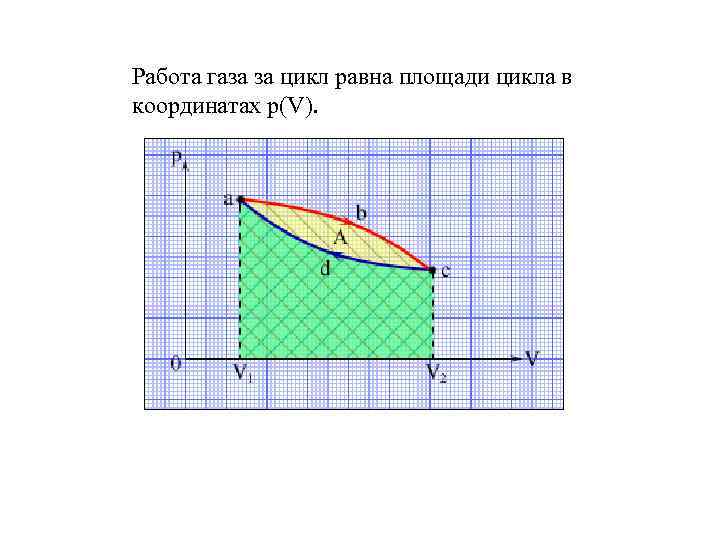
Работа газа за цикл равна площади цикла в координатах p(V).

Определим работу газа в ходе изопроцессов: Изобарный процесс: Изохорный процесс: А = 0

Изотермический процесс: p 1 V 1 = p 2 V 2

Теплопередача - процесс обмена энергией между системой и окружающими ее телами, не сопровождающийся измерением внешних параметров состояния системы. Это процесс передачи энергии неупорядоченного движения от одних тел к другим. Энергия, получаемая или отдаваемая системой в процессе теплопередачи называется количеством тепла Q (1 Дж).

Работа и теплопередача являются эквивалентными формами передачи энергии : определенное количество тепла и определенная работа могут вызвать в системе одинаковые изменения. Вместе с тем, работа и теплопередача - неравноценные формы передачи энергии : если за счет работы может пополняться любой вид энергии, то за счет тепла непосредственно - только внутренняя энергия. Если в процессе совершения работы один вид энергии трансформируется в другой, то в процессе теплопередачи такого превращения не происходит.

7. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА. Внутренней энергий (U) какого-либо тела называется энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Внутренняя энергия является функцией состояния системы, следовательно ее изменение при переходе системы из одного состояния в другое равно разности значений внутренней энергии в этих состояниях и не зависит от пути перехода системы из одного состояния в другое.

Определим внутреннюю энергию идеального газа: Внутренняя энергия - функция температуры.

ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ I начало термодинамики говорит о сохранении полной энергии во всех процессах, имеющих молекулярно- статистическую основу и утверждает возможность взаимных превращений различных видов энергии. Количество тепла, сообщенное системе, расходуется на приращение внутренней энергии системы и на совершение системой работы: Q = U + A
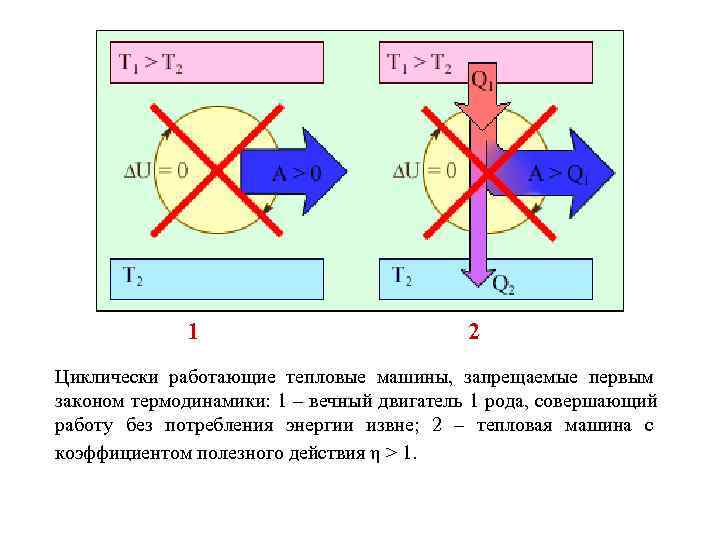
1 2 Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1.

Перепишем I начало термодинамики в дифференциальной форме: d. Q = d. U + d. A d. Q и d. A нельзя рассматривать как приращения величин Q и A. df можно рассматривать как приращение величины f только в том случае, если интеграл от df при переходе из состояния 1 в состояние 2 не зависит от пути, по которому совершается переход, то есть если f - функция состояния. Символ df означает элементарное приращение величины f и является полным дифференциалом: df(x, y, z) = f(x+dx, y+dy, z+dz) - f(x, y, z)

Внутренняя энергия обладает соответствующими свойствами, поэтому для ее элементарного приращения будем использовать символ d. U. Для записи элементарно го количества тепла и элементарной работы будем использовать другие символы: Q и A соответственно: Q = d. U + A Рассмотрим применение I начала термодинамики к изопроцессам в газах: Изобарический процесс: Q = d. U + A Изохорический процесс: Q = d. U ( A = 0, т. к. V = const) Изотермический процесс: Q = A (d. U = 0, т. к. T = const)

8. ТЕПЛОЕМКОСТЬ Теплоемкостью тела (полной теплоемкостью) называется физическая величина, численно равная количеству тепла, которое надо сообщить телу, чтобы нагреть его на один Кельвин:

Удельной теплоемкостью вещества называется физическая величина, численно равная количеству тепла, которое надо сообщить 1 кг вещества, чтобы нагреть его на один Кельвин :

Молярной теплоемкостью вещества называется физическая величина, численно равная количеству тепла, которое надо сообщить 1 молю вещества, чтобы нагреть его на один Кельвин :

Различают теплоемкость для случаев, когда нагревание происходит при постоянном объеме ( С V ) или при постоянном давлении (CP). Теплоемкость при постоянном объеме. Если нагревание происходит при постоянном объеме, система не совершает работы над внешними телами и, следовательно, согласно первому началу термодинамики, все тепло идет на приращение внутренней энергии тела: Q = d. U + A А = 0 Q = d. U

Тогда молярная теплоемкость при постоянном объеме равна: Теплоемкость идеального газа при постоянном объеме оказывается постоянной величиной и не зависит от параметров состояния газа.

Теплоемкость при постоянном давлении. Если нагревание газа происходит при постоянном давлении, то газ будет расширяться, совершая над внешними телами положительную работу. Следовательно, для повышения температуры газа на один градус в этом случае понадобится больше тепла, чем при нагревании при постоянном объеме, так как часть тепла будет затрачиваться на совершение работы над внешними телами. Поэтому теплоемкость газа при постоянном давлении должна быть больше, чем теплоемкость при постоянном объеме.

Определим соотношение между теплоемкостями при постоянном давлении и объеме: - коэффициент Пуассона

