6. Носители 6.1. Роль носителей в катализаторах 6.2.




























6518-l_06+07-spa-nositeli_oksidnye_nositeli.ppt
- Количество слайдов: 46
 6. Носители 6.1. Роль носителей в катализаторах 6.2. Физико-химические свойства основных синтетических и природных носителей 6.2.1. Диоксид кремния (силикагель) 6.2.2. Оксиды алюминия 6.2.3. Диоксид титана 6.2.4. Диоксид циркония 6.2.5. Оксид магния 6.2.6. Многокомпонентные носители 6.2.7. Блочные носители сотовой структуры 6.2.8. Углеродные носители Лекции 6-7
6. Носители 6.1. Роль носителей в катализаторах 6.2. Физико-химические свойства основных синтетических и природных носителей 6.2.1. Диоксид кремния (силикагель) 6.2.2. Оксиды алюминия 6.2.3. Диоксид титана 6.2.4. Диоксид циркония 6.2.5. Оксид магния 6.2.6. Многокомпонентные носители 6.2.7. Блочные носители сотовой структуры 6.2.8. Углеродные носители Лекции 6-7
 6.1. Роль носителей в катализаторах Взгляды на роль носителей 1) До середины XX в.: носитель – инертный материал, ответственный за поддержание дисперсного состояния активного компонента 2) Конец XX в.: “носитель может и должен рассматриваться как активная часть каталитической системы, так как между носителем и активным компонентом может происходить достаточно сложное взаимодействие вплоть до образования химических соединений” (Э.Б.Стайлз, Носители и нанесенные катализаторы. Теория и практика. М.:Химия, 1991)
6.1. Роль носителей в катализаторах Взгляды на роль носителей 1) До середины XX в.: носитель – инертный материал, ответственный за поддержание дисперсного состояния активного компонента 2) Конец XX в.: “носитель может и должен рассматриваться как активная часть каталитической системы, так как между носителем и активным компонентом может происходить достаточно сложное взаимодействие вплоть до образования химических соединений” (Э.Б.Стайлз, Носители и нанесенные катализаторы. Теория и практика. М.:Химия, 1991)
 Требования к носителям ► Носитель должен быть индифферентен в отношении основной каталитической реакции и не ускорять побочных процессов, которые могут привести к снижению селективности ► В случае бифункциональных катализаторов носитель должен обладать определенными кислотными (или другими) свойствами ► Носитель должен быть инертен к активному компоненту или же не должен образовывать с ним неактивных соединений ► Требование инертности не отрицает возможности или даже необходимости проявления носителем промотирующих и модифицирующих функций Изучение процессов взаимодействия активного компонента с носителем, приводящих к образованию как активных, так и неактивных соединений – одна из важных проблем научных основ приготовления нанесенных катализаторов
Требования к носителям ► Носитель должен быть индифферентен в отношении основной каталитической реакции и не ускорять побочных процессов, которые могут привести к снижению селективности ► В случае бифункциональных катализаторов носитель должен обладать определенными кислотными (или другими) свойствами ► Носитель должен быть инертен к активному компоненту или же не должен образовывать с ним неактивных соединений ► Требование инертности не отрицает возможности или даже необходимости проявления носителем промотирующих и модифицирующих функций Изучение процессов взаимодействия активного компонента с носителем, приводящих к образованию как активных, так и неактивных соединений – одна из важных проблем научных основ приготовления нанесенных катализаторов
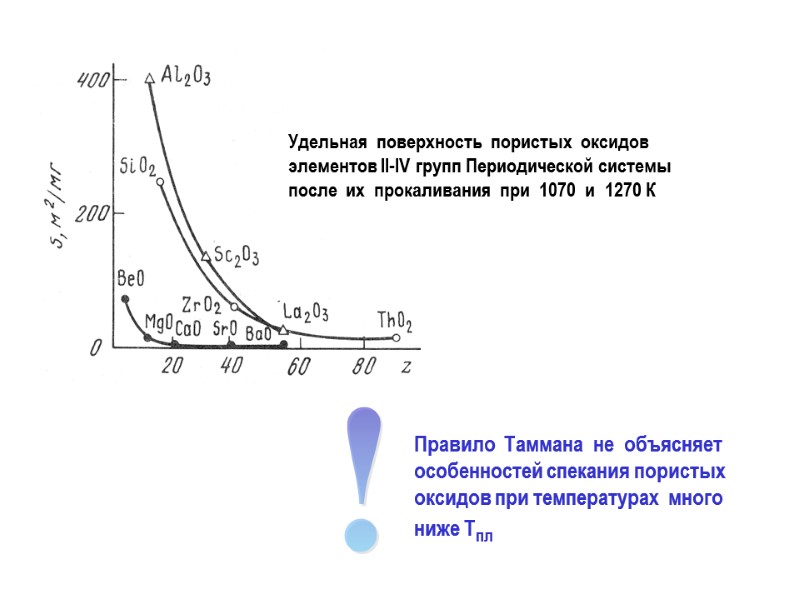
 При оценке термической стабильности носителя принято ориентироваться на значения температур Таммана и Хюттига При температуре Таммана (0.5Тпл. К) наблюдается заметная подвижность атомов в узлах кристаллической решетки. При этой температуре с заметной скоростью начинают протекать процессы спекания пористого материала. При температуре Хюттига ( 0.3Тпл. К) наблюдается заметная поверхностная подвижность атомов. Данная температура важна при оценке устойчивости к спеканию нанесенных на поверхность носителя частиц активного компонента. ► Носитель должен обладать высокой термической стабильностью в условиях каталитического процесса
При оценке термической стабильности носителя принято ориентироваться на значения температур Таммана и Хюттига При температуре Таммана (0.5Тпл. К) наблюдается заметная подвижность атомов в узлах кристаллической решетки. При этой температуре с заметной скоростью начинают протекать процессы спекания пористого материала. При температуре Хюттига ( 0.3Тпл. К) наблюдается заметная поверхностная подвижность атомов. Данная температура важна при оценке устойчивости к спеканию нанесенных на поверхность носителя частиц активного компонента. ► Носитель должен обладать высокой термической стабильностью в условиях каталитического процесса
 Удельная поверхность пористых оксидов элементов II-IV групп Периодической системы после их прокаливания при 1070 и 1270 К Правило Таммана не объясняет особенностей спекания пористых оксидов при температурах много ниже Tпл !
Удельная поверхность пористых оксидов элементов II-IV групп Периодической системы после их прокаливания при 1070 и 1270 К Правило Таммана не объясняет особенностей спекания пористых оксидов при температурах много ниже Tпл !
 ► Носитель должен быть химически инертен к компонентам реакционной среды и в условиях регенерации катализатора ► Носитель должен обладать оптимальной величиной удельной поверхности ► Носитель должен обладать оптимальной пористой структурой ► Носитель должен обладать необходимыми механическими свойст-вами, теплопроводностью, а в ряде случаев – электропроводностью, которые предопределяются условиями эксплуатации катализатора ► Носитель должен обладать определенной нанотекстурой поверхности и набором поверхностных функциональных групп как для требуемого взаимодействия с предшественниками активного компонента на стадиях приготовления, так и для фиксации частиц активного компонента в конечном катализаторе
► Носитель должен быть химически инертен к компонентам реакционной среды и в условиях регенерации катализатора ► Носитель должен обладать оптимальной величиной удельной поверхности ► Носитель должен обладать оптимальной пористой структурой ► Носитель должен обладать необходимыми механическими свойст-вами, теплопроводностью, а в ряде случаев – электропроводностью, которые предопределяются условиями эксплуатации катализатора ► Носитель должен обладать определенной нанотекстурой поверхности и набором поверхностных функциональных групп как для требуемого взаимодействия с предшественниками активного компонента на стадиях приготовления, так и для фиксации частиц активного компонента в конечном катализаторе
 Оксиды SiO2 (силикагель), (-,-,-) Al2O3, TiO2 (рутил, анатаз), ZrO2, MgO Сложные оксиды (шпинели, цеолиты и др.) Соли, карбиды – BaSO4, MgCl2, MgF2, SiC, WC Металлы и сплавы Углеродные материалы Полимеры (полистирол, полиамид и др.) Блочные носители, стекловолокна, мембраны Композиционные материалы (керамика, керметы и углерод-минеральные композиты и др.) Основные синтетические носители Природные минералы, используемые в качестве носителей Кизельгур (или диатомит), пемза Асбест Глины Графит
Оксиды SiO2 (силикагель), (-,-,-) Al2O3, TiO2 (рутил, анатаз), ZrO2, MgO Сложные оксиды (шпинели, цеолиты и др.) Соли, карбиды – BaSO4, MgCl2, MgF2, SiC, WC Металлы и сплавы Углеродные материалы Полимеры (полистирол, полиамид и др.) Блочные носители, стекловолокна, мембраны Композиционные материалы (керамика, керметы и углерод-минеральные композиты и др.) Основные синтетические носители Природные минералы, используемые в качестве носителей Кизельгур (или диатомит), пемза Асбест Глины Графит
 6.2. Физико-химические свойства основных синтетических и природных носителей
6.2. Физико-химические свойства основных синтетических и природных носителей
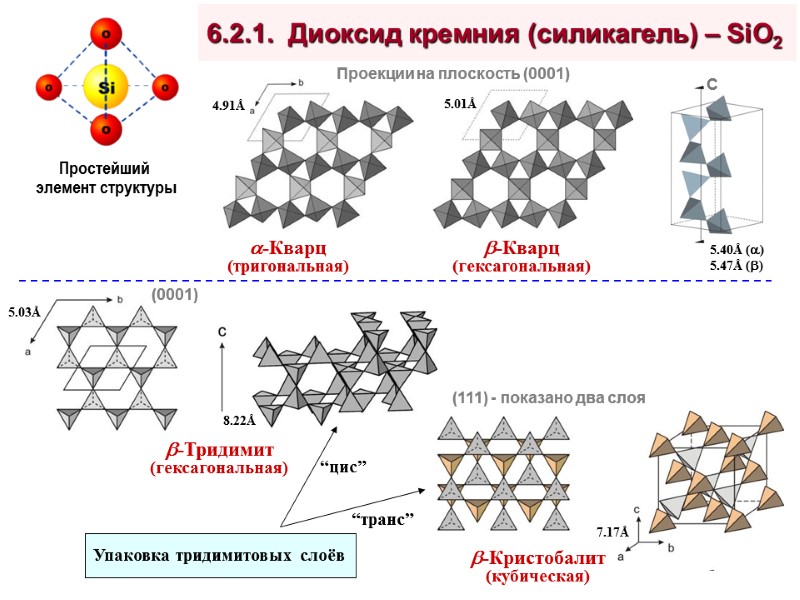
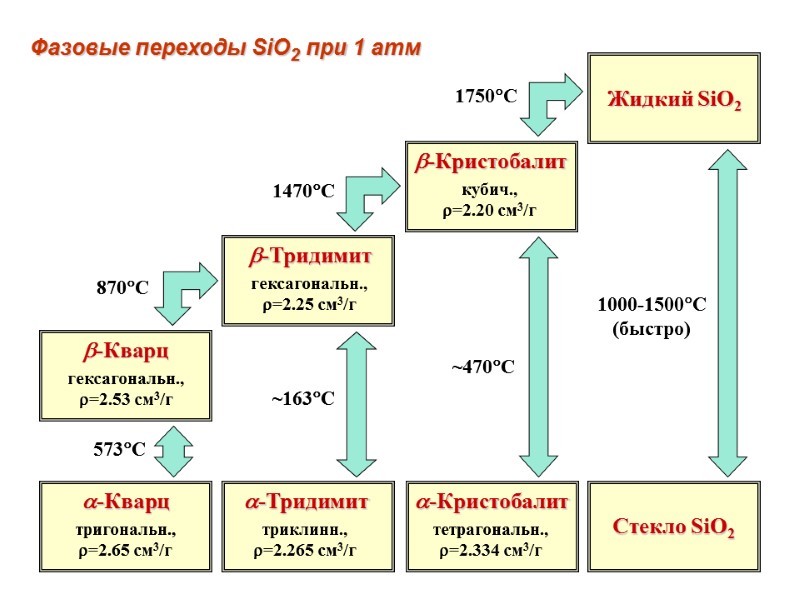
 6.2.1. Диоксид кремния (силикагель) – SiO2
6.2.1. Диоксид кремния (силикагель) – SiO2

 Использование SiO2 в катализе Носитель для диспергирования активного компонента: металлов: Pt, Pd, Ni расплавов V2O5+K2S2O7, оксидов Cr, Mo, V, W, Ti и др., кислот (H3PO4), солей В качестве носителя применяется преимущественно пористый аморфный оксид кремния – силикагель, из природных материалов – кизельгур, пемза Собственная каталитическая активность незначительна
Использование SiO2 в катализе Носитель для диспергирования активного компонента: металлов: Pt, Pd, Ni расплавов V2O5+K2S2O7, оксидов Cr, Mo, V, W, Ti и др., кислот (H3PO4), солей В качестве носителя применяется преимущественно пористый аморфный оксид кремния – силикагель, из природных материалов – кизельгур, пемза Собственная каталитическая активность незначительна
 Методы получения силикагелей ► Пламенный гидролиз SiCl4 c образованием аэросила – непористого мелкодисперсного порошка ► Осаждение в виде коагеля осаждение из растворов силиката натрия при введении легко- гидролизующихся солей (Cu2+, Fe3+, NH4+) с последующим удалением катионов промывкой растворами кислот
Методы получения силикагелей ► Пламенный гидролиз SiCl4 c образованием аэросила – непористого мелкодисперсного порошка ► Осаждение в виде коагеля осаждение из растворов силиката натрия при введении легко- гидролизующихся солей (Cu2+, Fe3+, NH4+) с последующим удалением катионов промывкой растворами кислот
 Основные характеристики силикагелей ► Пористый материал, первичные частицы глобулярной структуры ► Термическая стабильность - высокая Для чистого силикагеля – до 1000С, однако присутствие примесей Na+ (Ca2+) способствует его спеканию при более низких температурах ► Формуемость - хорошая ► Механическая прочность – высокая однако крайне низкая для аэрогелей и аэросилов ► Текстурные свойства - варьируются в широких пределах SБЭТ 5 - 800 м2/г Vпор 0.3 - 2.5 см3/г, 4 - 14 см3/г (аэрогель) Rпор (средний) 1 - 100 нм Насыпной вес 0.03 (аэрогель) - 0.15 (аэросил) - 0.9 г/см3 ► Химическая стойкость – высокая растворим при рН> 10, а также в растворах HF, при t>600С в присутствии пара и газов-восстановителей может сублимировать и блокировать активный компонент катализатора или уноситься из реактора
Основные характеристики силикагелей ► Пористый материал, первичные частицы глобулярной структуры ► Термическая стабильность - высокая Для чистого силикагеля – до 1000С, однако присутствие примесей Na+ (Ca2+) способствует его спеканию при более низких температурах ► Формуемость - хорошая ► Механическая прочность – высокая однако крайне низкая для аэрогелей и аэросилов ► Текстурные свойства - варьируются в широких пределах SБЭТ 5 - 800 м2/г Vпор 0.3 - 2.5 см3/г, 4 - 14 см3/г (аэрогель) Rпор (средний) 1 - 100 нм Насыпной вес 0.03 (аэрогель) - 0.15 (аэросил) - 0.9 г/см3 ► Химическая стойкость – высокая растворим при рН> 10, а также в растворах HF, при t>600С в присутствии пара и газов-восстановителей может сублимировать и блокировать активный компонент катализатора или уноситься из реактора

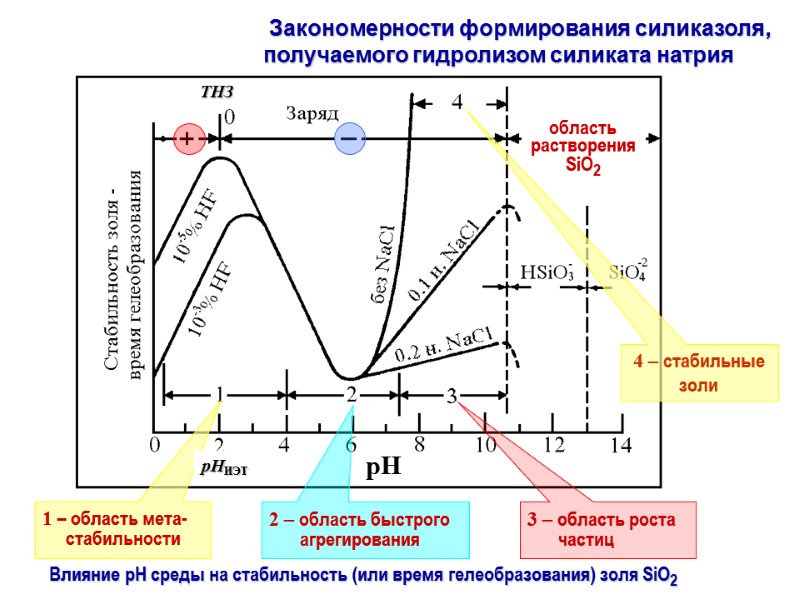
 Закономерности формирования силиказоля, получаемого гидролизом силиката натрия
Закономерности формирования силиказоля, получаемого гидролизом силиката натрия
 Механизмы роста частиц золя SiO2 при различных рН среды
Механизмы роста частиц золя SiO2 при различных рН среды
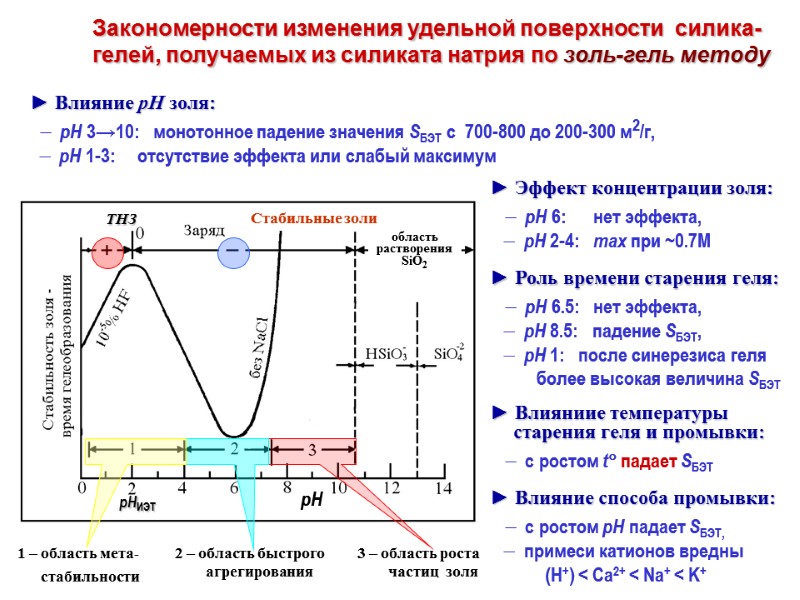
 Закономерности изменения удельной поверхности силика-гелей, получаемых из силиката натрия по золь-гель методу ► Влияние рН золя: рН 3→10: монотонное падение значения SБЭТ с 700-800 до 200-300 м2/г, рН 1-3: отсутствие эффекта или слабый максимум ► Эффект концентрации золя: рН 6: нет эффекта, рН 2-4: max при ~0.7М ► Роль времени старения геля: рН 6.5: нет эффекта, рН 8.5: падение SБЭТ, рН 1: после синерезиса геля более высокая величина SБЭТ ► Влияниие температуры старения геля и промывки: с ростом t падает SБЭТ ► Влияние способа промывки: с ростом рН падает SБЭТ, примеси катионов вредны (H+) < Ca2+ < Na+ < K+
Закономерности изменения удельной поверхности силика-гелей, получаемых из силиката натрия по золь-гель методу ► Влияние рН золя: рН 3→10: монотонное падение значения SБЭТ с 700-800 до 200-300 м2/г, рН 1-3: отсутствие эффекта или слабый максимум ► Эффект концентрации золя: рН 6: нет эффекта, рН 2-4: max при ~0.7М ► Роль времени старения геля: рН 6.5: нет эффекта, рН 8.5: падение SБЭТ, рН 1: после синерезиса геля более высокая величина SБЭТ ► Влияниие температуры старения геля и промывки: с ростом t падает SБЭТ ► Влияние способа промывки: с ростом рН падает SБЭТ, примеси катионов вредны (H+) < Ca2+ < Na+ < K+
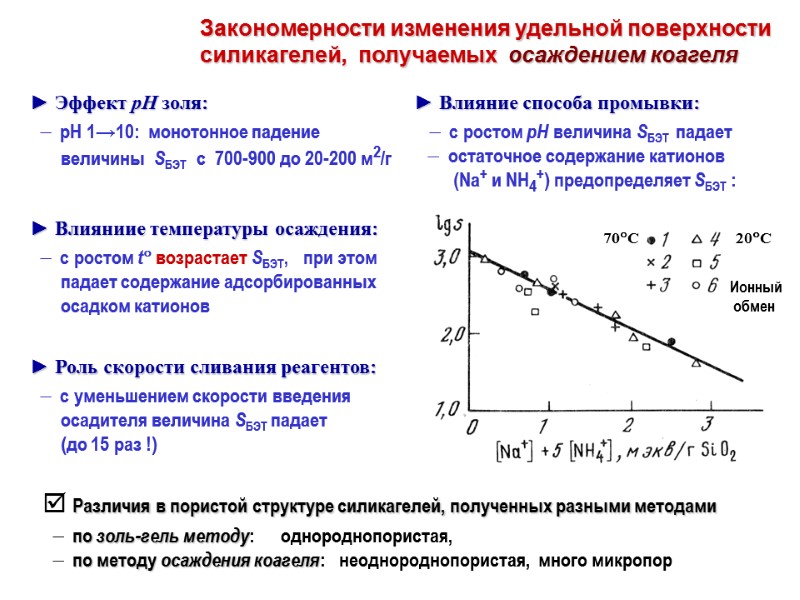
 Закономерности изменения удельной поверхности силикагелей, получаемых осаждением коагеля ► Эффект рН золя: рН 1→10: монотонное падение величины SБЭТ с 700-900 до 20-200 м2/г Различия в пористой структуре силикагелей, полученных разными методами по золь-гель методу: однороднопористая, по методу осаждения коагеля: неоднороднопористая, много микропор ► Влияниие температуры осаждения: с ростом t возрастает SБЭТ, при этом падает содержание адсорбированных осадком катионов ► Роль скорости сливания реагентов: с уменьшением скорости введения осадителя величина SБЭТ падает (до 15 раз !)
Закономерности изменения удельной поверхности силикагелей, получаемых осаждением коагеля ► Эффект рН золя: рН 1→10: монотонное падение величины SБЭТ с 700-900 до 20-200 м2/г Различия в пористой структуре силикагелей, полученных разными методами по золь-гель методу: однороднопористая, по методу осаждения коагеля: неоднороднопористая, много микропор ► Влияниие температуры осаждения: с ростом t возрастает SБЭТ, при этом падает содержание адсорбированных осадком катионов ► Роль скорости сливания реагентов: с уменьшением скорости введения осадителя величина SБЭТ падает (до 15 раз !)
 6.2.2. Оксид алюминия – Al2O3
6.2.2. Оксид алюминия – Al2O3
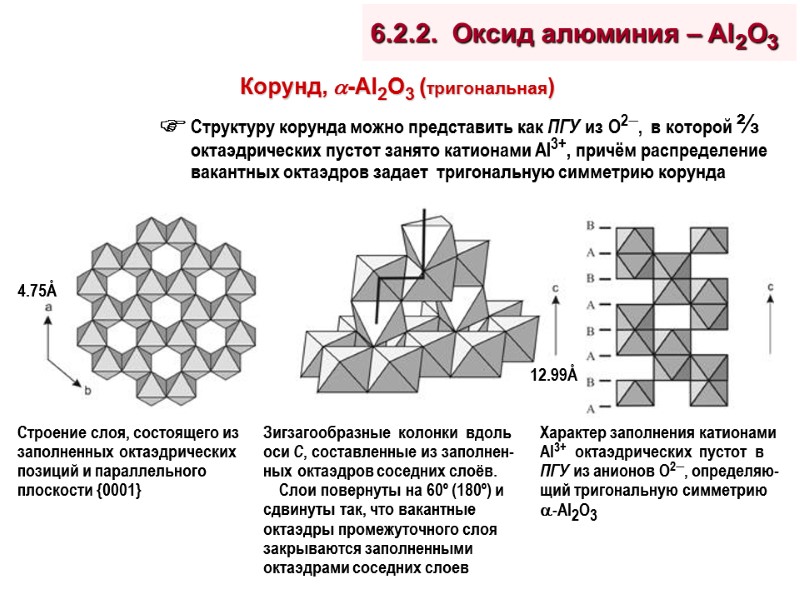
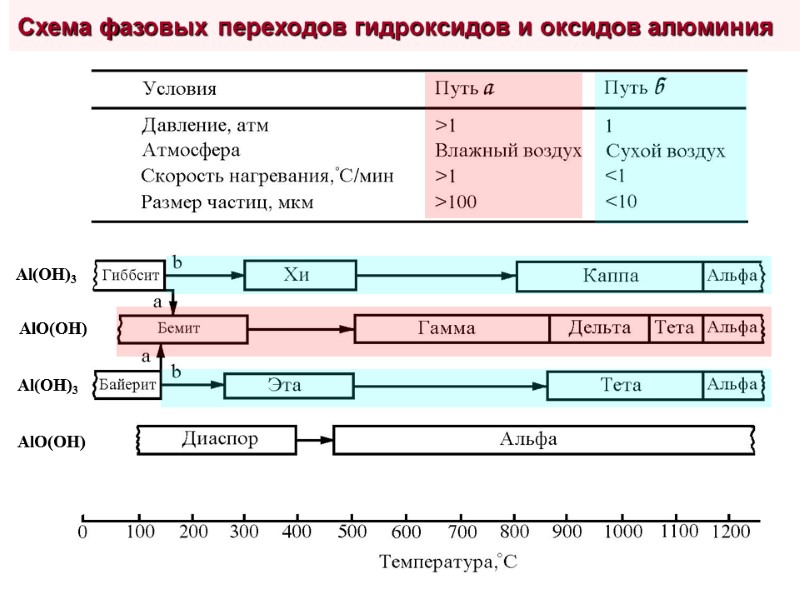
 Переходные фазы: -, -, -, -, -, -Al2O3 Общая формула: Al2O3xH2O (0< x <1) Получают дегидратацией природных и синтетических гидроокисей алюминия: Al(OH)3 (гиббсит, байерит) и AlO(OH) (бемит, псевдобемит) Метастабильны, но переход в -Al2O3 крайне затруднён, что обуславливает их термостабильность в довольно широком диапазоне температур Имеют дефектные гексагональную ( -, -) или шпинельную ( -, -, -, -) структуры, отличаясь друг от друга типом дефектов и их распределением в объёме кристаллитов. Обычно сосуществуют и содержат заметное количество Al2O3 в аморфном состоянии Обладают развитой пористостью и поверхностью, особенно -, -, - и - формы ( 500 м2/г) Тип получаемого оксида алюминия однозначно зависит от природы исходного гидроксида и условий прокаливания (T, P, скорость удаления паров H2O)
Переходные фазы: -, -, -, -, -, -Al2O3 Общая формула: Al2O3xH2O (0< x <1) Получают дегидратацией природных и синтетических гидроокисей алюминия: Al(OH)3 (гиббсит, байерит) и AlO(OH) (бемит, псевдобемит) Метастабильны, но переход в -Al2O3 крайне затруднён, что обуславливает их термостабильность в довольно широком диапазоне температур Имеют дефектные гексагональную ( -, -) или шпинельную ( -, -, -, -) структуры, отличаясь друг от друга типом дефектов и их распределением в объёме кристаллитов. Обычно сосуществуют и содержат заметное количество Al2O3 в аморфном состоянии Обладают развитой пористостью и поверхностью, особенно -, -, - и - формы ( 500 м2/г) Тип получаемого оксида алюминия однозначно зависит от природы исходного гидроксида и условий прокаливания (T, P, скорость удаления паров H2O)
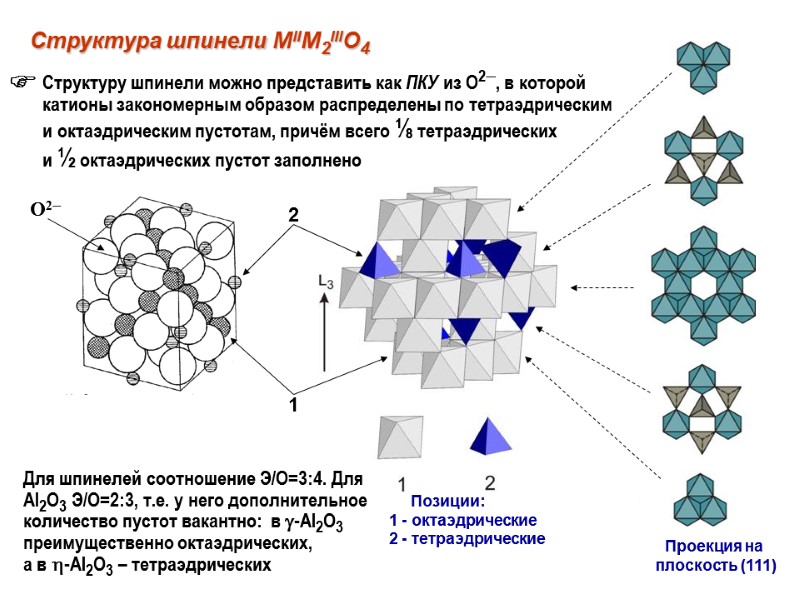
 Структура шпинели MIIM2IIIO4
Структура шпинели MIIM2IIIO4
 Al(OH)3 Al(OH)3 AlO(OH) AlO(OH) Схема фазовых переходов гидроксидов и оксидов алюминия
Al(OH)3 Al(OH)3 AlO(OH) AlO(OH) Схема фазовых переходов гидроксидов и оксидов алюминия
 Использование Al2O3 в катализе Катализатор Собственная каталитическая активность: незначительна – для -Al2O3, высока – для «активных» оксидов (особенно для - и -Al2O3) ● активация HH, CH, CC связей, кислотно-основной катализ, синтез Клауса ● сокатализатор в бифункциональных системах
Использование Al2O3 в катализе Катализатор Собственная каталитическая активность: незначительна – для -Al2O3, высока – для «активных» оксидов (особенно для - и -Al2O3) ● активация HH, CH, CC связей, кислотно-основной катализ, синтез Клауса ● сокатализатор в бифункциональных системах
 Основные характеристики «активного» оксида алюминия ► Термическая стабильность - высокая (до 1000С) ► Формуемость - хорошая ► Механическая прочность – высокая ► Текстурные свойства - варьируются в широких пределах SБЭТ 10 – 250 – 550 м2/г Vпор 0.3 – 0.85 – 6.0 см3/г Rпор (средний) 10 - 60 нм Насыпной вес 0.2 - 0.8 – 0.05 г/см3 ► Химическая стойкость – средняя амфотерен, растворим в сильных кислотах и щелочах, при нагревании с оксидами MeO (Me = Ca, Mg, Cu, Ni) при 500-600С образует шпинели
Основные характеристики «активного» оксида алюминия ► Термическая стабильность - высокая (до 1000С) ► Формуемость - хорошая ► Механическая прочность – высокая ► Текстурные свойства - варьируются в широких пределах SБЭТ 10 – 250 – 550 м2/г Vпор 0.3 – 0.85 – 6.0 см3/г Rпор (средний) 10 - 60 нм Насыпной вес 0.2 - 0.8 – 0.05 г/см3 ► Химическая стойкость – средняя амфотерен, растворим в сильных кислотах и щелочах, при нагревании с оксидами MeO (Me = Ca, Mg, Cu, Ni) при 500-600С образует шпинели
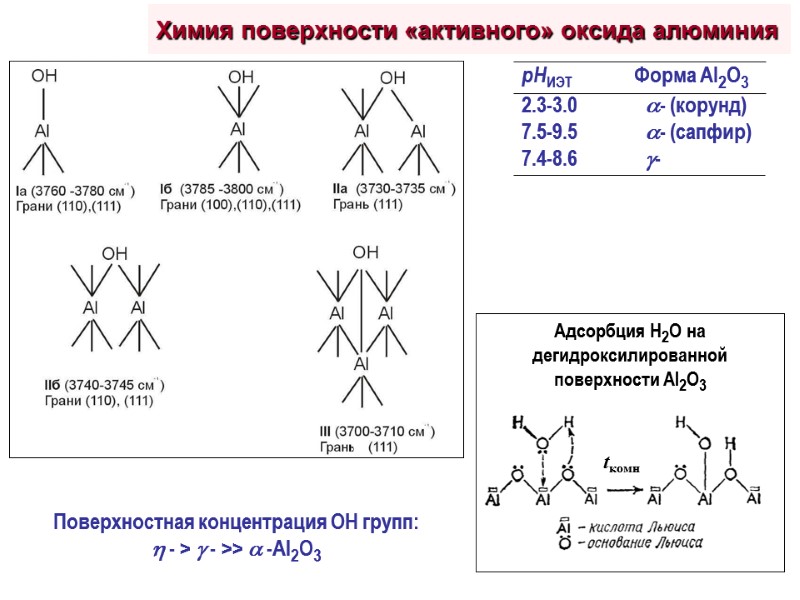
 Химия поверхности «активного» оксида алюминия
Химия поверхности «активного» оксида алюминия
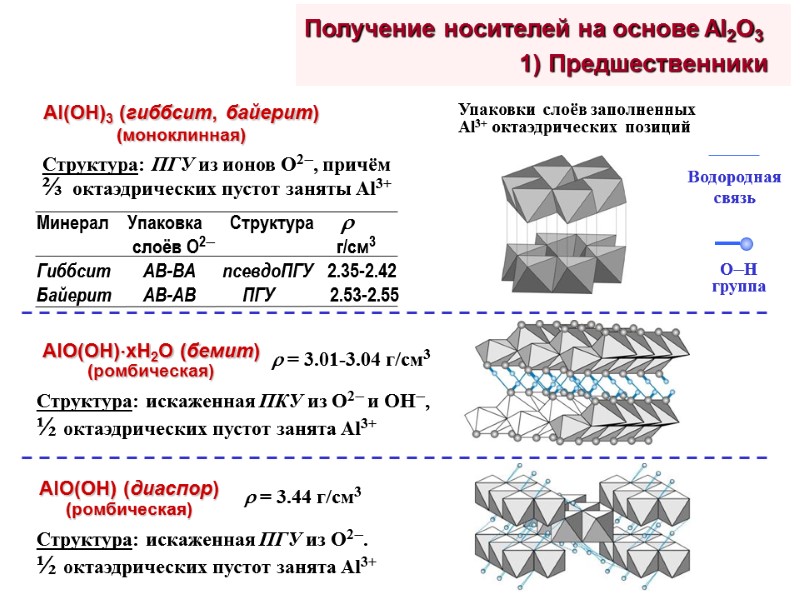
 Получение носителей на основе Al2O3 1) Предшественники
Получение носителей на основе Al2O3 1) Предшественники
 Получение носителей на основе Al2O3 1) Предшественники AlO(OH)xH2O х1 (бемит) 1.4<х<2 (псевдобемит) Химическая активность гидроксидов алюминия: аморфный Al2O3 > байерит > гиббсит > бемит > диаспор Аморфный Al(OH)3 Структура псевдобемита: плохо окристаллизован, смещение и уширение пика 020 на дифрактограммах коррелирует с содержанием избыточной H2O
Получение носителей на основе Al2O3 1) Предшественники AlO(OH)xH2O х1 (бемит) 1.4<х<2 (псевдобемит) Химическая активность гидроксидов алюминия: аморфный Al2O3 > байерит > гиббсит > бемит > диаспор Аморфный Al(OH)3 Структура псевдобемита: плохо окристаллизован, смещение и уширение пика 020 на дифрактограммах коррелирует с содержанием избыточной H2O
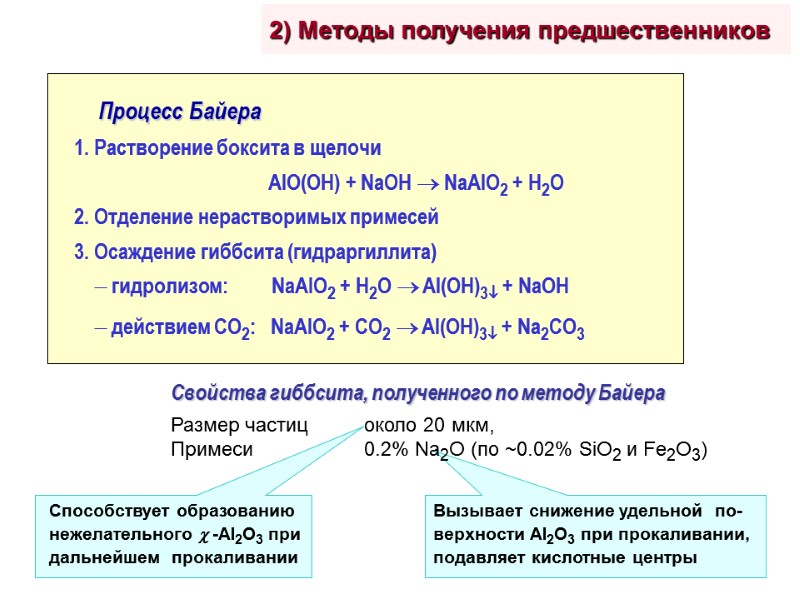
 2) Методы получения предшественников Свойства гиббсита, полученного по методу Байера Размер частиц около 20 мкм, Примеси 0.2% Na2O (по ~0.02% SiO2 и Fe2O3)
2) Методы получения предшественников Свойства гиббсита, полученного по методу Байера Размер частиц около 20 мкм, Примеси 0.2% Na2O (по ~0.02% SiO2 и Fe2O3)
 Очистка гиббсита, полученного по методу Байера Переосаждение по “алюминатной” технологии 1. Растворение гиббсита в щелочи с образованием алюмината натрия: Аl(ОН)3 + NаОН NaAlO2 + 2 H2O 2. Переосаждение кислотой (HNO3, H2SO4): NaAlO2 + HNO3 + H2O Аl(ОН)3 (байерит) + NaNO3 рН=10-12 NaAlO2 + HNO3 AlO(OH) (псевдобемит) + NaNO3 рН <9 или солями алюминия (нитратом, сульфатом): 3NaAlO2 + Al(NO3)3 + 6 H2O 4Аl(ОН)3 + 3NaNO3 Переосаждение по “нитратной” технологии: 1. Растворение гиббсита в кислоте: Аl(ОН)3 + 3HNO3 Al(NO3)3 + 3H2O 2. Осаждение щелочью или раствором NH4OH ((NH4)2CO3) Al(NO3)3 + 3NaOH Аl(OH)3 + 3NaNO3 рН>10 Al(NO3) 3 + 3NH4OH АlO(OH) + 3NH4NO3 + H2O рН<9
Очистка гиббсита, полученного по методу Байера Переосаждение по “алюминатной” технологии 1. Растворение гиббсита в щелочи с образованием алюмината натрия: Аl(ОН)3 + NаОН NaAlO2 + 2 H2O 2. Переосаждение кислотой (HNO3, H2SO4): NaAlO2 + HNO3 + H2O Аl(ОН)3 (байерит) + NaNO3 рН=10-12 NaAlO2 + HNO3 AlO(OH) (псевдобемит) + NaNO3 рН <9 или солями алюминия (нитратом, сульфатом): 3NaAlO2 + Al(NO3)3 + 6 H2O 4Аl(ОН)3 + 3NaNO3 Переосаждение по “нитратной” технологии: 1. Растворение гиббсита в кислоте: Аl(ОН)3 + 3HNO3 Al(NO3)3 + 3H2O 2. Осаждение щелочью или раствором NH4OH ((NH4)2CO3) Al(NO3)3 + 3NaOH Аl(OH)3 + 3NaNO3 рН>10 Al(NO3) 3 + 3NH4OH АlO(OH) + 3NH4NO3 + H2O рН<9
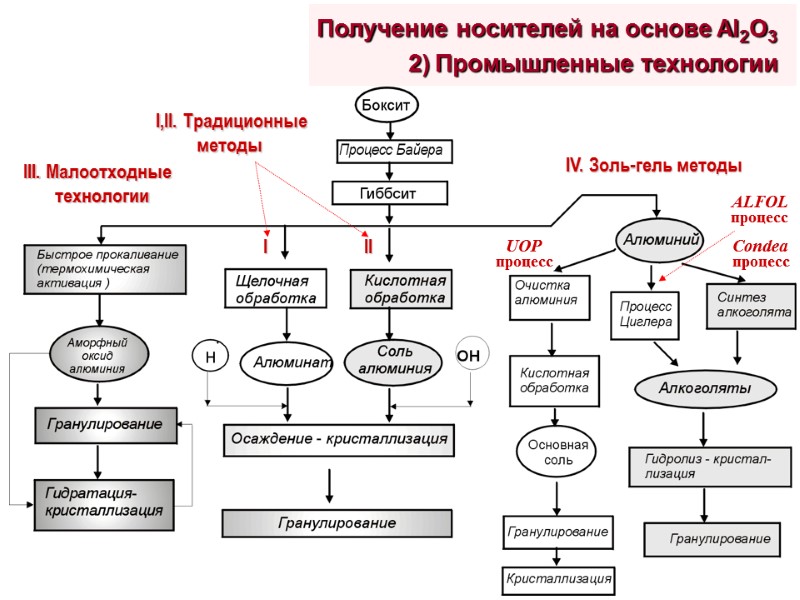
 Получение носителей на основе Al2O3 2) Промышленные технологии
Получение носителей на основе Al2O3 2) Промышленные технологии
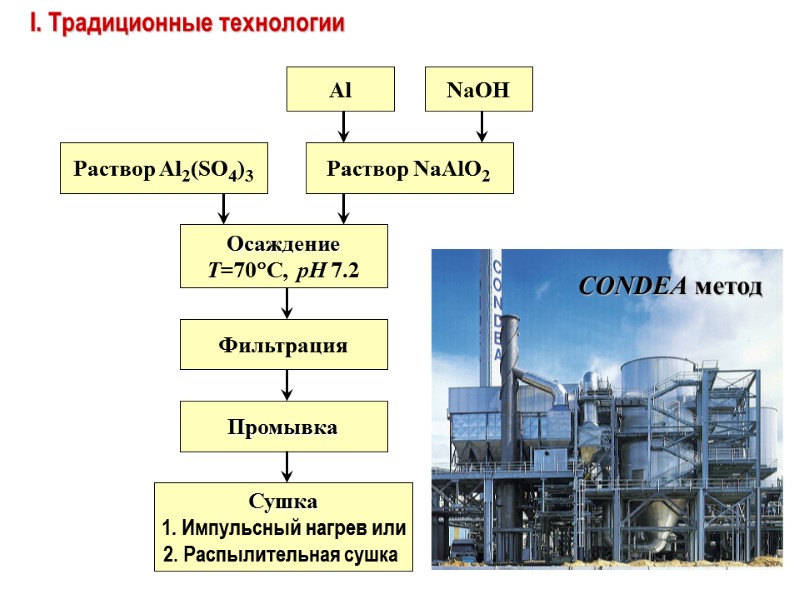
 I. Традиционные технологии
I. Традиционные технологии
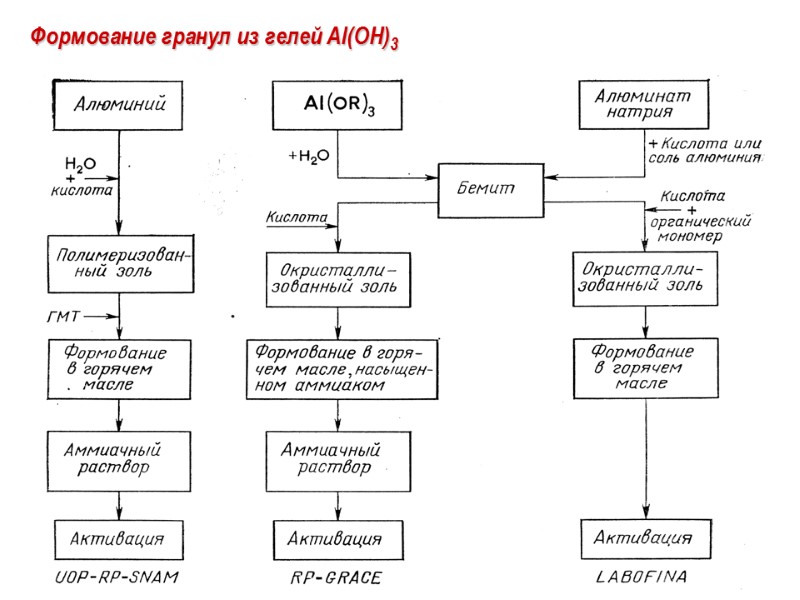
 Формование гранул из гелей Al(OH)3
Формование гранул из гелей Al(OH)3
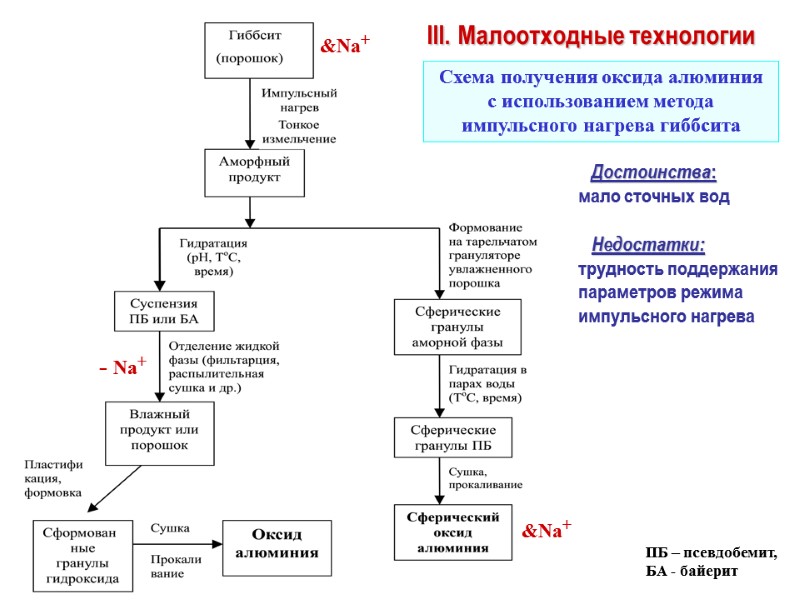
 III. Малоотходные технологии &Na+ - Na+ &Na+ Достоинства: мало сточных вод Недостатки: трудность поддержания параметров режима импульсного нагрева Схема получения оксида алюминия с использованием метода импульсного нагрева гиббсита ПБ – псевдобемит, БА - байерит
III. Малоотходные технологии &Na+ - Na+ &Na+ Достоинства: мало сточных вод Недостатки: трудность поддержания параметров режима импульсного нагрева Схема получения оксида алюминия с использованием метода импульсного нагрева гиббсита ПБ – псевдобемит, БА - байерит
 IV. Золь-гель методы Процесс UOP 1. Синтез основной соли Аl2(ОН)5Cl из металлического Al: 2Аl + 5H2O + HCl Аl2(ОН)5Cl + 3H2↑ 2. Смешение раствора Аl2(ОН)5Cl с гексаметилентетрамином 3. Жидкостная формовка гидроксида алюминия в горячем масле (CH2)6N4 + 10H2O 6CH2O + 4NH4OH Аl2(ОН)5Cl + 2NH4OH 2Аl(ОН)3 + 2NH4Cl +2H2O 4. Старение (кристаллизация) 5. Прокаливание
IV. Золь-гель методы Процесс UOP 1. Синтез основной соли Аl2(ОН)5Cl из металлического Al: 2Аl + 5H2O + HCl Аl2(ОН)5Cl + 3H2↑ 2. Смешение раствора Аl2(ОН)5Cl с гексаметилентетрамином 3. Жидкостная формовка гидроксида алюминия в горячем масле (CH2)6N4 + 10H2O 6CH2O + 4NH4OH Аl2(ОН)5Cl + 2NH4OH 2Аl(ОН)3 + 2NH4Cl +2H2O 4. Старение (кристаллизация) 5. Прокаливание
 Ziegler ALFOL процесс CONDEA On-Purpose Alumina Process Использование алкоксидов
Ziegler ALFOL процесс CONDEA On-Purpose Alumina Process Использование алкоксидов
 Использование органических осадителей 1. Этиленхлоргидрин как источник кислоты NaAlO2 + HOCH2CH2Cl + 2H2O Аl(ОН)3 + NaCl + HOCH2CH2OH Пат. Японии 48-38774 (1973) 3. Этиленоксид как акцептор кислоты АlCl3 + 3O(C2H4) + 3H2O Аl(ОН)3 + 3HOCH2CH2Cl Пат. США 3961036 (1976)
Использование органических осадителей 1. Этиленхлоргидрин как источник кислоты NaAlO2 + HOCH2CH2Cl + 2H2O Аl(ОН)3 + NaCl + HOCH2CH2OH Пат. Японии 48-38774 (1973) 3. Этиленоксид как акцептор кислоты АlCl3 + 3O(C2H4) + 3H2O Аl(ОН)3 + 3HOCH2CH2Cl Пат. США 3961036 (1976)
 6.2.3. Диоксид титана – TiO2
6.2.3. Диоксид титана – TiO2
 Основные характеристики диоксида титана ► Термическая стабильность - средняя у анатаза (до 500-800С), высокая у рутила ► Формуемость – плохая (за исключением гелей) ► Механическая прочность – низкая (кроме полученных из гелей) ► Текстурные свойства SБЭТ 3-10 м2/г (рутил) – 60-250 (анатаз) – 600 (золь-гель) Vпор 0.2 – 0. 5 см3/г (анатаз) – 2.1 (золь-гель) Rпор (средний) 1 – 20 нм ► Химическая стойкость – средняя амфотерен, растворим в HF, сильных кислотах и щелочах, сильными восстановителями восстанавливается до поверхностных соединений Ti3+ ► рНИЭТ – 4.7 (рутил), 6.0-6.7 (анатаз) ► Полупроводник – =3.1-3.2 эВ (рутил), 3.3-3.4 эВ (анатаз)
Основные характеристики диоксида титана ► Термическая стабильность - средняя у анатаза (до 500-800С), высокая у рутила ► Формуемость – плохая (за исключением гелей) ► Механическая прочность – низкая (кроме полученных из гелей) ► Текстурные свойства SБЭТ 3-10 м2/г (рутил) – 60-250 (анатаз) – 600 (золь-гель) Vпор 0.2 – 0. 5 см3/г (анатаз) – 2.1 (золь-гель) Rпор (средний) 1 – 20 нм ► Химическая стойкость – средняя амфотерен, растворим в HF, сильных кислотах и щелочах, сильными восстановителями восстанавливается до поверхностных соединений Ti3+ ► рНИЭТ – 4.7 (рутил), 6.0-6.7 (анатаз) ► Полупроводник – =3.1-3.2 эВ (рутил), 3.3-3.4 эВ (анатаз)
 Использование TiO2 в катализе Носитель для диспергирования активного компонента: металлов: Pt, Pd, Ni Сильное взаимодействие металл-носитель необычные каталитические свойства, “наползание” носителя на частицы металлов оксидов Mn, V V2O5/TiO2 лучший катализатор парциального окисления органических соединений окисление метанола в формальдегид (80%-ный выход), окисление ароматических углеводородов в присутствии NH3 в C6H5NO2, разложение изопропанола в ацетон или пропилен, окисление о-ксилола во фталевый ангидрид, пропана в малеиновый ангидрид MnO2/TiO2 окисляет CH3OH в CH2O c 80%-ным выходом, тогда как MnO2/ZrO2 (CeO2, Al2O3 или MgO) – до CO2 Собственная каталитическая активность незначительна Фотокатализатор (анатаз)
Использование TiO2 в катализе Носитель для диспергирования активного компонента: металлов: Pt, Pd, Ni Сильное взаимодействие металл-носитель необычные каталитические свойства, “наползание” носителя на частицы металлов оксидов Mn, V V2O5/TiO2 лучший катализатор парциального окисления органических соединений окисление метанола в формальдегид (80%-ный выход), окисление ароматических углеводородов в присутствии NH3 в C6H5NO2, разложение изопропанола в ацетон или пропилен, окисление о-ксилола во фталевый ангидрид, пропана в малеиновый ангидрид MnO2/TiO2 окисляет CH3OH в CH2O c 80%-ным выходом, тогда как MnO2/ZrO2 (CeO2, Al2O3 или MgO) – до CO2 Собственная каталитическая активность незначительна Фотокатализатор (анатаз)
 Получение носителей на основе TiO2 Сернокислотный способ из титансодержащего сырья (ильменит, титановые шлаки, лопарит) 1931 г.: разложение концентрата серной кислотой, очистка растворов сульфата титана от примесей, гидролиз с выделением метатитановой кислоты, прокаливание TiO2 образуется только в форме анатаза и загрязнен сульфат-ионами, которые удерживаются при прокаливании до ~850-900C Формирование структуры TiO2 (анатаз или рутил) зависит от типа исходной соли и способа её гидролиза, от условий выделения метатитановой кислоты и, главным образом, от температуры её прокаливания Хлорный парофазный способ из титансодержащего сырья – DuPont, 1948 г.: разложение концентрата хлором и отделение летучих хлоридов, очистка TiCl4 от примесей, превращение TiCl4 в TiO2 любым из методов, прокаливание (при необходимости) При осаждении TiO2 аммиаком из солянокислых растворов при рН <2 получаются образцы со структурой рутила, при 2<рН<5 – со структурой анатаза, а из щелочной среды – рентгеноаморфные.
Получение носителей на основе TiO2 Сернокислотный способ из титансодержащего сырья (ильменит, титановые шлаки, лопарит) 1931 г.: разложение концентрата серной кислотой, очистка растворов сульфата титана от примесей, гидролиз с выделением метатитановой кислоты, прокаливание TiO2 образуется только в форме анатаза и загрязнен сульфат-ионами, которые удерживаются при прокаливании до ~850-900C Формирование структуры TiO2 (анатаз или рутил) зависит от типа исходной соли и способа её гидролиза, от условий выделения метатитановой кислоты и, главным образом, от температуры её прокаливания Хлорный парофазный способ из титансодержащего сырья – DuPont, 1948 г.: разложение концентрата хлором и отделение летучих хлоридов, очистка TiCl4 от примесей, превращение TiCl4 в TiO2 любым из методов, прокаливание (при необходимости) При осаждении TiO2 аммиаком из солянокислых растворов при рН <2 получаются образцы со структурой рутила, при 2<рН<5 – со структурой анатаза, а из щелочной среды – рентгеноаморфные.
 Получение носителей на основе TiO2 Гидролиз TiCl4: TiCl4 + 2H2O TiO2 + 4HCl TiCl4 + 2H2 + O2 TiO2 + 4HCl Окисление TiCl4 при 900-1000С: TiCl4 + O2 TiO2 + 2Cl2 Гидролиз алкоксидов Ti(OR)4 по золь-гель методу
Получение носителей на основе TiO2 Гидролиз TiCl4: TiCl4 + 2H2O TiO2 + 4HCl TiCl4 + 2H2 + O2 TiO2 + 4HCl Окисление TiCl4 при 900-1000С: TiCl4 + O2 TiO2 + 2Cl2 Гидролиз алкоксидов Ti(OR)4 по золь-гель методу
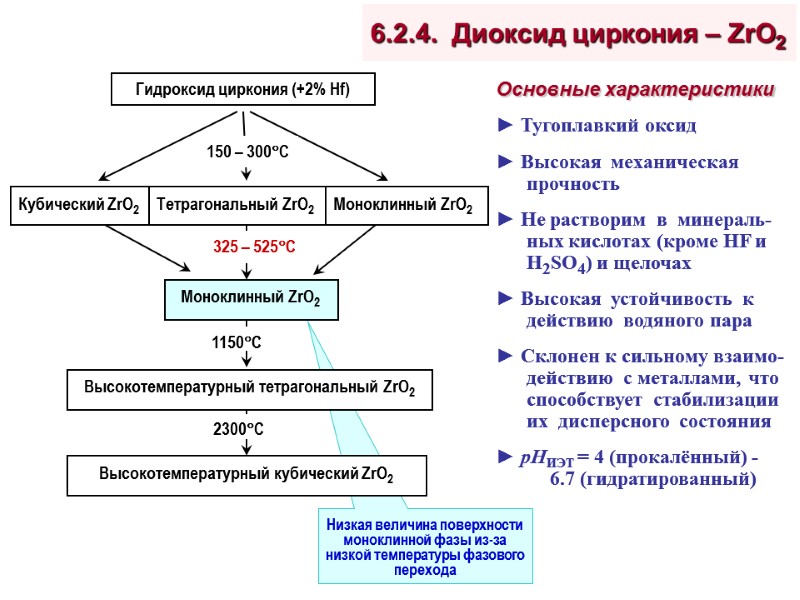
 6.2.4. Диоксид циркония – ZrO2 Основные характеристики ► Тугоплавкий оксид ► Высокая механическая прочность ► Не растворим в минераль-ных кислотах (кроме HF и H2SO4) и щелочах ► Высокая устойчивость к действию водяного пара ► Склонен к сильному взаимо-действию с металлами, что способствует стабилизации их дисперсного состояния ► рНИЭТ = 4 (прокалённый) - 6.7 (гидратированный)
6.2.4. Диоксид циркония – ZrO2 Основные характеристики ► Тугоплавкий оксид ► Высокая механическая прочность ► Не растворим в минераль-ных кислотах (кроме HF и H2SO4) и щелочах ► Высокая устойчивость к действию водяного пара ► Склонен к сильному взаимо-действию с металлами, что способствует стабилизации их дисперсного состояния ► рНИЭТ = 4 (прокалённый) - 6.7 (гидратированный)
 Использование ZrO2 в катализе Носитель для катализаторов высокотемпературных процессов: получение синтез-газа паровой конверсией метана восстановление NOx окисление СО синтез Фишера-Тропша гидрообессеривание дегидрирование этилбензола в стирол Промотированный SO42 активный катализатор кислотного типа: изомеризация алканов нитрование бензола
Использование ZrO2 в катализе Носитель для катализаторов высокотемпературных процессов: получение синтез-газа паровой конверсией метана восстановление NOx окисление СО синтез Фишера-Тропша гидрообессеривание дегидрирование этилбензола в стирол Промотированный SO42 активный катализатор кислотного типа: изомеризация алканов нитрование бензола
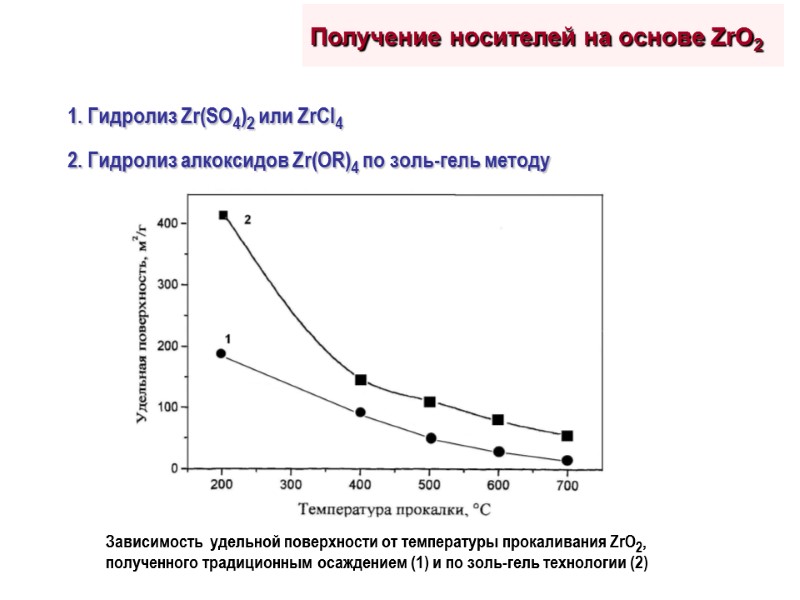
 Получение носителей на основе ZrO2
Получение носителей на основе ZrO2
 6.2.5. Оксид магния – MgO Основные характеристики ► Очень тугоплавкий оксид ► Неудовлетворительная механическая прочность ► Плохо формуется ► Химически нестоек ► рНИЭТ = 12.4 Структура: кубическая (NaCl) Использование в катализе ● Модельный носитель щелочного типа ● Носитель для металлов Ru-Cs/MgO – синтез аммиака Pd/MgO – глубокое окисление ● Носитель для оксидов V2O5/MgO – окислительное дегидрирова-ние пропана в пропилен Получение носителей на основе MgO Термическое разложение солей: MgCO3, MgC2O4 брусита (или осажденного гидроксида): Mg(OH)2 Гидролиз алкоксидов Mg(OR)2 по золь-гель методу
6.2.5. Оксид магния – MgO Основные характеристики ► Очень тугоплавкий оксид ► Неудовлетворительная механическая прочность ► Плохо формуется ► Химически нестоек ► рНИЭТ = 12.4 Структура: кубическая (NaCl) Использование в катализе ● Модельный носитель щелочного типа ● Носитель для металлов Ru-Cs/MgO – синтез аммиака Pd/MgO – глубокое окисление ● Носитель для оксидов V2O5/MgO – окислительное дегидрирова-ние пропана в пропилен Получение носителей на основе MgO Термическое разложение солей: MgCO3, MgC2O4 брусита (или осажденного гидроксида): Mg(OH)2 Гидролиз алкоксидов Mg(OR)2 по золь-гель методу
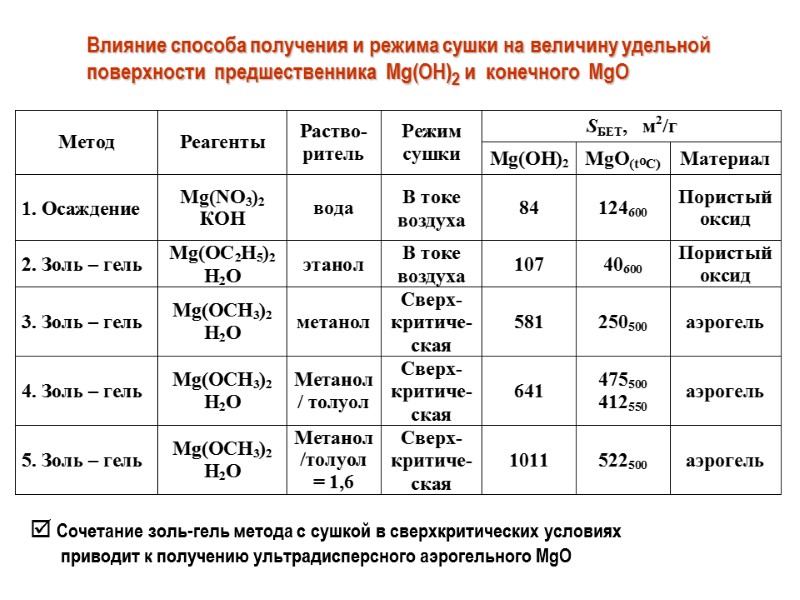
 Влияние способа получения и режима сушки на величину удельной поверхности предшественника Mg(OH)2 и конечного MgO Сочетание золь-гель метода с сушкой в сверхкритических условиях приводит к получению ультрадисперсного аэрогельного MgO
Влияние способа получения и режима сушки на величину удельной поверхности предшественника Mg(OH)2 и конечного MgO Сочетание золь-гель метода с сушкой в сверхкритических условиях приводит к получению ультрадисперсного аэрогельного MgO

