НИТРОВАНИЕ.ppt
- Количество слайдов: 29
 6. НИТРОВАНИЕ Нитрование ароматических соединений. Нитрующие агенты, их влияние на механизм, кинетику и основные факторы процесса нитрования. . Особенности нитрования различных классов ароматических соединений (бензол, нафталин, антрахинон, ароматические сульфокислоты, амины и фенолы). Теоретический и прикладной аспекты. Методы контроля. Побочные реакции Технология нитрования непрерывным и периодическим методами
6. НИТРОВАНИЕ Нитрование ароматических соединений. Нитрующие агенты, их влияние на механизм, кинетику и основные факторы процесса нитрования. . Особенности нитрования различных классов ароматических соединений (бензол, нафталин, антрахинон, ароматические сульфокислоты, амины и фенолы). Теоретический и прикладной аспекты. Методы контроля. Побочные реакции Технология нитрования непрерывным и периодическим методами
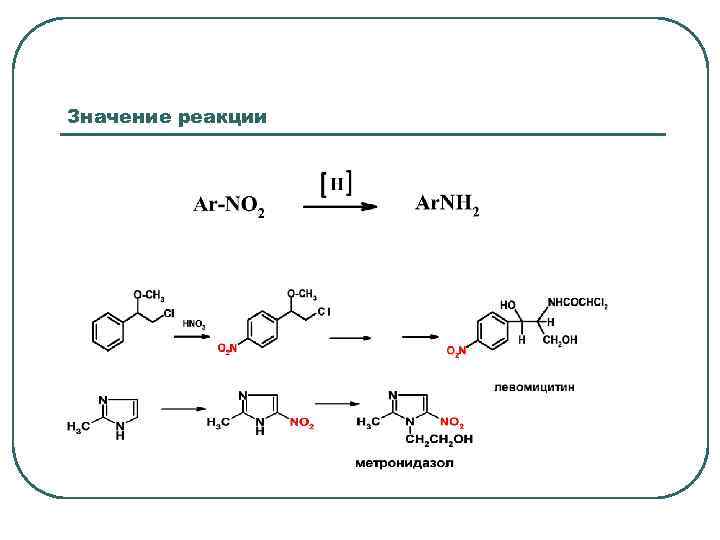 Значение реакции
Значение реакции

 Реагенты для проведения реакции нитрования: l l l l 1. Наиболее распространенный: HNO 3 (63 -65%, d 1. 35 г/мл, ) + H 2 SO 4 (96%). 2. Для мало реакционноспособных соединений. HNO 3 (98%, d 1. 5 г/мл) + H 2 SO 4 (96%-100 %). 3. Для очень мало реакционноспособных соединений. HNO 3 (98%) + SO 3 (4 -63%), олеум. 4. Для получения полинитропроизводных: К(Na)NO 3 или NH 4 NO 3 + H 2 SO 4 (96%). 5. Для реакционноспособных соединений, селективный реагент: HNO 3 (98%, d 1. 5 г/мл) + (CH 3 CO)2 O (или СН 3 СООН 6. Для реакционноспособных соединений: Для реакционноспособных соединений. HNO 3 (d 1, 3 - 1, 5). Осложнение – побочная реакция окисления.
Реагенты для проведения реакции нитрования: l l l l 1. Наиболее распространенный: HNO 3 (63 -65%, d 1. 35 г/мл, ) + H 2 SO 4 (96%). 2. Для мало реакционноспособных соединений. HNO 3 (98%, d 1. 5 г/мл) + H 2 SO 4 (96%-100 %). 3. Для очень мало реакционноспособных соединений. HNO 3 (98%) + SO 3 (4 -63%), олеум. 4. Для получения полинитропроизводных: К(Na)NO 3 или NH 4 NO 3 + H 2 SO 4 (96%). 5. Для реакционноспособных соединений, селективный реагент: HNO 3 (98%, d 1. 5 г/мл) + (CH 3 CO)2 O (или СН 3 СООН 6. Для реакционноспособных соединений: Для реакционноспособных соединений. HNO 3 (d 1, 3 - 1, 5). Осложнение – побочная реакция окисления.
 В отличие от сульфирования реакция нитрования необратима. дейтерированными соединениями показали, что медленной является образование промежуточного комплекса. Распад протекает практически мгновенно. Таким образом, общая процесса определяется первой его стадией. Опыты с стадией же его скорость
В отличие от сульфирования реакция нитрования необратима. дейтерированными соединениями показали, что медленной является образование промежуточного комплекса. Распад протекает практически мгновенно. Таким образом, общая процесса определяется первой его стадией. Опыты с стадией же его скорость
 Кинетическое уравнение процесса Скорость реакции прямо зависит от концентрации азотной и серной кислот
Кинетическое уравнение процесса Скорость реакции прямо зависит от концентрации азотной и серной кислот
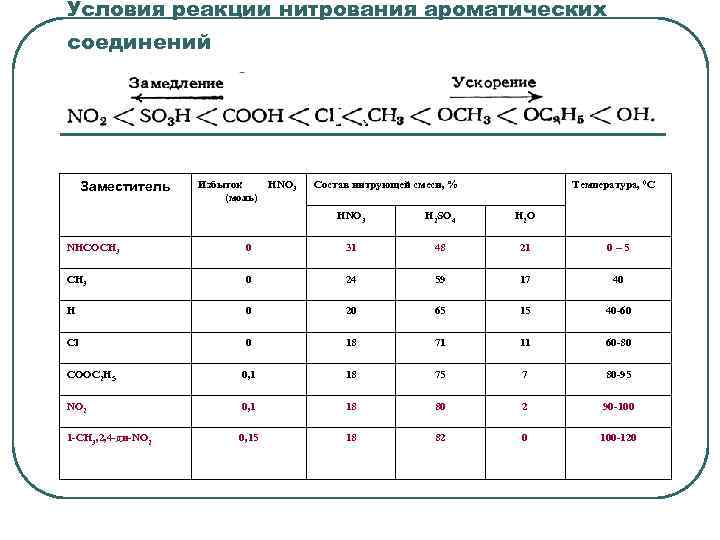 Условия реакции нитрования ароматических соединений Заместитель Избыток HNO 3 (моль) Состав нитрующей смеси, % Температура, 0 С HNO 3 H 2 SO 4 H 2 O NHCOCH 3 0 31 48 21 0– 5 CH 3 0 24 59 17 40 H 0 20 65 15 40 -60 Cl 0 18 71 11 60 -80 COOC 2 H 5 0, 1 18 75 7 80 -95 NO 2 0, 1 18 80 2 90 -100 1 -CH 3, 2, 4 -ди-NO 2 0, 15 18 82 0 100 -120
Условия реакции нитрования ароматических соединений Заместитель Избыток HNO 3 (моль) Состав нитрующей смеси, % Температура, 0 С HNO 3 H 2 SO 4 H 2 O NHCOCH 3 0 31 48 21 0– 5 CH 3 0 24 59 17 40 H 0 20 65 15 40 -60 Cl 0 18 71 11 60 -80 COOC 2 H 5 0, 1 18 75 7 80 -95 NO 2 0, 1 18 80 2 90 -100 1 -CH 3, 2, 4 -ди-NO 2 0, 15 18 82 0 100 -120
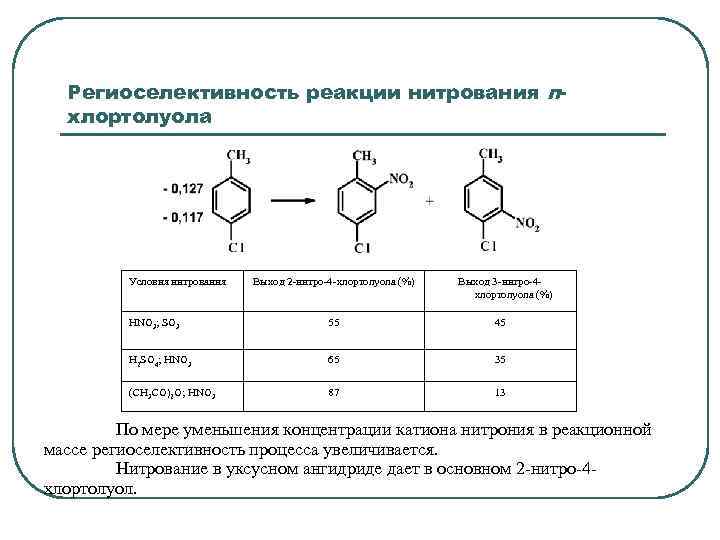 Региоселективность реакции нитрования пхлортолуола Условия нитрования Выход 2 -нитро-4 -хлортолуола (%) Выход 3 -нитро-4 хлортолуола (%) HNO 3; SO 3 55 45 H 2 SO 4; HNO 3 65 35 (CH 3 CO)2 О; HNO 3 87 13 По мере уменьшения концентрации катиона нитрония в реакционной массе региоселективность процесса увеличивается. Нитрование в уксусном ангидриде дает в основном 2 -нитро-4 хлортолуол.
Региоселективность реакции нитрования пхлортолуола Условия нитрования Выход 2 -нитро-4 -хлортолуола (%) Выход 3 -нитро-4 хлортолуола (%) HNO 3; SO 3 55 45 H 2 SO 4; HNO 3 65 35 (CH 3 CO)2 О; HNO 3 87 13 По мере уменьшения концентрации катиона нитрония в реакционной массе региоселективность процесса увеличивается. Нитрование в уксусном ангидриде дает в основном 2 -нитро-4 хлортолуол.
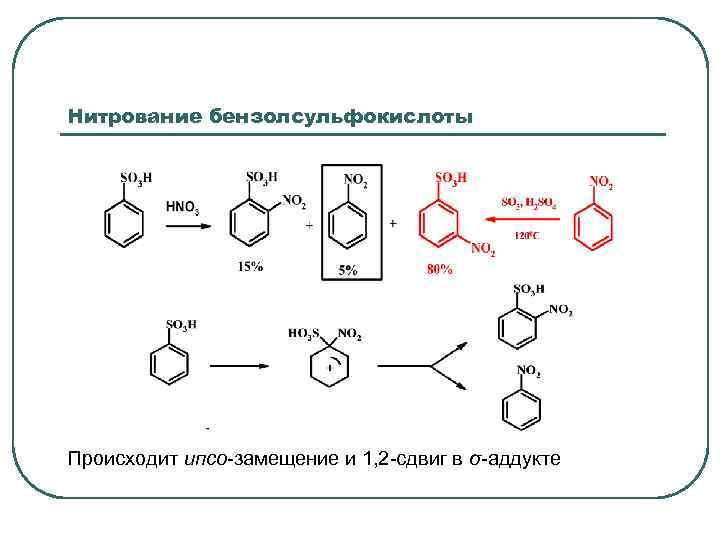 Нитрование бензолсульфокислоты Происходит ипсо-замещение и 1, 2 -сдвиг в σ-аддукте
Нитрование бензолсульфокислоты Происходит ипсо-замещение и 1, 2 -сдвиг в σ-аддукте
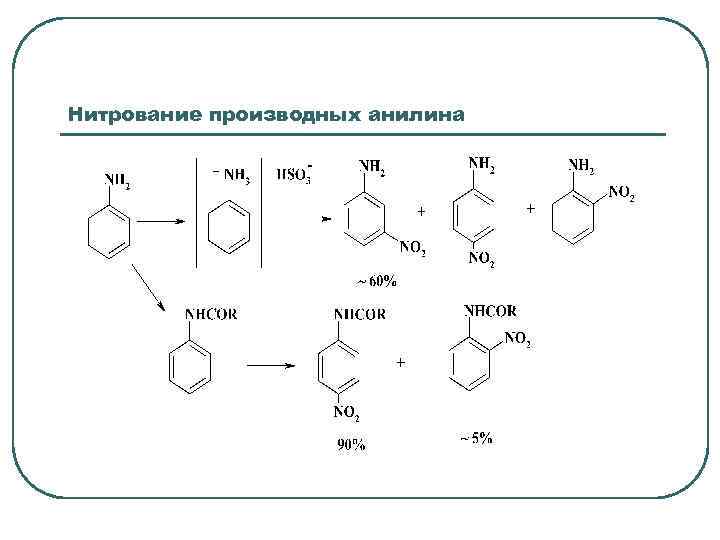 Нитрование производных анилина
Нитрование производных анилина
 При концентрации серной кислоты выше 80% анилин полностью протонирован и присутствует в растворе в виде анилиний сульфата, аммонийная группа ориентирует атаку катиона нитрония в метаположение. Тем не менее при нитровании анилина в 98% серной кислоте образуется смесь изомеров: о- ~ 1%, п- около 30%, м- более 60% и продукты осмоления. Для N, N-диметиланилина соотношение м- и пизомеров составляет 78: 22. Синтез п-нитроанилина может быть осуществлен нитрованием ациланилида при низкой температуре с последующим гидролизом ацильной группы. В промышленности о- и п-нитроанилины синтезируют из соответствующих производных нитрохлорбензола с водным аммиаком под давлением
При концентрации серной кислоты выше 80% анилин полностью протонирован и присутствует в растворе в виде анилиний сульфата, аммонийная группа ориентирует атаку катиона нитрония в метаположение. Тем не менее при нитровании анилина в 98% серной кислоте образуется смесь изомеров: о- ~ 1%, п- около 30%, м- более 60% и продукты осмоления. Для N, N-диметиланилина соотношение м- и пизомеров составляет 78: 22. Синтез п-нитроанилина может быть осуществлен нитрованием ациланилида при низкой температуре с последующим гидролизом ацильной группы. В промышленности о- и п-нитроанилины синтезируют из соответствующих производных нитрохлорбензола с водным аммиаком под давлением
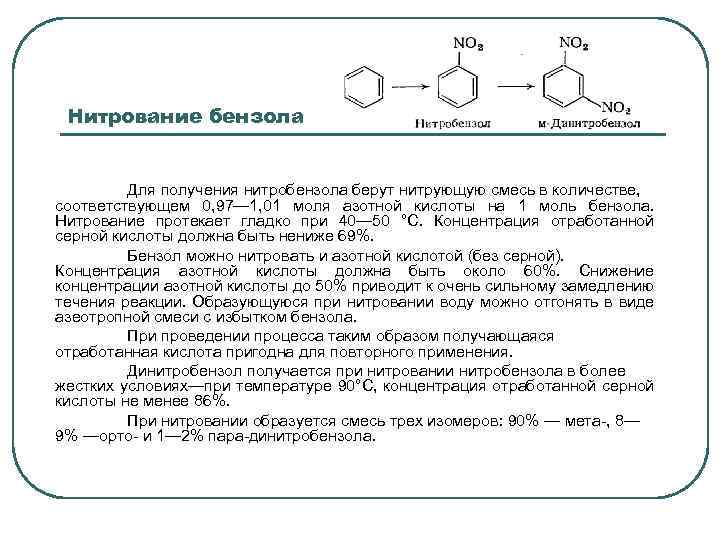 Нитрование бензола Для получения нитробензола берут нитрующую смесь в количестве, соответствующем 0, 97— 1, 01 моля азотной кислоты на 1 моль бензола. Нитрование протекает гладко при 40— 50 °С. Концентрация отработанной серной кислоты должна быть нениже 69%. Бензол можно нитровать и азотной кислотой (без серной). Концентрация азотной кислоты должна быть около 60%. Снижение концентрации азотной кислоты до 50% приводит к очень сильному замедлению течения реакции. Образующуюся при нитровании воду можно отгонять в виде азеотропной смеси с избытком бензола. При проведении процесса таким образом получающаяся отработанная кислота пригодна для повторного применения. Динитробензол получается при нитровании нитробензола в более жестких условиях—при температуре 90°С, концентрация отработанной серной кислоты не менее 86%. При нитровании образуется смесь трех изомеров: 90% — мета-, 8— 9% —орто- и 1— 2% пара-динитробензола.
Нитрование бензола Для получения нитробензола берут нитрующую смесь в количестве, соответствующем 0, 97— 1, 01 моля азотной кислоты на 1 моль бензола. Нитрование протекает гладко при 40— 50 °С. Концентрация отработанной серной кислоты должна быть нениже 69%. Бензол можно нитровать и азотной кислотой (без серной). Концентрация азотной кислоты должна быть около 60%. Снижение концентрации азотной кислоты до 50% приводит к очень сильному замедлению течения реакции. Образующуюся при нитровании воду можно отгонять в виде азеотропной смеси с избытком бензола. При проведении процесса таким образом получающаяся отработанная кислота пригодна для повторного применения. Динитробензол получается при нитровании нитробензола в более жестких условиях—при температуре 90°С, концентрация отработанной серной кислоты не менее 86%. При нитровании образуется смесь трех изомеров: 90% — мета-, 8— 9% —орто- и 1— 2% пара-динитробензола.
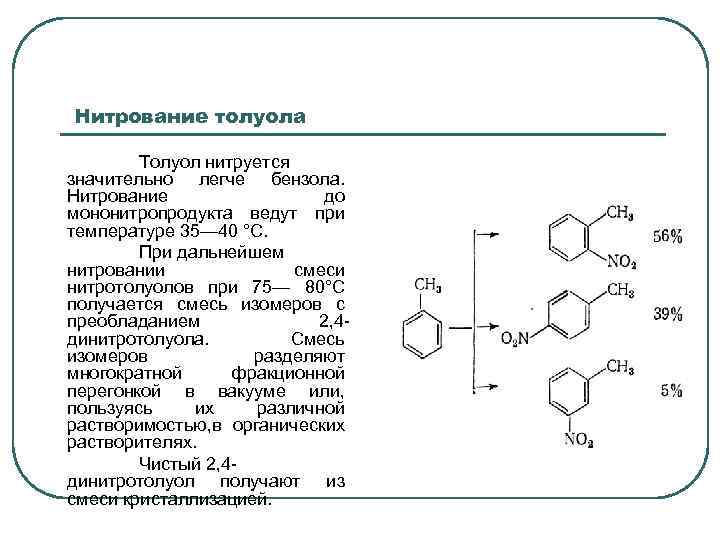 Нитрование толуола Толуол нитруется значительно легче бензола. Нитрование до мононитропродукта ведут при температуре 35— 40 °С. При дальнейшем нитровании смеси нитротолуолов при 75— 80°С получается смесь изомеров с преобладанием 2, 4 динитротолуола. Смесь изомеров разделяют многократной фракционной перегонкой в вакууме или, пользуясь их различной растворимостью, в органических растворителях. Чистый 2, 4 динитротолуол получают из смеси кристаллизацией.
Нитрование толуола Толуол нитруется значительно легче бензола. Нитрование до мононитропродукта ведут при температуре 35— 40 °С. При дальнейшем нитровании смеси нитротолуолов при 75— 80°С получается смесь изомеров с преобладанием 2, 4 динитротолуола. Смесь изомеров разделяют многократной фракционной перегонкой в вакууме или, пользуясь их различной растворимостью, в органических растворителях. Чистый 2, 4 динитротолуол получают из смеси кристаллизацией.
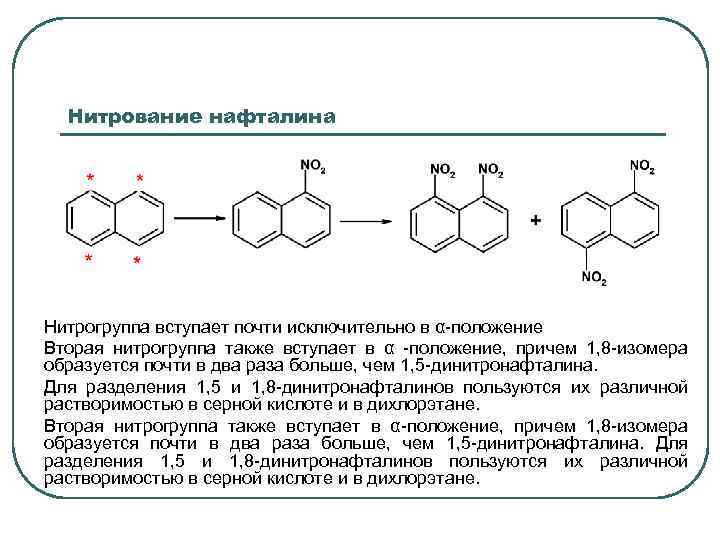 Нитрование нафталина Нитрогруппа вступает почти исключительно в α-положение Вторая нитрогруппа также вступает в α -положение, причем 1, 8 -изомера образуется почти в два раза больше, чем 1, 5 -динитронафталина. Для разделения 1, 5 и 1, 8 -динитронафталинов пользуются их различной растворимостью в серной кислоте и в дихлорэтане. Вторая нитрогруппа также вступает в α-положение, причем 1, 8 -изомера образуется почти в два раза больше, чем 1, 5 -динитронафталина. Для разделения 1, 5 и 1, 8 -динитронафталинов пользуются их различной растворимостью в серной кислоте и в дихлорэтане.
Нитрование нафталина Нитрогруппа вступает почти исключительно в α-положение Вторая нитрогруппа также вступает в α -положение, причем 1, 8 -изомера образуется почти в два раза больше, чем 1, 5 -динитронафталина. Для разделения 1, 5 и 1, 8 -динитронафталинов пользуются их различной растворимостью в серной кислоте и в дихлорэтане. Вторая нитрогруппа также вступает в α-положение, причем 1, 8 -изомера образуется почти в два раза больше, чем 1, 5 -динитронафталина. Для разделения 1, 5 и 1, 8 -динитронафталинов пользуются их различной растворимостью в серной кислоте и в дихлорэтане.
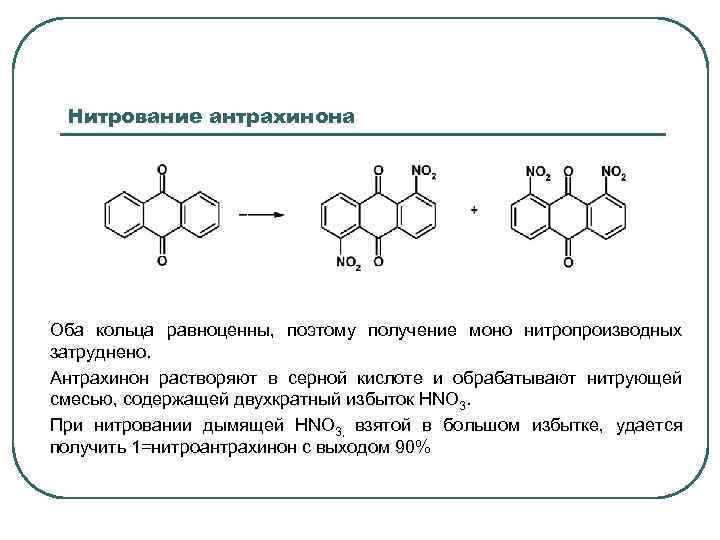 Нитрование антрахинона Оба кольца равноценны, поэтому получение моно нитропроизводных затруднено. Антрахинон растворяют в серной кислоте и обрабатывают нитрующей смесью, содержащей двухкратный избыток НNО 3. При нитровании дымящей НNО 3, взятой в большом избытке, удается получить 1=нитроантрахинон с выходом 90%
Нитрование антрахинона Оба кольца равноценны, поэтому получение моно нитропроизводных затруднено. Антрахинон растворяют в серной кислоте и обрабатывают нитрующей смесью, содержащей двухкратный избыток НNО 3. При нитровании дымящей НNО 3, взятой в большом избытке, удается получить 1=нитроантрахинон с выходом 90%
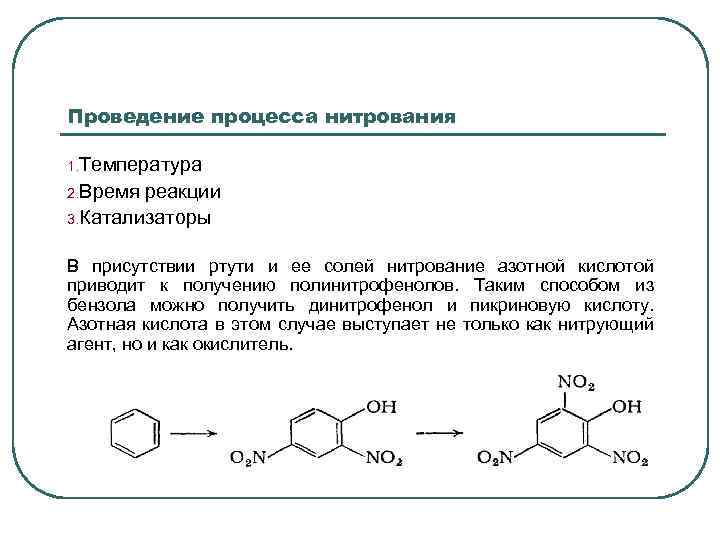 Проведение процесса нитрования 1. Температура 2. Время реакции 3. Катализаторы В присутствии ртути и ее солей нитрование азотной кислотой приводит к получению полинитрофенолов. Таким способом из бензола можно получить динитрофенол и пикриновую кислоту. Азотная кислота в этом случае выступает не только как нитрующий агент, но и как окислитель.
Проведение процесса нитрования 1. Температура 2. Время реакции 3. Катализаторы В присутствии ртути и ее солей нитрование азотной кислотой приводит к получению полинитрофенолов. Таким способом из бензола можно получить динитрофенол и пикриновую кислоту. Азотная кислота в этом случае выступает не только как нитрующий агент, но и как окислитель.
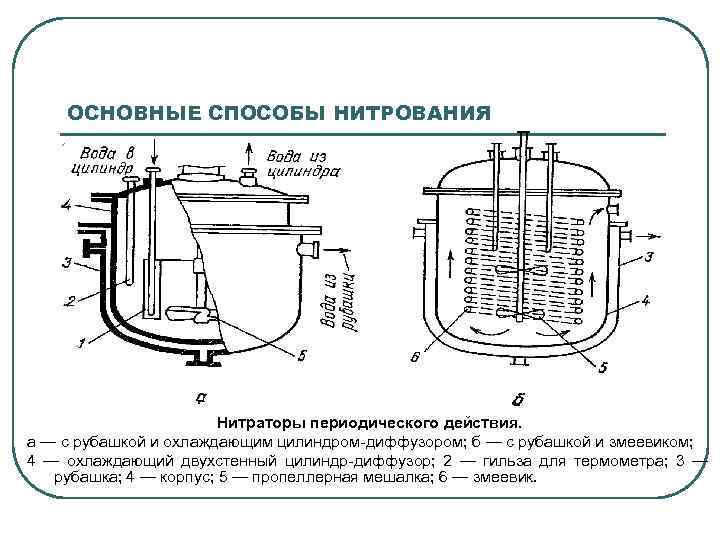 ОСНОВНЫЕ СПОСОБЫ НИТРОВАНИЯ Нитраторы периодического действия. а — с рубашкой и охлаждающим цилиндром-диффузором; б — с рубашкой и змеевиком; 4 — охлаждающий двухстенный цилиндр-диффузор; 2 — гильза для термометра; 3 — рубашка; 4 — корпус; 5 — пропеллерная мешалка; 6 — змеевик.
ОСНОВНЫЕ СПОСОБЫ НИТРОВАНИЯ Нитраторы периодического действия. а — с рубашкой и охлаждающим цилиндром-диффузором; б — с рубашкой и змеевиком; 4 — охлаждающий двухстенный цилиндр-диффузор; 2 — гильза для термометра; 3 — рубашка; 4 — корпус; 5 — пропеллерная мешалка; 6 — змеевик.
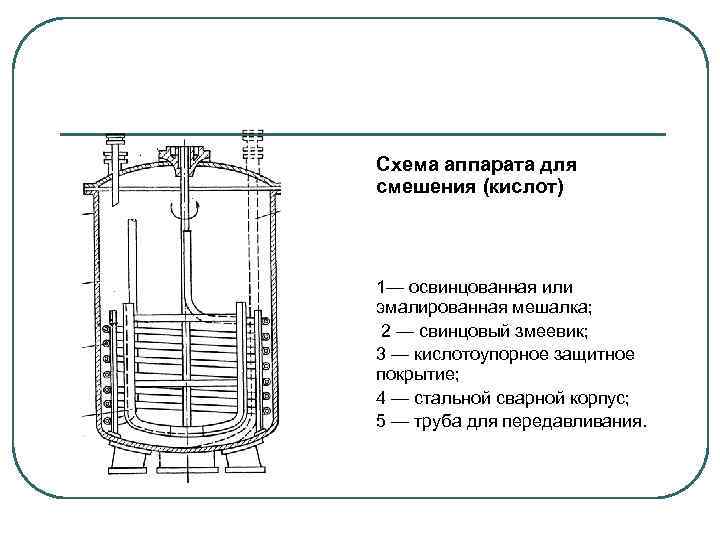 Схема аппарата для смешения (кислот) 1— освинцованная или эмалированная мешалка; 2 — свинцовый змеевик; 3 — кислотоупорное защитное покрытие; 4 — стальной сварной корпус; 5 — труба для передавливания.
Схема аппарата для смешения (кислот) 1— освинцованная или эмалированная мешалка; 2 — свинцовый змеевик; 3 — кислотоупорное защитное покрытие; 4 — стальной сварной корпус; 5 — труба для передавливания.

 Нитратор непрерывного действия. 1— пропеллерная мешалка; 2 — трубчатка; 3 -корпус; 4 --кран для регулирования подачи нитрующего агента
Нитратор непрерывного действия. 1— пропеллерная мешалка; 2 — трубчатка; 3 -корпус; 4 --кран для регулирования подачи нитрующего агента
 Выделение нитропродуктов l. Отстаивание l. Нейтрализация l. Кристаллизация (перегонка) l. Денитрация и концентрирование отработанной кислоты При отделении застывающих нитропродуктов отстойники снабжают рубашками или змеевиками для обогрева. В некоторых случаях для предохранения от коррозии отстойники футеруют кислотоупорной плиткой или освинцовывают.
Выделение нитропродуктов l. Отстаивание l. Нейтрализация l. Кристаллизация (перегонка) l. Денитрация и концентрирование отработанной кислоты При отделении застывающих нитропродуктов отстойники снабжают рубашками или змеевиками для обогрева. В некоторых случаях для предохранения от коррозии отстойники футеруют кислотоупорной плиткой или освинцовывают.
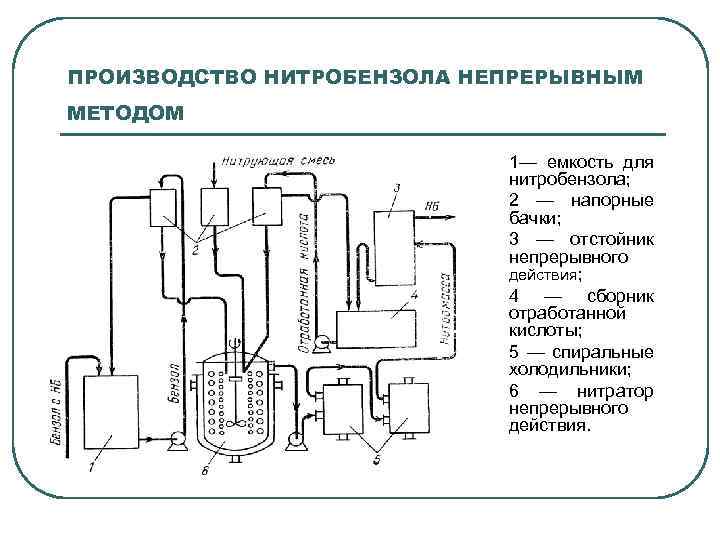 ПРОИЗВОДСТВО НИТРОБЕНЗОЛА НЕПРЕРЫВНЫМ МЕТОДОМ 1— емкость для нитробензола; 2 — напорные бачки; 3 — отстойник непрерывного действия; 4 — сборник отработанной кислоты; 5 — спиральные холодильники; 6 — нитратор непрерывного действия.
ПРОИЗВОДСТВО НИТРОБЕНЗОЛА НЕПРЕРЫВНЫМ МЕТОДОМ 1— емкость для нитробензола; 2 — напорные бачки; 3 — отстойник непрерывного действия; 4 — сборник отработанной кислоты; 5 — спиральные холодильники; 6 — нитратор непрерывного действия.
 Контроль процесса Для определения конца реакции lизмеряют плотность нитросоединения (при нитровании бензола, толуола, хлорбензола), lтемпературу застывания реакционной массы (производство динитробензола, динитрохлорбензола, а-нитронафталина), lсодержание HNO 3 в отработанной кислоте. Для количественного определения содержания нитросоединеий в продукте обычно восстанавливают нитрогруппу в уксуснокислом растворе цинком или в солянокислом растворе хлоридом олова(II) с последующим количественным определением аминогруппы диазотированием. Хорошим методом количественного определения нитрогруппы является титрование хлоридом титана. Реакция протекает по уравнению: RNO 2 + 6 Ti. C 13 -I- 6 HC 1 > RNH 2 + 6 Ti. Cl 4 + 2 R>0. Титр хлорида титана предварительно устанавливают по раствору соли желсза(Ш), обычно железоаммопийных квасцов, индикатором служит роданид калия. Чистоту полученных нитросоединений контролируют также по точке плавления.
Контроль процесса Для определения конца реакции lизмеряют плотность нитросоединения (при нитровании бензола, толуола, хлорбензола), lтемпературу застывания реакционной массы (производство динитробензола, динитрохлорбензола, а-нитронафталина), lсодержание HNO 3 в отработанной кислоте. Для количественного определения содержания нитросоединеий в продукте обычно восстанавливают нитрогруппу в уксуснокислом растворе цинком или в солянокислом растворе хлоридом олова(II) с последующим количественным определением аминогруппы диазотированием. Хорошим методом количественного определения нитрогруппы является титрование хлоридом титана. Реакция протекает по уравнению: RNO 2 + 6 Ti. C 13 -I- 6 HC 1 > RNH 2 + 6 Ti. Cl 4 + 2 R>0. Титр хлорида титана предварительно устанавливают по раствору соли желсза(Ш), обычно железоаммопийных квасцов, индикатором служит роданид калия. Чистоту полученных нитросоединений контролируют также по точке плавления.
 5. Нитрозирование
5. Нитрозирование
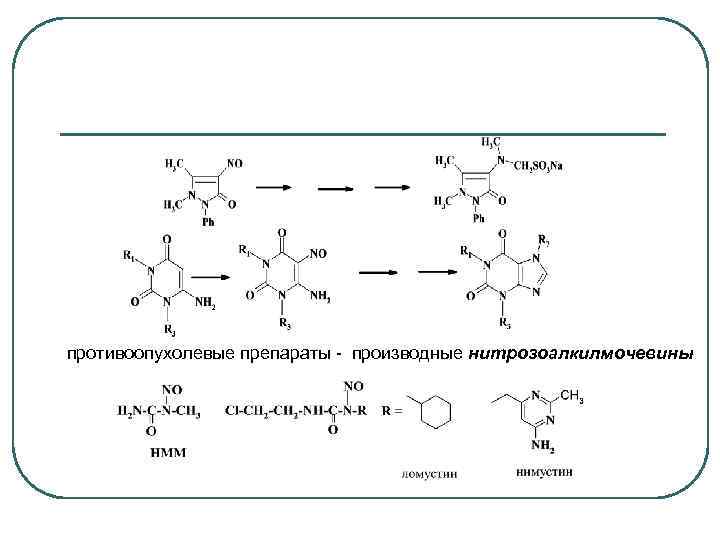 противоопухолевые препараты - производные нитрозоалкилмочевины
противоопухолевые препараты - производные нитрозоалкилмочевины
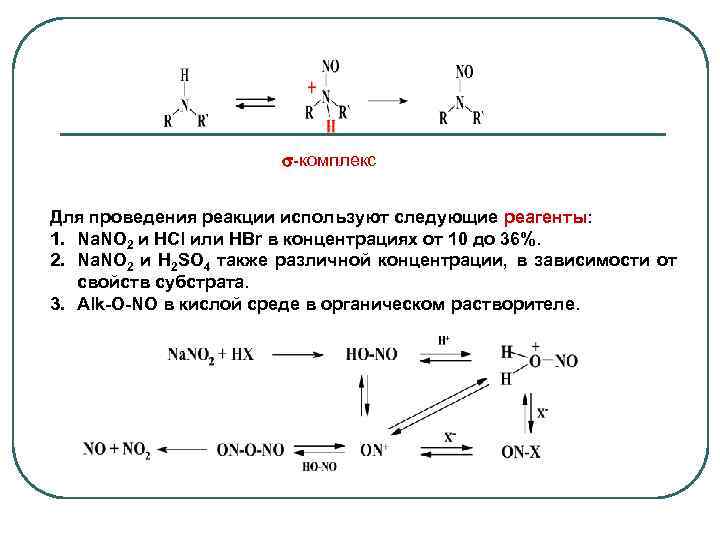 -комплекс Для проведения реакции используют следующие реагенты: 1. Na. NO 2 и HCl или HBr в концентрациях от 10 до 36%. 2. Na. NO 2 и H 2 SO 4 также различной концентрации, в зависимости от свойств субстрата. 3. Alk-O-NO в кислой среде в органическом растворителе.
-комплекс Для проведения реакции используют следующие реагенты: 1. Na. NO 2 и HCl или HBr в концентрациях от 10 до 36%. 2. Na. NO 2 и H 2 SO 4 также различной концентрации, в зависимости от свойств субстрата. 3. Alk-O-NO в кислой среде в органическом растворителе.
 Агент - катион нитрозония - NO+ существенно более слабый электрофил, чем катион нитрония Реакция нитрозирования может быть осуществлена в мягких условиях при наличии таких сильных электронодонорных групп, как OH, NH 2, NHAlk, NHAr, N(Alk)2 Имеются ограничения. При наличии в субстрате реакции первичной аминогруппы практически во всех случаях, за редким исключением, идет реакция диазотирования. Прямое С-нитрозирование первичных аминов удалось осуществить добавлением амина к охлажденному раствору Na. NO 2 в концентрированной серной кислоте без доступа влаги.
Агент - катион нитрозония - NO+ существенно более слабый электрофил, чем катион нитрония Реакция нитрозирования может быть осуществлена в мягких условиях при наличии таких сильных электронодонорных групп, как OH, NH 2, NHAlk, NHAr, N(Alk)2 Имеются ограничения. При наличии в субстрате реакции первичной аминогруппы практически во всех случаях, за редким исключением, идет реакция диазотирования. Прямое С-нитрозирование первичных аминов удалось осуществить добавлением амина к охлажденному раствору Na. NO 2 в концентрированной серной кислоте без доступа влаги.
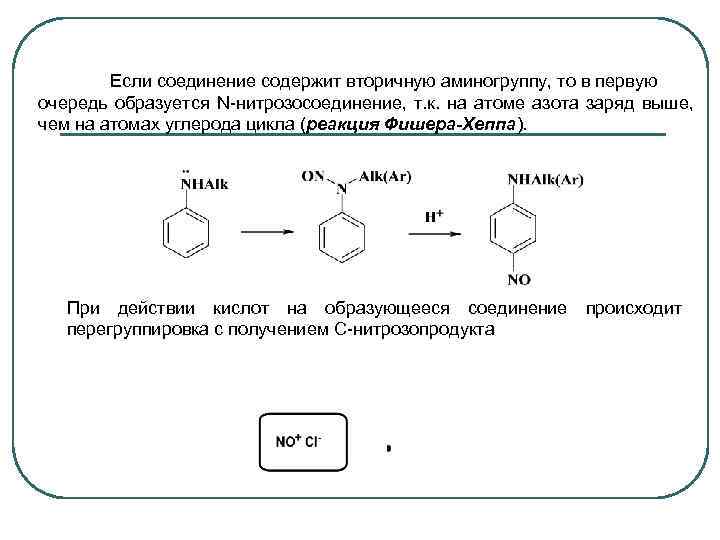 Если соединение содержит вторичную аминогруппу, то в первую очередь образуется N-нитрозосоединение, т. к. на атоме азота заряд выше, чем на атомах углерода цикла (реакция Фишера-Хеппа). При действии кислот на образующееся соединение перегруппировка с получением С-нитрозопродукта происходит
Если соединение содержит вторичную аминогруппу, то в первую очередь образуется N-нитрозосоединение, т. к. на атоме азота заряд выше, чем на атомах углерода цикла (реакция Фишера-Хеппа). При действии кислот на образующееся соединение перегруппировка с получением С-нитрозопродукта происходит



