5. Химическая кинетика











 5. Химическая кинетика • учение о механизме(стадиях) химических реакций • закономерности развития химических реакций во времени в зависимости от условий протекания. Факторы, влияющие на скорость протекания реакции: - концентрация реагирующих веществ, - температура, - давление, - свойства среды, -катализаторы, …. Хим. кинетика содержит 2 раздела: -учение о механизме хим. взаимодействия(стадии, молекулярность) -формальная кинетика- математ. описание изменения количества реагирующих веществ во времени без учета реального механизма)
5. Химическая кинетика • учение о механизме(стадиях) химических реакций • закономерности развития химических реакций во времени в зависимости от условий протекания. Факторы, влияющие на скорость протекания реакции: - концентрация реагирующих веществ, - температура, - давление, - свойства среды, -катализаторы, …. Хим. кинетика содержит 2 раздела: -учение о механизме хим. взаимодействия(стадии, молекулярность) -формальная кинетика- математ. описание изменения количества реагирующих веществ во времени без учета реального механизма)
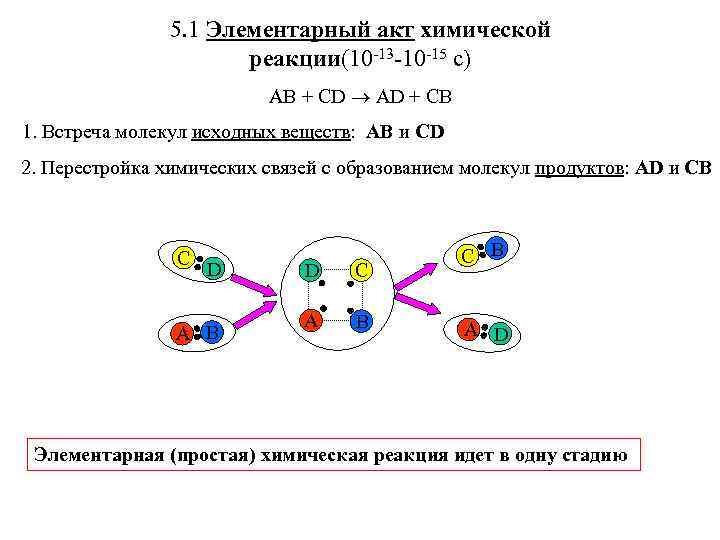
 5. 1 Элементарный акт химической реакции(10 -13 -10 -15 с) AB + CD AD + CB 1. Встреча молекул исходных веществ: AB и CD 2. Перестройка химических связей с образованием молекул продуктов: AD и CB C B D C A B A D A B Элементарная (простая) химическая реакция идет в одну стадию
5. 1 Элементарный акт химической реакции(10 -13 -10 -15 с) AB + CD AD + CB 1. Встреча молекул исходных веществ: AB и CD 2. Перестройка химических связей с образованием молекул продуктов: AD и CB C B D C A B A D A B Элементарная (простая) химическая реакция идет в одну стадию
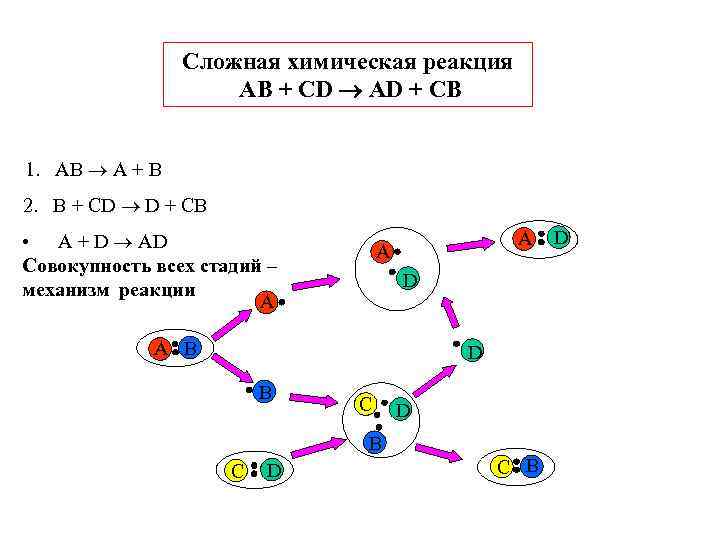
 Сложная химическая реакция AB + CD AD + CB 1. AB A + B 2. B + CD D + CB • A + D AD A Совокупность всех стадий – механизм реакции D A B D B C D B C D C B
Сложная химическая реакция AB + CD AD + CB 1. AB A + B 2. B + CD D + CB • A + D AD A Совокупность всех стадий – механизм реакции D A B D B C D B C D C B
 Частицы, участвующие в элементарной химической реакции: • Молекулы 2 NO + O 2 2 NO 2 • Ионы H+ + OH- H 2 O • Радикалы H + Cl HCl макромолекулы (~102 – 106 атомов) поверхностные атомы или молекулы
Частицы, участвующие в элементарной химической реакции: • Молекулы 2 NO + O 2 2 NO 2 • Ионы H+ + OH- H 2 O • Радикалы H + Cl HCl макромолекулы (~102 – 106 атомов) поверхностные атомы или молекулы
 5. 2 Элементарная(одностадийная) гомогенная реакция AA + BB DD • реакционное пространство V – объем(гомогенн. процесс) • реакционная поверхность S - пов-ть (гетерогенн. процесс) • Число частиц, участвующих в элементарном химическом акте: A + B молекулярность реакции мономолекулярные A + B =1 АВ А + В бимолекулярные A + B =2 А + В АВ тримолекулярные A + B =3 2 А + В А 2 В • скорость элементарной химической реакции - число элементарных актов (r), совершающихся в единицу времени (t) в единице реакционного объема:
5. 2 Элементарная(одностадийная) гомогенная реакция AA + BB DD • реакционное пространство V – объем(гомогенн. процесс) • реакционная поверхность S - пов-ть (гетерогенн. процесс) • Число частиц, участвующих в элементарном химическом акте: A + B молекулярность реакции мономолекулярные A + B =1 АВ А + В бимолекулярные A + B =2 А + В АВ тримолекулярные A + B =3 2 А + В А 2 В • скорость элементарной химической реакции - число элементарных актов (r), совершающихся в единицу времени (t) в единице реакционного объема:
 Скорость элементарной реакции число элементарных актов(r) в единицу времени t в единице реакционного объёма V AA + BB DD
Скорость элементарной реакции число элементарных актов(r) в единицу времени t в единице реакционного объёма V AA + BB DD
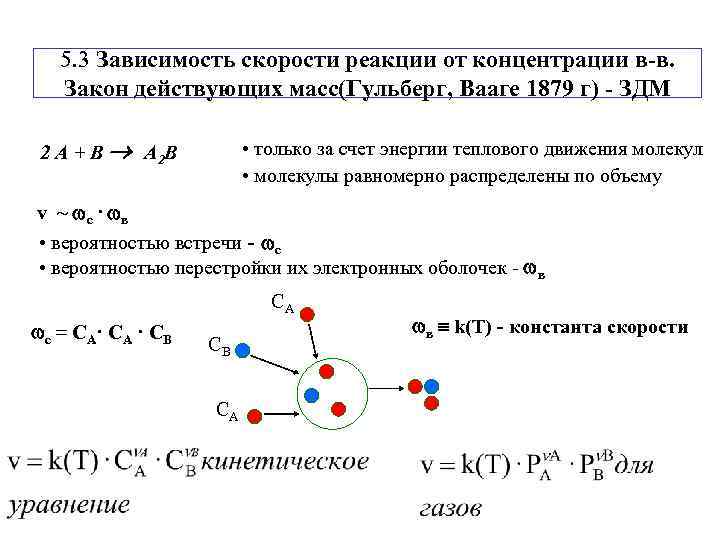
 5. 3 Зависимость скорости реакции от концентрации в-в. Закон действующих масс(Гульберг, Вааге 1879 г) - ЗДМ 2 А + В А 2 В • только за счет энергии теплового движения молекул • молекулы равномерно распределены по объему v ~ с · в • вероятностью встречи - с • вероятностью перестройки их электронных оболочек - в СА с = СА· СА · СВ в k(T) - константа скорости СВ СА
5. 3 Зависимость скорости реакции от концентрации в-в. Закон действующих масс(Гульберг, Вааге 1879 г) - ЗДМ 2 А + В А 2 В • только за счет энергии теплового движения молекул • молекулы равномерно распределены по объему v ~ с · в • вероятностью встречи - с • вероятностью перестройки их электронных оболочек - в СА с = СА· СА · СВ в k(T) - константа скорости СВ СА
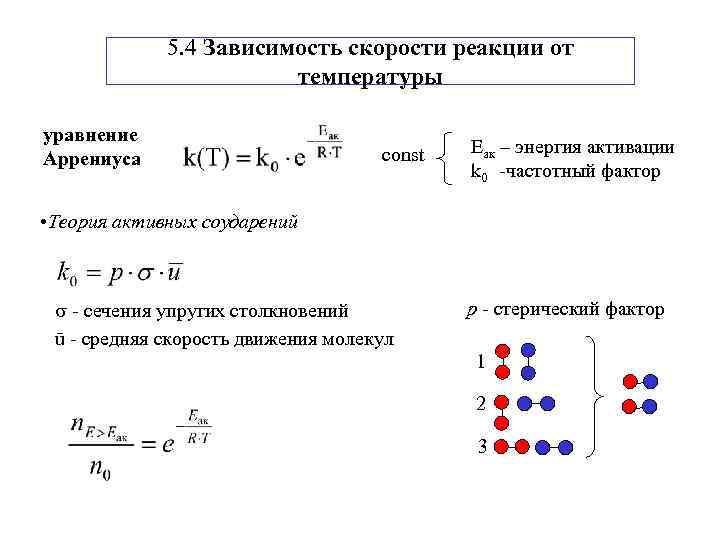
 5. 4 Зависимость скорости реакции от температуры уравнение const Еак – энергия активации Аррениуса k 0 -частотный фактор • Теория активных соударений - сечения упругих столкновений р - cтерический фактор ū - средняя скорость движения молекул 1 2 3
5. 4 Зависимость скорости реакции от температуры уравнение const Еак – энергия активации Аррениуса k 0 -частотный фактор • Теория активных соударений - сечения упругих столкновений р - cтерический фактор ū - средняя скорость движения молекул 1 2 3
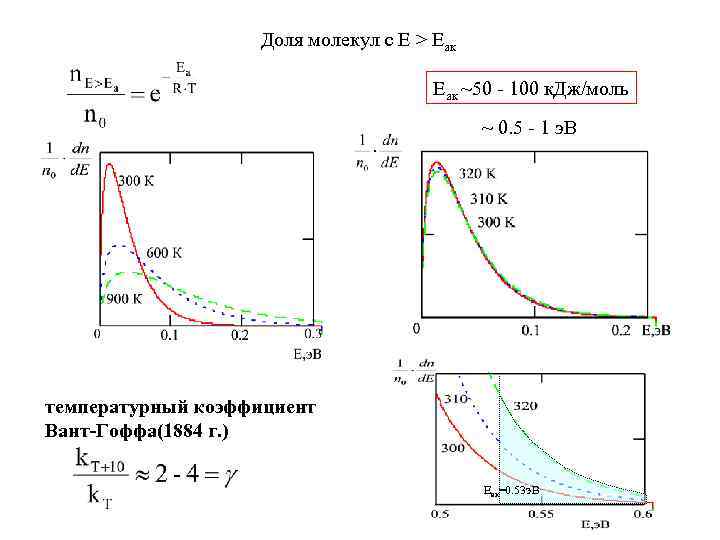
 Доля молекул с Е > Еак Еак ~50 - 100 к. Дж/моль ~ 0. 5 - 1 э. В температурный коэффициент Вант-Гоффа(1884 г. ) Еак=0. 53 э. В
Доля молекул с Е > Еак Еак ~50 - 100 к. Дж/моль ~ 0. 5 - 1 э. В температурный коэффициент Вант-Гоффа(1884 г. ) Еак=0. 53 э. В
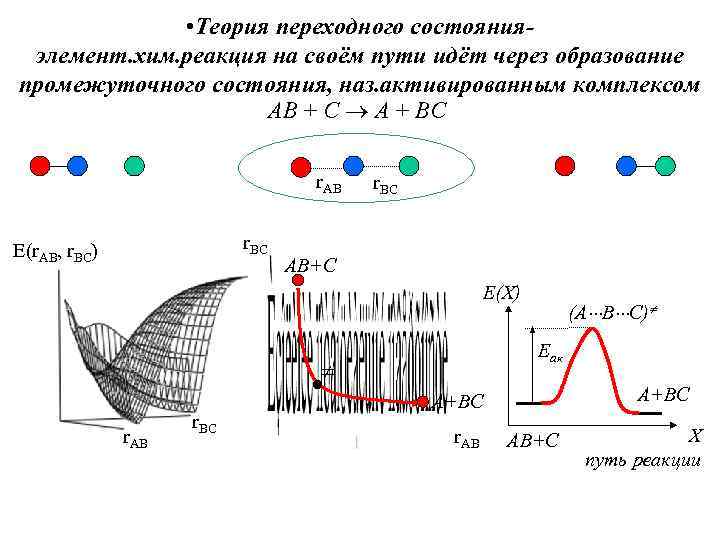
 • Теория переходного состояния- элемент. хим. реакция на своём пути идёт через образование промежуточного состояния, наз. активированным комплексом АВ + С А + ВС r. AB r. BC E(r. AB, r. BC) r. BC АВ+С Е(X) (А В С) Еак А+ВС r. BC r. AB АВ+С X путь реакции
• Теория переходного состояния- элемент. хим. реакция на своём пути идёт через образование промежуточного состояния, наз. активированным комплексом АВ + С А + ВС r. AB r. BC E(r. AB, r. BC) r. BC АВ+С Е(X) (А В С) Еак А+ВС r. BC r. AB АВ+С X путь реакции
 5. 5 Сложные химические реакции(формальная кинетика) AA + BB DD скоростью реакции по i–му компоненту Лимитирующая стадия формально простые реакции (x + y ) - суммарный порядок реакции уравнение Еак - энергия активации Аррениуса k 0 - предэкспоненциальный множитель(частотный фактор)
5. 5 Сложные химические реакции(формальная кинетика) AA + BB DD скоростью реакции по i–му компоненту Лимитирующая стадия формально простые реакции (x + y ) - суммарный порядок реакции уравнение Еак - энергия активации Аррениуса k 0 - предэкспоненциальный множитель(частотный фактор)
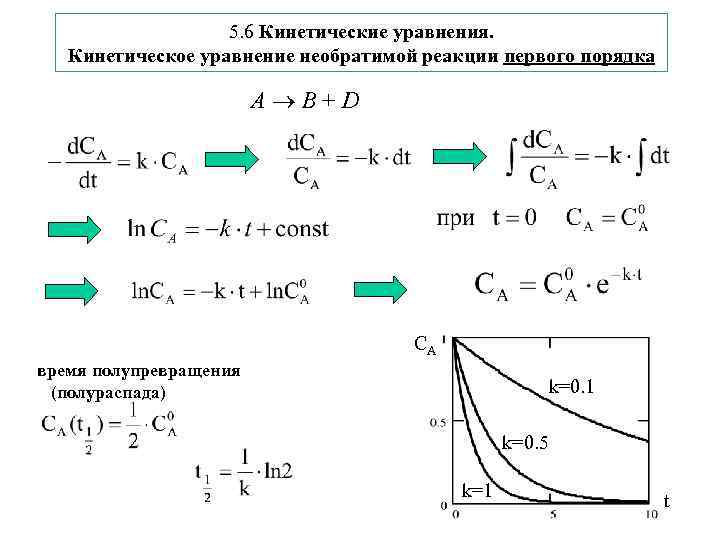
 5. 6 Кинетические уравнения. Кинетическое уравнение необратимой реакции первого порядка A B + D CA время полупревращения (полураспада) k=0. 1 k=0. 5 k=1 t
5. 6 Кинетические уравнения. Кинетическое уравнение необратимой реакции первого порядка A B + D CA время полупревращения (полураспада) k=0. 1 k=0. 5 k=1 t
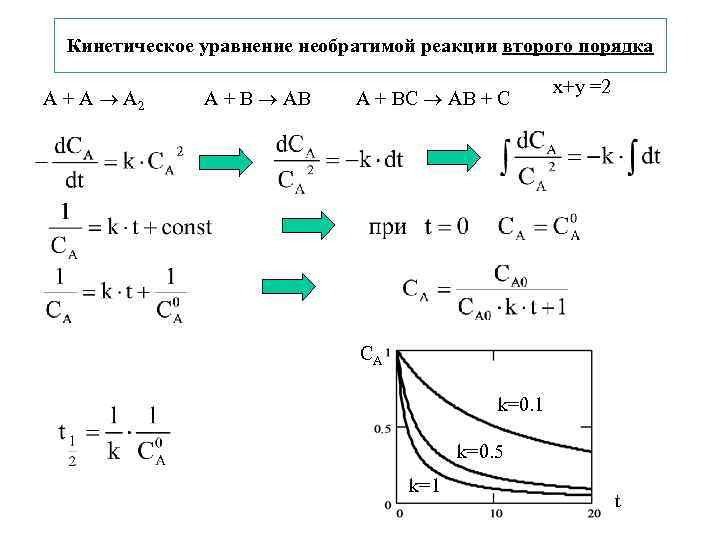
 Кинетическое уравнение необратимой реакции второго порядка x+y =2 A + A A 2 A + B AB A + BС AB + С CA k=0. 1 k=0. 5 k=1 t
Кинетическое уравнение необратимой реакции второго порядка x+y =2 A + A A 2 A + B AB A + BС AB + С CA k=0. 1 k=0. 5 k=1 t
 5. 7 Цепной механизм химической реакции Цепные реакции - ряд регулярно повторяющихся многостадийных элементарных реакций с участием активных частиц (радикалов R ), которые взаимодействуют с молекулами реагентов с образованием продуктов реакции и новых активных частиц. А В • Стадия зарождения цепи А R + R • Развитие цепи* А + R 1 R 2+ В • Обрыв цепи R + R А *длина цепи γ- число актов взаимодействия от зарождения до обрыва цепи - неразветвленный цепной процесс-коэфф. размножения n = 1 - разветвленный цепной процесс n 1(число активн. частиц образ. в элемент. акте)
5. 7 Цепной механизм химической реакции Цепные реакции - ряд регулярно повторяющихся многостадийных элементарных реакций с участием активных частиц (радикалов R ), которые взаимодействуют с молекулами реагентов с образованием продуктов реакции и новых активных частиц. А В • Стадия зарождения цепи А R + R • Развитие цепи* А + R 1 R 2+ В • Обрыв цепи R + R А *длина цепи γ- число актов взаимодействия от зарождения до обрыва цепи - неразветвленный цепной процесс-коэфф. размножения n = 1 - разветвленный цепной процесс n 1(число активн. частиц образ. в элемент. акте)
 Примеры 1. Неразветвленный цепной процесс H 2 + Br 2 2 HBr - зарождение цепи Br 2+ h 2 Br H 2+ h 2 H - развитие цепи Br + H 2 HBr + H + H + Br 2 HBr + Br - обрыв цепи Br + Br 2 H + Br HBr + 2. Разветвленный цепной процесс 2 H 2 + O 2 2 H 2 O - зарождение цепи H 2+ h 2 H O 2+ h 2 O - развитие цепи H + O 2 OH + O + H 2 OH + H + + OH + H 2 O + H - обрыв цепи H + H H 2 + OH + H H 2 O
Примеры 1. Неразветвленный цепной процесс H 2 + Br 2 2 HBr - зарождение цепи Br 2+ h 2 Br H 2+ h 2 H - развитие цепи Br + H 2 HBr + H + H + Br 2 HBr + Br - обрыв цепи Br + Br 2 H + Br HBr + 2. Разветвленный цепной процесс 2 H 2 + O 2 2 H 2 O - зарождение цепи H 2+ h 2 H O 2+ h 2 O - развитие цепи H + O 2 OH + O + H 2 OH + H + + OH + H 2 O + H - обрыв цепи H + H H 2 + OH + H H 2 O
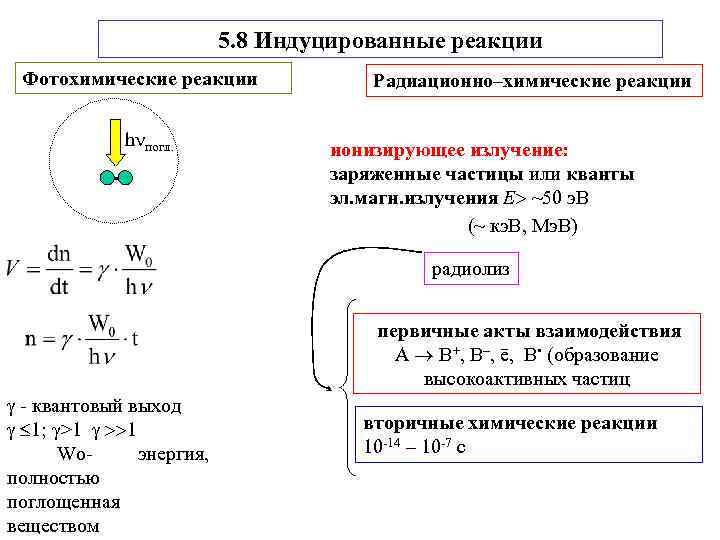
 5. 8 Индуцированные реакции Фотохимические реакции Радиационно–химические реакции h погл. ионизирующее излучение: заряженные частицы или кванты эл. магн. излучения Е ~50 э. В (~ кэ. В, Мэ. В) радиолиз первичные акты взаимодействия А В+, В–, ē, В • (образование высокоактивных частиц - квантовый выход 1; γ>1 1 вторичные химические реакции Wo- энергия, 10 -14 – 10 -7 с полностью поглощенная веществом
5. 8 Индуцированные реакции Фотохимические реакции Радиационно–химические реакции h погл. ионизирующее излучение: заряженные частицы или кванты эл. магн. излучения Е ~50 э. В (~ кэ. В, Мэ. В) радиолиз первичные акты взаимодействия А В+, В–, ē, В • (образование высокоактивных частиц - квантовый выход 1; γ>1 1 вторичные химические реакции Wo- энергия, 10 -14 – 10 -7 с полностью поглощенная веществом
 5. 9 Гетерогенные реакции B А A(тв) + В B(газ) D D A тв JB газ Лимитирующая стадия CB 0 режимы реакции: - кинетический JD - диффузионный CD 0 - смешанный x 1. стадия подвода реагирующих веществ к реакционной поверхности JB - диффузионный поток 2. химическая реакция на поверхности 3. отвод продуктов химической реакции от реакционной поверхности обновление поверхности JD - диффузионный поток изменением поверхности
5. 9 Гетерогенные реакции B А A(тв) + В B(газ) D D A тв JB газ Лимитирующая стадия CB 0 режимы реакции: - кинетический JD - диффузионный CD 0 - смешанный x 1. стадия подвода реагирующих веществ к реакционной поверхности JB - диффузионный поток 2. химическая реакция на поверхности 3. отвод продуктов химической реакции от реакционной поверхности обновление поверхности JD - диффузионный поток изменением поверхности
 А A(тв) + В B(газ) D D • Кинетический режим • Диффузионный режим(J-дифф. поток) D =f(T) – коэффициент диффузии
А A(тв) + В B(газ) D D • Кинетический режим • Диффузионный режим(J-дифф. поток) D =f(T) – коэффициент диффузии
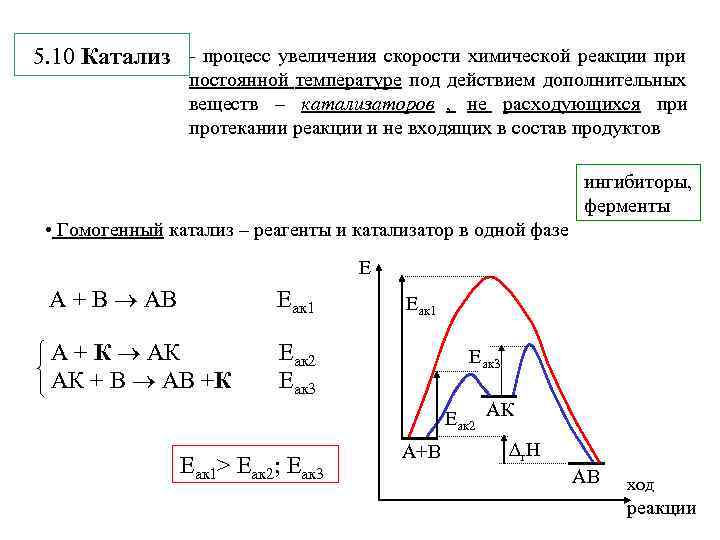
 5. 10 Катализ - процесс увеличения скорости химической реакции при постоянной температуре под действием дополнительных веществ – катализаторов , не расходующихся при протекании реакции и не входящих в состав продуктов ингибиторы, ферменты • Гомогенный катализ – реагенты и катализатор в одной фазе Е А + В АВ Еак 1 А + К АК Еак 2 Еак 3 АК + В АВ +К Еак 3 Еак 2 АК А+В r. H Еак 1> Еак 2; Еак 3 АВ ход реакции
5. 10 Катализ - процесс увеличения скорости химической реакции при постоянной температуре под действием дополнительных веществ – катализаторов , не расходующихся при протекании реакции и не входящих в состав продуктов ингибиторы, ферменты • Гомогенный катализ – реагенты и катализатор в одной фазе Е А + В АВ Еак 1 А + К АК Еак 2 Еак 3 АК + В АВ +К Еак 3 Еак 2 АК А+В r. H Еак 1> Еак 2; Еак 3 АВ ход реакции
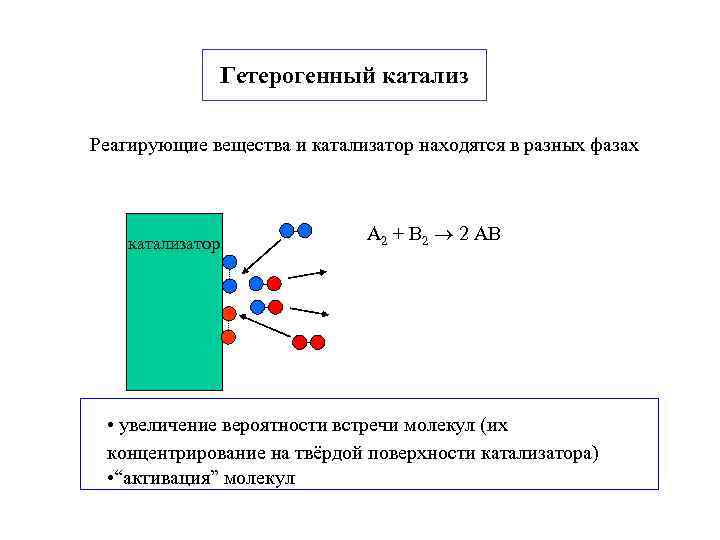
 Гетерогенный катализ Реагирующие вещества и катализатор находятся в разных фазах катализатор А 2 + В 2 2 АВ • увеличение вероятности встречи молекул (их концентрирование на твёрдой поверхности катализатора) • “активация” молекул
Гетерогенный катализ Реагирующие вещества и катализатор находятся в разных фазах катализатор А 2 + В 2 2 АВ • увеличение вероятности встречи молекул (их концентрирование на твёрдой поверхности катализатора) • “активация” молекул
 5. 11 Горение и взрыв(взрывчатые превращения) Исходные Продукты Реакции: v • экзотермические Н 0 вещества реакции • высокая скорость Р 1, Т 1 Р 3, Т 3 • газообразование Р 2, Т 2 Область химической реакции • Горение (лин. скорость области хим. реакции) v 10 -3 -102 м с; теплопередача, диффузия • Взрыв v 103 -104 м с; ударная(сжатия) волна, vmax - детонация(макс. скорость равна скорости звука в веществе)
5. 11 Горение и взрыв(взрывчатые превращения) Исходные Продукты Реакции: v • экзотермические Н 0 вещества реакции • высокая скорость Р 1, Т 1 Р 3, Т 3 • газообразование Р 2, Т 2 Область химической реакции • Горение (лин. скорость области хим. реакции) v 10 -3 -102 м с; теплопередача, диффузия • Взрыв v 103 -104 м с; ударная(сжатия) волна, vmax - детонация(макс. скорость равна скорости звука в веществе)
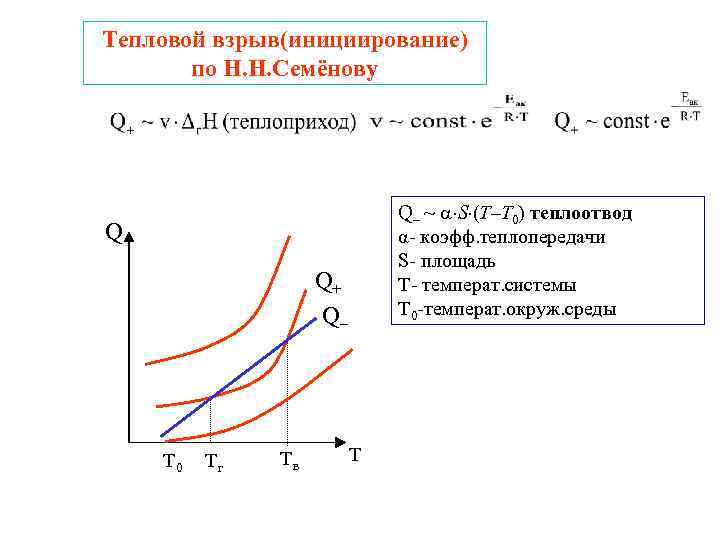
 Тепловой взрыв(инициирование) по Н. Н. Семёнову Q– ~ S (T–T 0) теплоотвод Q α- коэфф. теплопередачи S- площадь Q+ Т- температ. системы Q– Т 0 -температ. окруж. среды Т 0 Тг Тв Т
Тепловой взрыв(инициирование) по Н. Н. Семёнову Q– ~ S (T–T 0) теплоотвод Q α- коэфф. теплопередачи S- площадь Q+ Т- температ. системы Q– Т 0 -температ. окруж. среды Т 0 Тг Тв Т

