lektsia-1-mat-2012-2013-ispr2.ppt
- Количество слайдов: 16
 4605 -Материаловедение Доцент, к. т. н. Тюрина Светлана Александровна 10 лекций 4 практических занятия 1 домашняя контрольная работа 5 аудиторных проверочных работ зачет
4605 -Материаловедение Доцент, к. т. н. Тюрина Светлана Александровна 10 лекций 4 практических занятия 1 домашняя контрольная работа 5 аудиторных проверочных работ зачет
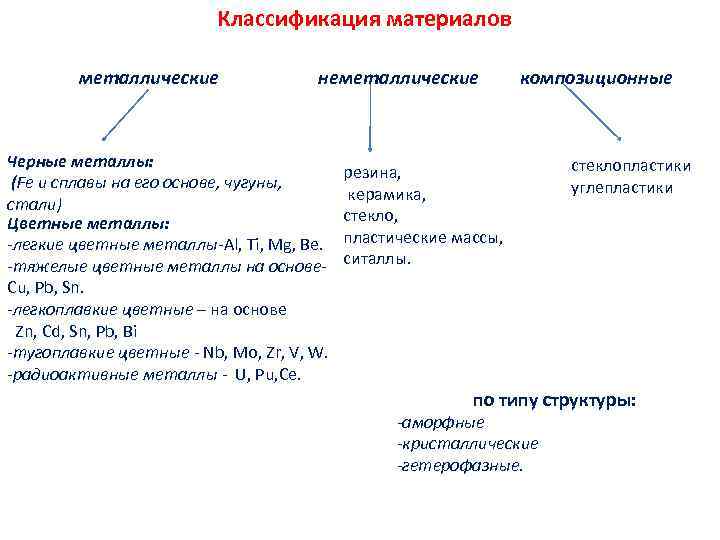 Классификация материалов металлические неметаллические Черные металлы: (Fe и сплавы на его основе, чугуны, стали) Цветные металлы: -легкие цветные металлы-Al, Ti, Mg, Be. -тяжелые цветные металлы на основе. Cu, Pb, Sn. -легкоплавкие цветные – на основе Zn, Cd, Sn, Pb, Bi -тугоплавкие цветные - Nb, Mo, Zr, V, W. -радиоактивные металлы - U, Pu, Ce. композиционные резина, керамика, стекло, пластические массы, ситаллы. стеклопластики углепластики по типу структуры: -аморфные -кристаллические -гетерофазные.
Классификация материалов металлические неметаллические Черные металлы: (Fe и сплавы на его основе, чугуны, стали) Цветные металлы: -легкие цветные металлы-Al, Ti, Mg, Be. -тяжелые цветные металлы на основе. Cu, Pb, Sn. -легкоплавкие цветные – на основе Zn, Cd, Sn, Pb, Bi -тугоплавкие цветные - Nb, Mo, Zr, V, W. -радиоактивные металлы - U, Pu, Ce. композиционные резина, керамика, стекло, пластические массы, ситаллы. стеклопластики углепластики по типу структуры: -аморфные -кристаллические -гетерофазные.
 Содержание металлов и элементов в Земной коре Кислород (О)=47, 4% Кремний (Si) =25. 7 %, Алюминий (Al)=7. 5 %, Железо (Fe)=4. 7 %, Магний (Mg)=1. 94 %, Титан (Ti)=0. 58 %, Медь (Cu)= 0. 01 %, Цинк (Zn)= 2*10 -2 %, Серебро (Ag)=4*10 -6 %, Золото (Au)=5*10 -7%.
Содержание металлов и элементов в Земной коре Кислород (О)=47, 4% Кремний (Si) =25. 7 %, Алюминий (Al)=7. 5 %, Железо (Fe)=4. 7 %, Магний (Mg)=1. 94 %, Титан (Ti)=0. 58 %, Медь (Cu)= 0. 01 %, Цинк (Zn)= 2*10 -2 %, Серебро (Ag)=4*10 -6 %, Золото (Au)=5*10 -7%.
 Освоение человечеством различных материалов -каменный век (начало палеолита, конец неолита около 8 -3 тыс. лет до н. э. ) -медный век (энеолит) -бронзовый век (конец IV-начало I тыс. до н. э. ) -железный век -эпоха полимеров -эпоха композиционных материалов
Освоение человечеством различных материалов -каменный век (начало палеолита, конец неолита около 8 -3 тыс. лет до н. э. ) -медный век (энеолит) -бронзовый век (конец IV-начало I тыс. до н. э. ) -железный век -эпоха полимеров -эпоха композиционных материалов
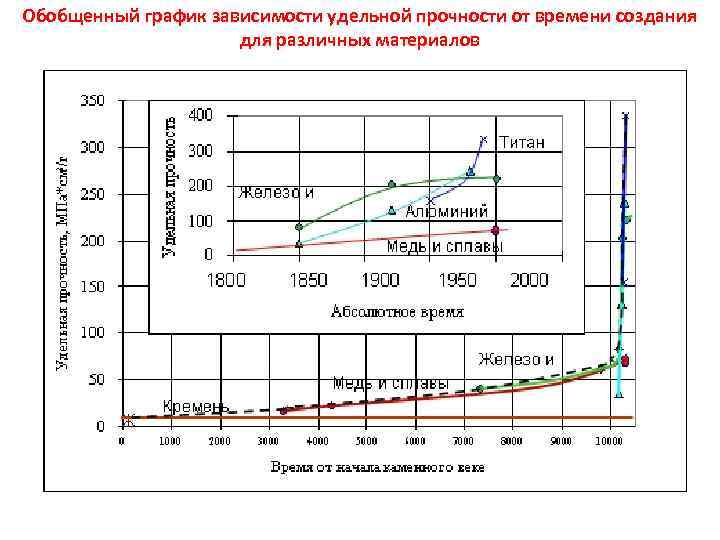 Обобщенный график зависимости удельной прочности от времени создания для различных материалов
Обобщенный график зависимости удельной прочности от времени создания для различных материалов
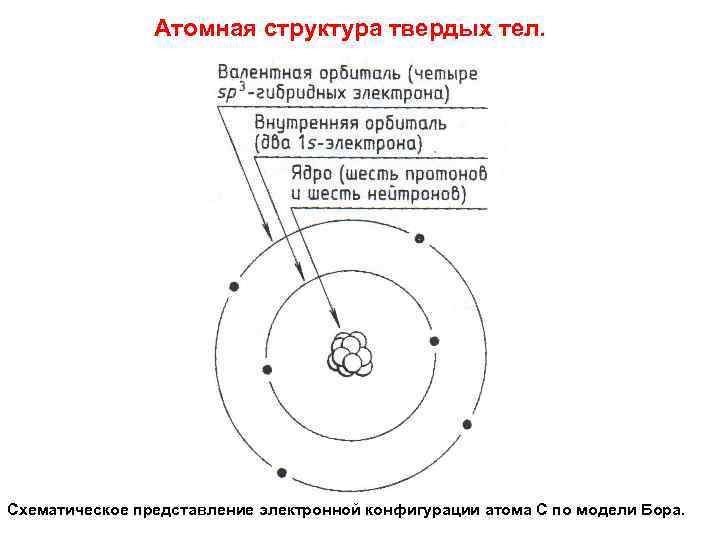 Атомная структура твердых тел. Схематическое представление электронной конфигурации атома С по модели Бора.
Атомная структура твердых тел. Схематическое представление электронной конфигурации атома С по модели Бора.
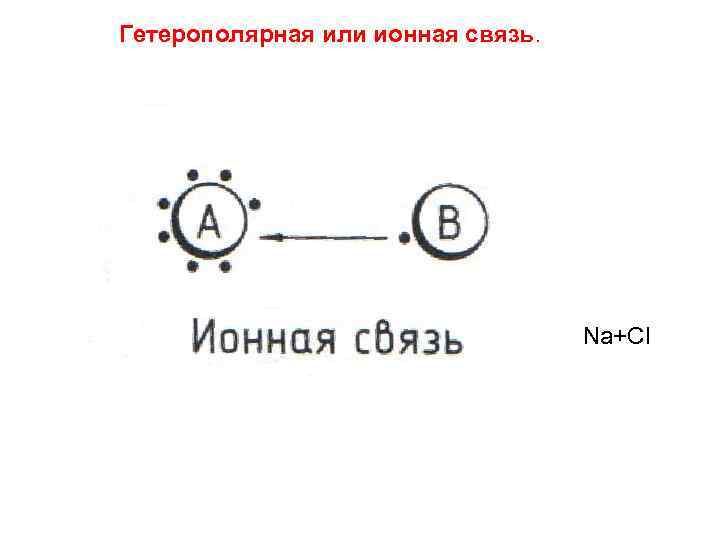 Гетерополярная или ионная связь. Na+Cl
Гетерополярная или ионная связь. Na+Cl
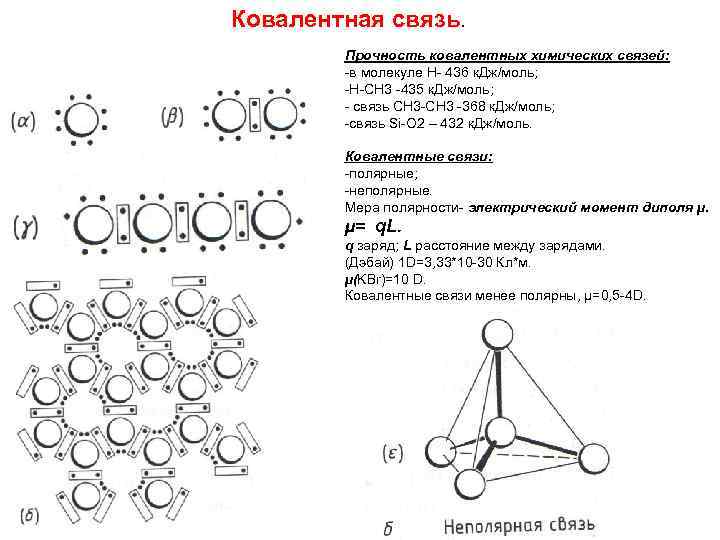 Ковалентная связь. Прочность ковалентных химических связей: -в молекуле Н- 436 к. Дж/моль; -H-CH 3 -435 к. Дж/моль; - связь СН 3 -СН 3 -368 к. Дж/моль; -связь Si-O 2 – 432 к. Дж/моль. Ковалентные связи: -полярные; -неполярные. Мера полярности- электрический момент диполя µ. µ= q. L. q заряд; L расстояние между зарядами. (Дэбай) 1 D=3, 33*10 -30 Кл*м. µ(KBr)=10 D. Ковалентные связи менее полярны, µ=0, 5 -4 D.
Ковалентная связь. Прочность ковалентных химических связей: -в молекуле Н- 436 к. Дж/моль; -H-CH 3 -435 к. Дж/моль; - связь СН 3 -СН 3 -368 к. Дж/моль; -связь Si-O 2 – 432 к. Дж/моль. Ковалентные связи: -полярные; -неполярные. Мера полярности- электрический момент диполя µ. µ= q. L. q заряд; L расстояние между зарядами. (Дэбай) 1 D=3, 33*10 -30 Кл*м. µ(KBr)=10 D. Ковалентные связи менее полярны, µ=0, 5 -4 D.
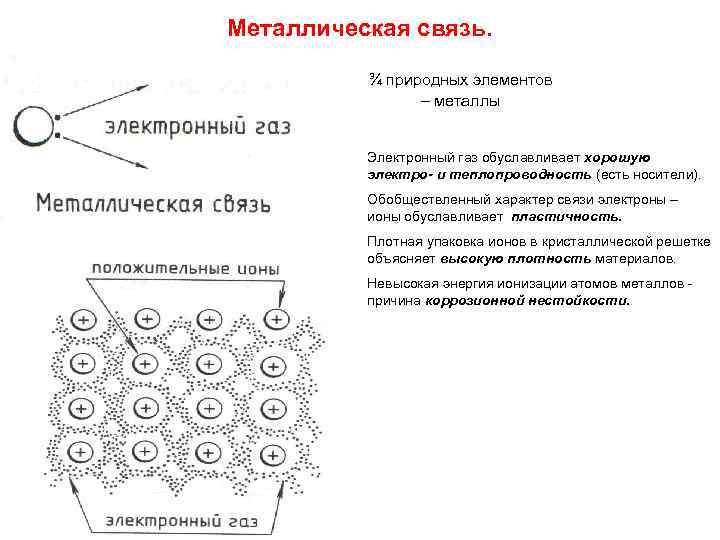 Металлическая связь. ¾ природных элементов – металлы Электронный газ обуславливает хорошую электро- и теплопроводность (есть носители). Обобществленный характер связи электроны – ионы обуславливает пластичность. Плотная упаковка ионов в кристаллической решетке объясняет высокую плотность материалов. Невысокая энергия ионизации атомов металлов - причина коррозионной нестойкости.
Металлическая связь. ¾ природных элементов – металлы Электронный газ обуславливает хорошую электро- и теплопроводность (есть носители). Обобществленный характер связи электроны – ионы обуславливает пластичность. Плотная упаковка ионов в кристаллической решетке объясняет высокую плотность материалов. Невысокая энергия ионизации атомов металлов - причина коррозионной нестойкости.
 Ван-дер-ваальсова связь. прочность связи невысока ≈4 - 40 к. Дж/моль.
Ван-дер-ваальсова связь. прочность связи невысока ≈4 - 40 к. Дж/моль.
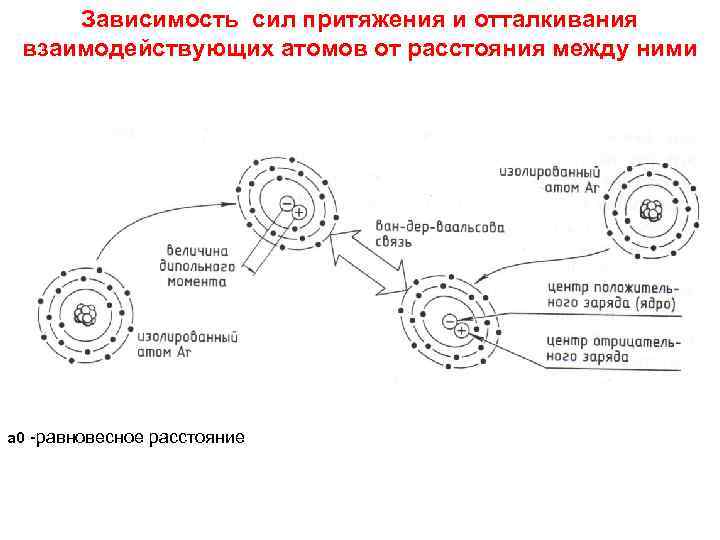 Зависимость сил притяжения и отталкивания взаимодействующих атомов от расстояния между ними а 0 -равновесное расстояние
Зависимость сил притяжения и отталкивания взаимодействующих атомов от расстояния между ними а 0 -равновесное расстояние
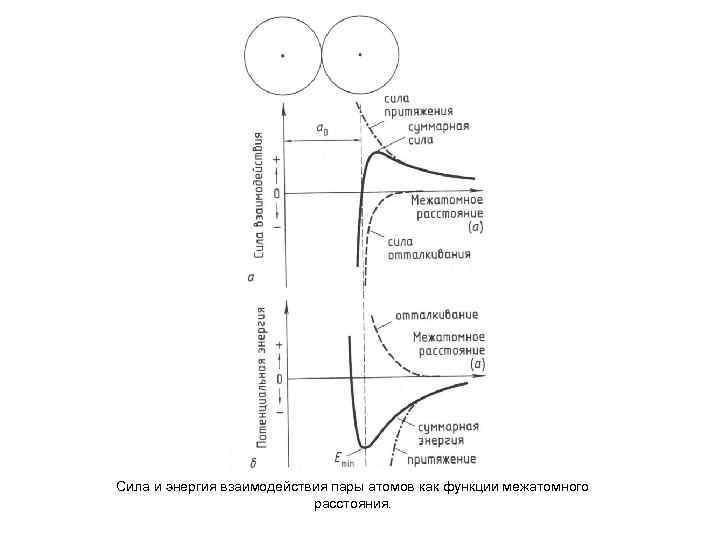 Сила и энергия взаимодействия пары атомов как функции межатомного расстояния.
Сила и энергия взаимодействия пары атомов как функции межатомного расстояния.
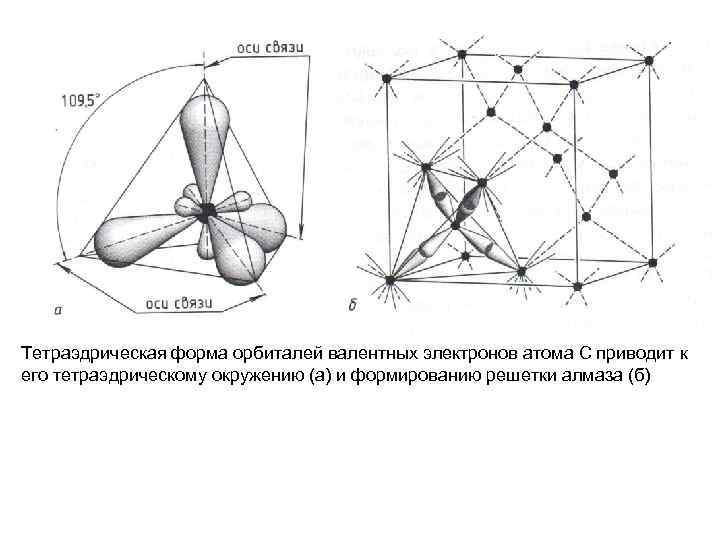 Тетраэдрическая форма орбиталей валентных электронов атома С приводит к его тетраэдрическому окружению (а) и формированию решетки алмаза (б)
Тетраэдрическая форма орбиталей валентных электронов атома С приводит к его тетраэдрическому окружению (а) и формированию решетки алмаза (б)
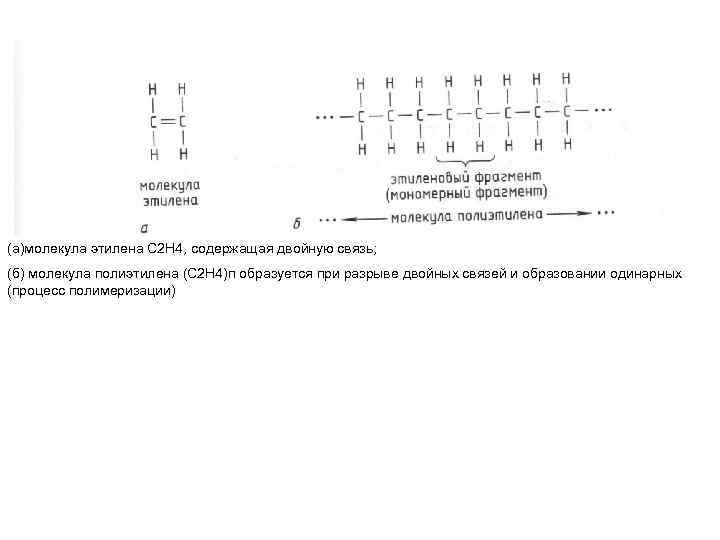 (а)молекула этилена С 2 Н 4, содержащая двойную связь; (б) молекула полиэтилена (С 2 Н 4)п образуется при разрыве двойных связей и образовании одинарных (процесс полимеризации)
(а)молекула этилена С 2 Н 4, содержащая двойную связь; (б) молекула полиэтилена (С 2 Н 4)п образуется при разрыве двойных связей и образовании одинарных (процесс полимеризации)
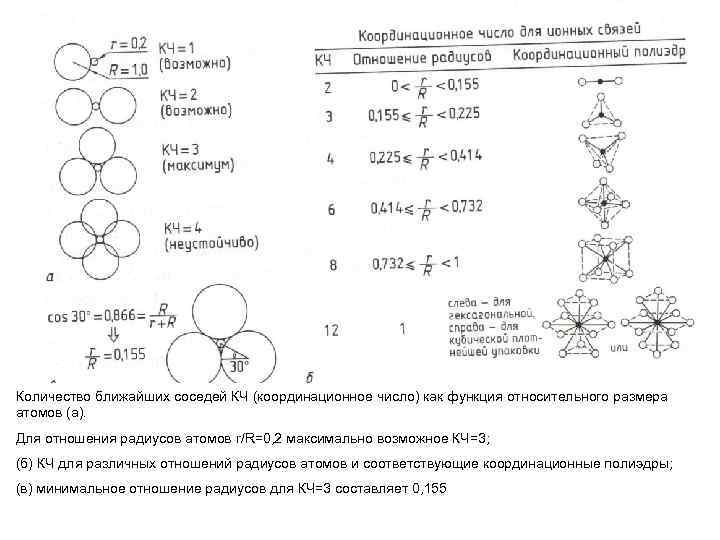 Количество ближайших соседей КЧ (координационное число) как функция относительного размера атомов (а). Для отношения радиусов атомов r/R=0, 2 максимально возможное КЧ=3; (б) КЧ для различных отношений радиусов атомов и соответствующие координационные полиэдры; (в) минимальное отношение радиусов для КЧ=3 составляет 0, 155
Количество ближайших соседей КЧ (координационное число) как функция относительного размера атомов (а). Для отношения радиусов атомов r/R=0, 2 максимально возможное КЧ=3; (б) КЧ для различных отношений радиусов атомов и соответствующие координационные полиэдры; (в) минимальное отношение радиусов для КЧ=3 составляет 0, 155
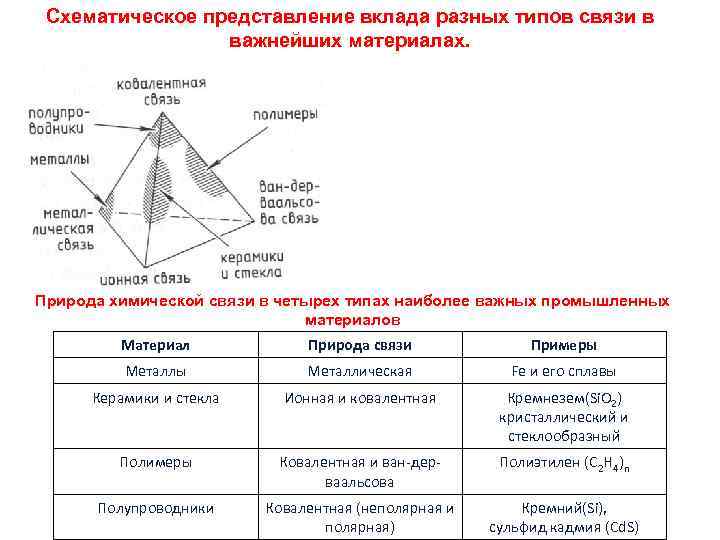 Схематическое представление вклада разных типов связи в важнейших материалах. Природа химической связи в четырех типах наиболее важных промышленных материалов Материал Природа связи Примеры Металлическая Fe и его сплавы Керамики и стекла Ионная и ковалентная Кремнезем(Si. O 2) кристаллический и стеклообразный Полимеры Ковалентная и ван-дерваальсова Полиэтилен (C 2 H 4)n Полупроводники Ковалентная (неполярная и полярная) Кремний(Si), сульфид кадмия (Cd. S)
Схематическое представление вклада разных типов связи в важнейших материалах. Природа химической связи в четырех типах наиболее важных промышленных материалов Материал Природа связи Примеры Металлическая Fe и его сплавы Керамики и стекла Ионная и ковалентная Кремнезем(Si. O 2) кристаллический и стеклообразный Полимеры Ковалентная и ван-дерваальсова Полиэтилен (C 2 H 4)n Полупроводники Ковалентная (неполярная и полярная) Кремний(Si), сульфид кадмия (Cd. S)


