4. 3 Перегонка




















 4. 3 Перегонка и ректификация – предназначены для разделения жидких однородных смесей (растворов), состоящих из двух и более числа компонентов. Если исходную смесь, состоящую из компонентов с различной температурой кипения, частично испарить, а затем образовавшиеся пары – конденсировать, то полученный жидкий отгон будет отличатся по составу более высоким содержанием легколетучего или низкокипящего компонента (НК). В оставшейся исходной смеси содержится большее количество труднолетучего или высококипящего компонента (ВК). Эту жидкость называют остатком , а жидкость полученная в результате конденсации паров – дистиллятом. Разделение смеси углеводородов проходит тем полнее, чем больше различия в упругости паров этих компонентов, определяемых температурой их кипения. Два способа разделения смесей: - простая перегонка (дистилляция) - ректификация Простая перегонка – процесс однократного частичного испарения исходной жидкой смеси и конденсации образующихся при этом паров. Перегонка обычно используется для первичного разделения смесей легколетучего (НК) с небольшим содержанием труднолетучего (ВК) компонентов. Ректификация – процесс многократного испарения исходной смеси и конденсации образующихся паров в аппаратах, называемых ректификационными колоннами. Процесс ректификации протекает следующим образом.
4. 3 Перегонка и ректификация – предназначены для разделения жидких однородных смесей (растворов), состоящих из двух и более числа компонентов. Если исходную смесь, состоящую из компонентов с различной температурой кипения, частично испарить, а затем образовавшиеся пары – конденсировать, то полученный жидкий отгон будет отличатся по составу более высоким содержанием легколетучего или низкокипящего компонента (НК). В оставшейся исходной смеси содержится большее количество труднолетучего или высококипящего компонента (ВК). Эту жидкость называют остатком , а жидкость полученная в результате конденсации паров – дистиллятом. Разделение смеси углеводородов проходит тем полнее, чем больше различия в упругости паров этих компонентов, определяемых температурой их кипения. Два способа разделения смесей: - простая перегонка (дистилляция) - ректификация Простая перегонка – процесс однократного частичного испарения исходной жидкой смеси и конденсации образующихся при этом паров. Перегонка обычно используется для первичного разделения смесей легколетучего (НК) с небольшим содержанием труднолетучего (ВК) компонентов. Ректификация – процесс многократного испарения исходной смеси и конденсации образующихся паров в аппаратах, называемых ректификационными колоннами. Процесс ректификации протекает следующим образом.
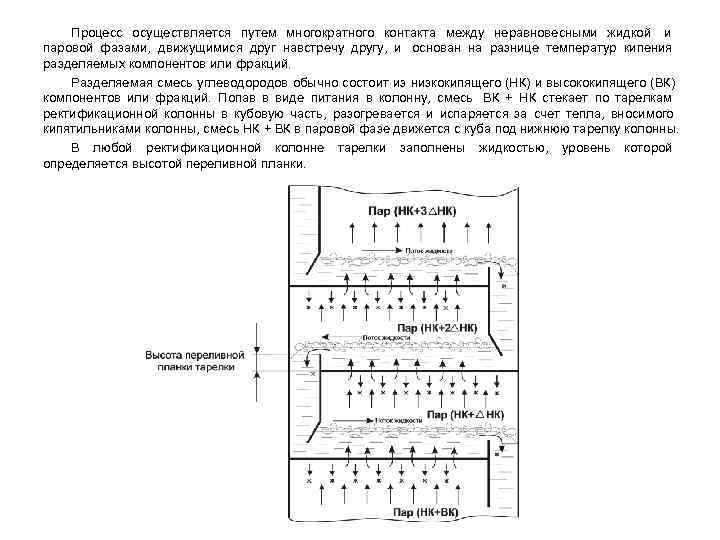
 Процесс осуществляется путем многократного контакта между неравновесными жидкой и паровой фазами, движущимися друг навстречу другу, и основан на разнице температур кипения разделяемых компонентов или фракций. Разделяемая смесь углеводородов обычно состоит из низкокипящего (НК) и высококипящего (ВК) компонентов или фракций. Попав в виде питания в колонну, смесь ВК + НК стекает по тарелкам ректификационной колонны в кубовую часть, разогревается и испаряется за счет тепла, вносимого кипятильниками колонны, смесь НК + ВК в паровой фазе движется с куба под нижнюю тарелку колонны. В любой ректификационной колонне тарелки заполнены жидкостью, уровень которой определяется высотой переливной планки.
Процесс осуществляется путем многократного контакта между неравновесными жидкой и паровой фазами, движущимися друг навстречу другу, и основан на разнице температур кипения разделяемых компонентов или фракций. Разделяемая смесь углеводородов обычно состоит из низкокипящего (НК) и высококипящего (ВК) компонентов или фракций. Попав в виде питания в колонну, смесь ВК + НК стекает по тарелкам ректификационной колонны в кубовую часть, разогревается и испаряется за счет тепла, вносимого кипятильниками колонны, смесь НК + ВК в паровой фазе движется с куба под нижнюю тарелку колонны. В любой ректификационной колонне тарелки заполнены жидкостью, уровень которой определяется высотой переливной планки.
 Пары НК + ВК, поднимающиеся с кубовой секции колонны барботируют через слой жидкости на тарелке, где происходит массотеплообмен между разделяемыми компонентами или фракциями, частичная конденсация паров и испарение жидкости на тарелке. При этом на тарелке конденсируются частично пары более тяжелого компонента (ВК) разделяемой смеси. За счет тепла конденсации высококипящего компонента (ВК) из жидкости на тарелке выпаривается часть низкокипящего компонента (НК). В результате этого состав пара, поднимающегося с этой тарелки на вышележащую обогащен легколетучим компонентом (НК + ∆НК), а жидкая фаза на этой тарелке более обогащена высококипящим компонентом (ВК). На следующей вышележащей тарелке также происходит частичная конденсация ВК и дальнейшая отпарка НК, т. е. пар, поднимающийся с этой второй тарелки еще более обогащен низкокипящим компонентом (НК + 2∆НК). Орошение, состоящее практически из чистого низкокипящего компонента (НК) и подающееся на верхнюю тарелку колонны, взаимодействует с поднимающимися с куба колонны парами ВК+НК. При этом из паровой фазы (НК+ВК) конденсируется преимущественно высококипящий компонент (ВК), а из флегмы испаряется преимущественно низкокипящий компонент (НК). Таким образом, стекающая с верху вниз по тарелкам флегма обогащается ВК, а поднимающиеся с куба колонны пары – низкокипящим компонентом (НК). При взаимодействии жидкой и газовой фаз между ними, как описано выше, происходит массо- теплообмен, обусловленный стремлением системы к равновесию. В результате контакта жидкости и пара на каждой тарелке компоненты перераспределяются между фазами: пар, движущийся вверх колонны, обогащается НК, а жидкость, стекающая вниз – обогащается ВК.
Пары НК + ВК, поднимающиеся с кубовой секции колонны барботируют через слой жидкости на тарелке, где происходит массотеплообмен между разделяемыми компонентами или фракциями, частичная конденсация паров и испарение жидкости на тарелке. При этом на тарелке конденсируются частично пары более тяжелого компонента (ВК) разделяемой смеси. За счет тепла конденсации высококипящего компонента (ВК) из жидкости на тарелке выпаривается часть низкокипящего компонента (НК). В результате этого состав пара, поднимающегося с этой тарелки на вышележащую обогащен легколетучим компонентом (НК + ∆НК), а жидкая фаза на этой тарелке более обогащена высококипящим компонентом (ВК). На следующей вышележащей тарелке также происходит частичная конденсация ВК и дальнейшая отпарка НК, т. е. пар, поднимающийся с этой второй тарелки еще более обогащен низкокипящим компонентом (НК + 2∆НК). Орошение, состоящее практически из чистого низкокипящего компонента (НК) и подающееся на верхнюю тарелку колонны, взаимодействует с поднимающимися с куба колонны парами ВК+НК. При этом из паровой фазы (НК+ВК) конденсируется преимущественно высококипящий компонент (ВК), а из флегмы испаряется преимущественно низкокипящий компонент (НК). Таким образом, стекающая с верху вниз по тарелкам флегма обогащается ВК, а поднимающиеся с куба колонны пары – низкокипящим компонентом (НК). При взаимодействии жидкой и газовой фаз между ними, как описано выше, происходит массо- теплообмен, обусловленный стремлением системы к равновесию. В результате контакта жидкости и пара на каждой тарелке компоненты перераспределяются между фазами: пар, движущийся вверх колонны, обогащается НК, а жидкость, стекающая вниз – обогащается ВК.
 Многократное контактирование приводит к практически полному разделению исходной смеси. Пар, выходящий с верха колонны по шлемовой линии, состоит почти целиком из НК и конденсируется в специальном холодильнике-конденсаторе или дефлегматоре, образуя жидкую фракцию НК. Часть этой жидкой фракции НК подается в виде орошения на колонну, а другая часть в виде дистиллята выводится, как готовый продукт. При взаимодействии жидкой и газовой фаз между ними, как описано выше, происходит массо- теплообмен, обусловленный стремлением системы к равновесию. В результате контакта жидкости и пара на каждой тарелке компоненты перераспределяются между фазами: пар, движущийся вверх колонны, обогащается НК, а жидкость, стекающая вниз – обогащается ВК. Многократное контактирование приводит к практически полному разделению исходной смеси. Пар, выходящий с верха колонны по шлемовой линии, состоит почти целиком из НК и конденсируется в специальном холодильнике-конденсаторе или дефлегматоре, образуя жидкую фракцию НК. Часть этой жидкой фракции НК подается в виде орошения на колонну, а другая часть в виде дистиллята выводится, как готовый продукт. Жидкость, выходящая с нижней части колонны и состоящая практически из чистого ВК называют кубовым остатком. Таким образом, отсутствие равновесия (и соответственно, наличие разности температур фаз) при движении фаз с определенной относительной скоростью и многократным их контактировании является необходимым условием проведения ректификации. Ректификационная колонна имеет цилиндрический корпус, внутри которого установлены контактные устройства в виде тарелок или насадки. Типы внутренних устройств ректификационной колонны (тарелки и насадки) приведены на рис. 21, 23. Ректификационные колонны поз. Е- D А 402, Е- D А 406, Е- D А 301, Е- D А 403, Е- D А 410, Е- D А 404 оснащены клапанными тарелками (тип клапанов М- VALVE ). Колонны поз. Е- D А 304, Е- D А 409 насадочные, в которых загружена нерегулярная насадка типа кольца “ Паля “ - 2 ”.
Многократное контактирование приводит к практически полному разделению исходной смеси. Пар, выходящий с верха колонны по шлемовой линии, состоит почти целиком из НК и конденсируется в специальном холодильнике-конденсаторе или дефлегматоре, образуя жидкую фракцию НК. Часть этой жидкой фракции НК подается в виде орошения на колонну, а другая часть в виде дистиллята выводится, как готовый продукт. При взаимодействии жидкой и газовой фаз между ними, как описано выше, происходит массо- теплообмен, обусловленный стремлением системы к равновесию. В результате контакта жидкости и пара на каждой тарелке компоненты перераспределяются между фазами: пар, движущийся вверх колонны, обогащается НК, а жидкость, стекающая вниз – обогащается ВК. Многократное контактирование приводит к практически полному разделению исходной смеси. Пар, выходящий с верха колонны по шлемовой линии, состоит почти целиком из НК и конденсируется в специальном холодильнике-конденсаторе или дефлегматоре, образуя жидкую фракцию НК. Часть этой жидкой фракции НК подается в виде орошения на колонну, а другая часть в виде дистиллята выводится, как готовый продукт. Жидкость, выходящая с нижней части колонны и состоящая практически из чистого ВК называют кубовым остатком. Таким образом, отсутствие равновесия (и соответственно, наличие разности температур фаз) при движении фаз с определенной относительной скоростью и многократным их контактировании является необходимым условием проведения ректификации. Ректификационная колонна имеет цилиндрический корпус, внутри которого установлены контактные устройства в виде тарелок или насадки. Типы внутренних устройств ректификационной колонны (тарелки и насадки) приведены на рис. 21, 23. Ректификационные колонны поз. Е- D А 402, Е- D А 406, Е- D А 301, Е- D А 403, Е- D А 410, Е- D А 404 оснащены клапанными тарелками (тип клапанов М- VALVE ). Колонны поз. Е- D А 304, Е- D А 409 насадочные, в которых загружена нерегулярная насадка типа кольца “ Паля “ - 2 ”.
 В любой ректификационного колонне тарелки заполнены жидкостью, уровень которой определяется высотой переливной планки h. Жидкая фракция питания, состоящая из углеводородной смеси (НК + ВК) подается на питательную тарелку колонны, стекает вниз по тарелкам и попадает в кубовую секцию, где нагревается в кипятильнике, работающем по принципу термосифона. Разогретые пары (НК + ВК), поднимающиеся с кубовой части колонны, поступают под нижнюю тарелку, барботируют через слой жидкости на тарелке, на которой собственно и протекает процесс массо-теплообмена. При этом из слоя жидкости на тарелке отпариваются НК, а часть газообразного ВК, поступающего с куба, конденсируется. ЗА счет тепла частичной конденсации ВК из жидкости на этой тарелке происходит дополнительная отпарка НК. Т. о. пары, поступающие с нижней тарелки колонны, более обогащены НК компонентами НК + ΔНК. На следующей по ходу паров (НК + ВК) снизу вверх тарелке протекает аналогичный процесс частичного испарения НК и конденсации ВК, т. е. поток паров, поднимающихся с тарелки № 2, более обогащен НК + 2 ΔНК. В результате такого взаимодействия (массо-теплообмена) пары, поднимающиеся по колонне, обогащаются НК и практически с верха колонны отводится почти чистый низкокипящий компонент, а стекающая сверху вниз по тарелкам жидкость – высококипящим компонентом. Пары, отводимые с верха колонны, направляются в конденсатор, конденсируются и состоят в основном из НК, называются дистиллятом. Жидкость, отводимая кубом колонны, по составу близка к чистому ВК и называется кубовым остатком. Для обеспечения хорошего массо-теплообмена между паровой и жидкой фазами внутри колонны, на верхнюю тарелку колонны подается часть дистиллята, называемого флегмой. Для непрерывного проведения ректификации необходимо, чтобы поступающая на разделение смесь НК+ВК соприкасалась внутри колонны со встречным потоком пара с несколько большей концентрацией ВК, чем в жидкой смеси, поступающей на разделение. Поэтому питание (ВК+НК) подают в такое место ректификационной колонны, которое отвечает этому условию. Место ввода исходной смеси, нагретой до температуры кипения, называется тарелкой питания или питательной тарелкой
В любой ректификационного колонне тарелки заполнены жидкостью, уровень которой определяется высотой переливной планки h. Жидкая фракция питания, состоящая из углеводородной смеси (НК + ВК) подается на питательную тарелку колонны, стекает вниз по тарелкам и попадает в кубовую секцию, где нагревается в кипятильнике, работающем по принципу термосифона. Разогретые пары (НК + ВК), поднимающиеся с кубовой части колонны, поступают под нижнюю тарелку, барботируют через слой жидкости на тарелке, на которой собственно и протекает процесс массо-теплообмена. При этом из слоя жидкости на тарелке отпариваются НК, а часть газообразного ВК, поступающего с куба, конденсируется. ЗА счет тепла частичной конденсации ВК из жидкости на этой тарелке происходит дополнительная отпарка НК. Т. о. пары, поступающие с нижней тарелки колонны, более обогащены НК компонентами НК + ΔНК. На следующей по ходу паров (НК + ВК) снизу вверх тарелке протекает аналогичный процесс частичного испарения НК и конденсации ВК, т. е. поток паров, поднимающихся с тарелки № 2, более обогащен НК + 2 ΔНК. В результате такого взаимодействия (массо-теплообмена) пары, поднимающиеся по колонне, обогащаются НК и практически с верха колонны отводится почти чистый низкокипящий компонент, а стекающая сверху вниз по тарелкам жидкость – высококипящим компонентом. Пары, отводимые с верха колонны, направляются в конденсатор, конденсируются и состоят в основном из НК, называются дистиллятом. Жидкость, отводимая кубом колонны, по составу близка к чистому ВК и называется кубовым остатком. Для обеспечения хорошего массо-теплообмена между паровой и жидкой фазами внутри колонны, на верхнюю тарелку колонны подается часть дистиллята, называемого флегмой. Для непрерывного проведения ректификации необходимо, чтобы поступающая на разделение смесь НК+ВК соприкасалась внутри колонны со встречным потоком пара с несколько большей концентрацией ВК, чем в жидкой смеси, поступающей на разделение. Поэтому питание (ВК+НК) подают в такое место ректификационной колонны, которое отвечает этому условию. Место ввода исходной смеси, нагретой до температуры кипения, называется тарелкой питания или питательной тарелкой
 Положение тарелки питания или ввода исходной смеси, как и количество тарелок, требуемое для разделения смеси, специально рассчитывается. Тарелка питания делит колонну на две части: верхнюю – укрепляющую и нижнюю – исчерпывающую. В укрепляющей части колонны происходит обогащение поднимающихся с куба паров низкокипящим компонентом, а в исчерпывающей части – максимальное удаление из жидкости НК, т. е. исчерпывание жидкости до состояния ВК. Поток пара, поднимающейся по ректификационной колонне с куба вверх, поддерживается испарением части кубовой жидкости в кубовом кипятильнике, а поток жидкости, текущей по тарелкам колонны сверху вниз – возвратом части флегмы, образующейся при конденсации в дефлегматоре паров верхнего погона колонны. Пар, выходящий из кипятильника, по мере движения вверх по колонне, все больше обогащается низкокипящим компонентом и покидает верхнюю тарелку колонны в виде почти чистого НК, который практически переходит в паровую фазу на пути от кипятильника до верха колонны. Жидкость, поступающая на орошение колонны (флегма), представляет собой почти чистый НК. Однако, стекая по тарелкам колонны и взаимодействуя с паром, она все более обогащается ВК, конденсирующимся из паровой фазы. Когда жидкость достигает самой нижней тарелки, она становится практически чистым ВК и поступает на разогрев в кубовый кипятильник. Принципиальная конструкция тарелки ректификационной колонны и типы клапанов клапанной тарелки приведены на рис. 21 Для любой ректификационной колонны можно установить наиболее динамичную, показательную тарелку, состав жидкой фазы которой определяет наличие остатка НК в кубовом остатке колонны.
Положение тарелки питания или ввода исходной смеси, как и количество тарелок, требуемое для разделения смеси, специально рассчитывается. Тарелка питания делит колонну на две части: верхнюю – укрепляющую и нижнюю – исчерпывающую. В укрепляющей части колонны происходит обогащение поднимающихся с куба паров низкокипящим компонентом, а в исчерпывающей части – максимальное удаление из жидкости НК, т. е. исчерпывание жидкости до состояния ВК. Поток пара, поднимающейся по ректификационной колонне с куба вверх, поддерживается испарением части кубовой жидкости в кубовом кипятильнике, а поток жидкости, текущей по тарелкам колонны сверху вниз – возвратом части флегмы, образующейся при конденсации в дефлегматоре паров верхнего погона колонны. Пар, выходящий из кипятильника, по мере движения вверх по колонне, все больше обогащается низкокипящим компонентом и покидает верхнюю тарелку колонны в виде почти чистого НК, который практически переходит в паровую фазу на пути от кипятильника до верха колонны. Жидкость, поступающая на орошение колонны (флегма), представляет собой почти чистый НК. Однако, стекая по тарелкам колонны и взаимодействуя с паром, она все более обогащается ВК, конденсирующимся из паровой фазы. Когда жидкость достигает самой нижней тарелки, она становится практически чистым ВК и поступает на разогрев в кубовый кипятильник. Принципиальная конструкция тарелки ректификационной колонны и типы клапанов клапанной тарелки приведены на рис. 21 Для любой ректификационной колонны можно установить наиболее динамичную, показательную тарелку, состав жидкой фазы которой определяет наличие остатка НК в кубовом остатке колонны.
 Такая тарелка называется контрольной. При увеличении концентрации НК в жидкой фазе этой тарелки адекватно снижается и температура жидкости на этой тарелки, что используется для каскадного управления процессом. Контур (Т R С → FIC → FCV → теплоноситель) как правило, регулирует остаточное содержание НК в кубовом остатке колонны и является упреждающим: в случае снижения температуры контрольной тарелки от регламентируемого значения, что свидетельствует об увеличении НК компонента в жидкости на этой тарелке, каскад Т RC → FIC → FCV увеличивает заблаговременно подачу теплоносителя в кубовый кипятильник. Разогрев куба колонны и, следовательно, парообразование в кубе увеличивается, интенсифицируя отгон НК с контрольной тарелки, т. е. упреждая возможность попадания сверхдопустимых количеств НК в кубовый остаток колонны. Для ректификационных колонн, рассчитанных на разделение бинарных смесей, предусматривается каскадное регулирование концентрации контрольной тарелки по схеме: ARC→FIC→FCV→теплоноситель в кубовый кипятильник. Устройство колонны с колпачковыми тарелками приведено на рис. ниже. К достоинствам клапанных тарелок следует отнести прежде всего их гидродинамическую устойчивость и высокую эффективность в широком интервале изменения нагрузок по газу. К недостаткам этих тарелок относятся их повышенное гидравлическое сопротивление, обусловленное весом клапана, и усложненная конструкция тарелки.
Такая тарелка называется контрольной. При увеличении концентрации НК в жидкой фазе этой тарелки адекватно снижается и температура жидкости на этой тарелки, что используется для каскадного управления процессом. Контур (Т R С → FIC → FCV → теплоноситель) как правило, регулирует остаточное содержание НК в кубовом остатке колонны и является упреждающим: в случае снижения температуры контрольной тарелки от регламентируемого значения, что свидетельствует об увеличении НК компонента в жидкости на этой тарелке, каскад Т RC → FIC → FCV увеличивает заблаговременно подачу теплоносителя в кубовый кипятильник. Разогрев куба колонны и, следовательно, парообразование в кубе увеличивается, интенсифицируя отгон НК с контрольной тарелки, т. е. упреждая возможность попадания сверхдопустимых количеств НК в кубовый остаток колонны. Для ректификационных колонн, рассчитанных на разделение бинарных смесей, предусматривается каскадное регулирование концентрации контрольной тарелки по схеме: ARC→FIC→FCV→теплоноситель в кубовый кипятильник. Устройство колонны с колпачковыми тарелками приведено на рис. ниже. К достоинствам клапанных тарелок следует отнести прежде всего их гидродинамическую устойчивость и высокую эффективность в широком интервале изменения нагрузок по газу. К недостаткам этих тарелок относятся их повышенное гидравлическое сопротивление, обусловленное весом клапана, и усложненная конструкция тарелки.
 Равновесие в системах пар – жидкость (информация для сведения) Характер поведения жидкой смеси, состоящей, к примеру, из компонентов А и В, зависит главным образом от природы составляющих ее компонентов и давления. Для идеальных растворов (смесей) характерно, что сила взаимодействия между всеми молекулами (одноименными А…А…А и разноименными А…В…А…В) равна. Общая сила, с которой молекулы удерживаются в смеси, на зависит от состава смеси (А+В). Очевидно, что парциальное давление в этом случае должно зависеть лишь от числа молекул, достигающих в единицу времени поверхности жидкости со скоростью, необходимой для преодоления сил внутреннего притяжения молекул, но при данной температуре парциальное давление соответствующего компонента в парах над смесью А+В возрастает пропорционально его содержанию в жидкой смеси. (Закон Рауля). РА = р. А • ХА РВ = р. В • (1 -ХА) РА и РВ – парциальное давление низкокипящего (А) и высококипящего (В) компонентов р. НК и р. ВК – давление насыщенных паров чистых компонентов А и В при данной температуре. ХА – мольная доля компонента А в исходной смеси.
Равновесие в системах пар – жидкость (информация для сведения) Характер поведения жидкой смеси, состоящей, к примеру, из компонентов А и В, зависит главным образом от природы составляющих ее компонентов и давления. Для идеальных растворов (смесей) характерно, что сила взаимодействия между всеми молекулами (одноименными А…А…А и разноименными А…В…А…В) равна. Общая сила, с которой молекулы удерживаются в смеси, на зависит от состава смеси (А+В). Очевидно, что парциальное давление в этом случае должно зависеть лишь от числа молекул, достигающих в единицу времени поверхности жидкости со скоростью, необходимой для преодоления сил внутреннего притяжения молекул, но при данной температуре парциальное давление соответствующего компонента в парах над смесью А+В возрастает пропорционально его содержанию в жидкой смеси. (Закон Рауля). РА = р. А • ХА РВ = р. В • (1 -ХА) РА и РВ – парциальное давление низкокипящего (А) и высококипящего (В) компонентов р. НК и р. ВК – давление насыщенных паров чистых компонентов А и В при данной температуре. ХА – мольная доля компонента А в исходной смеси.
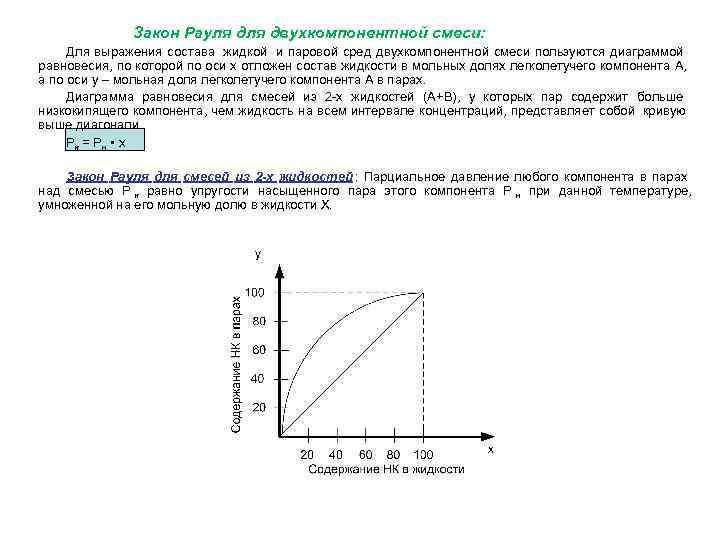
 Закон Рауля двухкомпонентной смеси: Для выражения состава жидкой и паровой сред двухкомпонентной смеси пользуются диаграммой равновесия, по которой по оси х отложен состав жидкости в мольных долях легколетучего компонента А, а по оси у – мольная доля легколетучего компонента А в парах. Диаграмма равновесия для смесей из 2 -х жидкостей (А+В), у которых пар содержит больше низкокипящего компонента, чем жидкость на всем интервале концентраций, представляет собой кривую выше диагонали. Рк = Рн • х Закон Рауля для смесей из 2 -х жидкостей : Парциальное давление любого компонента в парах над смесью Р к равно упругости насыщенного пара этого компонента Р н при данной температуре, умноженной на его мольную долю в жидкости Х.
Закон Рауля двухкомпонентной смеси: Для выражения состава жидкой и паровой сред двухкомпонентной смеси пользуются диаграммой равновесия, по которой по оси х отложен состав жидкости в мольных долях легколетучего компонента А, а по оси у – мольная доля легколетучего компонента А в парах. Диаграмма равновесия для смесей из 2 -х жидкостей (А+В), у которых пар содержит больше низкокипящего компонента, чем жидкость на всем интервале концентраций, представляет собой кривую выше диагонали. Рк = Рн • х Закон Рауля для смесей из 2 -х жидкостей : Парциальное давление любого компонента в парах над смесью Р к равно упругости насыщенного пара этого компонента Р н при данной температуре, умноженной на его мольную долю в жидкости Х.
 Однако не все взаимно растворимые жидкости подчиняются закону Рауля и имеют содержание НК в парах (у) выше на всем интервале концентраций Х. Кривые равновесия таких смесей расположены выше диагонали только в интервале 0 -х1 и пересекают диагональ в точке А с абсциссой х=х1. В этой точке состав пара х1 равен составу жидкости Х 1, поэтому при испарении жидкости и последующей конденсации не происходит обогащение паровой фазы низкокипящими компонентами. Точка А пересечения кривой равновесия с диагональю называется азеотропной точкой. Смеси, имеющие азеотропную точку , разделяются обычной ректификацией в пределах концентраций НК в жидкости от 0 до Х 1, т. е. только на этом интервале кривой, где при испарении жидкости происходит обогащением паровой фазы низкокипящим компонентом.
Однако не все взаимно растворимые жидкости подчиняются закону Рауля и имеют содержание НК в парах (у) выше на всем интервале концентраций Х. Кривые равновесия таких смесей расположены выше диагонали только в интервале 0 -х1 и пересекают диагональ в точке А с абсциссой х=х1. В этой точке состав пара х1 равен составу жидкости Х 1, поэтому при испарении жидкости и последующей конденсации не происходит обогащение паровой фазы низкокипящими компонентами. Точка А пересечения кривой равновесия с диагональю называется азеотропной точкой. Смеси, имеющие азеотропную точку , разделяются обычной ректификацией в пределах концентраций НК в жидкости от 0 до Х 1, т. е. только на этом интервале кривой, где при испарении жидкости происходит обогащением паровой фазы низкокипящим компонентом.
 Фазовая диаграмма t-х, у (для сведения) Точки, лежащие на кривой t А , А 2 , А 1 и t В отвечают жидкой фазе, находящейся при температуре кипения. Любая точка, лежащая на этой кривой, характеризует систему, состоящую только из жидкой фазы. Любая же точка, лежащая выше кривой t. А, В 2, В 1 и t. В, характеризует систему, температура которой выше температуры начала конденсации пара, т. е. пары в этой точке являются перегретыми, и. система состоит только из паровой фазы. Линия конденсации t=f(у) – зависимость Тконденсации пара от его состава. Линия кипения - t=f(х) – зависимость Ткипения бинарной смеси от ее состава. Точки, находящиеся между кривыми кипения и конденсации, например С, характеризуют системы, температуры которых выше Т кипения жидкости данного состава и ниже Т конденсации паров этого состава, таким образом, эти точки отвечают равновесным парожидкостным системам.
Фазовая диаграмма t-х, у (для сведения) Точки, лежащие на кривой t А , А 2 , А 1 и t В отвечают жидкой фазе, находящейся при температуре кипения. Любая точка, лежащая на этой кривой, характеризует систему, состоящую только из жидкой фазы. Любая же точка, лежащая выше кривой t. А, В 2, В 1 и t. В, характеризует систему, температура которой выше температуры начала конденсации пара, т. е. пары в этой точке являются перегретыми, и. система состоит только из паровой фазы. Линия конденсации t=f(у) – зависимость Тконденсации пара от его состава. Линия кипения - t=f(х) – зависимость Ткипения бинарной смеси от ее состава. Точки, находящиеся между кривыми кипения и конденсации, например С, характеризуют системы, температуры которых выше Т кипения жидкости данного состава и ниже Т конденсации паров этого состава, таким образом, эти точки отвечают равновесным парожидкостным системам.
 ПРОЦЕСС МАССООБМЕНА МЕЖДУ ФАЗАМИ (для сведения) Переход вещества из одной фазы в другую, т. е. процесс массообмена (массопередачи), происходит при отсутствии равновесия между фазами. Для наглядности рассмотрим простой пример. Пусть распределяемое вещество находится в паровой фазе G и имеет начальную концентрацию у. Если фазу G привести в соприкосновение с жидкой фазой L , то распределяемое вещество начнет переходить из фазы G в L , . С момента появления распределяемого вещества в жидкой фазе (обозначим концентрацию в ней через х) начнется также обратный переход в фазу G, но преобладающим (на начальном этапе) будет поток из G в L. По мере накопления распределяемого вещества в фазе L скорость обратного перехода будет возрастать и через определенный промежуток времени наступит равенство скоростей перехода, вещества из фазы G в фазу L и обратно (состояние равновесия). Каждому определенному значению концентрации х в жидкой фазе в состоянии равновесия соответствует вполне определенное значение концентрации у * в паровой фазе (знаком * отмечают величины, относящиеся к равновесному состоянию). Математически это выражается формулой. у* = f (х) Графически взаимодействие между фазами в колонном аппарате можно представить на диаграмме у—х С В Диаграмма у — х
ПРОЦЕСС МАССООБМЕНА МЕЖДУ ФАЗАМИ (для сведения) Переход вещества из одной фазы в другую, т. е. процесс массообмена (массопередачи), происходит при отсутствии равновесия между фазами. Для наглядности рассмотрим простой пример. Пусть распределяемое вещество находится в паровой фазе G и имеет начальную концентрацию у. Если фазу G привести в соприкосновение с жидкой фазой L , то распределяемое вещество начнет переходить из фазы G в L , . С момента появления распределяемого вещества в жидкой фазе (обозначим концентрацию в ней через х) начнется также обратный переход в фазу G, но преобладающим (на начальном этапе) будет поток из G в L. По мере накопления распределяемого вещества в фазе L скорость обратного перехода будет возрастать и через определенный промежуток времени наступит равенство скоростей перехода, вещества из фазы G в фазу L и обратно (состояние равновесия). Каждому определенному значению концентрации х в жидкой фазе в состоянии равновесия соответствует вполне определенное значение концентрации у * в паровой фазе (знаком * отмечают величины, относящиеся к равновесному состоянию). Математически это выражается формулой. у* = f (х) Графически взаимодействие между фазами в колонном аппарате можно представить на диаграмме у—х С В Диаграмма у — х
 Линия АВ называется рабочей линией, а кривая ОС, изображающая зависимость равновесной концентрации у* от х, - линией равновесия , или равновесной кривой. Рабочая линия показывает, что поступающая в колонну жидкость концентрации Х 1 по мере движения вниз освобождается от НК, на выходе из колонны концентрация Х 2 минимальная. По мере движения пара вверх концентрация НК в нем возрастает. Направление перехода вещества из одной фазы в другую определяется концентрацией распределяемого вещества. Если рабочая концентрация у больше равновесной у* {у>у*), то вещество переходит из фазы G в фазу L. Если же у<у*, то вещество переходит из фазы L в фазу G. Скорость перехода вещества пропорциональна разности равновесной и рабочей концентраций вещества в одной из фаз. Эта разность называется движущей силой процесса массопередачи. Кроме того, скорость перехода вещества пропорциональна поверхности соприкосновения жидкой и паровой фаз. Если за скорость перехода принять количество вещества, переходящее в единицу времени из одной фазы в другую, то уравнение массопередачи можно написать в следующем виде: Mф=KFфΔ где М ф - количество вещества, перешедшего из одной фазы в другую; К - коэффициент массопередачи; F ф - поверхность соприкосновения фаз; Δ — движущая сила процесса массопередачи. Размерность коэффициента массопередачи зависит от способа выражения движущей силы Δ, которая в свою очередь может быть выражена в любых единицах, применяемых для выражения составов фаз. Интенсификацию процесса массопередачи можно осуществить путем увеличения поверхности контакта Fф между взаимодействующими фазами. Практически это достигается барботажем пара через жидкость, развитием смоченной поверхности насадки: Повышения коэффициента массопередачи К можно достичь путем турбулизации (интенсивного перемешивания) взаимодействующих фаз, что обеспечивается соответствующим конструктивным оформлением проточной части аппарата. Возрастание движущей силы процесса Δ также способствует интенсификации массопередачи и достигается за счет увеличения подачи флегмы в колонну (увеличением флегмового числа R, ).
Линия АВ называется рабочей линией, а кривая ОС, изображающая зависимость равновесной концентрации у* от х, - линией равновесия , или равновесной кривой. Рабочая линия показывает, что поступающая в колонну жидкость концентрации Х 1 по мере движения вниз освобождается от НК, на выходе из колонны концентрация Х 2 минимальная. По мере движения пара вверх концентрация НК в нем возрастает. Направление перехода вещества из одной фазы в другую определяется концентрацией распределяемого вещества. Если рабочая концентрация у больше равновесной у* {у>у*), то вещество переходит из фазы G в фазу L. Если же у<у*, то вещество переходит из фазы L в фазу G. Скорость перехода вещества пропорциональна разности равновесной и рабочей концентраций вещества в одной из фаз. Эта разность называется движущей силой процесса массопередачи. Кроме того, скорость перехода вещества пропорциональна поверхности соприкосновения жидкой и паровой фаз. Если за скорость перехода принять количество вещества, переходящее в единицу времени из одной фазы в другую, то уравнение массопередачи можно написать в следующем виде: Mф=KFфΔ где М ф - количество вещества, перешедшего из одной фазы в другую; К - коэффициент массопередачи; F ф - поверхность соприкосновения фаз; Δ — движущая сила процесса массопередачи. Размерность коэффициента массопередачи зависит от способа выражения движущей силы Δ, которая в свою очередь может быть выражена в любых единицах, применяемых для выражения составов фаз. Интенсификацию процесса массопередачи можно осуществить путем увеличения поверхности контакта Fф между взаимодействующими фазами. Практически это достигается барботажем пара через жидкость, развитием смоченной поверхности насадки: Повышения коэффициента массопередачи К можно достичь путем турбулизации (интенсивного перемешивания) взаимодействующих фаз, что обеспечивается соответствующим конструктивным оформлением проточной части аппарата. Возрастание движущей силы процесса Δ также способствует интенсификации массопередачи и достигается за счет увеличения подачи флегмы в колонну (увеличением флегмового числа R, ).
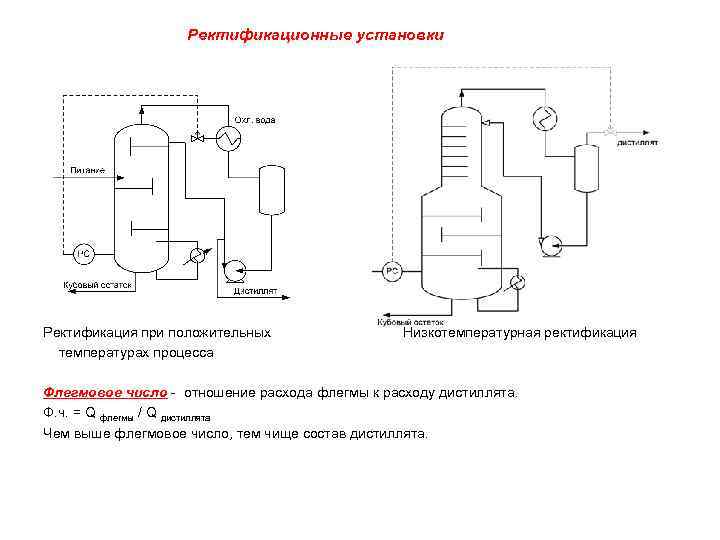
 Ректификационные установки Ректификация при положительных Низкотемпературная ректификация температурах процесса Флегмовое число - отношение расхода флегмы к расходу дистиллята. Ф. ч. = Q флегмы / Q дистиллята Чем выше флегмовое число, тем чище состав дистиллята.
Ректификационные установки Ректификация при положительных Низкотемпературная ректификация температурах процесса Флегмовое число - отношение расхода флегмы к расходу дистиллята. Ф. ч. = Q флегмы / Q дистиллята Чем выше флегмовое число, тем чище состав дистиллята.
 Основные параметры ректификационных установок - Производительность по дистилляту; - Качество получаемого дистиллята; - Расход греющего пара в кипятильник; - Флегмовое число колонны; - Высота (число и тип тарелок) Общие принципы конструирования ректификационных установок - Увеличение числа тарелок увеличивает количество взаимодействий между поднимающимися парами и стекающей флегмой. При этом улучшается степень разделения, но увеличивается высота колонны; - Увеличение расхода флегмы снижает производительность колонны (количество получаемого дистиллята), но улучшает условия массообмена на контактных устройствах, что в конечном итоге улучшает качество дистиллята; - Увеличение флегмового числа (расход возвращаемой в колонну флегмы) требует увеличения расхода греющего пара в кипятильник.
Основные параметры ректификационных установок - Производительность по дистилляту; - Качество получаемого дистиллята; - Расход греющего пара в кипятильник; - Флегмовое число колонны; - Высота (число и тип тарелок) Общие принципы конструирования ректификационных установок - Увеличение числа тарелок увеличивает количество взаимодействий между поднимающимися парами и стекающей флегмой. При этом улучшается степень разделения, но увеличивается высота колонны; - Увеличение расхода флегмы снижает производительность колонны (количество получаемого дистиллята), но улучшает условия массообмена на контактных устройствах, что в конечном итоге улучшает качество дистиллята; - Увеличение флегмового числа (расход возвращаемой в колонну флегмы) требует увеличения расхода греющего пара в кипятильник.
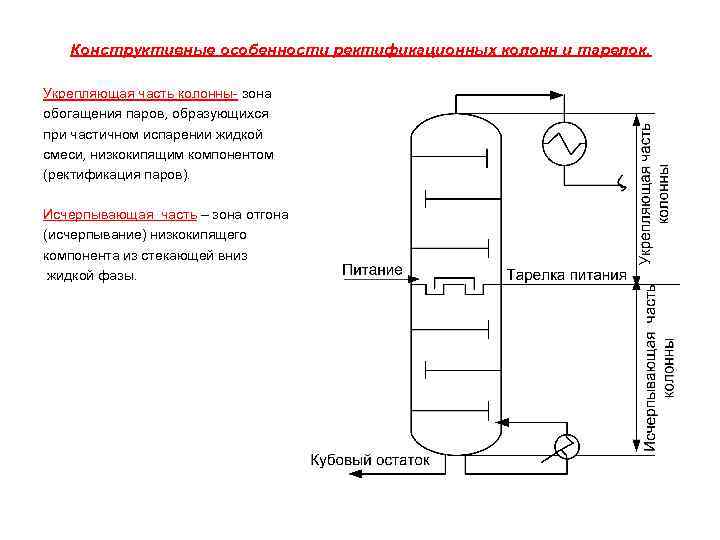
 Конструктивные особенности ректификационных колонн и тарелок. Укрепляющая часть колонны- зона обогащения паров, образующихся при частичном испарении жидкой смеси, низкокипящим компонентом (ректификация паров). Исчерпывающая часть – зона отгона (исчерпывание) низкокипящего компонента из стекающей вниз жидкой фазы.
Конструктивные особенности ректификационных колонн и тарелок. Укрепляющая часть колонны- зона обогащения паров, образующихся при частичном испарении жидкой смеси, низкокипящим компонентом (ректификация паров). Исчерпывающая часть – зона отгона (исчерпывание) низкокипящего компонента из стекающей вниз жидкой фазы.
 Наиболее важными геометрическими размерами тарелки ректификационной колонны являются: а) h 1 – высота переливной планки, поддерживающей требуемый уровень жидкой фазы на тарелке. Выдерживание уровня жидкой фазы на тарелке обеспечивает требуемый массо- теплообмен между жидкой и паровой фазами. б) h 2 – зазор края сливной пластины и нижележащей тарелкой обеспечивает гидрозатвор в сливном устройстве, не допускающей проскока пара помимо полотна с клапанами через это устройство. в) свободное сечение на полотнах тарелки в совокупности с конструкцией клапанов обеспечивает требуемый уровень жидкости на тарелке, т. е. необходимый тепло- массообмен жидкости и пара. г) горизонтальность тарелки. Допуск ± 3 мм обеспечивает равномерное распределение жидкости на тарелке, т. е. исключает «канальное» истечение жидкости и газа по поперечному сечению колонны.
Наиболее важными геометрическими размерами тарелки ректификационной колонны являются: а) h 1 – высота переливной планки, поддерживающей требуемый уровень жидкой фазы на тарелке. Выдерживание уровня жидкой фазы на тарелке обеспечивает требуемый массо- теплообмен между жидкой и паровой фазами. б) h 2 – зазор края сливной пластины и нижележащей тарелкой обеспечивает гидрозатвор в сливном устройстве, не допускающей проскока пара помимо полотна с клапанами через это устройство. в) свободное сечение на полотнах тарелки в совокупности с конструкцией клапанов обеспечивает требуемый уровень жидкости на тарелке, т. е. необходимый тепло- массообмен жидкости и пара. г) горизонтальность тарелки. Допуск ± 3 мм обеспечивает равномерное распределение жидкости на тарелке, т. е. исключает «канальное» истечение жидкости и газа по поперечному сечению колонны.
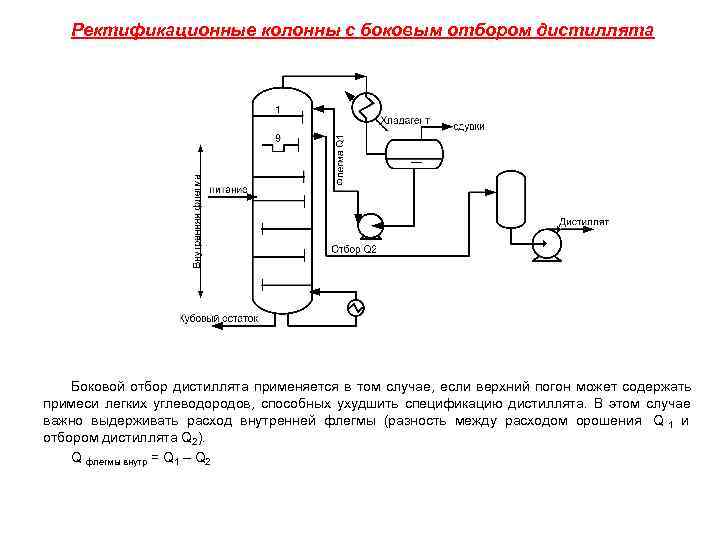
 Ректификационные колонны с боковым отбором дистиллята Боковой отбор дистиллята применяется в том случае, если верхний погон может содержать примеси легких углеводородов, способных ухудшить спецификацию дистиллята. В этом случае важно выдерживать расход внутренней флегмы (разность между расходом орошения Q 1 и отбором дистиллята Q 2). Q флегмы внутр = Q 1 – Q 2
Ректификационные колонны с боковым отбором дистиллята Боковой отбор дистиллята применяется в том случае, если верхний погон может содержать примеси легких углеводородов, способных ухудшить спецификацию дистиллята. В этом случае важно выдерживать расход внутренней флегмы (разность между расходом орошения Q 1 и отбором дистиллята Q 2). Q флегмы внутр = Q 1 – Q 2
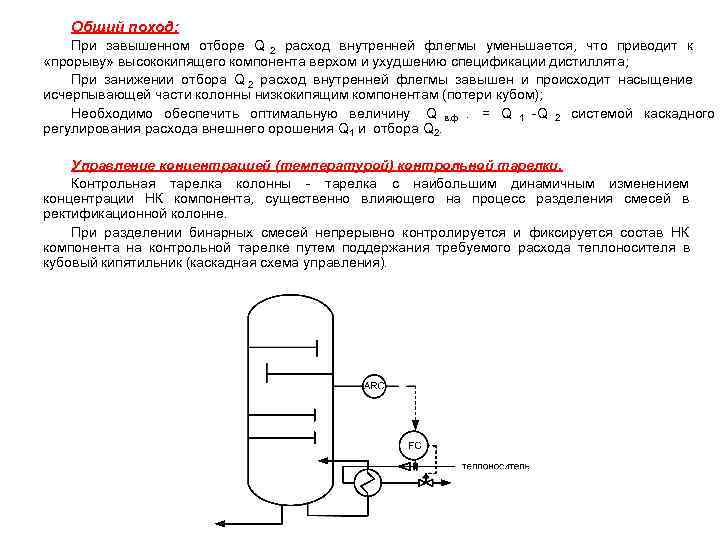
 Общий поход: При завышенном отборе Q 2 расход внутренней флегмы уменьшается, что приводит к «прорыву» высококипящего компонента верхом и ухудшению спецификации дистиллята; При занижении отбора Q 2 расход внутренней флегмы завышен и происходит насыщение исчерпывающей части колонны низкокипящим компонентам (потери кубом); Необходимо обеспечить оптимальную величину Q в. ф. = Q 1 -Q 2 системой каскадного регулирования расхода внешнего орошения Q 1 и отбора Q 2. Управление концентрацией (температурой) контрольной тарелки. Контрольная тарелка колонны - тарелка с наибольшим динамичным изменением концентрации НК компонента, существенно влияющего на процесс разделения смесей в ректификационной колонне. При разделении бинарных смесей непрерывно контролируется и фиксируется состав НК компонента на контрольной тарелке путем поддержания требуемого расхода теплоносителя в кубовый кипятильник (каскадная схема управления).
Общий поход: При завышенном отборе Q 2 расход внутренней флегмы уменьшается, что приводит к «прорыву» высококипящего компонента верхом и ухудшению спецификации дистиллята; При занижении отбора Q 2 расход внутренней флегмы завышен и происходит насыщение исчерпывающей части колонны низкокипящим компонентам (потери кубом); Необходимо обеспечить оптимальную величину Q в. ф. = Q 1 -Q 2 системой каскадного регулирования расхода внешнего орошения Q 1 и отбора Q 2. Управление концентрацией (температурой) контрольной тарелки. Контрольная тарелка колонны - тарелка с наибольшим динамичным изменением концентрации НК компонента, существенно влияющего на процесс разделения смесей в ректификационной колонне. При разделении бинарных смесей непрерывно контролируется и фиксируется состав НК компонента на контрольной тарелке путем поддержания требуемого расхода теплоносителя в кубовый кипятильник (каскадная схема управления).
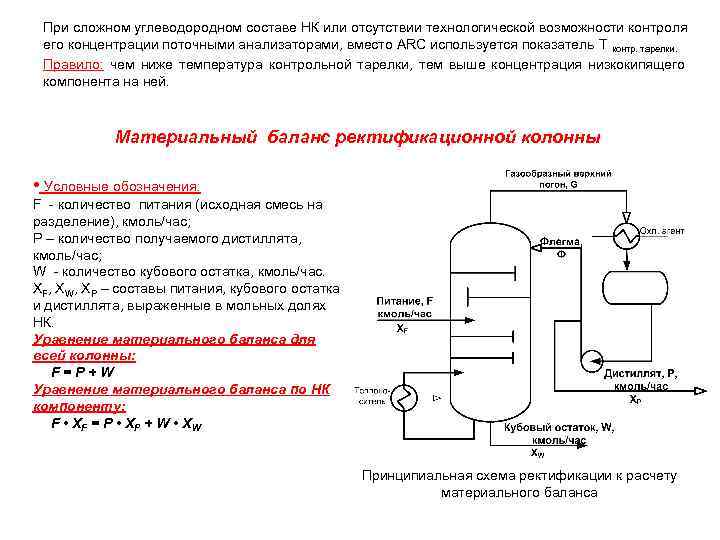
 При сложном углеводородном составе НК или отсутствии технологической возможности контроля его концентрации поточными анализаторами, вместо ARC используется показатель Т контр. тарелки. Правило: чем ниже температура контрольной тарелки, тем выше концентрация низкокипящего компонента на ней. Материальный баланс ректификационной колонны • Условные обозначения: F - количество питания (исходная смесь на разделение), кмоль/час; Р – количество получаемого дистиллята, кмоль/час; W - количество кубового остатка, кмоль/час. XF, XW, XP – составы питания, кубового остатка и дистиллята, выраженные в мольных долях НК. Уравнение материального баланса для всей колонны: F=P+W Уравнение материального баланса по НК компоненту: F • ХF = P • Х P + W • XW Принципиальная схема ректификации к расчету материального баланса
При сложном углеводородном составе НК или отсутствии технологической возможности контроля его концентрации поточными анализаторами, вместо ARC используется показатель Т контр. тарелки. Правило: чем ниже температура контрольной тарелки, тем выше концентрация низкокипящего компонента на ней. Материальный баланс ректификационной колонны • Условные обозначения: F - количество питания (исходная смесь на разделение), кмоль/час; Р – количество получаемого дистиллята, кмоль/час; W - количество кубового остатка, кмоль/час. XF, XW, XP – составы питания, кубового остатка и дистиллята, выраженные в мольных долях НК. Уравнение материального баланса для всей колонны: F=P+W Уравнение материального баланса по НК компоненту: F • ХF = P • Х P + W • XW Принципиальная схема ректификации к расчету материального баланса
 При помощи этих уравнений решаются все задачи, связанные с определением количеств или составов веществ, участвующих в процессе ректификации. Чаще всего задан расход исходной смеси F и содержание НК в питании XF, в кубовом остатке XW и в верхнем погоне – дистилляте X P. Концентрация X P НК в верхнем погоне обычно требуется максимально возможной, т. к. это целевой продукт процесса ректификации. Обычно F, P, W задаются в массовых величинах (кг/час, т/час), а составы исходного питания, дистиллята и кубовый остаток задаются в массовых долях. Расход верхнего газообразного погона колонны складываются из расхода флегмы и расхода дистиллята. G=Ф +P R = Ф - флегмовое число Р • Уравнение материального баланса укрепляющей (верхней) части колонны (для сведения) Баланс по потокам: G=Ф +P 1 Баланс по низкокипящему компоненту: G • y = Ф • x + P • x. P 2 где, - G, Ф и Р – мольный расход пара по верху колонны (шлем), флегмы и дистиллята. - у и х – переменные по высоте колонны неравновесные концентрации (мольные доли) легколетучего компонента в паре и жидкости в данном сечении колонны. -х. Р – содержание (мольная доля) легколетучего компонента в дистилляте. Уравнение 2 может быть переписано Это уравнение рабочей линии укрепляющей части колонны. Оно связывает текущие (неравновесные) составы пара и жидкости (для тарельчатых колонн – состав пара, входящего на тарелку и состав жидкости, стекающей с этой тарелки).
При помощи этих уравнений решаются все задачи, связанные с определением количеств или составов веществ, участвующих в процессе ректификации. Чаще всего задан расход исходной смеси F и содержание НК в питании XF, в кубовом остатке XW и в верхнем погоне – дистилляте X P. Концентрация X P НК в верхнем погоне обычно требуется максимально возможной, т. к. это целевой продукт процесса ректификации. Обычно F, P, W задаются в массовых величинах (кг/час, т/час), а составы исходного питания, дистиллята и кубовый остаток задаются в массовых долях. Расход верхнего газообразного погона колонны складываются из расхода флегмы и расхода дистиллята. G=Ф +P R = Ф - флегмовое число Р • Уравнение материального баланса укрепляющей (верхней) части колонны (для сведения) Баланс по потокам: G=Ф +P 1 Баланс по низкокипящему компоненту: G • y = Ф • x + P • x. P 2 где, - G, Ф и Р – мольный расход пара по верху колонны (шлем), флегмы и дистиллята. - у и х – переменные по высоте колонны неравновесные концентрации (мольные доли) легколетучего компонента в паре и жидкости в данном сечении колонны. -х. Р – содержание (мольная доля) легколетучего компонента в дистилляте. Уравнение 2 может быть переписано Это уравнение рабочей линии укрепляющей части колонны. Оно связывает текущие (неравновесные) составы пара и жидкости (для тарельчатых колонн – состав пара, входящего на тарелку и состав жидкости, стекающей с этой тарелки).
 • Уравнение материального баланса исчерпывающей (нижней) части колонны - баланс по потокам G+W=F+R 3 где, G – мольный расход паров верхнего погона (шлем); W – мольный расход куб. остатка F – мольный расход питания Ф- мольный расход флегмы - баланс по легколетучему компоненту G • y + W • x. W = (F + Ф) • x 4 где - W – мольный расход кубового остатка x. W – мольная доля НК в кубовом остатке F – мольный расход питания Ф – мольный расход флегмы. Уравнение 4 может быть переписано: R – флегмовое число колонны (R = Ф/Р) f = F питания Рдистиллят Это уравнение рабочей линии нижней исчерпывающей части колонны.
• Уравнение материального баланса исчерпывающей (нижней) части колонны - баланс по потокам G+W=F+R 3 где, G – мольный расход паров верхнего погона (шлем); W – мольный расход куб. остатка F – мольный расход питания Ф- мольный расход флегмы - баланс по легколетучему компоненту G • y + W • x. W = (F + Ф) • x 4 где - W – мольный расход кубового остатка x. W – мольная доля НК в кубовом остатке F – мольный расход питания Ф – мольный расход флегмы. Уравнение 4 может быть переписано: R – флегмовое число колонны (R = Ф/Р) f = F питания Рдистиллят Это уравнение рабочей линии нижней исчерпывающей части колонны.
 Определение числа тарелок и высоты насадки в колонне (для сведения) Для определения числа тарелок в ректификационной колонне графо-аналитическим методом строят диаграмму «у – х» в крупном масштабе, на которой по табличным данным строят равновесную кривую. Рассчитать флегмовое число R = Ф Р Для построения рабочих линий на оси абцисс диаграммы откладдывают заданные составы жидкостей X F (мольное содержание НК в питании), X W (мольное содержание НК в куб. остатке), X Р (мольное содержание НК в дистилляте). С учетом принятых допущений о равенстве составов пара, уходящего с верхней тарелки с дистиллята (У Р = Х Р ), из точек ХР восстанавливаем вертикаль до пересечения с диагональю диаграммы в точке в. Далее откладываем на оси ординат (у) отрезок (уравнение верхней рабочей линии) при Х = 0, получаем точку а. Эту точку а соединяем с точкой в, которая получена пересечением диагонали с вертикалью из точки ХР. Восстановив вертикаль из точки Х F (мольный состав питания колонны ) на пересечении с линией ав находят точку с. Прямая вс – рабочая линия укрепляющей части колонны. Согласно допущению УW=ХW о равенстве состава пара, уходящего с последней (нижней) тарелки и состава кубового остатка, из точки, соответствующей составу Х W , восстанавливаем вертикаль до пересечения с диагональю диаграммы и получаем точку d. Соединяя точку d с точкой с, принадлежащей одновременно рабочим линиям укрепляющей и исчерпывающей частей колонны, получаем отрезок с d , соответствующий рабочей линии исчерпывающей части колонны. Рабочие линии отвечают изменению рабочих концентраций в верхней и нижней частях ректификационной колонны.
Определение числа тарелок и высоты насадки в колонне (для сведения) Для определения числа тарелок в ректификационной колонне графо-аналитическим методом строят диаграмму «у – х» в крупном масштабе, на которой по табличным данным строят равновесную кривую. Рассчитать флегмовое число R = Ф Р Для построения рабочих линий на оси абцисс диаграммы откладдывают заданные составы жидкостей X F (мольное содержание НК в питании), X W (мольное содержание НК в куб. остатке), X Р (мольное содержание НК в дистилляте). С учетом принятых допущений о равенстве составов пара, уходящего с верхней тарелки с дистиллята (У Р = Х Р ), из точек ХР восстанавливаем вертикаль до пересечения с диагональю диаграммы в точке в. Далее откладываем на оси ординат (у) отрезок (уравнение верхней рабочей линии) при Х = 0, получаем точку а. Эту точку а соединяем с точкой в, которая получена пересечением диагонали с вертикалью из точки ХР. Восстановив вертикаль из точки Х F (мольный состав питания колонны ) на пересечении с линией ав находят точку с. Прямая вс – рабочая линия укрепляющей части колонны. Согласно допущению УW=ХW о равенстве состава пара, уходящего с последней (нижней) тарелки и состава кубового остатка, из точки, соответствующей составу Х W , восстанавливаем вертикаль до пересечения с диагональю диаграммы и получаем точку d. Соединяя точку d с точкой с, принадлежащей одновременно рабочим линиям укрепляющей и исчерпывающей частей колонны, получаем отрезок с d , соответствующий рабочей линии исчерпывающей части колонны. Рабочие линии отвечают изменению рабочих концентраций в верхней и нижней частях ректификационной колонны.
 Для определения числа теоретических тарелок в колонне из точки в проводим горизонтальную линию до равновесной кривой, а из точки встречи этой линии с кривой построим вертикальную линию до рабочей линии и т. д. Число ступенек в полученной таким образом «лесенке» равно требуемому числу тарелок в верхней части колонны. Построение для определения числа тарелок в исчерпывающей части колонны начинают с вертикали от ХW до равновесной кривой. На рис. 18 в укрепляющей части колонны получилось пять тарелок, а в исчерпывающей части — три тарелки, т. е. всего в колонне восемь теоретических тарелок. В реальной колонне число тарелок принимают в 1, 5— 2 раза больше теоретического, так как достичь полного обогащения на тарелке практически не удается по целому ряду причин: неравномерная работа тарелки по сечению, унос жидкости на расположенную выше тарелку, недостаточное время контакта и т. п. Если в колонне в качестве контактного устройства применена насадка, то высоту насадки можно определить по формуле: Н = п. ТНТ где Н — общая высота насадки, м; п Т — число ступеней контакта; Н Т — высота насадки, соответствующая одной ступени контакта, м. Другие, более сложные методы определения рабочей высоты ректификационной колонны рассматриваться здесь не будут. В заключение рассмотрим влияние флегмового числа на высоту колонны, т. е. на число теоретических тарелок. Из рисунка 19 следует, что при полной флегме, когда R = ∞, число тарелок минимальное. В случае R=R мин число тарелок равно бесконечности, т. е. требуется колонна бесконечной высоты, что нереально. Наконец, для рабочего оптимального флегмового числа R = 2 Rмин требуется число тарелок несколько большее, чем для R= ∞. Рис. 19 Влияние флегмы на число тарелок в колонне: а — полная флегма (бесконечное флегмовое число); б — рабочее (оптимальное) флегмовое число; в — минимальное флегмовое число.
Для определения числа теоретических тарелок в колонне из точки в проводим горизонтальную линию до равновесной кривой, а из точки встречи этой линии с кривой построим вертикальную линию до рабочей линии и т. д. Число ступенек в полученной таким образом «лесенке» равно требуемому числу тарелок в верхней части колонны. Построение для определения числа тарелок в исчерпывающей части колонны начинают с вертикали от ХW до равновесной кривой. На рис. 18 в укрепляющей части колонны получилось пять тарелок, а в исчерпывающей части — три тарелки, т. е. всего в колонне восемь теоретических тарелок. В реальной колонне число тарелок принимают в 1, 5— 2 раза больше теоретического, так как достичь полного обогащения на тарелке практически не удается по целому ряду причин: неравномерная работа тарелки по сечению, унос жидкости на расположенную выше тарелку, недостаточное время контакта и т. п. Если в колонне в качестве контактного устройства применена насадка, то высоту насадки можно определить по формуле: Н = п. ТНТ где Н — общая высота насадки, м; п Т — число ступеней контакта; Н Т — высота насадки, соответствующая одной ступени контакта, м. Другие, более сложные методы определения рабочей высоты ректификационной колонны рассматриваться здесь не будут. В заключение рассмотрим влияние флегмового числа на высоту колонны, т. е. на число теоретических тарелок. Из рисунка 19 следует, что при полной флегме, когда R = ∞, число тарелок минимальное. В случае R=R мин число тарелок равно бесконечности, т. е. требуется колонна бесконечной высоты, что нереально. Наконец, для рабочего оптимального флегмового числа R = 2 Rмин требуется число тарелок несколько большее, чем для R= ∞. Рис. 19 Влияние флегмы на число тарелок в колонне: а — полная флегма (бесконечное флегмовое число); б — рабочее (оптимальное) флегмовое число; в — минимальное флегмовое число.
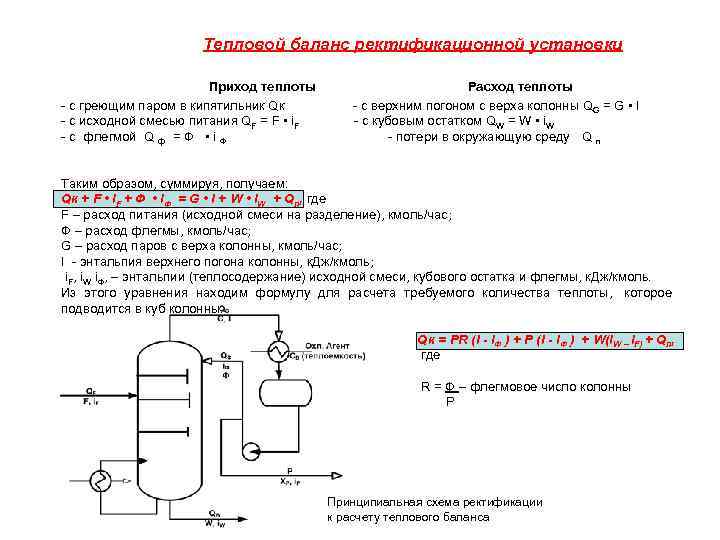
 Тепловой баланс ректификационной установки Приход теплоты Расход теплоты - с греющим паром в кипятильник Qк - с верхним погоном с верха колонны QG = G • I - с исходной смесью питания QF = F • i. F - с кубовым остатком QW = W • i. W - с флегмой Q ф = Ф • i Ф - потери в окружающую среду Q п Таким образом, суммируя, получаем: Qк + F • i. F + Ф • i. Ф = G • I + W • i. W + Qп, где F – расход питания (исходной смеси на разделение), кмоль/час; Ф – расход флегмы, кмоль/час; G – расход паров с верха колонны, кмоль/час; I - энтальпия верхнего погона колонны, к. Дж/кмоль; i. F, i. W i. Ф, – энтальпии (теплосодержание) исходной смеси, кубового остатка и флегмы, к. Дж/кмоль. Из этого уравнения находим формулу для расчета требуемого количества теплоты, которое подводится в куб колонны. Qк = PR (I - i. Ф ) + Р (I - i. Ф ) + W(i. W – i. F) + Qп, где R = Ф – флегмовое число колонны Р Принципиальная схема ректификации к расчету теплового баланса
Тепловой баланс ректификационной установки Приход теплоты Расход теплоты - с греющим паром в кипятильник Qк - с верхним погоном с верха колонны QG = G • I - с исходной смесью питания QF = F • i. F - с кубовым остатком QW = W • i. W - с флегмой Q ф = Ф • i Ф - потери в окружающую среду Q п Таким образом, суммируя, получаем: Qк + F • i. F + Ф • i. Ф = G • I + W • i. W + Qп, где F – расход питания (исходной смеси на разделение), кмоль/час; Ф – расход флегмы, кмоль/час; G – расход паров с верха колонны, кмоль/час; I - энтальпия верхнего погона колонны, к. Дж/кмоль; i. F, i. W i. Ф, – энтальпии (теплосодержание) исходной смеси, кубового остатка и флегмы, к. Дж/кмоль. Из этого уравнения находим формулу для расчета требуемого количества теплоты, которое подводится в куб колонны. Qк = PR (I - i. Ф ) + Р (I - i. Ф ) + W(i. W – i. F) + Qп, где R = Ф – флегмовое число колонны Р Принципиальная схема ректификации к расчету теплового баланса
 Расход греющего пара в кипятильник (G гр. ) где rгр - удельная теплота конденсации (парообразования) греющего пара xгр - степень сухости греющего пара Q кип – тепло, необходимое для подвода в куб колонны кубовым кипятильником Тепло, необходимое для подвода кипятильником, определяется по формуле: Qkип = GD (R + 1) I + GW • i. W + Q потерь, где GD – расход дистиллята R – флегмовое число колонны I – энтальпия паров, выходящих с верха колонны GW – расход куб. остатка i. W – энтальпия куб. остатка Q потерь – теплопотери. Из вышеприведенного уравнения следует: тепло, подводимое в кипятильник, затрачивается на а) испарение флегмы GD(R + 1) I б) нагрев кубового остатка до температуры кипения GW • i. W , в) компенсацию потерь тепла в окружающую среду. Расход воды на конденсацию Св – удельная теплоемкость воды tк и tн – конечная и начальная температура воды на выходе и входе в конденсатор
Расход греющего пара в кипятильник (G гр. ) где rгр - удельная теплота конденсации (парообразования) греющего пара xгр - степень сухости греющего пара Q кип – тепло, необходимое для подвода в куб колонны кубовым кипятильником Тепло, необходимое для подвода кипятильником, определяется по формуле: Qkип = GD (R + 1) I + GW • i. W + Q потерь, где GD – расход дистиллята R – флегмовое число колонны I – энтальпия паров, выходящих с верха колонны GW – расход куб. остатка i. W – энтальпия куб. остатка Q потерь – теплопотери. Из вышеприведенного уравнения следует: тепло, подводимое в кипятильник, затрачивается на а) испарение флегмы GD(R + 1) I б) нагрев кубового остатка до температуры кипения GW • i. W , в) компенсацию потерь тепла в окружающую среду. Расход воды на конденсацию Св – удельная теплоемкость воды tк и tн – конечная и начальная температура воды на выходе и входе в конденсатор
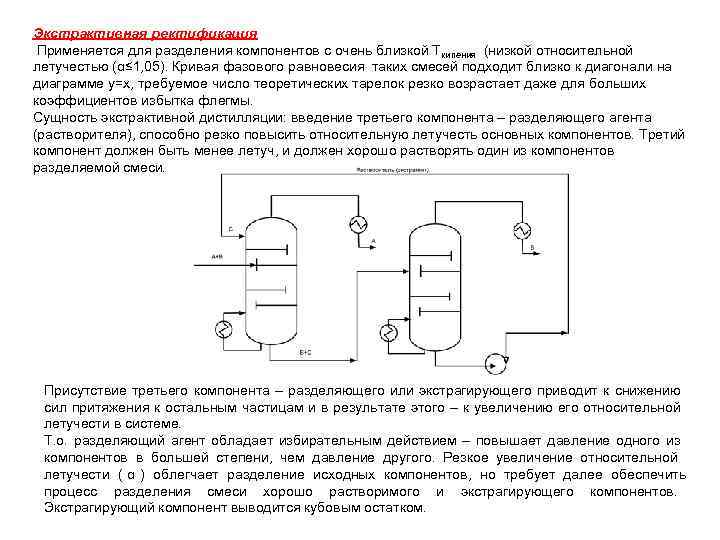
 Экстрактивная ректификация Применяется для разделения компонентов с очень близкой Ткипения (низкой относительной летучестью (α≤ 1, 05). Кривая фазового равновесия таких смесей подходит близко к диагонали на диаграмме у=х, требуемое число теоретических тарелок резко возрастает даже для больших коэффициентов избытка флегмы. Сущность экстрактивной дистилляции: введение третьего компонента – разделяющего агента (растворителя), способно резко повысить относительную летучесть основных компонентов. Третий компонент должен быть менее летуч, и должен хорошо растворять один из компонентов разделяемой смеси. Присутствие третьего компонента – разделяющего или экстрагирующего приводит к снижению сил притяжения к остальным частицам и в результате этого – к увеличению его относительной летучести в системе. Т. о. разделяющий агент обладает избирательным действием – повышает давление одного из компонентов в большей степени, чем давление другого. Резкое увеличение относительной летучести ( α ) облегчает разделение исходных компонентов, но требует далее обеспечить процесс разделения смеси хорошо растворимого и экстрагирующего компонентов. Экстрагирующий компонент выводится кубовым остатком.
Экстрактивная ректификация Применяется для разделения компонентов с очень близкой Ткипения (низкой относительной летучестью (α≤ 1, 05). Кривая фазового равновесия таких смесей подходит близко к диагонали на диаграмме у=х, требуемое число теоретических тарелок резко возрастает даже для больших коэффициентов избытка флегмы. Сущность экстрактивной дистилляции: введение третьего компонента – разделяющего агента (растворителя), способно резко повысить относительную летучесть основных компонентов. Третий компонент должен быть менее летуч, и должен хорошо растворять один из компонентов разделяемой смеси. Присутствие третьего компонента – разделяющего или экстрагирующего приводит к снижению сил притяжения к остальным частицам и в результате этого – к увеличению его относительной летучести в системе. Т. о. разделяющий агент обладает избирательным действием – повышает давление одного из компонентов в большей степени, чем давление другого. Резкое увеличение относительной летучести ( α ) облегчает разделение исходных компонентов, но требует далее обеспечить процесс разделения смеси хорошо растворимого и экстрагирующего компонентов. Экстрагирующий компонент выводится кубовым остатком.
 Азеотропная ректификация Принцип: к разделяемой смеси А+В добавляется третий компонент С, который образует с одним из компонентов разделяемой смеси новую (более летучую, чем исходная) азеотропную смесь, обладающую минимальной температурой кипения. Эта более летучая, чем исходная, азеотропная смесь отгоняется в качестве дистиллята, а чистый другой компонент выводится в виде кубового остатка. В и С находятся в жидком состоянии и не растворимы. Наиболее сложная задача экстрактивной и азеотропной ректификации – выбор разделяющего агента, который должен : - обеспечивать возможно большее повышение коэффициента отно разделяемых компонентов; - достаточно легко регенерироваться; - хорошо растворить разделяемые компоненты для предотвращения расслаивания жидкой фазы при рабочих температурах в колонне; - быть безопасным, доступным, термически стабильным, дешевым.
Азеотропная ректификация Принцип: к разделяемой смеси А+В добавляется третий компонент С, который образует с одним из компонентов разделяемой смеси новую (более летучую, чем исходная) азеотропную смесь, обладающую минимальной температурой кипения. Эта более летучая, чем исходная, азеотропная смесь отгоняется в качестве дистиллята, а чистый другой компонент выводится в виде кубового остатка. В и С находятся в жидком состоянии и не растворимы. Наиболее сложная задача экстрактивной и азеотропной ректификации – выбор разделяющего агента, который должен : - обеспечивать возможно большее повышение коэффициента отно разделяемых компонентов; - достаточно легко регенерироваться; - хорошо растворить разделяемые компоненты для предотвращения расслаивания жидкой фазы при рабочих температурах в колонне; - быть безопасным, доступным, термически стабильным, дешевым.

