3.ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ и жидкостях 3.1

![Полярность связи Дипольный момент = l [Клм], Дебай Полярность связи Дипольный момент = l [Клм], Дебай](https://present5.com/presentacii-2/20171208\12136-3-tverdoe_telo.ppt\12136-3-tverdoe_telo_3.jpg)


12136-3-tverdoe_telo.ppt
- Количество слайдов: 32
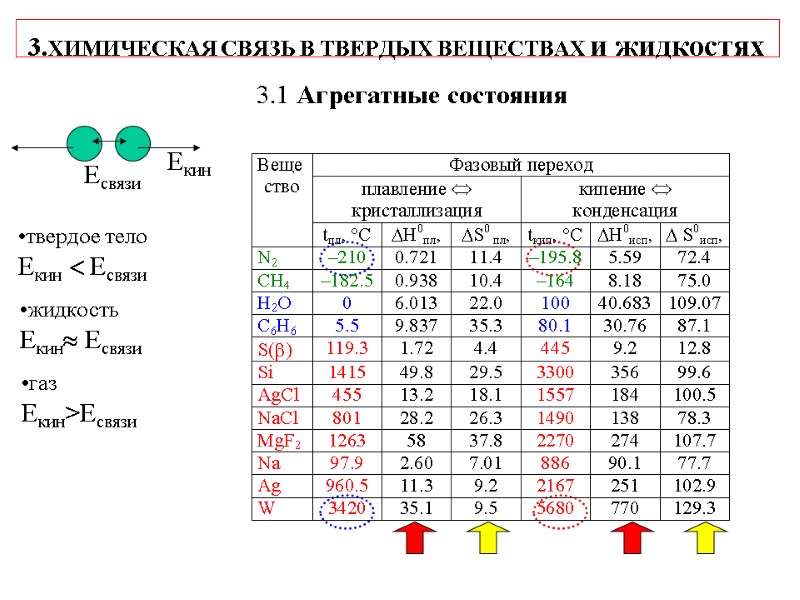
 3.ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ и жидкостях 3.1 Агрегатные состояния твердое тело Екин Есвязи жидкость Екин Есвязи газ Екин>Есвязи
3.ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ и жидкостях 3.1 Агрегатные состояния твердое тело Екин Есвязи жидкость Екин Есвязи газ Екин>Есвязи
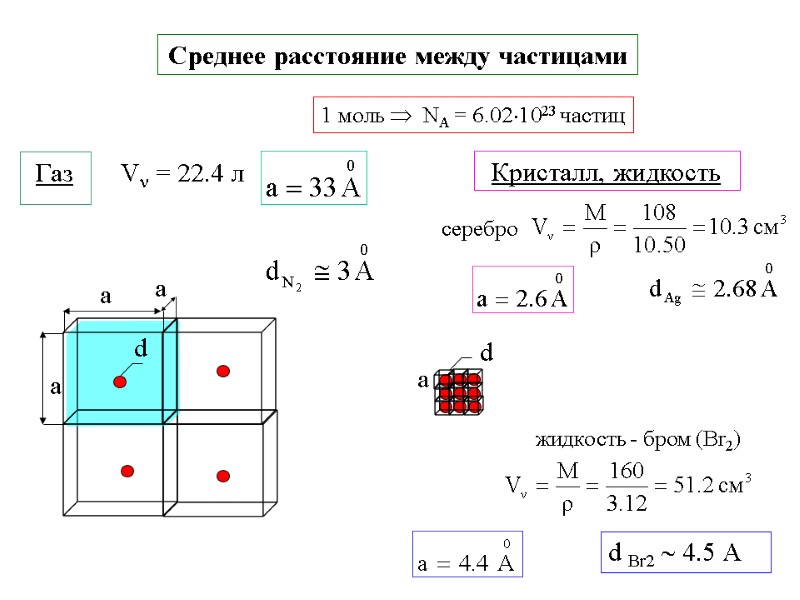
 Среднее расстояние между частицами V = 22.4 л 1 моль NA = 6.021023 частиц Кристалл, жидкость жидкость - бром (Br2) d Br2 4.5 А
Среднее расстояние между частицами V = 22.4 л 1 моль NA = 6.021023 частиц Кристалл, жидкость жидкость - бром (Br2) d Br2 4.5 А
![>Полярность связи Дипольный момент = l [Клм], Дебай >Полярность связи Дипольный момент = l [Клм], Дебай](https://present5.com/presentacii-2/20171208\12136-3-tverdoe_telo.ppt\12136-3-tverdoe_telo_3.jpg) Полярность связи Дипольный момент = l [Клм], Дебай (D) 1 D = 3,3310-30 Клм Диполь μи –индуцированный(наведенный) дип.момент - коэффициент поляризуемости (поляризуемость) Е – напряженность электрического поля Поляризуемость молекул 3.1 Межмолекулярное взаимодействие
Полярность связи Дипольный момент = l [Клм], Дебай (D) 1 D = 3,3310-30 Клм Диполь μи –индуцированный(наведенный) дип.момент - коэффициент поляризуемости (поляризуемость) Е – напряженность электрического поля Поляризуемость молекул 3.1 Межмолекулярное взаимодействие
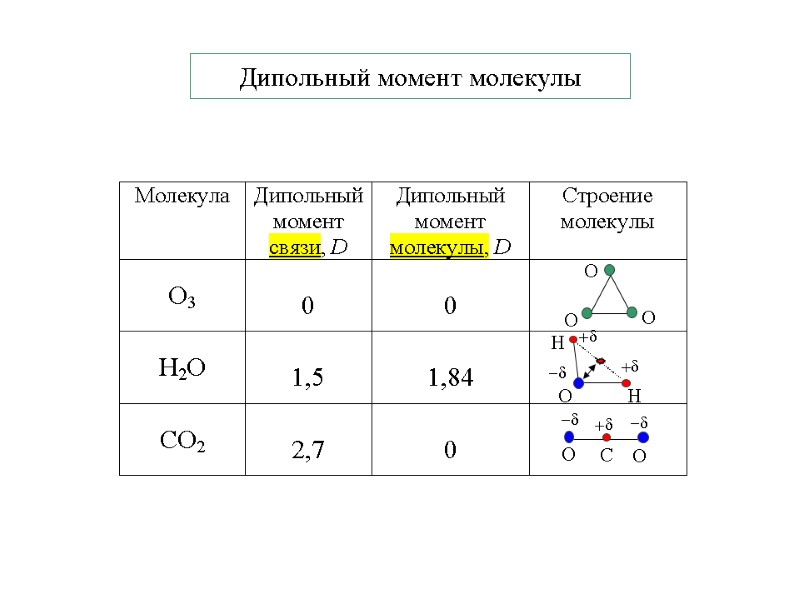
 Дипольный момент молекулы
Дипольный момент молекулы
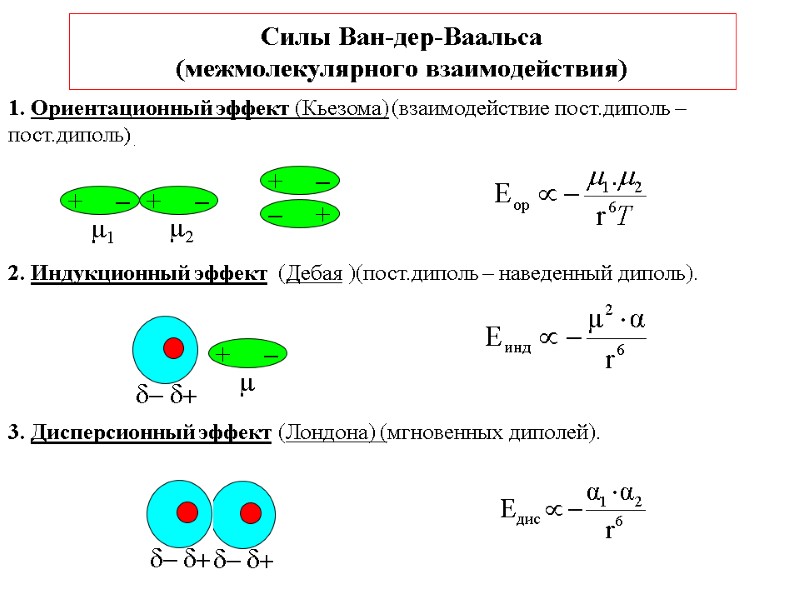
 Силы Ван-дер-Ваальса (межмолекулярного взаимодействия) 1. Ориентационный эффект (Кьезома) (взаимодействие пост.диполь – пост.диполь) . 2. Индукционный эффект (Дебая )(пост.диполь – наведенный диполь). 3. Дисперсионный эффект (Лондона) (мгновенных диполей).
Силы Ван-дер-Ваальса (межмолекулярного взаимодействия) 1. Ориентационный эффект (Кьезома) (взаимодействие пост.диполь – пост.диполь) . 2. Индукционный эффект (Дебая )(пост.диполь – наведенный диполь). 3. Дисперсионный эффект (Лондона) (мгновенных диполей).
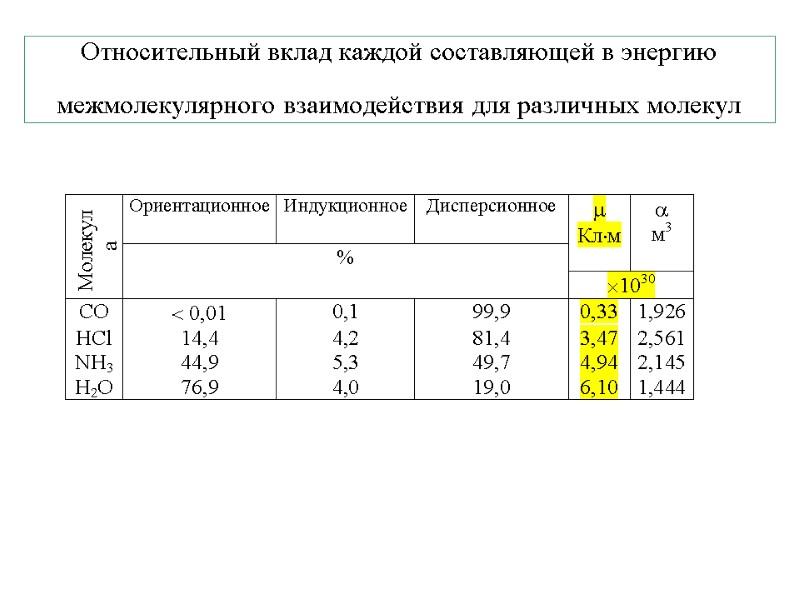
 Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
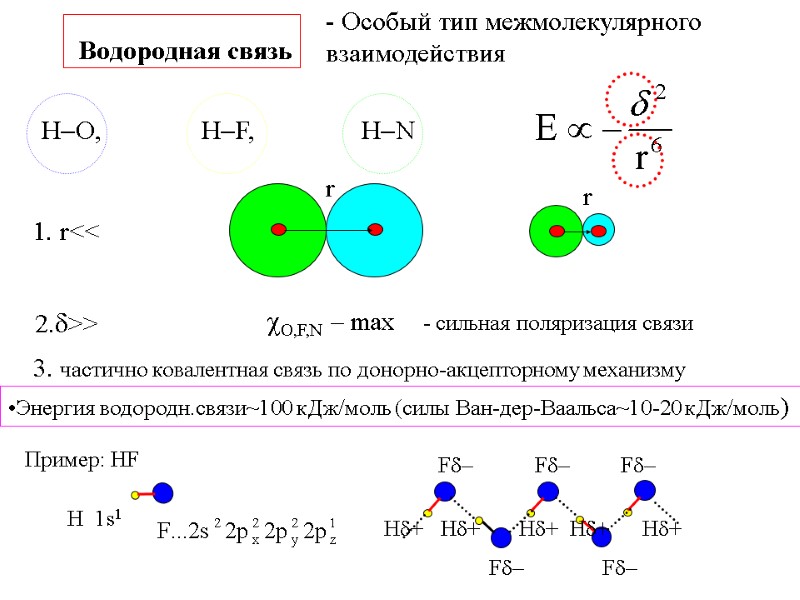
 Водородная связь - Особый тип межмолекулярного взаимодействия 1. r<< 2.>> O,F,N – max - сильная поляризация связи 3. частично ковалентная связь по донорно-акцепторному механизму Энергия водородн.связи~100 кДж/моль (силы Ван-дер-Ваальса~10-20 кДж/моль) Пример: HF
Водородная связь - Особый тип межмолекулярного взаимодействия 1. r<< 2.>> O,F,N – max - сильная поляризация связи 3. частично ковалентная связь по донорно-акцепторному механизму Энергия водородн.связи~100 кДж/моль (силы Ван-дер-Ваальса~10-20 кДж/моль) Пример: HF
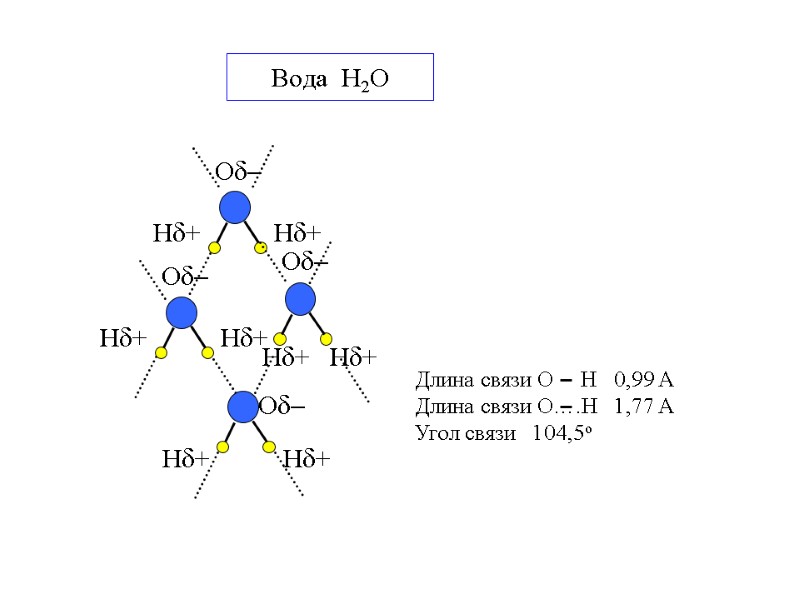
 Вода H2O
Вода H2O
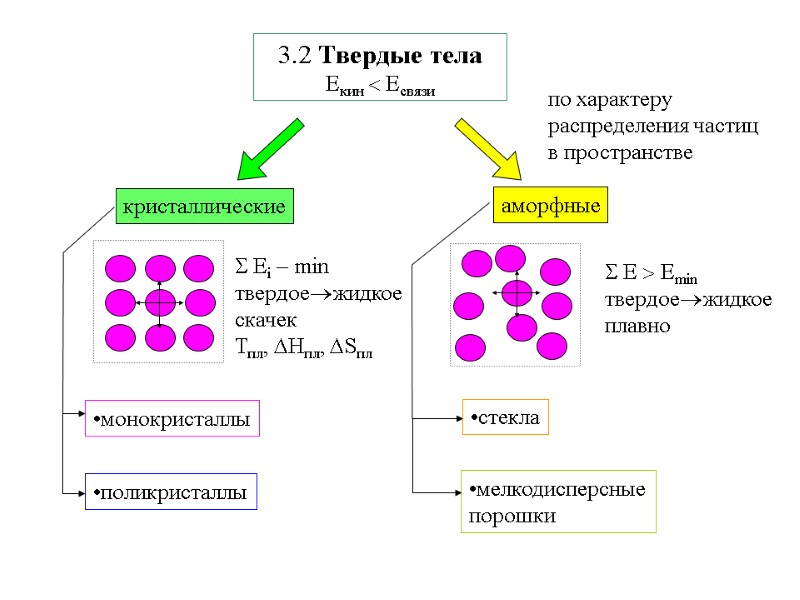
 3.2 Твердые тела Екин Есвязи по характеру распределения частиц в пространстве
3.2 Твердые тела Екин Есвязи по характеру распределения частиц в пространстве
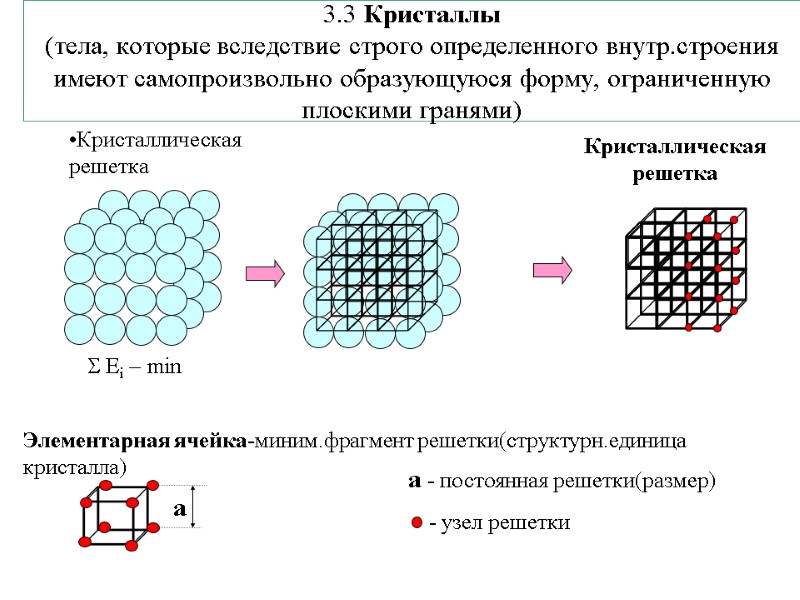
 3.3 Кристаллы (тела, которые вследствие строго определенного внутр.строения имеют самопроизвольно образующуюся форму, ограниченную плоскими гранями) Кристаллическая решетка а - постоянная решетки(размер)
3.3 Кристаллы (тела, которые вследствие строго определенного внутр.строения имеют самопроизвольно образующуюся форму, ограниченную плоскими гранями) Кристаллическая решетка а - постоянная решетки(размер)
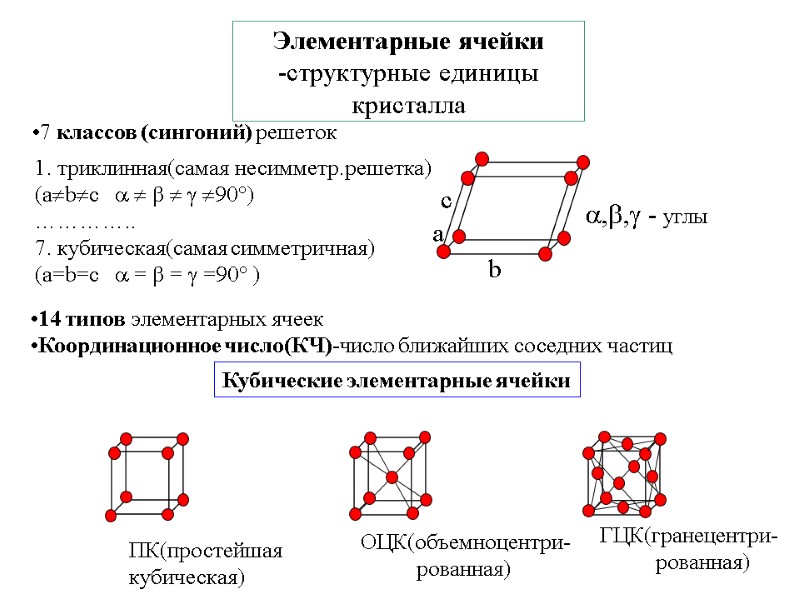
 Элементарные ячейки -структурные единицы кристалла 7 классов (сингоний) решеток 1. триклинная(самая несимметр.решетка) (abc 90°) ………….. 7. кубическая(самая симметричная) (a=b=c = = =90° ) Кубические элементарные ячейки 14 типов элементарных ячеек Координационное число(КЧ)-число ближайших соседних частиц
Элементарные ячейки -структурные единицы кристалла 7 классов (сингоний) решеток 1. триклинная(самая несимметр.решетка) (abc 90°) ………….. 7. кубическая(самая симметричная) (a=b=c = = =90° ) Кубические элементарные ячейки 14 типов элементарных ячеек Координационное число(КЧ)-число ближайших соседних частиц
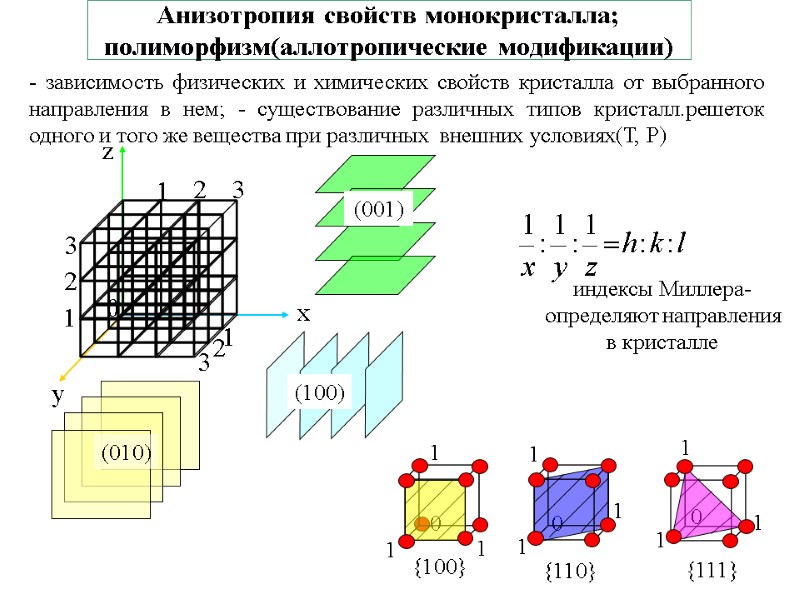
 Анизотропия свойств монокристалла; полиморфизм(аллотропические модификации) - зависимость физических и химических свойств кристалла от выбранного направления в нем; - существование различных типов кристалл.решеток одного и того же вещества при различных внешних условиях(Т, Р)
Анизотропия свойств монокристалла; полиморфизм(аллотропические модификации) - зависимость физических и химических свойств кристалла от выбранного направления в нем; - существование различных типов кристалл.решеток одного и того же вещества при различных внешних условиях(Т, Р)
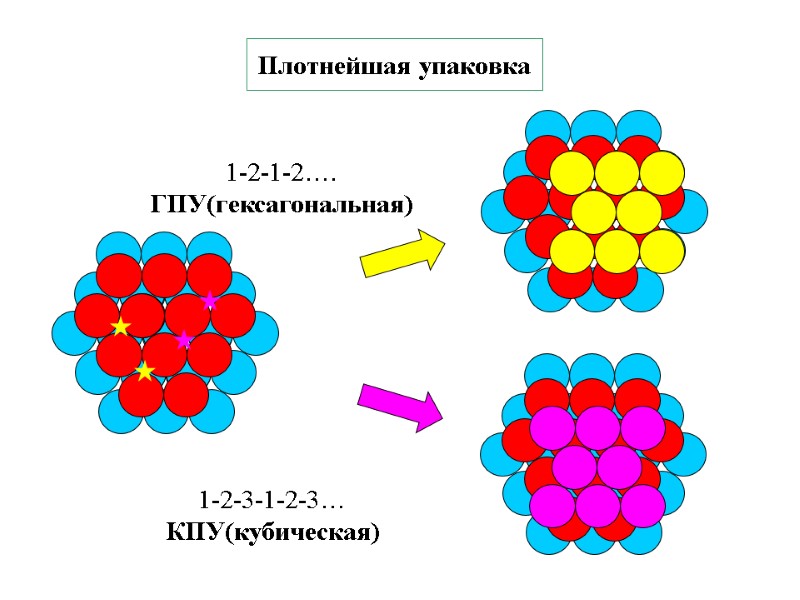
 Плотнейшая упаковка 1-2-1-2…. ГПУ(гексагональная) 1-2-3-1-2-3… КПУ(кубическая)
Плотнейшая упаковка 1-2-1-2…. ГПУ(гексагональная) 1-2-3-1-2-3… КПУ(кубическая)
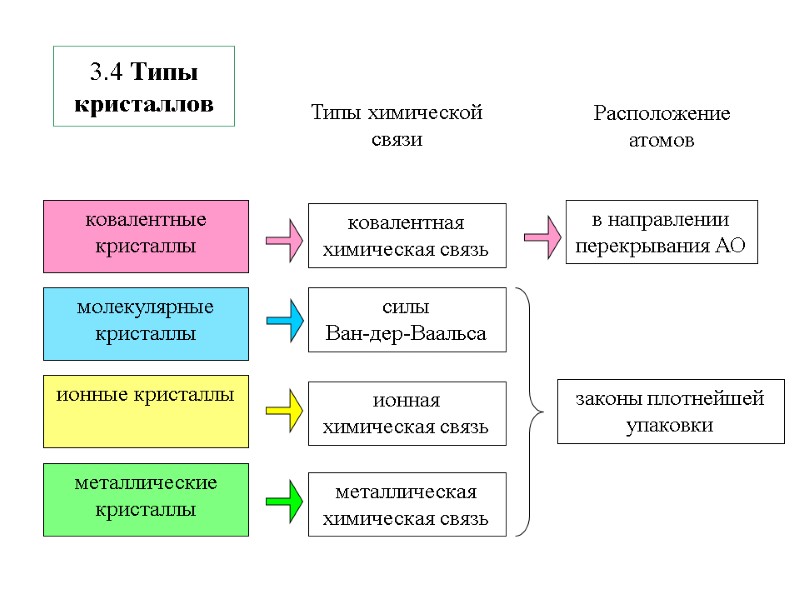
 3.4 Типы кристаллов молекулярные кристаллы ионные кристаллы металлические кристаллы ковалентные кристаллы Типы химической связи Расположение атомов
3.4 Типы кристаллов молекулярные кристаллы ионные кристаллы металлические кристаллы ковалентные кристаллы Типы химической связи Расположение атомов
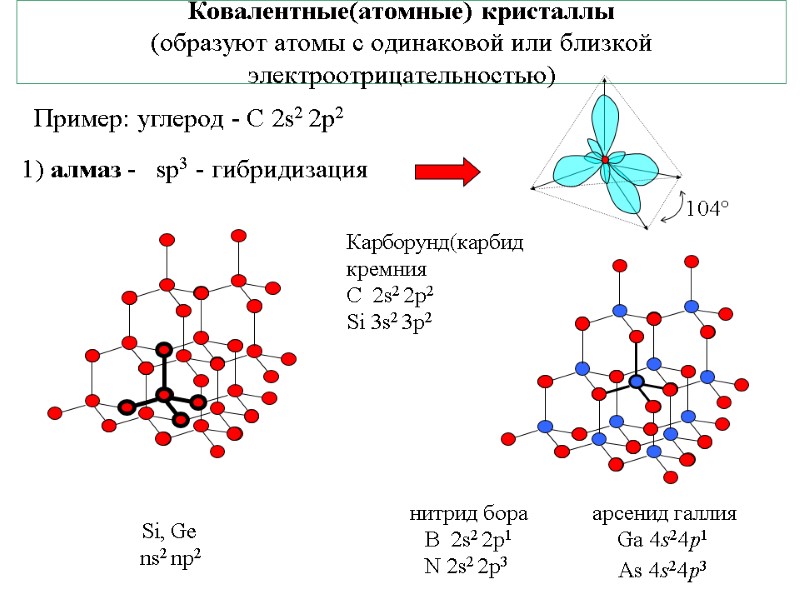
 Ковалентные(атомные) кристаллы (образуют атомы с одинаковой или близкой электроотрицательностью) Пример: углерод - С 2s2 2p2 1) алмаз - sp3 - гибридизация Si, Ge ns2 np2 Карборунд(карбид кремния С 2s2 2p2 Si 3s2 3p2 нитрид бора B 2s2 2p1 N 2s2 2p3 арсенид галлия Ga 4s24p1 As 4s24p3
Ковалентные(атомные) кристаллы (образуют атомы с одинаковой или близкой электроотрицательностью) Пример: углерод - С 2s2 2p2 1) алмаз - sp3 - гибридизация Si, Ge ns2 np2 Карборунд(карбид кремния С 2s2 2p2 Si 3s2 3p2 нитрид бора B 2s2 2p1 N 2s2 2p3 арсенид галлия Ga 4s24p1 As 4s24p3
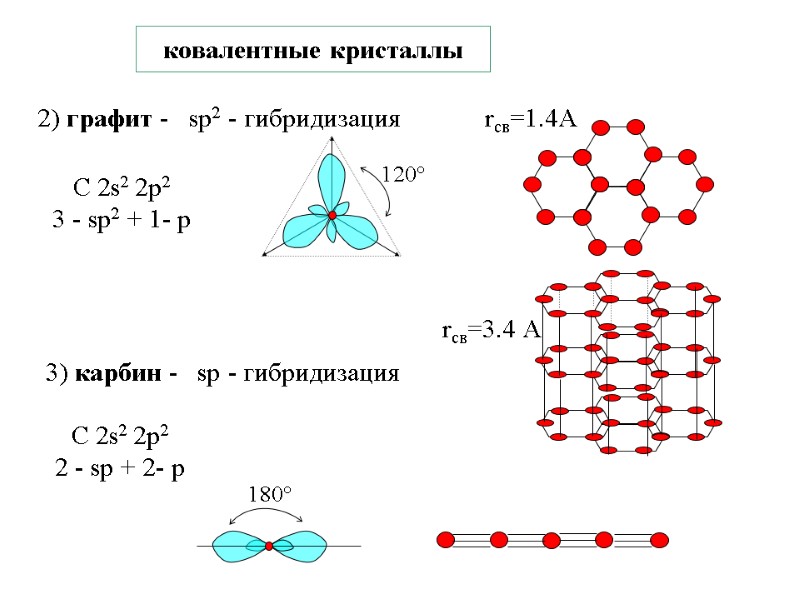
 ковалентные кристаллы 2) графит - sp2 - гибридизация С 2s2 2p2 3 - sp2 + 1- р 3) карбин - sp - гибридизация rсв=1.4А С 2s2 2p2 2 - sp + 2- р rсв=3.4 А
ковалентные кристаллы 2) графит - sp2 - гибридизация С 2s2 2p2 3 - sp2 + 1- р 3) карбин - sp - гибридизация rсв=1.4А С 2s2 2p2 2 - sp + 2- р rсв=3.4 А
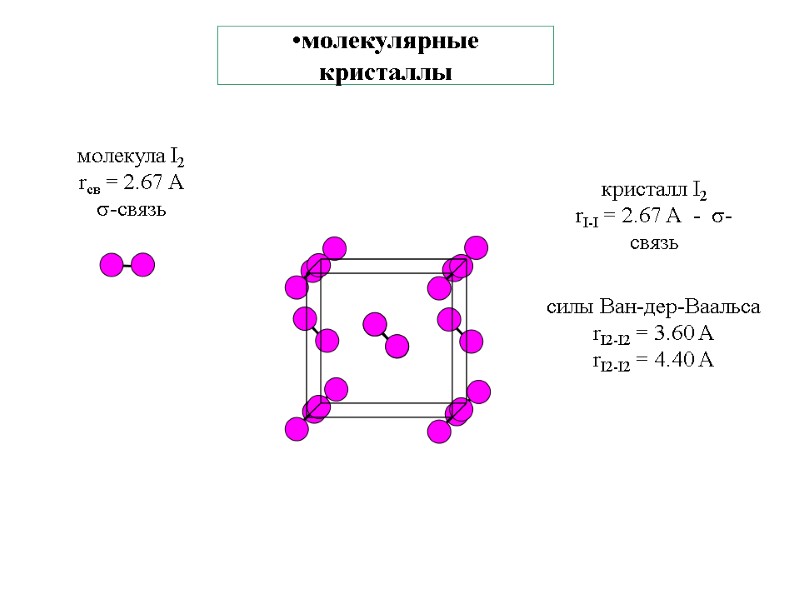
 молекулярные кристаллы силы Ван-дер-Ваальса rI2-I2 = 3.60 А rI2-I2 = 4.40 А кристалл I2 rI-I = 2.67 А - -связь
молекулярные кристаллы силы Ван-дер-Ваальса rI2-I2 = 3.60 А rI2-I2 = 4.40 А кристалл I2 rI-I = 2.67 А - -связь
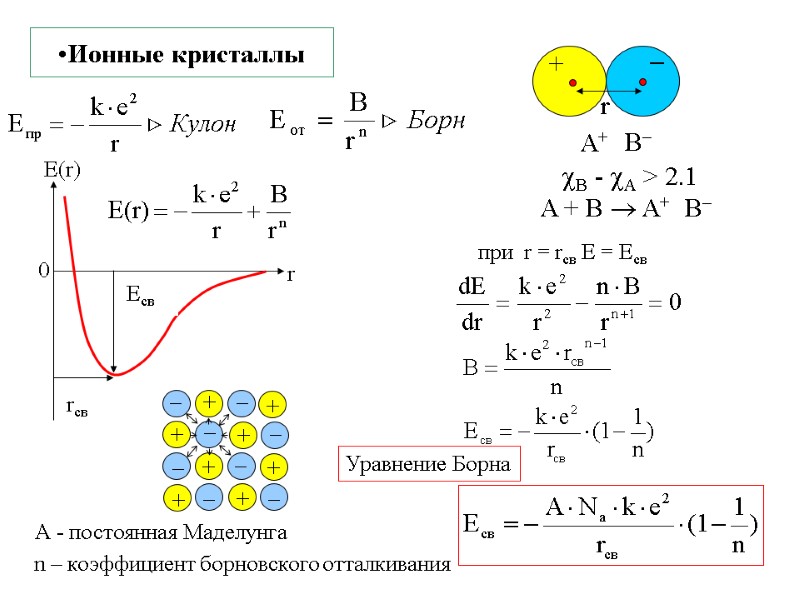
 Ионные кристаллы B - A > 2.1 A + B A+ B А - постоянная Маделунга n – коэффициент борновского отталкивания
Ионные кристаллы B - A > 2.1 A + B A+ B А - постоянная Маделунга n – коэффициент борновского отталкивания
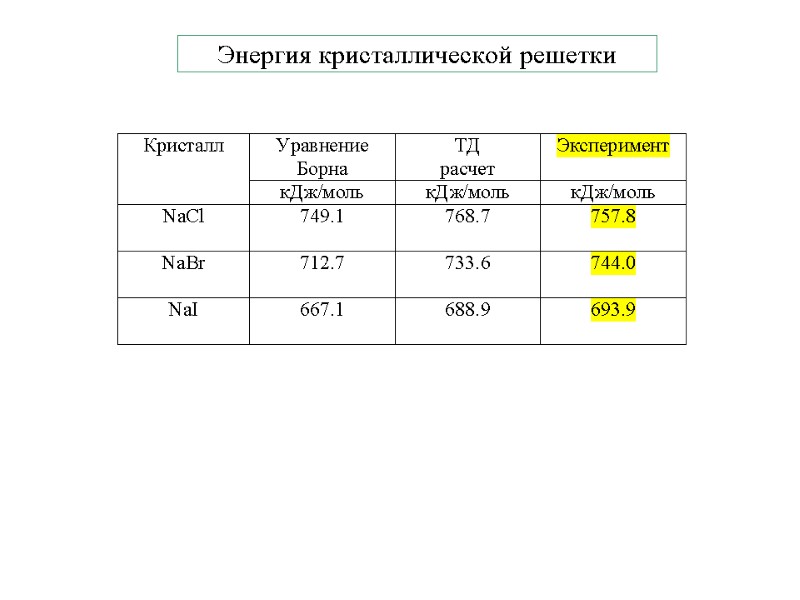
 Энергия кристаллической решетки
Энергия кристаллической решетки
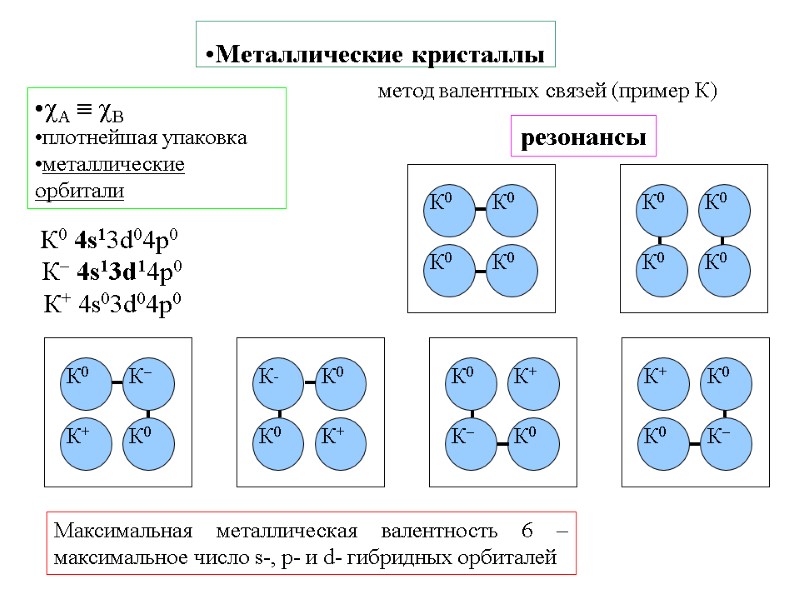
 Металлические кристаллы A B плотнейшая упаковка металлические орбитали метод валентных связей (пример К) К0 4s13d04р0 К 4s13d14р0 К+ 4s03d04р0 резонансы Максимальная металлическая валентность 6 – максимальное число s-, p- и d- гибридных орбиталей
Металлические кристаллы A B плотнейшая упаковка металлические орбитали метод валентных связей (пример К) К0 4s13d04р0 К 4s13d14р0 К+ 4s03d04р0 резонансы Максимальная металлическая валентность 6 – максимальное число s-, p- и d- гибридных орбиталей
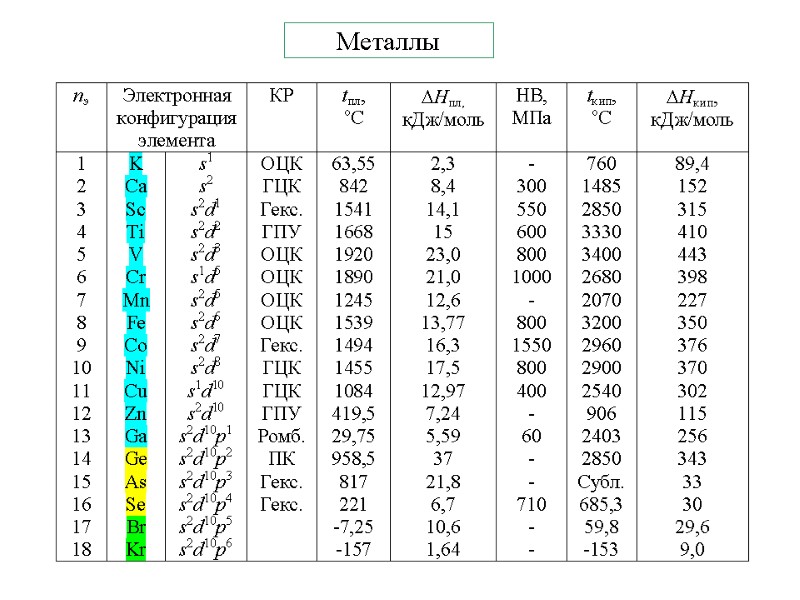
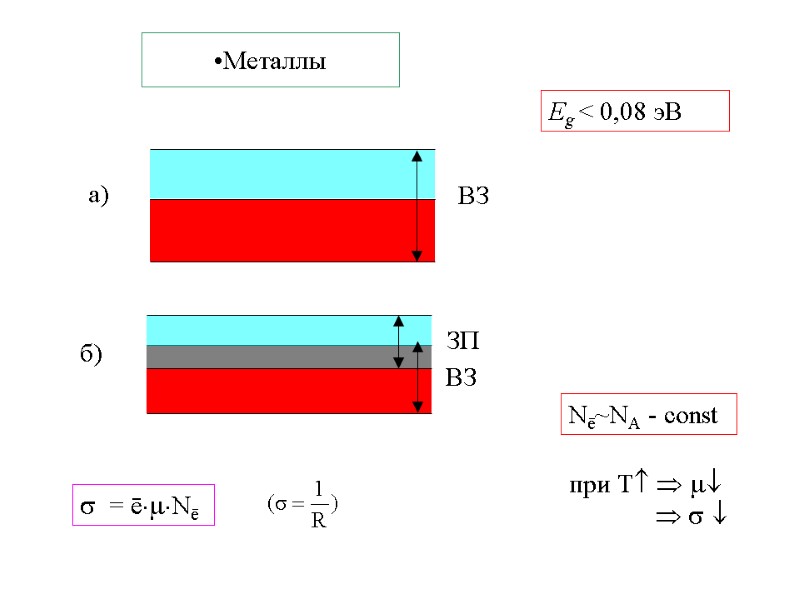
 Металлы
Металлы
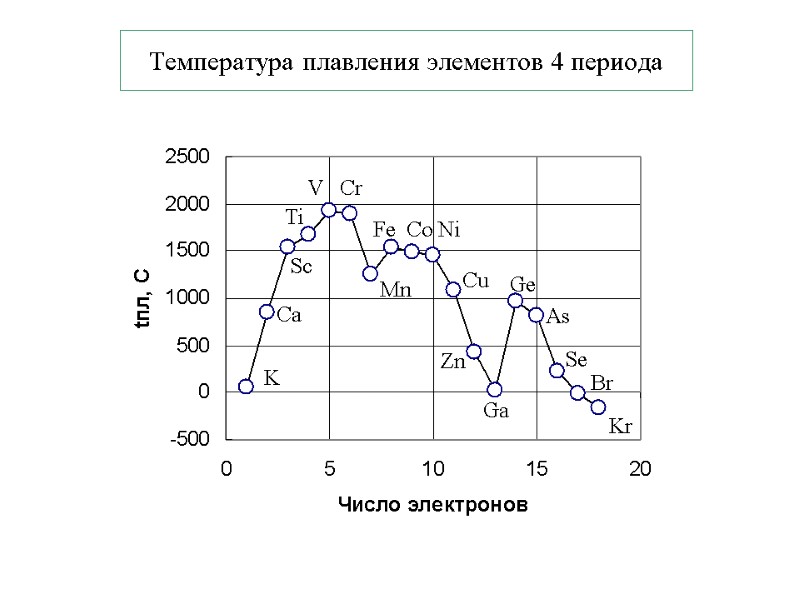
 Температура плавления элементов 4 периода
Температура плавления элементов 4 периода
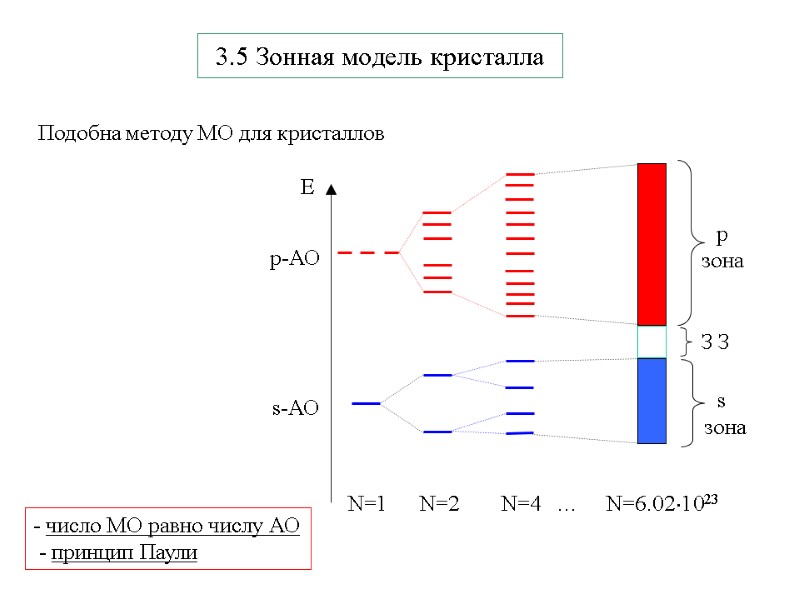
 3.5 Зонная модель кристалла Подобна методу МО для кристаллов - число МО равно числу АО - принцип Паули
3.5 Зонная модель кристалла Подобна методу МО для кристаллов - число МО равно числу АО - принцип Паули
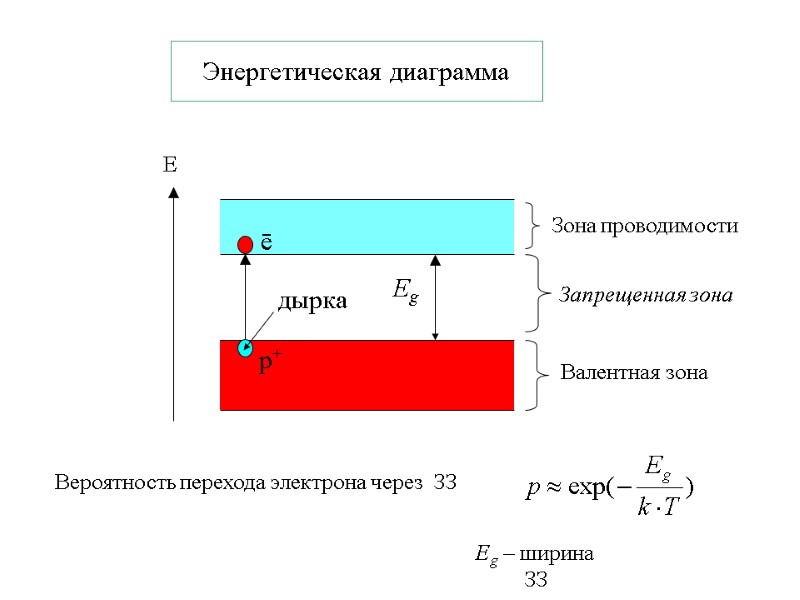
 Энергетическая диаграмма
Энергетическая диаграмма
 Металлы Nē~NА - const Eg < 0,08 эВ при Т
Металлы Nē~NА - const Eg < 0,08 эВ при Т
 Eg > 3 эВ Nē = 0 = 0 Диэлектрики
Eg > 3 эВ Nē = 0 = 0 Диэлектрики
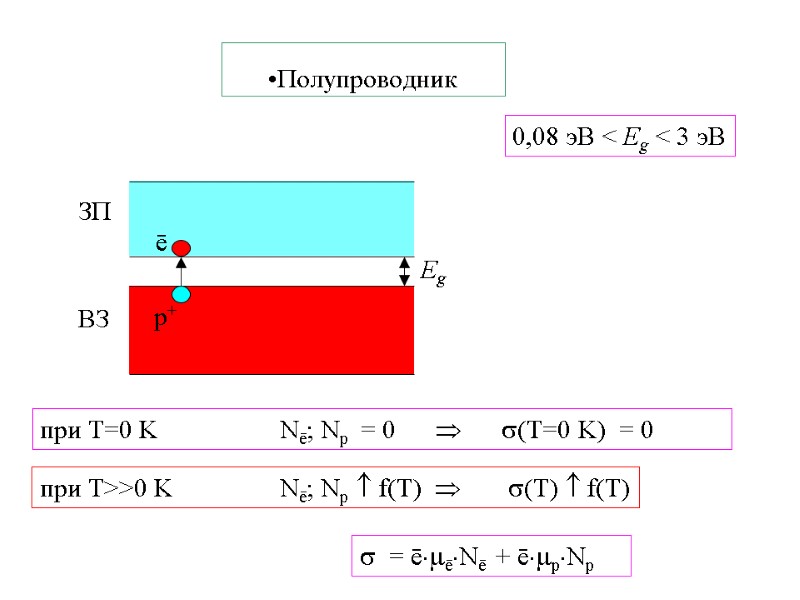
 Полупроводник 0,08 эВ < Eg < 3 эВ при T=0 K Nē; Nр = 0 (T=0 K) = 0 = ēēNē + ēрNр при T>>0 K Nē; Nр f(T) (T) f(T)
Полупроводник 0,08 эВ < Eg < 3 эВ при T=0 K Nē; Nр = 0 (T=0 K) = 0 = ēēNē + ēрNр при T>>0 K Nē; Nр f(T) (T) f(T)
 3.6 Кристаллические материалы (с.99 уч.пос., ч.I) Дефекты кристаллической решетки - электронные ē-р (А- А+); ex0 (А*) - точечные собственные: вакансии; межузельные атомы - линейные дислокации
3.6 Кристаллические материалы (с.99 уч.пос., ч.I) Дефекты кристаллической решетки - электронные ē-р (А- А+); ex0 (А*) - точечные собственные: вакансии; межузельные атомы - линейные дислокации
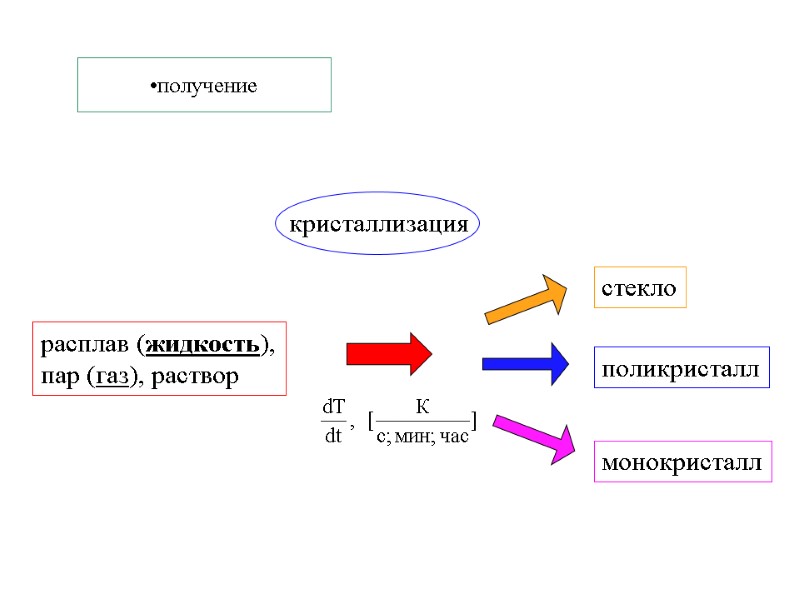
 получение расплав (жидкость), пар (газ), раствор
получение расплав (жидкость), пар (газ), раствор
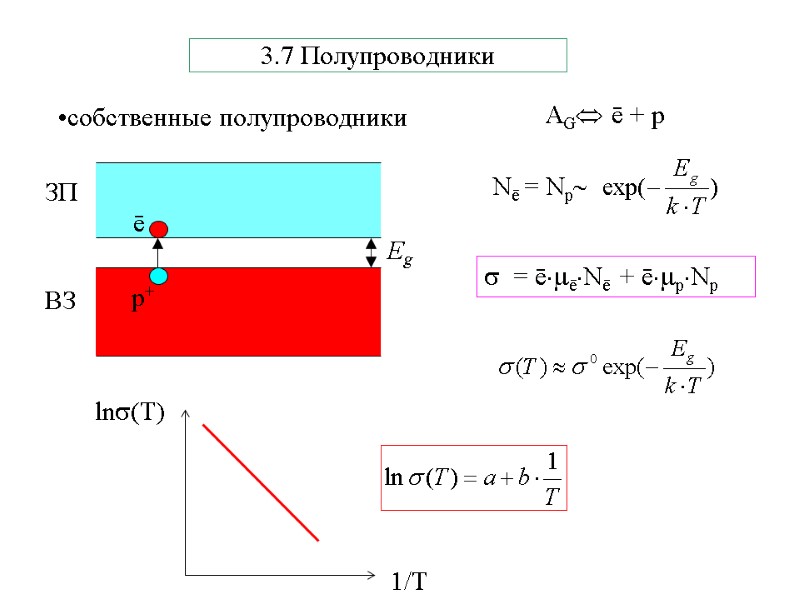
 3.7 Полупроводники = ēēNē + ēрNр
3.7 Полупроводники = ēēNē + ēрNр
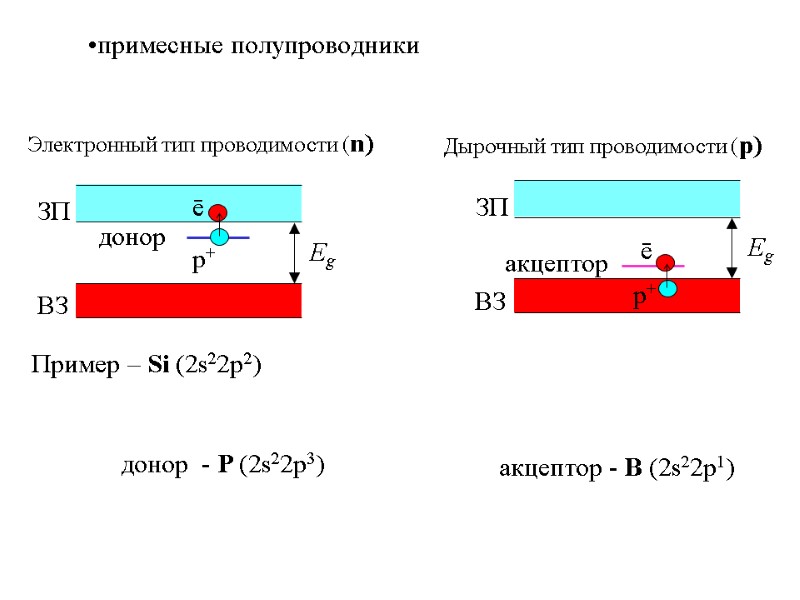
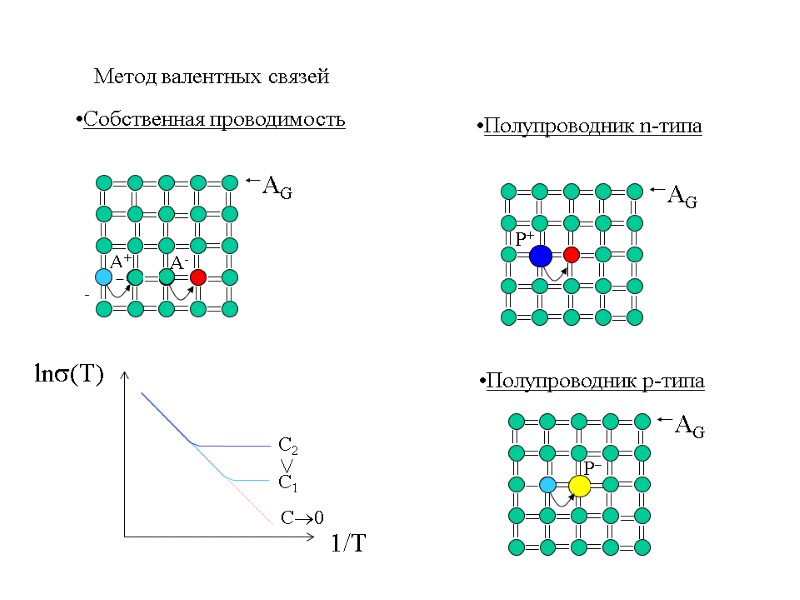
 примесные полупроводники Пример – Si (2s22p2) донор - P (2s22p3) акцептор - B (2s22p1) Электронный тип проводимости (n) Дырочный тип проводимости (р)
примесные полупроводники Пример – Si (2s22p2) донор - P (2s22p3) акцептор - B (2s22p1) Электронный тип проводимости (n) Дырочный тип проводимости (р)
 Метод валентных связей Собственная проводимость Полупроводник n-типа Полупроводник p-типа
Метод валентных связей Собственная проводимость Полупроводник n-типа Полупроводник p-типа

